氮素对棉花幼苗生长、养分分配及氮素利用效率的影响
2023-04-29陈丹丹王金玉彭杰谢晓麒卢丽文杜轩孟令浩杨国正
陈丹丹 王金玉 彭杰 谢晓麒 卢丽文 杜轩 孟令浩 杨国正

摘要:【目的】筛选棉花苗期适宜的氮浓度并研究其对棉花幼苗生长、养分吸收及氮素利用效率的影响。【方法】以华棉3097为材料,设置6个氮浓度0、0.04、0.4、1、4、8 mmol·L-1Ca(NO3)2,分别记为N0、N0.04、N0.4、N1、N4、N8,在培养液中培养21 d。测定棉花幼苗根系和地上部形态、干物质质量和主要营养元素吸收量及其分配、光合能力、氮素吸收效率及利用效率等指标。【结果】随着氮浓度的增加,棉花幼苗根系及地上部的生长、干物质质量、营养元素累积量、光合能力等均呈先增加后降低的趋势,4 mmol·L-1Ca(NO3)2是棉花苗期最适宜的氮浓度,其生长最旺盛。棉花幼苗单株氮、磷、钾、钙的最大积累量分别为34.4 mg、6.3 mg、41.6 mg和16.5 mg,比例约为1∶0.2∶1.2∶0.5。氮素吸收效率和利用效率均与根冠比正相关,还与根干物质分配比例、根平均直径、根养分分配比例等变化规律一致,均随氮浓度的增加而降低。在0~4 mmol·L-1Ca(NO3)2范围内,植株氮钾钙含量、叶片干物质质量和地上部养分分配比例均随氮浓度的增加而提高。【结论】4 mmol·L-1Ca(NO3)2是棉花苗期最适宜的氮浓度,可显著促进棉花幼苗对氮、磷、钾、钙的吸收。1 mmol·L-1Ca(NO3)2能提高根系养分分配比例,促进根系伸长与增殖,提高氮素吸收及利用效率。
关键词:棉花;氮;根系形态;养分分配;光合作用
Effects of nitrogen on cotton growth, macronutrients distribution and nitrogen use efficiency
Chen Dandan, Wang Jinyu, Peng Jie, Xie Xiaoqi, Lu Liwen, Du Xuan, Meng Linghao, Yang Guozheng*
(College of Plant Science and Technology, Huazhong Agricultural University/Key Laboratory of Crop Ecophysiology and Farming System in Middle Reaches of the Yangtze River, Ministry of Agriculture and Rural Affairs, Wuhan 430070, China)
Abstract: [Objective] This study aims to screen the suitable nitrogen (N) concentration and investigate its effects on the growth, macronutrients uptake and N use efficiency of cotton at seedling stage. [Methods] HM3097 was used and cultured with nutrient solution for 21 d of six N concentrations with 0, 0.04, 0.4, 1, 4, 8 mmol·L-1Ca(NO3)2, named N0, N0.04, N0.4, N1, N4 , N8, respectively. The root and shoot morphology, biomass, absorption and distribution of macronutrients, photosynthetic capacity, N uptake efficiency (NUpE) and N utilization efficiency (NUtE) of cotton seedlings were determined. [Results] With the increase of N concentration, the growth (include root and shoot), biomass, macronutrients accumulation and photosynthetic capacity of cotton seedlings increased first and then decreased, and 4 mmol·L-1Ca(NO3)2was the most appropriate N concentration for cotton at seedling stage, at which the cotton growth was the most vigorous. The maximum accumulations of N, P, K, and Ca of cotton seedlings were 34.4 mg, 6.3 mg, 41.6 mg, and 16.5 mg per plant, respectively, with the ratio of 1∶0.2∶1.2∶0.5. NUpE and NUtE were positively correlated with root-shoot ratio, and the change trend were also consistent with the root biomass distribution proportion, root average diameter, and the root macronutrients distribution proportion, which decreased with the increase of N concentration. In the range of 0-4 mmol·L-1Ca(NO3)2, the contents of N, K, and Ca, leaf biomass and the shoot macronutrients distribution proportion all increased with the increase of N concentration. [Conclusion] 4 mmol·L-1Ca(NO3)2was the most appropriate N concentration for cotton at seedling stage, which could significantly promote the absorption of N, P, K, and Ca of cotton seedlings. 1 mmol·L-1Ca(NO3)2could increase the root macronutrients distribution proportion, promote root elongation and proliferation, and improve NUpE and NUtE.
Keywords: cotton; nitrogen; root morphology; macronutrients distribution; photosynthesis
棉花(Gossypium hirustum L.)是世界重要的经济作物之一,在世界经济发展中占有重要地位[1]。棉花是主要的纺织原料,随着棉纺织产业的快速发展和棉花副产品多功能的开发,人们对棉花的需求不断增加[2]。棉花生产对氮(nitrogen, N)肥需求较高,长期以来,棉花产量的提高依赖于大量的氮肥投入,过量施用氮肥降低了氮素利用效率(N utilization efficiency, NUtE),并且造成了严重的环境污染[3]。此外,氮肥的大量使用也增加了生产成本。因此,减少氮肥用量、提高氮素利用效率已成为国际农业研究热点[3]。
Lynch[4]提出通过调控根系结构提高养分利用效率将是农业生产的第二次绿色革命。根系是吸收养分和水分的主要器官,因此根系在适应养分缺乏方面起着核心作用。研究表明,植物缺氮时,首先是促进侧根生长,从土壤中获取更多的氮[5-6]。玉米对中度氮缺乏(0.5和5 mmol·L-1纯N,下同)的典型反应是减少冠根的数量、促进轴根(包括初生根和种子根)的伸长,这是因为植物在缺氮条件下无法获得足够的氮来支持地上部的生长,会通过减少侧根的生长来减少碳和氮的消耗,从而将大量的养分转移到初生根,保持轴根的伸长来吸收更深土层的养分[7-8]。玉米氮吸收与根系构型相关性状存在显著的正相关关系,表明最优的根系构型能够促进氮素吸收[9]。中度缺氮(275和550 μmol·L-1)时,拟南芥1°和2°侧根的平均长度显著增加;严重缺氮(110 μmol·L-1)时,拟南芥主根和侧根的伸长均受到抑制,根冠比和2°侧根密度随氮浓度的降低而逐渐增加[10]。有些植物在严重缺氮时几乎不长侧根,表明植物需要一定水平的氮来维持生长[11]。当氮充足时,根系生长受到抑制,根冠比较低,较少的根系就能获得足够的养分[12],营养生长被延长[13]。在0.5和1 mmol·L-1N水平下,棉花总根长、总根表面积和根体积较不施氮处理显著提高[14],而在2.5 mmol·L-1N水平下的棉花根系形态性状较5 mmol·L-1N水平下显著增加[15]。祝令晓[16]用根系原位观测装置研究了低氮(0 mg·kg-1N,以土壤质量计,下同)与正常氮(138 mg·kg-1 N)对棉花生长的影响,结果表明低氮显著抑制株高、茎粗、叶面积等地上部生长,并显著降低棉花各器官和总的干物质质量。低氮处理下,棉花1°侧根和2°侧根的根毛长度与密度显著增加,侧根寿命也较正常氮处理增加了4~5 d。邓忠等[17]研究表明随着施氮量(150、225、300、375 kg·hm-2)的增加,棉花根系干物质质量呈先增加后降低的趋势,地上部分干物质质量呈逐渐增加的趋势,根冠比呈逐渐降低的趋势;施氮量为300 kg·hm-2时,根干物质质量最大,棉花叶片光合速率、蒸腾速率及叶绿素含量也最大。Iqbal[14]研究表明不同氮效率基因型的棉花的地下部相关性状与氮素利用效率正相关,而地上部性状和氮同化酶活性与氮素吸收效率(N uptake efficiency, NUpE)正相关。作为连接土壤与植物地上部物质能量交换的重要桥梁,根系在提高氮肥利用效率方面的作用备受关注,因此探究氮浓度与棉花根系的互作关系具有重要意义。
氮、磷、钾和钙被称为“肥料的四要素”,是维持植物生长发育的关键营养物质[18],其中一种营养元素的缺乏会导致植物中其他营养元素的失衡[19]。研究表明,施氮能促进小麦对磷、钾的吸收和利用,但过量施氮则会抑制对磷、钾的吸收和利用[20]。高璐阳等[21]研究表明,在同一生育时期,随着施氮量的增加,甘薯地上部氮、磷、钾含量增加,而地下部氮、磷、钾含量呈先增加后降低的趋势,过量施氮会降低根系养分分配比例。棉花生产中存在偏施氮肥、氮磷钾肥比例变化幅度较大的问题,制约了肥料利用效率的提高与土壤养分平衡。研究表明,适宜的氮磷钾肥比例可显著提高棉花产量与肥料利用效率,因此结合棉花生长对养分的需求,探究氮浓度对棉花关键营养物质的吸收与分配的影响及其与氮素吸收利用效率的关系十分必要。
氮是植物体内蛋白质、核酸、酶和叶绿素的重要组成部分,植物叶片中75%的氮存在于叶绿体中。叶绿体是光合作用进行的主要场所,1,5-二磷酸核酮糖羧化/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase, Rubisco)是光合作用的关键酶,含有叶片20%~50%的氮,因此氮供应直接影响棉花光合作用。陈静等[22]对水培条件下不同棉花品种幼苗生长和光合特性的研究发现,随氮浓度(0、2、4、8 mmol·L-1N)的增加,棉花幼苗叶绿素a/b含量、净光合速率、光系统Ⅱ(photosystem Ⅱ, PSⅡ)的潜在活性和PSII光化学最大效率均呈先升高后降低趋势,且棉花幼苗生长的最适宜氮浓度为4 mmol·L-1。李永竟[23]研究表明增施氮肥可以促进棉花地上部分和根系的生长,通过提高叶片蒸腾作用带动营养物质的运输和转移,叶片气孔导度增加便于CO2进入叶肉细胞,进而净光合速率增加促进干物质的积累。Iqbal[14]研究表明氮高效基因型棉花品种中光合作用相关基因的表达量显著高于氮低效基因型棉花品种。光合作用为氮的吸收和代谢提供能量和碳骨架,也是干物质累积的基础[3],因此探究不同氮浓度对棉花幼苗光合作用的影响有助于理解氮浓度对棉花幼苗生长的效应。
总而言之,如何减少施氮量和提高氮素利用效率被认为是棉花等作物必须攻克的一个关键挑战。本研究设置了一系列氮浓度梯度,考察了棉花幼苗地上部生长、根系生长、干物质质量与分配、常量元素的吸收与分配、光合能力以及氮素吸收效率和利用效率等对氮浓度的响应,筛选棉花苗期适宜的氮浓度,进而为研究棉花氮高效利用提供理论依据。
1 试验材料与方法
1.1 材料与处理
以湖北省推广品种华棉3097(HM3097)为试验材料,在华中农业大学植物科学技术学院水培温室中进行试验。取大小一致的棉花种子于无菌水中浸泡4 h催芽,然后播种于装有蛭石的营养钵(8 cm×8 cm)中,每钵均匀放4粒种子,播种深度约2.5 cm,用水浇透蛭石,置于培养架中培养(30 ℃/26 ℃,昼/夜分别为16 h/8 h)。子叶平展后,将幼苗根系洗净,然后移栽至不同氮浓度的营养液中培养。营养液置于黑色塑料盆(27 cm×18 cm×7.5 cm)中,用黑色泡沫板与定植棉固定幼苗,每盆均匀分布6株幼苗。移栽当天塑料盒盛放2.5 L营养液并画上刻度线,由于水分蒸发,每周补充一次营养液至刻度线,培养21 d后不同处理的幼苗表现出明显差异时取样分析。每盆消耗营养液共计3.7 L。每个处理3盆。
营养液配制采用改良版霍格兰营养液配方[24]并略作修改,微量元素液:0.1 mmol·L-1H3BO3,29.9 μmol·L-1ZnSO4·7H2O,0.1 μmol·L-1CuSO4·5H2O,5.0 μmol·L-1KI,0.1 mmol·L-1MnSO4·4H2O,1.0 μmol·L-1Na2MoO4·2H2O,0.2 μmol·L-1CoCl2·2H2O;EDTA-Fe2+贮备液:20.0 mmol·L-1FeSO4·7H2O和20.0 mmol·L-1EDTA-Na2;大量元素液:1 mmol·L-1KH2PO4,2.5 mmol·L-1K2SO4和2 mmol·L-1MgSO4·7H2O,6个氮浓度处理N0、N0.04、N0.4、N1、N4、N8分别为0、0.04、0.4、1、4、8 mmol·L-1Ca(NO3)2·4H2O,用CaCl2将各处理Ca2+浓度调节至4 mmol·L-1[14],营养液初始pH为6.7±0.1。
1.2 测定项目与方法
每个处理每次取4株幼苗进行形态指标测定,重复测定3批次作为3个生物学重复。用直尺测量侧根起始部位到生长点的长度为苗高,用游标卡尺测量子叶节处厚度为茎粗,每株幼苗平展真叶的数量为叶片数,将每株叶片剪下并铺平,用中晶Phantom 9900XL Plus扫描仪进行扫描,图片用Image J软件分析得到每株叶面积。
从侧根起始部位剪下根系,放入透明玻璃托盘中,将根系在水中展平,尽量避免重叠,用中晶Phantom 9900XL Plus根系扫描仪进行扫描。用万深LA-S系列植物图像分析系统分析图片,得到每株根系的总根长、总根表面积、总根体积、根平均直径和根尖数等,计算直径小于0.5 mm的细根长、细根表面积、细根体积、细根尖长等分别占总根长、总根表面积、总根体积、总根长的比例。
将以上测完形态的幼苗按照根、茎、叶分离,分别装入牛皮纸袋中,用烘箱105 ℃杀青0.5 h,再调至75 ℃烘干至质量恒定,分别称量每株棉苗的根、茎、叶质量并计算全株干物质质量、根冠比及根、茎、叶干物质质量百分比。
将烘干的幼苗地上部与地下部分别混合,用球磨仪研成粉末,称0.2 g放入耐高温玻璃消化管中,加5 mL H2SO4浸没,用H2SO4-H2O2法在红外消煮炉中将样品消化至澄清透明,每个处理称量3份作为3次重复。将消化液过滤并稀释至一定浓度后用全自动化学分析仪Smarchem 200测定氮、磷含量,用火焰光度计(FP6431, IINESA)测定钾、钙含量,计算氮吸收利用效率和氮、磷、钾、钙等营养元素累积量及其分配比例,计算公式如下:营养元素含量(mg·g-1)=浓度(mg·L-1)×稀释后总体积(L)/样品质量(g);营养元素分配比例(%)=单株某组织某元素含量(mg)/单株某元素总含量(mg)×100%;NUtE=单株干物质质量(mg)/单株氮含量(mg);NUpE=单株吸收氮量(mg)/单株施氮量(mg)×100%。
不同氮浓度处理后21 d,利用便携式光合系统LI-COR-6800在生长室中使用附加的红蓝光叶室测定每个处理8株幼苗的功能叶(第2片真叶)的净光合速率(Pn),蒸腾速率(Tr),气孔导度(Gs)和胞间CO2浓度(Ci),试验CO2浓度设为400 μmol·mol-1,光强度设为500 μmol·m-2·s-1,水分设为55%,温度设为26 ℃[22]。
1.3 数据分析
使用SPSS 22.0对数据进行平均值与标准误计算并进行方差分析,采用Duncan法在0.05水平进行差异显著性分析。聚类热图采用行标准化,数据标准化方式为z-score标准化,聚类方式为行与列,聚类类型为曼哈顿,用Origin 2021进行绘图。
2 结果与分析
2.1 不同氮浓度对棉花幼苗生长的影响
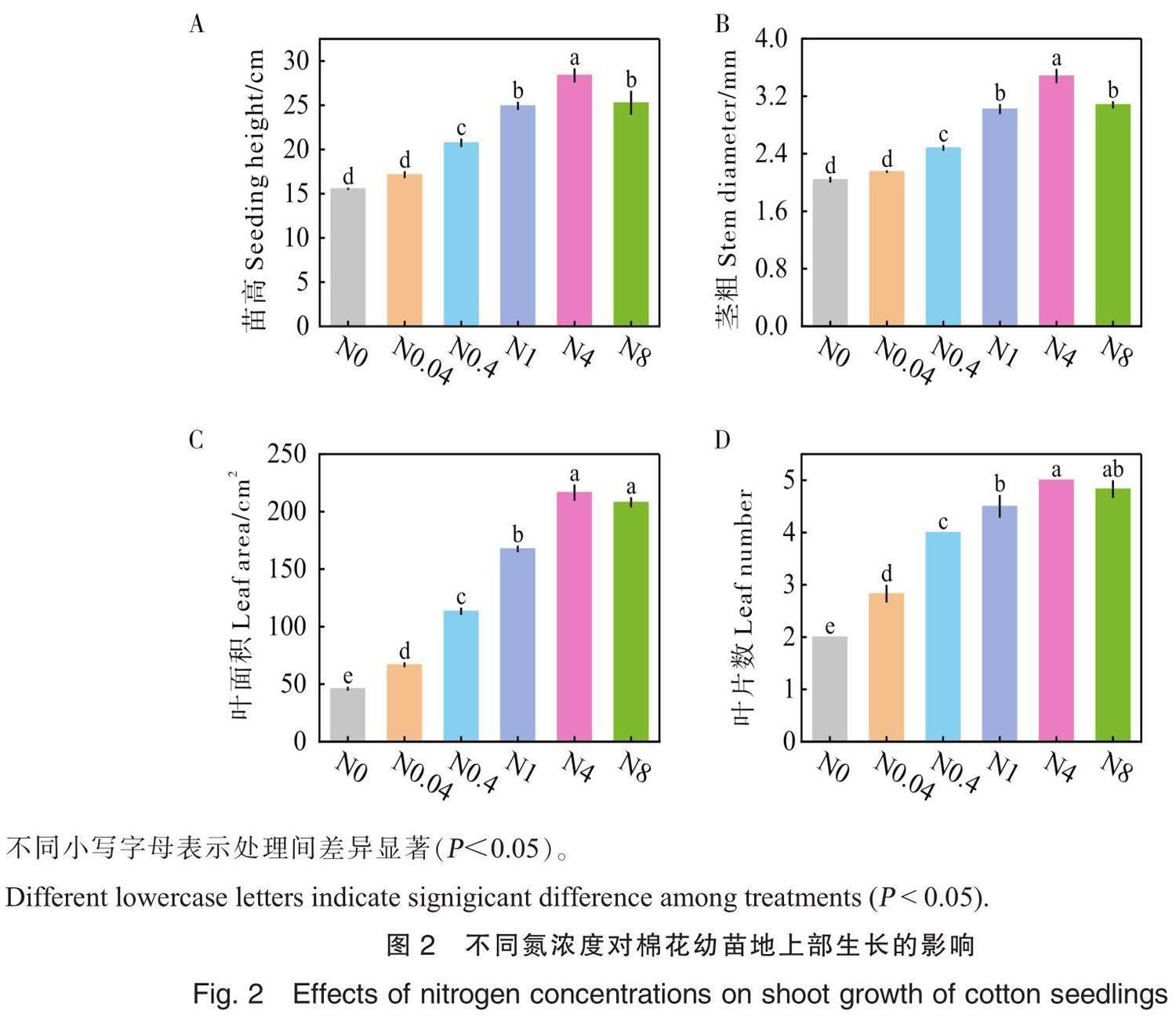
棉花幼苗苗高、茎粗、叶片数和叶面积等指标均随氮浓度的增加呈先增加后降低的趋势,多数处理间差异显著,其中N4处理棉花幼苗长势最旺(图1和图2)。与N0处理相比,N0.04、N0.4、N1、N4、N8的苗高分别增加10.2%、33.4%、60.2%、82.4%和62.4%;茎粗分别增加5.6%、21.7%、48.0%、70.8%和50.9%;叶面积分别增加45.1%、146.3%、264.0%、370.1%、351.7%;叶片数分别增加41.7%、100.0%、125.0%、150.0%、141.7%。由此可见施氮浓度对棉花幼苗叶片数与叶面积的影响更大,对茎粗影响较小。
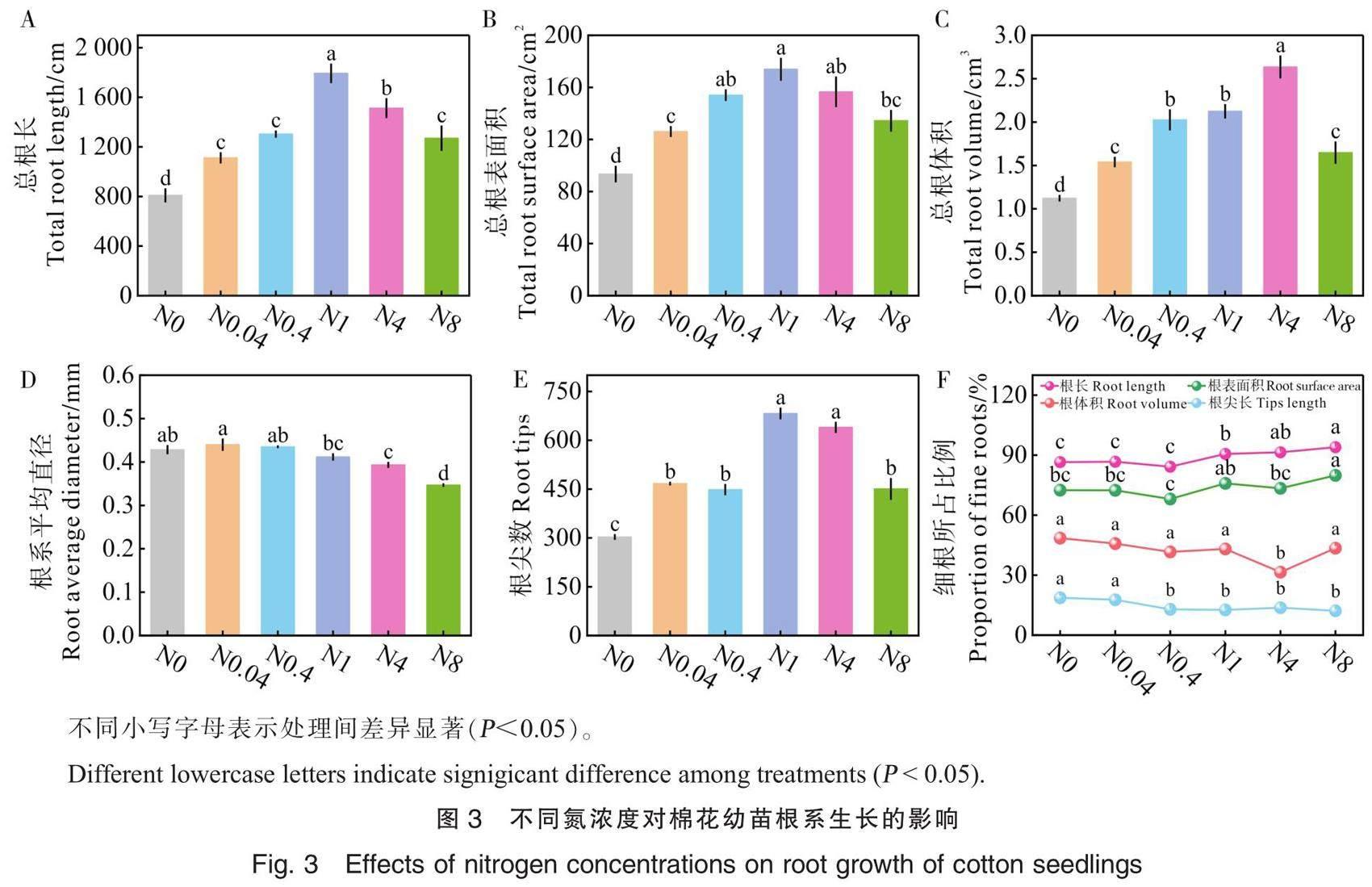
棉花幼苗根系的生长指标随氮浓度的增加呈现先增加后降低的趋势(图1和图3),主要表现为N1的总根长、总根表面积与根尖数最大,N4的总根体积最大,多数处理间差异显著。根系平均直径总体上随氮浓度增加而降低;细根的根长、根表面积、根体积与根尖长分别占总根长、总根表面积、总根体积与总根长的88.9%、73.7%、42.3%和14.6%,且细根的根长占比与根表面积占比整体上随氮浓度增加而增加。这些结果表明,低浓度氮处理(N0、N0.0.4和N0.4)降低了根系数量但增加了根系平均直径,中等水平氮处理(N1和N4)可促进棉花幼苗根系伸长与增殖、增加根系吸收面积,而高水平氮(N8)抑制根系生长。
2.2 不同氮浓度对棉花幼苗干物质累积与分配的影响
棉花幼苗根、茎、叶及单株干物质质量等均随氮浓度增加呈先增加后降低的趋势(图4)。N1处理的根干物质质量最大,显著高于N0、N0.04与N8处理,与N0.4和N4无显著差异。N4处理的茎、叶及全株干物质质量最大,均显著高于其他处理。N0.04、N0.4、N1、N4、N8的根、茎、叶干物质质量分别较N0提高17.2%~76.5%、20.8%~187.8%和29.6%~232.0%。这些结果表明不同氮浓度对地上部干物质质量影响较大而对根干物质质量影响较小。随着氮浓度的增加,根冠比与根干物质占比显著下降、茎干物质质量占比无显著变化、叶干物质质量占比上升,说明氮浓度显著影响棉花幼苗根与叶片的干物质质量分配,氮浓度越高根干物质分配越少。
2.3 不同氮浓度对棉花幼苗养分吸收、分配及氮利用效率的影响
随着氮浓度增加,棉花幼苗根部与地上部氮含量均逐渐上升,其中N4与N8处理间无显著差异,但显著高于其他处理(图5A)。N0.4、N1、N4、N8的根部与地上部的氮含量较N0分别提高11.7%、34.0%、174.6%、187.9%和28.3%、94.5%、263.3%、301.3%。N0、N0.04和N0.4根部氮含量高于地上部氮含量,而N1、N4、N8根部氮含量低于地上部氮含量(图5A)。
随氮浓度增加,棉花幼苗地上部磷含量呈先增加后降低趋势,N0.4的最高,显著高于其他处理,其次是N1和N4,其余3个处理的地上部磷含量无显著差异。根部磷含量随氮浓度增加而降低。N0和N0.04的根部磷含量高于地上部磷含量,而其他处理则相反(图5B)。
幼苗地上部钾含量与全株钙含量随氮浓度增加整体呈增加趋势,根部钾含量受氮浓度影响较小,各处理地上部钾含量均低于根部钾含量,而地上部钙含量均高于根部钙含量(图5C和5D)。
随着氮浓度的增加,单株氮、磷、钾、钙累积量均呈先增加后降低的趋势,其中N1的磷累积量最高,N4的氮、钾、钙累积量最高,多数处理间差异显著(图6)。单株氮、磷、钾、钙最大吸收量分别为34.4 mg、6.3 mg、41.6 mg、16.5 mg,比例约为1∶0.2∶1.2∶0.5。N0.04、N0.4、N1、N4、N8的氮累积量分别较N0提高21.1%、121.9%、360.9%、884.2%和764.8%,磷累积量较N0分别提高29.3%、155.1%、219.2%、196.0%和112.3%,钾累积量较N0分别提高31.4%、130.2%、234.4%、318.5%和210.3%,钙累积量较N0分别提高29.6%、117.7%、272.3%、411.7%和371.5%。表明在0~4 mmol·L-1Ca(NO3)2范围内,提高施氮浓度可促进棉花幼苗对氮、磷、钾、钙的吸收,且氮浓度对氮和钙的吸收影响最大,其次是钾,对磷的吸收影响最小。
氮素吸收效率随施氮浓度的增加而显著下降(图6E),N0.04、N0.4、N1、N4、N8的氮素吸收效率分别为100.0%、61.3%、72.6%、44.4%和19.2%。氮素利用效率随施氮浓度的增加先升高后降低(图6F),N0.04的氮素利用效率较N0处理高5.2%,N0.4、N1、N4、N8的氮素利用效率较N0处理分别降低19.4%、44.6%、70.6%和73.6%。这些结果表明提高施氮浓度会显著降低氮素吸收效率及利用效率。结合各处理的表型结果,推测4 mmol·L-1Ca(NO3)2是棉花苗期适宜的施氮浓度。
各处理的根部氮含量占比为9.0%~23.4%,磷含量占比为5.7%~25.9%,钾含量占比为16.2%~40.8%,钙含量占比为2.6%~6.2%。各处理棉花幼苗地上部的氮、磷、钾、钙等营养元素含量占比均高于根部的占比(图7),说明根系吸收的营养元素大部分转运至地上部存储或者供应植物生长需求。随氮浓度的增加,根部各养分元素含量占比均呈降低趋势,说明缺氮可促进养分在根系的分配。各处理的氮、磷、钾在根和地上部分配比例差异较大,而Ca在根和地上部的的分配比例差异较小。
2.4 不同氮浓度对棉花幼苗光合作用参数的影响
随着氮浓度的增加,棉花幼苗净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均呈先升高后下降的趋势,N1或者N4处理最高,且显著高于其他处理。N1的胞间CO2浓度(Ci)显著低于除N4外的其他处理,其他处理的胞间CO2浓度无显著差异(图8),说明N1与N4处理下有效CO2的羧化效率较高,光合能力较强。
2.5 聚类分析
对不同氮浓度及棉花幼苗的相关性状进行聚类(图9)。对于氮浓度的聚类结果,6个氮浓度被分成2组,N0、N0.04和N0.4为一组,可能属于缺氮组,其中N0与N0.04处理各指标的色阶更相似,可能属于极度缺氮,而N0.4属于低氮;N1、N4和N8被聚为另一组,可能为氮充足组,其中N1和N4各指标的色阶更相似,可能属于合适氮浓度,而N8属于高氮浓度。
对于测定指标的聚类结果,NUpE、NUtE、根冠比、根干物质质量占比、根营养元素分配比例、根平均直径等表现出一致的变化规律,均随着氮浓度的增加而降低。根系生长相关指标(总根长、总根表面积、总根体积与根尖数)与光合参数(Pn,Tr和Gs)、磷累积量及茎干物质质量等表现出相似的变化规律,均随着氮浓度的增加呈先增加后降低的趋势,N1或者N4处理出现最大值。地上部生长相关指标、地上部养分含量占比、地上部养分累积量、叶片干物质质量及其占比等表现出相似的变化规律,它们在缺氮处理中较低,在氮充足组中值较高,在N4或者N8处理出现最大值。
3 讨论
3.1 氮素对棉花幼苗生长的影响
适宜的氮浓度是作物健康生长的基础[25]。在本研究中,棉花幼苗的株高、茎粗、叶片数、叶面积、茎和叶干物质质量等随着氮浓度的增加呈先增加后降低的趋势,多数处理间差异显著,N4处理最大(图2和图4),表明氮浓度过高或过低均会抑制棉花幼苗的生长,而4 mmol·L-1Ca(NO3)2是棉花苗期适宜的氮浓度。研究表明,氮浓度过高会抑制植株对氮的吸收,而在适宜氮浓度范围内,植株氮累积量随氮浓度增加而增加。氮素是蛋白质、核酸,酶等的重要组成部分,氮素的增加使植物可以合成更多的蛋白质来促进细胞分裂和增大[26-27],特别是叶片氮的增加,可使光合作用显著增强,光合作用是干物质累积的基础,这可能是随氮浓度增加,叶面积、地上部干物质质量及地上部干物质质量占比显著提高的原因。
氮对根系生长的影响是复杂的,并取决于氮浓度。重度缺氮与高氮会抑制根系的整体生长,而轻度缺氮则刺激根系的伸长与增殖[5-6, 10]。在本研究中,缺氮(N0, N0.04, N0.4)处理显著降低了棉花幼苗根系数量但增加了根系平均直径。研究表明,植物在缺氮时会通过减少侧根的生长来减少碳和氮的消耗,从而将养分转移到初生根,并通过轴根的伸长吸收土壤深处的的养分[7-8]。本研究可能是养分集中在最初长出来的根系,新根生成较少,老根增粗,因而导致根系数量较少而根系平均直径增加。与N4处理相比,N1处理显著促进了棉花幼苗根系伸长与增殖,而N8处理则抑制了棉花幼苗根系的长度、数量与直径等。越来越多的研究表明氮吸收与根系构型相关性状之间存在显著的正相关关系,表明最优的根系构型能够促进氮素吸收[9],因而N1处理发达的根系可能是其氮素吸收利用效率较高的原因。低氮诱导叶片早衰,同时延缓根系衰老[28-29]。根系直径与根系寿命呈显著正相关,与根系氮浓度呈显著负相关[30-31],本研究结果与之类似。研究发现,细根主要负责养分获取,而粗根主要负责养分运输[28, 32],施用控释肥有利于形成新根,增加细根比例,进而促进桃树吸收养分,提高肥料利用效率[28, 33]。
3.2 氮素对棉花幼苗养分吸收与分配的影响
磷和钾是作物生长不可或缺的大量元素。磷肥主要促进植物生殖生长,还可促进幼苗根系生长[34]。本研究中,极度缺氮处理(N0和N0.04)能显著提高根系中磷的含量,而低氮(N0.4)处理能显著提高地上部磷的含量,表明不同氮浓度对磷的吸收和分配有显著影响。钾参与植物活细胞的许多生理过程,还影响植物光合作用、蛋白质代谢和韧皮部运输[35]。在本研究中,随着氮浓度的增加,除N8处理外,其余各处理根系钾含量无显著差异,而地上部钾含量显著增加。植物缺氮时,根系吸收的钾优先供应根系自身生长需求,因而根系钾含量差异不大,且根系钾含量较地上部高,地上部钾含量差异显著,进而对植株地上部生长产生显著影响,这与Yang等[36]的研究结果一致。钙被称为“植物细胞代谢的总调节剂”,是调节细胞内和细胞外信息交流的重要第二信使[37]。本试验中,随着氮浓度的增加,根系和地上部的氮含量和钙含量均显著增加,说明在0~4 mmol·L-1Ca(NO3)2范围内增加氮浓度可显著促进棉花幼苗对氮和钙的吸收,这可能也是N4处理下棉花幼苗生长最好的原因之一。有研究表明随着施氮量的增加,植株氮含量、叶绿素含量和蛋白质含量显著增加[38]。适当提高氮浓度可促进棉花幼苗对钙的吸收[10, 39];钙随水移动,与叶片组织相比,很少有水移动到根,所以钙在地上部的浓度比在根中要高得多[40],本研究结果与之一致。受环境因素的影响,植物器官中的养分分布呈现出不同的格局[41]。30种沙漠植物的叶中氮和磷浓度比茎和根更高[42]。但更普遍的观点是,在正常条件下,吸收的NO3-大部分被运输到地上部或作为临时氮库储存在液泡中,而在不利环境条件下,更多的NO3-分配到根系,从而提高植物的抗逆性[43],本研究结果同样显示缺氮处理提高了根系养分分配比例。
在0~4 mmol·L-1Ca(NO3)2范围内,随着氮浓度的增加,棉花幼苗光合能力显著提高,有效CO2羧化效率显著增强,全株干物质质量也显著提高,而胞间CO2浓度降低。光合作用为养分吸收与代谢提供了能量与碳骨架,蒸腾速率的提高也有利于养分往地上部转运,因此,这可能是随氮浓度增加,地上部养分分配比例提高的原因之一。相反,在缺氮条件下,根系吸收的养分一方面可能优先供应自己生长需求,另一方面缺氮导致光合能力与蒸腾速率降低使得养分往地上部转运的能量与动力减弱,因而根系养分含量占比随氮浓度增加而下降,这可能也是低氮处理显著抑制地上部生长而对根系生长影响较小甚至促进根系伸长与增殖的原因之一。
3.3 氮素吸收利用效率及其影响因子
NUpE和NUtE是氮素利用效率的两个重要评价指标,分别描述了从土壤中获取氮的能力和利用吸收的氮生产可收获器官的能力[3]。许多研究报道了根系形态性状与氮素利用效率呈正相关,且受基因型的影响比受氮浓度的影响更大[3, 8, 14]。在本研究中,随着氮浓度的增加,棉花幼苗NUpE和NUtE均显著下降。聚类分析结果表明,NUpE、NUtE与根冠比、根干物质质量占比、根系氮、磷、钾、钙含量分配比等相关性强,它们表现出一致的变化规律。这表明,低氮处理显著增加了根系养分的分配比例,促进了根系的伸长和增殖,提高了根干物质质量和根冠比,这可能是低氮条件下根系吸收和利用氮素效率高的原因之一。研究表明,在中氮处理(240 kg·hm-2)下,棉花地上部和铃生物量的增加与根系特别是浅部根系的显著增加有关,从而提高了籽棉产量[44]。氮高效油菜品种营养生长期根长密度较高,有利于氮的吸收和生殖生长,可作为氮高效品种筛选的一个有效形态特征[45]。根系构型是水分和养分吸收效率的关键决定因素,根系构型的变化对玉米生物量和产量的增加有直接影响[46]。Postma等[47]报告称,增加侧根分支密度可以增加磷的吸收。Neto等[48]发现,不同咖啡品种的磷利用效率存在差异,在低磷供应条件下,所有品种的磷吸收效率与根冠比呈显著正相关。以上众多研究均表明养分吸收利用效率与根系形态密切相关,本研究结果与之一致。通过调控根系构型来优化土壤中根系的分布,从而提高养分吸收,这将成为农业领域的一个重要课题,现代作物育种正在利用根系形态的调控来提高作物生产力、养分利用效率,并减少氮肥投入[49]。
4 结论
适宜氮浓度1、4、8 mmol·L-1Ca(NO3)2可显著促进棉花幼苗对其他养分的吸收,并提高净光合速率与蒸腾速率,使地上部养分分配比例显著提高,从而使植株旺盛生长。4 mmol·L-1Ca(NO3)2是棉花苗期最适宜的氮浓度,植株体内N∶P∶K∶Ca最大累积量质量比约为1∶0.2∶1.2∶0.5。适度减氮即1 mmol·L-1Ca(NO3)2会轻度抑制地上部生长,但提高了根系养分分配比例,促进根系伸长与增殖,而NUpE、NUtE与根冠比正相关。缺氮如0、0.04、0.4 mmol·L-1Ca(NO3)2处理则会降低根系数量,提高根系直径,严重抑制地上部生长。
参考文献:
[1] 魏梦婷, 高维新. 中国棉花国际竞争力及影响因素分析[J/OL]. 中国棉花, 2023, 50(6): 1-5[2024-01-08]. https://doi.org/10.11963/cc20220197.Wei Mengting, Gao Weixin. Analysis on international competitiveness of Chinese cotton and its influencing factors[J/OL]. China Cotton, 2023, 50(6): 1-5[2024-01-08]. https://doi.org/10.11963/cc20220197.
[2] Yang A, Qi M, Wang X, et al. Refined cottonseed oil as a replacement for soybean oil in broiler diet[J/OL]. Food Science and Nutrition, 2019, 7(3): 1027-1034[2024-01-08]. https://doi.org/10.1002/fsn3.933.
[3] Shah A N, Javed T, Singhal R K, et al. Nitrogen use efficiency in cotton: challenges and opportunities against environmental constraints[J/OL]. Frontiers in Plant Science, 2022, 13: 970339[2024-01-08]. https://doi.org/10.3389/fpls.2022.970339.
[4] Lynch J P. Roots of the second green revolution[J/OL]. Australian Journal of Botany, 2007, 55(5): 493-512[2024-01-08]. https://doi.org/10.1016/S0264-410X(02)00552-2.
[5] Giehl R F, Gruber B D, von Wirén N. It's time to make changes: modulation of root system architecture by nutrient signals[J/OL]. Journal of Experimental Botany, 2014, 65(3): 769-778[2024-01-08]. https://doi.org/10.1093/jxb/ert421.
[6] Forde B G. Nitrogen signalling pathways shaping root system architecture: an update[J/OL]. Current Opinion in Plant Biology, 2014, 21: 30-36[2024-01-08]. https://doi.org/10.1016/j.pbi.2014.06.004.
[7] Sun X C, Chen F J, Yuan L X, et al. The physiological mechanism underlying root elongation in response to nitrogen deficiency in crop plants[J/OL]. Planta, 2020, 251(4): 84[2024-01-08]. https://doi.org/10.1007/s00425-020-03376-4.
[8] Kun G A, Chen F J, Yuan L X, et al. Cell production and expansion in the primary root of maize in response to low-nitrogen stress[J/OL]. Journal of Integrative Agriculture, 2014, 13(11): 2508-2517[2024-01-08]. https://doi.org/10.1016/S2095-3119(13)60523-7.
[9] Li P C, Chen F J, Cai H G, et al. A genetic relationship between nitrogen use efficiency and seedling root traits in maize as revealed by QTL analysis[J/OL]. Journal of Experimental Botany, 2015, 66(11): 3175-3188[2024-01-08]. https://doi.org/10.1093/jxb/erv127.
[10] Gruber B D, Giehl R F, Friedel S, et al. Plasticity of the Arabidopsis root system under nutrient deficiencies[J/OL]. Plant Physiology, 2013, 163(1): 161-179[2024-01-08]. https://doi.org/10.1104/pp.113.218453.
[11] Krouk G, Lacombe B, Bielach A, et al. Nitrate-regulated auxin transport by NRT1.1 definesa mechanism for nutrient sensing in plants[J/OL]. Developmental Cell, 2010, 18(6): 927-937[2024-01-08]. https://doi.org/10.1016/j.devcel.2010.05.008.
[12] 孙佳丽, 李洪波, 张爱平. 土壤养分异质性对玉米地上部、根系生长及种内竞争的影响[J/OL]. 中国农业大学学报, 2022, 27(8): 35-45[2024-01-08]. https://doi.org/ 10.11841/j.issn.1007-4333.2022.08.04.Sun Jiali, Li Hongbo, Zhang Aiping. Effects of nutrient heterogeneity on shoot and root growth of Zea mays and intraspecific competition[J/OL]. Journal of China Agricultural University, 2022, 27(8): 35-45[2024-01-08]. https://doi.org/ 10.11841/j.issn.1007-4333.2022.08.04.
[13] 孟凡, 罗建新, 蔡叶, 等. 土壤速效磷对烟草生长发育及干物质积累与分配的影响[J/OL]. 作物杂志, 2022, 38(2): 203-210[2024-01-08]. https://doi.org/10.16035/j.issn.1001-7283.Meng Fan, Luo Jianxin, Cai Ye, et al. Effects of soil available phosphorus on tobacco growth and dry matter accumulation and distribution[J/OL]. Crops, 2022, 38(2): 203-210[2024-01-08]. https://doi.org/10.16035/j.issn.1001-7283.
[14] Iqbal A. 棉花氮素高效利用的生理和分子机制研究[D]. 北京: 中国农业科学院, 2020.Iqbal A. The physiological and molecular mechanisms of nitrogen use efficiency in cotton[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[15] Asif I, Dong Q, Wang X R, et al. Genotypic variation in root morphology, cotton subtending leaf physiology and fiber quality against nitrogen[J/OL]. Journal of Cotton Research, 2021, 4: 32 [2024-01-08]. https://doi.org/10.1186/s42397-021-00107-2.
[16] 祝令晓. 低氮条件下棉花根冠形态、生理及根系转录组研究[D]. 河北: 河北农业大学, 2022.Zhu Lingxiao. Study on cotton root and shoot morphological and physiological characteristics and root transcriptome under low nitrogen conditions[D]. Hebei: Hebei Agricultural University, 2022
[17] 邓忠, 翟国亮, 宗洁, 等. 干旱区水氮调控对棉花根、冠生长特性及产量的影响[J/OL].中国土壤与肥料, 2015(6): 57-64[2024-01-08]. https://doi.org/10.11838/sfsc.20150609.Deng Zhong, Zhai Guoliang, Zong Jie, et al. Effects of water and nitrogen regulation on root and shoot growth characteristics and yield of cotton in arid area[J/OL]. Soil and Fertilizer Sciences in China, 2015(6): 57-64[2024-01-08]. https://doi.org/10.11838/sfsc.20150609.
[18] 贾赵东, 马佩勇, 边小峰, 等. 不同施磷水平下甘薯干物质积累及其氮磷钾养分吸收特性[J/OL]. 西南农业学报, 2016, 29(6): 1358-1365[2024-01-08]. https://doi.org/10.16213/j.cnki.scjas.2016.06.022.Jia Zhaodong, Ma Peiyong, Bian Xiaofeng, et al. Effects of different phosphorus application rates on dry matter accumulation and N, P, K absorption and utilization in sweetpotato[J/OL]. Southwest China Journal of Agricultural Sciences, 2016, 29(6): 1358-1365[2024-01-08]. https://doi.org/10.16213/j.cnki.scjas.2016.06.022.
[19] 薛欣欣, 吴小平, 王文斌, 等. 植物-土壤系统中钾镁营养及其交互作用研究进展[J/OL]. 土壤, 2019, 51(1): 1-10[2024-01-08]. https://doi.org/10.13758/j.cnki.tr.2019.01.001.Xue Xinxin, Wu Xiaoping, Wang Wenbin, et al. Progress of potassium, magnesium and their interaction in plant-soil system[J/OL]. Soils, 2019, 51(1): 1-10[2024-01-08]. https://doi.org/10.13758/j.cnki.tr.2019.01.001.
[20] 杜春明. 氮磷配施对燕麦生长发育及干物质积累的影响[D]. 沈阳: 辽宁大学, 2021.Du Chunming. Combined application of nitrogen and phosphorus on the growth and development of oats and dry matter accumulation[D]. Shenyang: Liaoning University, 2021.
[21] 高璐阳, 房增国. 施氮对鲜食型甘薯干物质及养分积累与分配特性的影响[J/OL]. 华北农学报, 2015, 30(4): 206-212[2024-01-08]. https://doi.org/10.7668/hbnxb.2015.04.035.Gao Luyang, Fang Zengguo. Effects of nitrogen application on characteristics of dry matter and nutrient accumulation and distribution of fresh-eating sweet potato[J/OL]. Acta Agriculturae Boreali-Sinica, 2015, 30(4): 206-212[2024-01-08]. https://doi.org/10.7668/hbnxb.2015.04.035.
[22] 陈静, 刘连涛, 孙红春, 等. 氮素水平对棉花幼苗生长和光合特性的影响[J/OL]. 棉花学报, 2013, 25(5): 403-409[2024-01-08]. https://doi.org/10.3969/j.issn.1002-7807.2013.05.005.Chen Jing, Liu Liantao, Sun Hongchun, et al. Effects of nitrogen concentrations on cotton (Gossypium hirsutum L.) seedling growth and photosynthetic characteristics[J/OL]. Cotton Science, 2013, 25(5): 403-409[2024-01-08]. https://doi.org/10.3969/j.issn.1002-7807.2013.05.005
[23] 李永竟. 棉花幼苗根冠生长及叶绿素荧光特性对水氮磷耦合的响应[D]. 开封: 河南大学, 2018.Li Yongjing. Response of growth and chlorophyll fluorescence characteristics of cotton seedlings to coupling of water, nitrogen and phosphorus[D]. Kaifeng: Henan University, 2018
[24] 王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015.Wang Xuekui, Huang Jianliang. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2015.
[25] 秦宇坤, 李鹏程, 郑苍松, 等. 施氮量对低肥力棉田土壤氮素及棉花养分吸收利用影响[J/OL]. 棉花学报, 2019, 31(3): 242-253[2024-01-08]. https://doi.org/10.11963/1002-7807.qykxwx.20190430.Qin Yukun, Li Pengcheng, Zheng Cangsong, et al. Effects of nitrogen application rates on soil nitrogen content, nutrient uptake and utilization of cotton in low fertility fields[J/OL]. Cotton Science, 2019, 31(3): 242-253[2024-01-08]. https://doi.org/10.11963/1002-7807.qykxwx.20190430.
[26] Liu T, Ren T, White P J, et al. Storage nitrogen co-ordinates leaf expansion and photosynthetic capacity in winter oilseed rape[J/OL]. Journal of Experimental Botany, 2018, 69(12): 2995-3007[2024-01-08]. https://doi.org/10.1093/jxb/ery134.
[27] Hernández-Montes E, Tomás M, Escalona J M, et al. Leaf growth rate and nitrogen content determine respiratory costs during leaf expansion in grapevines[J/OL]. Physiologia Plantarum, 2019, 165(4): 746-754[2024-01-08]. https://doi.org/10.1111/ppl.12769.
[28] Zhang Y F, Luo J J, Peng F T, et al. Application of bag-controlled release fertilizer facilitated new root formation, delayed leaf, and root senescence in peach trees and improved nitrogen utilization efficiency[J/OL]. Frontiers in Plant Science, 2021, 12: 627313[2024-01-08]. https://doi.org/10.3389/FPLS.2021.627313.
[29] Havé M, Marmagne A, Chardon F, et al. Nitrogen remobilization during leaf senescence: lessons from Arabidopsis to crops[J/OL]. Journal of Experimental Botany, 2017, 68(10): 2513-2529[2024-01-08]. https://doi.org/10.1093/jxb/erw365.
[30] Weemstra M, Mommer L, Visser E J, et al. Towards a multidimensional root trait framework: a tree root review[J/OL]. The New Phytologist, 2016, 211(4): 1159-1169[2024-01-08]. https://doi.org/10.1111/nph.14003.
[31] Ma Z Q, Guo D L, Xu X L, et al. Evolutionary history resolves global organization of root functional traits[J/OL]. Nature, 2018, 555(7694): 94-97[2024-01-08]. https://doi.org/10.1038/nature25783.
[32] Luo W, Zai X Y, Sun J Y, et al. Coupling root diameter with rooting depth to reveal the heterogeneous assembly of root-associated bacterial communities in soybean[J/OL]. Frontiers in Microbiology, 2021, 12: 783563[2024-01-08]. https://doi.org/10.3389/FMICB.2021.783563.
[33] 占亚楠. 控释氮肥提高我国棉花产量和纤维品质的元分析[J/OL]. 中国棉花, 2023, 50(4): 6-12[2024-01-08]. https://doi.org/10.11963/cc20220116.Zhan Ya'nan. Meta-analysis of controlled release nitrogen fertilizers in improving cotton yield and fiber quality in China[J/OL]. China Cotton, 2023, 50(4): 6-12[2024-01-08]. https://doi.org/10.11963/cc20220116.
[34] Yang H B, Zhang X, Gaxiola R A. Over-expression of the Arabidopsis proton-pyrophosphatase AVP1 enhances transplant survival, root mass, and fruit development under limiting phosphorus conditions[J/OL]. Journal of Experimental Botany, 2014, 65(12): 3045-3053[2024-01-08]. https://doi.org/10.1093/jxb/eru149.
[35] 武兆云, 薛刚, 孙聚涛, 等. 拟南芥钾离子吸收、转运及低钾胁迫的分子机理研究进展[J/OL]. 植物科学学报, 2022, 40(3): 426-436[2024-01-08]. https://doi.org/10.11913/PSJ.2095-0837.2022.30426.Wu Zhaoyun, Xue Gang, Sun Jutao, et al. Advances in research on the molecular mechanisms of potassium absorption, transport, and low potassium stress in Arabidopsis thaliana(L.) Heynh.[J/OL]. Plant Science Journal, 2022, 40(3): 426-436[2024-01-08]. https://doi.org/10.11913/PSJ.2095-0837.2022.30426.
[36] Yang T Y, Zhang S, Hu Y B, et al. The role of a potassium transporter OsHAK5 in potassium acquisition and transport from roots to shoots in rice at low potassium supply levels[J/OL]. Plant Physiology, 2014, 166(2): 945-959[2024-01-08]. https://doi.org/10.1104/pp.114.246520.
[37] Chen L, Ren F, Zhou L, et al. The Brassica napus Calcineurin B-Like 1/CBL-interacting protein kinase 6(CBL1/CIPK6) component is involved in the plant response to abiotic stress and ABA signalling[J/OL]. Journal of Experimental Botany, 2012, 63(17): 6211-6222[2024-01-08]. https://doi.org/10.1093/jxb/ers273.
[38] Zhang L H, Sun S M, Liang Y H, et al. Nitrogen levels regulate sugar metabolism and transport in the shoot tips of crabapple plants[J/OL]. Frontiers in Plant Science, 2021, 12: 626149[2024-01-08]. https://doi.org/10.3389/FPLS.2021.626149.
[39] Weng X H, Li H, Ren C S, et al. Calcium regulates growth and nutrient absorption in poplar seedlings[J/OL]. Frontiers in Plant Science, 2022, 13: 887098[2024-01-08]. https://doi.org/10.3389/FPLS.2022.887098.
[40] Gao H B, Wu X L, Zorrilla C, et al. Fractionating of calcium in tuber and leaf tissues explains the calcium deficiency symptoms in potato plant overexpressing CAX1[J/OL]. Frontiers in Plant Science, 2020, 10: 1793[2024-01-08]. https://doi.org/10.3389/FPLS.2022.887098.
[41] Peng Z H, Du Y, Niu S Y, et al. Differences in nitrogen and phosphorus sinks between the harvest and non-harvest of Miscanthus lutarioriparius in the Dongting Lake wetlands[J/OL]. Frontiers in Plant Science, 2022, 13: 989931[2024-01-08]. https://doi.org/10.3389/FPLS.2022.989931.
[42] Luo Y, Peng Q W, Li K H, et al. Patterns of nitrogen and phosphorus stoichiometry among leaf, stem and root of desert plants and responses to climate and soil factors in Xinjiang, China[J/OL]. Catena, 2021, 199: 105100[2024-01-08]. https://doi.org/10.1016/j.catena.2020.105100
[43] Jian S F, Luo J S, Liao Q, et al. NRT1.1 regulates nitrate allocation and cadmium tolerance in Arabidopsis[J/OL]. Frontiers in Plant Science, 2019, 10: 384[2024-01-08]. https://doi.org/10.3389/fpls.2019.00384.
[44] Chen J, Liu L, Wang Z, et al. Nitrogen fertilization increases root growth and coordinates the root-shoot relationship in cotton[J/OL]. Frontiers in Plant Science, 2020, 11: 880[2024-01-08]. https://doi.org/10.3389/fpls.2020.00880.
[45] Ulas A, Schulte auf'm Erley G, Kamh M, et al. Root-growth characteristics contributing to genotypic variation in nitrogen efficiency of oilseed rape[J/OL]. Journal of Plant Nutrition and Soil Science, 2012, 175(3): 489-498[2024-01-08]. https://doi.org/10.1002/jpln.201100301.
[46] Liu Z G, Gao K, Shan S C, et al. Comparative analysis of root traits and the associated qtls for maize seedlings grown in paper roll, hydroponics and vermiculite culture system[J/OL]. Frontiers in Plant Science, 2017, 8: 436[2024-01-08]. https://doi.org/10.3389/fpls.2017.00436.
[47] Postma J A, Dathe A, Lynch J P. The optimal lateral root branching density for maize depends on nitrogen and phosphorus availability[J/OL]. Plant Physiology, 2014, 166(2): 590-602[2024-01-08]. https://doi.org/10.1104/pp.113.233916.
[48] Neto A P, Favarin J L, Hammond J P, et al. Analysis of phosphorus use efficiency traits in Coffea genotypes reveals Coffea arabica and Coffea canephora have contrasting phosphorus uptake and utilization efficiencies[J/OL]. Frontiers in Plant Science, 2016, 7: 408[2024-01-08]. https://doi.org/10.3389/fpls.2016.00408.
[49] He Y J, Hu D X, You J C, et al. Genome-wide association study and protein network analysis for understanding candidate genes involved in root development at the rapeseed seedling stage[J/OL]. Plant Physiology and Biochemistry, 2019, 137: 42-52[2024-01-08]. https://doi.org/10.1016/j.plaphy.2019.01.028.
(责任编辑:王国鑫 责任校对:王小璐)
收稿日期:2023-08-03 第一作者简介:陈丹丹(1994―),女,博士,cdd_66@webmail.hzau.edu.cn。 *通信作者:ygzh9999@hzau.edu.cn
基金项目:湖北洪山实验室项目(2021hszd006)
