赶黄草水煎液对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌生物膜形成的影响
2023-04-29覃俊媛孙晨彭成谢晓芳
覃俊媛 孙晨 彭成 谢晓芳
摘要:目的 探究赶黄草水煎液在体外对金黄色葡萄球菌(SA)和耐甲氧西林金黄色葡萄球菌生物膜(MRSA)形成的影响。方法 采用微量肉汤稀释法测定赶黄草水煎液对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC),根据MIC和MBC绘制杀菌曲线,采用结晶紫染色法和激光共聚焦观察赶黄草水煎液对SA和MRSA生物膜形成的影响,并通过测定胞外多糖和胞外DNA的含量研究赶黄草水煎液破坏SA和MRSA生物膜的作用方式。结果 赶黄草水煎液对SA的MIC和MBC分别为1.36和2.71 mg/mL,对MRSA的MIC和MBC为2.71和5.73 mg/mL;赶黄草水煎液可使SA和MRSA均生长受到抑制,抑制生物膜的形成、减少胞外多糖和胞外DNA的释放。结论 赶黄草水煎液对SA和MRSA具有良好的抑菌作用,可通过抑制胞外多糖和DNA的分泌破坏生物膜的形成。
关键词:赶黄草;金黄色葡菌球菌;耐甲氧西林金黄色葡萄球菌;抗菌;细菌生物膜
中图分类号:R978.1文献标志码:A
Abstract Objective To explore the effects of Penthorum chinense Pursh decoction on the biofilm of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus in vitro. Methods The minimal inhibitory concentration (MIC) and minimal bactericidal concentration (MBC) of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus were determined by the micro broth dilution method, and the bactericidal curve was drawn according to MIC and MBC. The effects of Penthorum chinense Pursh decoction on the biofilm formation of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus were observed by crystal violet staining and laser confocal technique. By measuring the content of extracellular polysaccharide and extracellular DNA, the mechanism of its action on destroying biofilm of Staphylococcus aureus (SA) and methicillin-resistant Staphylococcus aureus (MRSA) was studied. Results The MIC and MBC of SA were 1.36 mg/mL and 2.71 mg/mL, and the MIC and MBC of MRSA were 2.71 and 5.73 mg/mL, respectively; under the action of Penthorum chinense Pursh decoction, the growth of SA and MRSA was inhibited. The results of crystal violet staining showed that the area of the bacterial biofilm was decreased under the action of Penthorum chinense Pursh decoction. Similarly, Penthorum chinense Pursh decoction could destroy the formation of bacterial biofilm of SA and MRSA through laser confocal observation. Moreover, it reduced the release of extracellular polysaccharides and extracellular DNA. Conclusion The Penthorum chinense Pursh decoction has remarkable antibacterial effects on Staphylococcus aureus and methicillin-resistant Staphylococcus aureus, and destroys the formation of biofilm by reducing the secretion of extracellular polysaccharide and DNA.
Key words Penthorum chinense Pursh; Staphylococcus aureus; Methicillin-resistant Staphylococcus aureus; Antibacterial; Bacterial biofilm
金黃色葡萄球菌(Staphylococcus aureus ,SA)是一种条件性致病的革兰阳性菌,可引起心包炎、脑膜炎、败血症和脓毒血症等感染性疾病[1]。在抗生素被发现之前,金黄色葡萄球菌菌血症患者的死亡率超过80%[2]。20世纪40年代初青霉素被发现,随着青霉素的应用,极大改善了治疗感染的困境;1960年,英国一家医院首次分离出青霉素耐药菌株[2]。耐甲氧西林金黄色葡萄球菌(methicillin-resistant S. aureus,MRSA)成为了一个世界性的难题,它几乎对所有可用的β-内酰胺类药物产生了耐药性。万古霉素曾被认为是治疗严重MRSA感染的最后选择之一[3],然而近年来发现MRSA的耐药性包括万古霉素以及相对较新的药物,如利奈唑胺和达托霉素[4-5]。MRSA 还可获得对多种替代抗菌药物的耐药性,使感染的治疗更加复杂[6]。自21世纪以来,中国SA的耐药性逐年上升,MRSA在医院和社区检出率较高,在健康的人群中MRSA携带率达21.2%[7-8]。有报道称在371名金黄色葡萄球菌菌血症患者中,MRSA占社区发病病例的42.2%和医院发病病例的74.5%,给治疗带来比较大的困难[9]。面对耐药率持续不断上升,而新抗生素的研发大幅度下降的情形,亟需寻找新抗菌剂或新方法来解决上述问题。
在中国传统医学中,中药及蒙药、藏药和苗药等少数民族药有悠久的临床应用历史,在治疗细菌性感染疾病中有着优势。赶黄草为虎耳草科扯根菜属植物扯根菜(Penthorum chinense Pursh)的地上部分,是苗族民间习用药,现收录于《四川省中药材标准》(2010年版)和《湖南省中药材标准》(2009年版)[10];在传统上常用来治疗黄疸、肝炎、水肿等。由赶黄草制成的中成药肝苏颗粒,有降酶、保肝、退黄、健脾功效,在临床用于治疗多种肝炎,包括乙型肝炎、急性病毒性肝炎[11]。赶黄草主要成分是槲皮素、槲皮苷、乔松素、东莨菪素和赶黄草苷等[12]。现代药理研究表明,赶黄草具有保肝、抗脂肪肝、抗肝纤维化和抗乙肝病毒等作用[11,13-14]。也有文献报道赶黄草水煎液及提取物可以在体外抑制金黄色葡萄球菌的生长[15-17]。然而关于抗耐甲氧西林金黄色葡萄球活性研究暂未见报道。因此本研究针对当前细菌耐药性的难题,采用体外抗菌实验方法,评价赶黄草水煎液对SA、MRSA的抗菌活性,并从细菌生物膜方面研究其可能的机制,为赶黄草抗菌活性的明确和相关药物开发提供基础依据。
1 材料和仪器
1.1 材料和试剂
赶黄草,购自四川省泸州市古蔺县古家赶黄草种植合作社,经成都中医药大学高继海副教授鉴定为虎耳草科扯根菜属扯根菜;金黄色葡萄球菌[CMCC(B)26001]购自中国食品药品检定研究院,耐甲氧西林金黄色葡萄球菌(CCTCC AB 2015112)购自中国典型培养物保藏中心;MHB培养基(Oxoid公司,批号:2963434);MHA培养基(Oxoid公司,批号:2487022);营养琼脂培养(北京奥博星生物技术有限公司,批号:20200602);氯化三苯四氮唑(TTC)(Sigma-Aldrich公司,批号:BCCB1241);1%结晶紫染色液(北京索莱宝科技有限公司,批号:20200821);SYTO9(Thermo Fisher Scientific,批号:2266591);D(+)-无水葡萄糖(北京索莱宝科技有限公司,批号:1122A0229);苯酚(成都市科隆化学品有限公司,批号:2021071201)等。
1.2 试验器材
DH124L电热恒温培养箱;IS-4恒温振荡培养箱;AL104 电子天平;Cytation 5细胞成像微板检测系统;LEGEND MICRO 21R离心机; FV-1200激光共焦显微镜。
2 方法
2.1 趕黄草水煎液制备
取赶黄草100 g,切碎,加水煎煮3次。第一次加10倍量的水,浸泡30 min,第二、三次加8倍量的水,每次煎煮2 h。每次滤过取水煎液,将3次煎液合并,浓缩到含生药1.39 g/mL。以108℃,2 min高压灭菌,冷却后放置-20℃培养。使用前用纯水稀释成173.75 mg/mL。
2.2 菌液配制
所有菌株都在营养琼脂平皿上35℃隔夜培养。使用前,挑取适量菌落用生理盐水调整浓度成0.5麦氏(1.5×108 CFU/mL),用MHB培养基稀释30倍,最终菌液浓度为5 ×106 CFU/mL。
2.3 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定
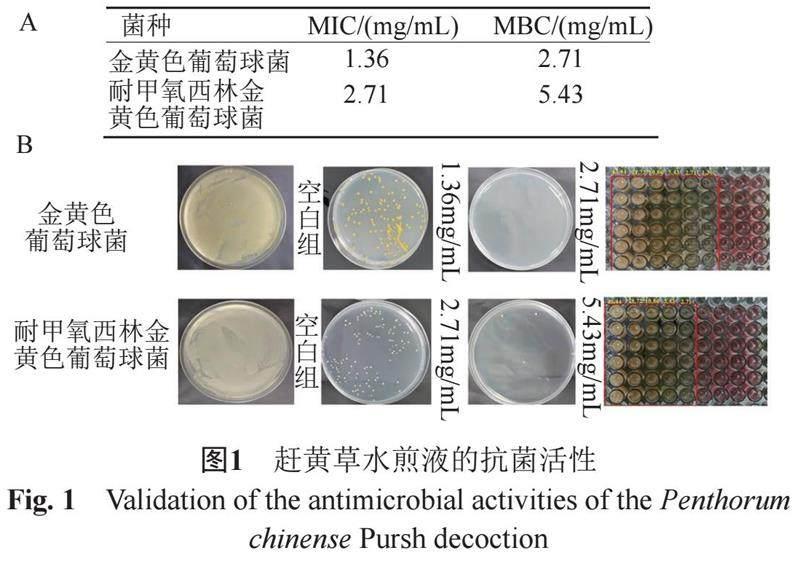
根据临床和实验室标准协会(CLSI2020版)的肉汤微量稀释法,使用96孔微板进行试验。96孔板除四周孔每孔加入100 μL MHB 培养基,于第2列每孔加入100 μL 173.75 mg/mL赶黄草水煎液,混匀,二倍稀释至第9列。第10列为空白对照,第11列为阴性对照。第2列到第10列每孔再加入100 μL菌液,第11列加入同等体积的培养基。培养24 h后,每孔加入0.25%TTC,孵育30 min,肉眼直接观察,变红色孔代表有菌,未变红的最低浓度孔判定为MIC。吸取上清液100 μL 接种至MHA平皿,培养24 h,长出菌落小于5个判定为MBC,实验重复3次。
2.4 杀菌曲线的绘制
移取SA和MRSA菌液于12孔板中,并向其加入不同浓度的赶黄草水煎液,使其最终浓度为2×MIC、1×MIC、1/2MIC、1/4MIC,选择不含药的菌液为空白组对照组,在35℃、120 r/min条件下处理24 h。分别在孵育0、4、8、16和24 h测定各组细菌数。每组设3个重复,实验重复3次。
2.5 赶黄草水煎液对SA和MRSA生物膜的影响
2.5.1 结晶紫半定量黏附实验
96孔板中分别接种200 ?LSA和MRSA菌液,35℃静置培养48 h后,清洗除去培养基和浮游菌,然后分别加入相对应的2MIC、MIC、1/2MIC,同时以不含赶黄草水煎液的孔作为空白对照,于 35℃孵育24 h。弃孔板中上清液,清洗3次,自然晾干之后每孔加入150 ?L甲醇固定15 min,去掉甲醇自然晾干,加入150 ?L 0.1%结晶紫染色15 mim,用自来水清洗,自然干燥,加入150 ?L 95%乙醇,37℃溶解30 min,用酶标仪在590 nm波长处测量各孔的吸光度。
2.5.2 激光共聚焦显微镜观察赶黄草水煎液对细菌生物膜的破坏
每个共聚焦培养皿中加入2 mL 菌液,35℃静置培养72 h。弃上清液,清洗3次,加入不同浓度的赶黄草水煎液作用8 h,以空白培养基作为对照。弃去液体,洗净,加入1 ?L SYTO9染色液,孵育20 min。除去染料,用激光共聚焦显微镜扫描。
2.6 赶黄草水煎液对SA和MRSA胞外多聚物的作用
2.6.1 赶黄草水煎液对SA 和MRSA胞外多糖的影响
参照Li等[18]的方法,将不同浓度的赶黄草水煎液加入含菌培养基中,终浓度为1×MIC、1/2MIC、1/4MIC,选择不含药菌液为空白对照组,在35℃、120 r/min条件下处理24 h。培养结束后,取 1mL离心10 min (12000 g,4℃),取上清液用滤膜(0.22 μm)过滤,加入3 mL预冷的乙醇,置于4℃冰箱过夜。次日,以15000 r/min、4℃离心10 min,弃去上清液,加入1 mL的去离子水以溶解多糖。胞外多糖含量的测定按照苯酚硫酸法于490 nm处进行测定,并同时采用葡萄糖作为标准物,测得标准曲线的方程为y=0.10756+4.45949x (R2=0. 0.9968)。
2.6.2 赶黄草水煎液对SA和MRSA胞外DNA的影响
参照Xie等[19]的方法,将不同浓度的赶黄草水煎液加入到含菌培养基中,终浓度为1×MIC、1/2MIC、1/4MIC,选择不含药的菌液为空白组对照组,在35℃、120 r/min条件下处理24 h。培养结束后,在孔板每孔加入20 μL 0.5 mol/L的EDTA放入4℃冷却1 h。弃去上清液,每孔加入700 μL 50 mmol/L 的TEN缓冲液进行吹打。在液体放入4℃预冷的离心管,离心5 min(18000 r/min,4℃)。取上清液,加入300 μL TE缓冲液和相同体积的苯酚:氯仿:异戊醇(25:24:1,V/V/V)混合液,涡旋萃取。离心10 min(12000 r/min,4℃),取上清液,加入相同体积的氯仿:异戊醇(24:1,V/V)混合液,涡旋萃取,离心10 min(12000 r/min,4℃)。取上层水相,加入3倍体积预冷的无水乙醇,加入1/10 3 mol/L醋酸钠,混合均匀,放入-20℃过夜。次日,离心20 min(18000 r/min,4℃),弃去上清液加入预冷的乙醇重悬,晾干。加入30 μL TE 缓冲液,充分溶解沉淀,用酶标仪检测,胞外DNA 的相对表达量用A600表示。
3结果
3.1 赶黄草水煎液的抗菌活性
培养24 h后,根据TTC显色结果,得到赶黄草水煎液对SA和MRSA的MIC值如下图1A显示。上清液涂布平皿结果显示,赶黄草水煎液对SA的MBC值为2.71 mg/mL,MRSA的MBC为5.43 mg/mL。表明赶黄草水煎液具有抗SA和MRSA活性。
3.3 赶黄草水煎液对SA和MRSA生长曲线的影响
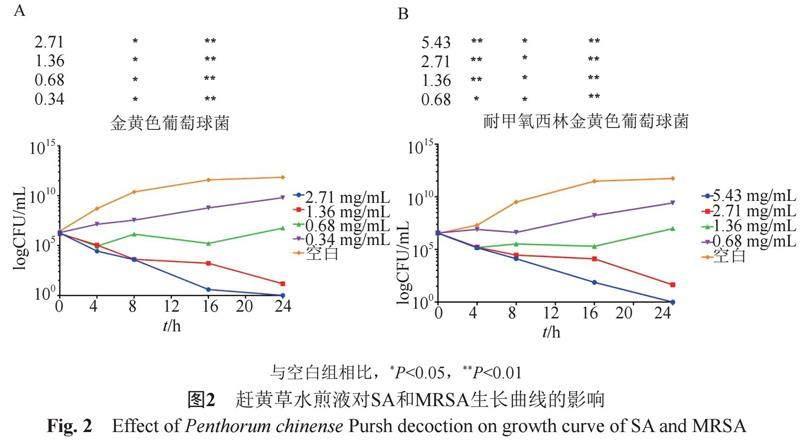
由图2可知,当赶黄草水煎液质量浓度为0时,两株细菌的生长未受到影响。当赶黄草水煎液质量浓度为0.34 mg/mL时,SA的生长趋势与空白组相似。当赶黄草水煎液质量浓度为0.68和1.36 mg/mL时,SA活菌数变化显著(P<0.05或P<0.01),说明赶黄草水煎液对SA的作用表现为抑菌方式。当赶黄草水煎液质量浓度增加到2.71 mg/mL时,SA活菌数显著降低(P<0.05或P<0.01),且在药物处理16 h后细菌数量下降至4 CFU/mL,杀菌效果大于99.9%,说明2.71 mg/mL浓度赶黄草水煎液对SA表现为杀菌作用。结果详见图2A。
当赶黄草水煎液质量浓度为0.68和1.36 mg/mL时,MRSA的生长趋势与空白组相似。当赶黄草水煎液质量浓度为2.71 mg/mL,MRSA活菌数变化显著(P<0.05或P<0.01),说明赶黄草水煎液对MRSA的作用表现为抑菌方式。当赶黄草水煎液质量浓度增加到5.43 mg/mL时,MRSA活菌数显著降低(P<0.05或P<0.01),且在药物处理24 h后细菌数量下降至1 CFU/mL,杀菌效果大于99.9%,说明5.43 mg/mL浓度赶黄草水煎液对MRSA表现为杀菌作用。结果详见图2B。结果表明赶黄草水煎液对SA和MRSA的抑制作用呈浓度相关性。
3.3 结晶紫半定量法测定赶黄草水煎液的抗生物膜效果
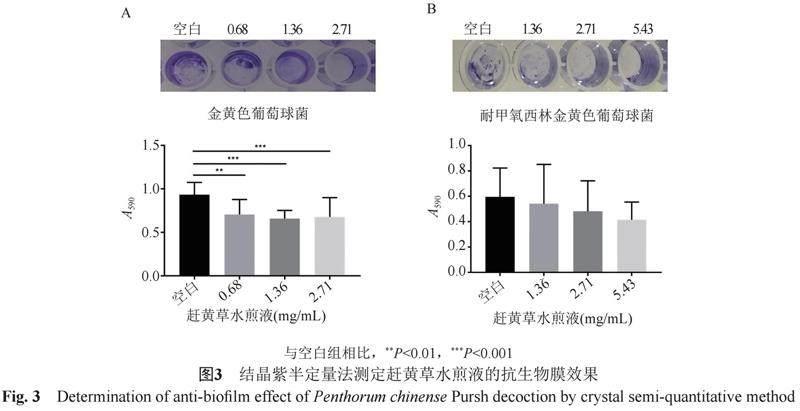
由图3可见,96孔板内细菌生物膜面积与药物浓度呈相关性。3个浓度赶黄草水煎液对SA的形成均有抑制作用(P<0.01或P<0.001),其中1.36 mg/mL的抑制作用最强(P<0.001)。赶黄草水煎液对MRSA形成有抑制作用趋势。
3.4 激光共聚焦显微镜观察赶黄草水煎液对细菌生物膜的破坏
SYTO 9是一种绿色荧光核酸染色剂,染色程度可以反映生物膜结构的稀疏,因此常用于观察药物对细菌生物膜的作用[20]。图4、5显示,随着赶黄草水煎液浓度的增加,有大量不能被SYTO 9着色区域,细菌分布稀疏,代表生物膜结构变松散,表明赶黄草水煎液以剂量依赖性方式抑制SA 和MRSA细菌生物膜的形成。
3.5 赶黄草水煎液对SA 和MRSA胞外多糖和DNA含量的影响
胞外多糖和DNA是细菌生物膜中的主要成分,是生物膜形成的关键[21-23]。由圖6A可知,赶黄草水煎液对SA胞外多糖分泌的抑制作用具有浓度依赖性,3个浓度均能显著减少胞外多糖的分泌(P<0.01)。而赶黄草水煎液3个浓度均能明显降低MRSA胞外多糖的分泌(P<0.05或P<0.01),但未呈剂量相关性,详见图6B。在胞外DNA释放方面,赶黄草水煎均能显著降低胞外DNA释放(P<0.05或P<0.01),两个菌株均呈浓度相关性,详见图7。
4 讨论
细菌生物膜是一种具有三维结构的细菌细胞群,黏附在非生物或生物表面上[24]。细菌分泌的蛋白质、胞外多糖、胞外DNA和脂质组成细胞外基质(EPS),为细菌生物膜提供机械稳定性,介导它们与惰性材料表面的粘附,其相互作用并固定细菌,将其包裹在黏性基质内以应对极端环境,抵抗抗生素和宿主免疫反应[25-26]。可见,细菌生物膜的存在提高了细菌对抗菌药物的耐药性,有研究发现生物膜内细菌的耐药性是浮游菌的10~1000倍[27-28]。生物膜形成耐药性的机制是多方面,至少包括渗透限制、抗生素外泵系统、耐药基因的传播、营养限制及生物膜表型等[29]。生物膜在SA产生耐药性中具有重要的作用[30],临床分离的MRSA菌株绝大多数具有生物膜[31]。因此,生物膜常作为药物抗菌作用的重要研究靶点之一。
SA分泌多种毒素和毒力因子如中毒性休克毒素-1 、凝集因子A、细菌生物膜,诱发多种感染[32]。随着抗生素的广泛应用,SA出现了对多种抗生素的耐药,包括β-内酰胺类抗生素、万古霉素、达托霉素、四环素类、氨基糖苷类等[33]。其对β-内酰胺类抗生素耐药性与青霉素结合蛋白(PBPs)结构的改变相关[33]。PBPs蛋白位于细菌细胞壁上,负责合成细胞壁过程中的转糖基化和转肽化,是β-内酰胺类抗生素作用的靶点,研究表明MRSA可以特异性改变PBPs蛋白的结构[34]。Hartman和Tomasz发现MRSA菌株和敏感菌株的主要差异是存在一种名为PBP2a蛋白,是一种具有转肽酶区、跨膜区和非青霉素结合区的细长蛋白,具有变构位点,它的活性部位较难被β-内酰胺类药物所接近,因此抗生素不会影响MRSA细胞壁肽聚糖的合成[35-37]。PBP2a蛋白的编码基因位于MRSA葡萄球菌染色体mec盒分型(SCCmec)上的mecA基因,因此mecA基因存在可增强MRSA的耐药性[38]。在本研究中,对赶黄草水煎液抗SA和MRSA活性进行了评估,并且在较低的浓度(1.36和2.71 mg/mL)下显示抑菌作用,最低杀菌浓度为2.71和5.43 mg/mL。动态杀菌曲线显示,赶黄草水煎液对SA和MRSA的生长具有抑制作用并呈浓度依赖性。结晶紫染色和激光共聚焦显微镜结果显示,随着赶黄草浓度的升高,结晶紫染色面积变小,表示细菌数量减少和生物膜结构的松散,提示赶黄草可破坏SA和MRSA生物膜。进一步通过检测生物膜形成关键因子胞外多糖和DNA,显示赶黄草水煎液可抑制SA和MRSA胞外多糖和DNA的释放,且对胞外DNA的合成抑制呈良好的量效正相关。以上研究结果表明,赶黄草水煎液对SA和MRSA具有杀菌作用,机制可能与其抑制生物膜的形成相关,研究结果为其抗菌作用的开发提供理论依据,也为从苗药等民族药物中发现新抗菌药物提供一种思路。然而,本研究对赶黄草的杀菌机制还需进一步研究,如药物是否改变细菌膜的通透性和细菌的形态和结构、是否抑制耐药蛋白的表达、是否改变细菌能量代谢或抑制相关酶的活性和基因表达等。
参 考 文 献
Wu S, Zhang J, Peng Q, et al. The role of Staphylococcus aureus YycFG in gene regulation, biofilm organization and drug resistance[J]. Antibiotics (Basel), 2021, 10(12):1555.
Lakhundi S, Zhang K. Methicillin-resistant Staphylococcus aureus: Molecular characterization, evolution, and epidemiology[J]. Clin Microbiol Rev. 2018, 31(4).e00020-18.
Rodvild K A, Mcconeghy K W. Methicillin-resistant Staphylococcus aureus therapy: Past, present, and future[J]. Clin Infect Dis, 2014, 58(Suppl 1): S20-S7.
Kos V N, Desjardins C A, Griggs A, et al. Comparative genomics of vancomycin-resistant Staphylococcus aureus strains and their positions within the clade most commonly associated with methicillin-resistant S. aureus hospital-acquired infection in the United States[J]. mBio, 2012, 3(3):e00020-18.
Gould I M, David M Z, Esposito S, et al. New insights into meticillin-resistant Staphylococcus aureus(MRSA) pathogenesis, treatment and resistance[J]. Int J Antimicrob Agents, 2012, 39(2): 96-104.
Liu C, Bayer A, Cosgrove S E, et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J]. Clin Infect Dis, 2011, 52(3): e18-e55.
China Antimicrobial Resistance Surveillance System. 全國细菌耐药监测网2014—2019年老年患者常见临床分离细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(02): 112-123.
Wu M, Tong X, Liu S, et al. Prevalence of methicillin-resistant Staphylococcus aureus in healthy Chinese population: A system review and meta-analysis[J]. PLoS One, 2019, 14(10): e0223599.
Wi Y M, Rhee J Y, Kang C I, et al. Clinical predictors of methicillin-resistance and their impact on mortality associated with Staphylococcus aureus bacteraemia[J]. Epidemiol Infect, 2018, 146(10): 1326-1336.
何育霖, 蒙春旺, 张潇,等. 赶黄草药材质量标准研究[J]. 中药材, 2017, 40(10): 2366-2371.
谢君. 肝苏颗粒对肝纤维化影响的实验研究[D]. 成都:成都中医药大学, 2017.
张剑, 伍淑明, 杨肖, 等. 赶黄草中化学成分研究进展[J]. 中草药, 2017, 48(21): 4571-4577.
Wang A, Lin L, Wang Y. Traditional Chinese herbal medicine penthorum chinense pursh: A phytochemical and pharmacological review[J]. American J Chin Med, 2015, 43(4): 601-620.
肖丽萍. 苗药赶黄草抗脂肪肝的实验研究[D]. 成都:成都中医药大学, 2015.
Ding B, Ding Q, Zhang S, et al. Characterization of the anti-Staphylococcus aureus fraction from Penthorum chinense Pursh stems[J]. BMC Compl Altern Med, 2019, 19(1): 219.
雷娇, 肖茂, 朱锐, 等. 赶黄草不同溶剂提取物抑菌活性的初步探讨[J]. 亚太传统医药, 2012, 8(9): 29-30.
余付香, 陈明旭, 成桥, 等. 赶黄草总黄酮分级萃取及活性分析[J]. 天然产物研究与开发, 2017, 29(6): 976-982.
Li C, Jiang C, Jing H, et al. Separation of phenolics from peony flowers and their inhibitory activities and action mechanism on bacterial biofilm[J]. Appl Microbiol Biotechnol, 2020, 104(10): 4321-4332.
Xie X, Liu X, Li Y, et al. Advanced glycation end products enhance biofilm formation by promoting extracellular DNA release through sigB upregulation in Staphylococcus aureus[J]. Front Microbiol, 2020, 11: 1479.
謝思露, 赵茂吉, 杨朝国. 水飞蓟宾对表皮葡萄球菌的抑菌机制研究[J]. 中药药理与临床, 2018, 34(6): 58-64.
Poulin M B, Kuperman L L. Regulation of biofilm exopolysaccharide production by cyclic di-guanosine monophosphate[J]. Front Microbiol, 2021, 12: 730980.
Buzzo J R, Devaraj, Gloag E S, et al. Z-form extracellular DNA is a structural component of the bacterial biofilm matrix[J]. Cell, 2021, 184(23): 5740-5758.
Yan X, Gu S, Shi Y, et al. The effect of emodin on Staphylococcus aureus strains in planktonic form and biofilm formation in vitro[J]. Arch Microbiol, 2017, 199(9): 1267-1275.
Wang B, Wei P W, Wan S, et al. Ginkgo biloba exocarp extracts inhibit S. aureus and MRSA by disrupting biofilms and affecting gene expression[J]. J Ethnopharmacol, 2021, 271: 113895.
Alpkvist E, Picioreanu C, Van Loosdrecht M C, et al. Three-dimensional biofilm model with individual cells and continuum EPS matrix[J]. Biotechnol Bioeng, 2006, 94(5): 961-979.
Abebe G M. The role of bacterial biofilm in antibiotic resistance and food contamination[J]. Int J Microbiol, 2020: 1705814.
Lu J, Turnbull L, Bueke C M, et al. Manuka-type honeys can eradicate biofilms produced by Staphylococcus aureus strains with different biofilm-forming abilities[J]. Peer J, 2014, 2: e326.
R?Mling U, Balsalobre C. Biofilm infections, their resilience to therapy and innovative treatment strategies[J]. J Intern Med, 2012, 272(6): 541-561.
姚泽明. D-酪氨酸联合万古霉素对MRSA及其生物膜的消除作用 [D]. 广州: 广州医科大学, 2017.
Rani S A, Pitts B, Beyenal H, et al. Spatial patterns of DNA replication, protein synthesis, and oxygen concentration within bacterial biofilms reveal diverse physiological states[J]. J Bacterio, 2007, 189(11): 4223-4233.
Cha J O, Yoo J I, Yoo J S, et al. Investigation of biofilm formation and its association with the molecular and clinical characteristics of methicillin-resistant Staphylococcus aureus[J]. Osong Public Health Res Perspect, 2013, 4(5): 225-232.
管程程, 于美美, 高伟, 等. 金黄色葡萄球菌的致病和耐药机制研究进展[J]. 实验与检验医学, 2017, 35(1): 1-4.
Foster T J. Antibiotic resistance in Staphylococcus aureus current status and future prospects[J]. FEMS microbiology Rev, 2017, 41(3): 430-449.
Pazos M, Vollmer W. Regulation and function of class A penicillin-binding proteins[J]. Curr Opin Microbiol, 2021, 60: 80-87.
Lim D, Strynadka N C. Structural basis for the beta lactam resistance of PBP2a from methicillin-resistant Staphylococcus aureus[J]. Nat Struct Biol, 2002, 9(11): 870-876.
Otero L H, Rojas-Altuve A, Llarrull L I, et al. How allosteric control of Staphylococcus aureus penicillin binding protein 2a enables methicillin resistance and physiological function [J]. Proc Natl Acad Sci U S A., 2013, 110(42): 16808-16813.
Hartman B J, Tomasz A. Low-affinity penicillin-binding protein associated with beta-lactam resistance in Staphylococcus aureus[J]. J Bacteri, 1984, 158(2): 513-516.
Katayama Y, Ito T, Hirmatsu K. A new class of genetic element, staphylococcus cassette chromosome mec, encodes methicillin resistance in Staphylococcus aureus[J]. Antimicro Agents Chemother, 2000, 44(6): 1549-1555.
基金項目:国家科技部重大新药创制任务(No. 2019ZX09721001-008)
作者简介:覃俊媛,女,生于1995年,在读硕士研究生,研究方向为中药药理,E-mail: junyuanqin@qq.com
