抗真菌药物非临床药效学研究技术指南
2023-04-29高路甄诚鹿辉姜远英
高路 甄诚 鹿辉 姜远英
摘要:本文是抗菌药物(包括抗细菌药物、抗真菌药物、抗结核菌药物等)非临床研究技术指南系列文章之一,是由中国药理学会化疗药理专委会组织国内从事相关研究的专家编写而成。本文主要针对真菌生物学特点,介绍了抗真菌药物非临床研究中药效学之体外药效学研究、体内药效学研究、体内PK/PD研究、抗真菌作用机制研究等方面的技术要点,其中省略了体外药效学研究中与抗细菌药物类同的内容。期望能为抗真菌药物非临床药效学研究提供参考。
关键词:抗真菌药物;非临床药效学评价;作用机制
中图分类号:R978.5文献标志码:A
Abstract This paper is one of a series of articles on the technical guidelines of pre-clinical research of antibiotic drugs including anti-bacterial drugs, antifungal drugs, and anti-tuberculosis drugs, which is compiled by domestic experts engaged in relevant research organized by the special committee of chemotherapy pharmacology of China Pharmacological Society. According to the biological characteristics of fungi, this paper mainly introduces the technical points of pre-clinical study of antifungal drugs, including in vitro pharmacodynamics, in vivo pharmacodynamics, in vivo PK/PD and antifungal mechanisms of action. The contents of in vitro pharmacodynamics similar to those of anti-bacterial drugs are omitted. It is expected to provide a reference for the pre-Clinical Pharmacodynamics research of antifungal drugs.
Key words Antifungal drugs; Non-clinical pharmacodynamic evaluation; Mechanism of action
随着免疫受损或免疫功能低下人群的增加,侵袭性真菌感染的发病率在近30年来一直呈上升趋势,已成为严重危害人类健康的致死性疾病,病死率高达30%~50%,全球每年约有150~200万人死于真菌感染[1]。真菌耐药性的产生,特别是超级耐药真菌——耳念珠菌(Candida auris)的传播[2-3],使侵袭性真菌感染的治疗面临更大困难,急需研发新結构类型、新作用机制的抗真菌药物。近年来,抗真菌药物研发已引起业界的广泛重视,但其临床前研究尚缺乏指导性的原则,本文尝试对抗真菌药物非临床研究技术要点进行综述,并对所需的技术进行了阐述,为非临床研究提供技术参考。
抗真菌药物从用途上分类,包括外用于浅表真菌感染的药物和全身应用于深部真菌感染的药物二大类。从抗真菌作用机制上主要分为:①氮唑类药物,通过抑制真菌CYP51,导致细胞膜麦角甾醇合成受阻发挥抗真菌作用[4],如酮康唑、咪康唑、氟康唑、伏立康唑、泊沙康唑、艾沙康唑[5]等,其中前二者主要用于浅表真菌感染,后四者主要用于深部真菌感染。②烯丙胺类药物,通过抑制角鲨烯环氧化酶,阻碍真菌细胞膜的麦角甾醇合成发挥抗真菌作用,如特比萘芬、布替萘芬等,主要用于浅表真菌感染[6]。③多烯类药物,通过与真菌细胞膜上的麦角甾醇结合,破坏细胞膜的屏障功能发挥抗真菌作用[7],如两性霉素B、制霉菌素等,前者主要用于系统性感染,后者主要用于局部感染。④嘧啶类药物,主要通过抑制嘧啶核苷的合成发挥抗真菌作用,如5-氟胞嘧啶,单用易产生耐药性,主要与两性霉素B或氟康唑合用治疗全身性真菌感染[8]。⑤棘白菌素类药物,通过抑制真菌细胞壁的β-(1,3)-D-葡聚糖合成酶,阻碍细胞壁的葡聚糖合成,发挥抗真菌作用,如卡泊芬净、米卡芬净和阿尼芬净等,主要用于全身性念珠菌感染的治疗[9]。
能使人致病的真菌主要包括:①皮肤癣菌类,如毛癣菌属、小孢子菌属和表皮癣菌属等,主要引起皮肤、毛发等部位的浅表真菌感染[10]。②念珠菌属,最常见,如白念珠菌、热带念珠菌、光滑念珠菌、克柔念珠菌和耳念珠菌等,可引起全身性感染或局部如消化道和泌尿生殖道黏膜感染[11]。③隐球菌属,包括新生隐球菌和格特隐球菌,主要引起全身性真菌感染,特别是隐球菌性脑膜炎等[12]。④曲霉菌,如烟曲霉、黄曲霉和黑曲霉等,常引起免疫功能受损患者的肺部感染[13]。⑤双相型真菌,如孢子丝菌属、组织胞浆菌属和球孢子菌属等,双相型真菌为自然界的腐生菌,是原发性真菌病的病原菌[14],除孢子丝菌多为皮肤外伤后感染外,其他主要引起呼吸道感染。⑥接合菌,比较常见的致病菌来自根霉属、梨头霉属、根毛霉属和毛霉属,接合菌病好发于免疫受损人群,可引起皮肤和鼻窦感染[15]。⑦暗色真菌,是一类具有黑色素样颜色的真菌,如链格孢、卡氏枝孢瓶霉、裴氏着色霉等,着色真菌病是一种慢性的,局限于皮肤和皮下组织的疾病,偶尔向深部组织浸润,甚至发生系统性感染而危及生命[16]。⑧卡氏肺孢子菌,可引起免疫受损者的肺部及全身感染[1],传统抗真菌药物对其无效,可用磺胺类药物如复方磺胺甲恶唑等治疗[17]。
抗真菌药物的非临床研究内容与其他药物相似,都包括:药效学(包括作用机制)、一般药理学、药动学和毒理学研究等[18-19],主要不同之处是药效学研究、药动学与药效学(pharmacokinetic/pharmacodynamics,PK/PD)研究。抗真菌药物的非临床研究内容与抗细菌药物更是相似,主要是药效学的部分研究内容有区别,本章主要介绍有区别的部分药效学研究内容,包括体外抗真菌试验、体内抗真菌试验、PK/PD研究和抗真菌作用机制研究。
药效学研究的主要内容是通过对药物的体内外活性、体内外量效关系、作用机制和靶点等进行研究,为临床用药提供参考。抗真药物的药效学研究内容主要分为两类,分别为体外和体内抗真菌试验[18]。
1 体外抗真菌试验[18]
1.1 最小抑菌浓度测定
体外抗真菌试验反映药物的抗真菌谱及抗真菌的效价效能等特点,通过体外抗真菌试验,获取最小抑菌浓度(minimal inhibitory concentration, MIC)、最小杀菌浓度(minimal bactericidal concentration, MBC)、时间杀菌曲线[21](time-killing curve)、抗生素后效应(post antibiotic effect,PAE)、联合药敏指数(fractional inhibitory concentration index,FICI)等数据[18,21]。这些试验与抗细菌药物的非临床药效研究内容相似,可参考抗细菌药物的相应内容。
抗真菌非临床药效试验的MIC测定[21]采用的主要方法是微量液基稀释法,常辅以纸片法和点板法等相互佐证。测试的真菌应包括皮肤癣菌类、念珠菌、隐球菌和曲霉菌等,每种真菌应包括购自中国医学科学院病原微生物菌(毒)种保藏中心的标准菌株、近期分离的采自不同地域、不同机构的临床菌株和耐药菌株,并注明出处,每种真菌测试30~80株。对其他罕见菌属如接合菌、双相型真菌、暗色真菌和卡氏肺孢子菌等也可委托有研究能力的专业机构做MIC/MBC测定。要尽可能全面考察化合物的抗真菌活性和抗真菌谱。
应根据抗真菌药物自身的特点及未来拟定的临床适应证选择受试真菌株,适当加大未来适应证中可能涵盖的病原真菌研究。考虑到病原真菌存在地区差异以及随时间的耐药性变迁等特性,入选的受试真菌应满足以下要求:①代表性:选择的受试真菌应尽可能来自未来可能的适应证菌株,并尽量体现其野生株的特点。②区域性:至少有3个区域的受试真菌株进行汇总分析。③近期分离:受试真菌一般应选择近2~3年的临床分离菌株,以反映流行病原真菌的敏感性和天然耐药特点。一些收集困难的菌种可考虑5年内或更长时间的临床分离菌株。应根据国际公认方法对各种受试菌进行鉴定和MIC测定。测定结果描述包括MIC范围、MIC50和MIC90等[22]。
药效试验要设阳性对照,选用同类药物中临床一线使用的品种,没有同类药物的原创新药选用临床一线使用的品种做阳性对照,通过比较,体现出试验药物在抗真菌谱和效价效能方面的特色优势。
要选择代表性的敏感真菌株研究不同培养条件(如温度变化)、不同培养基(如Spider培养基、RPMI1640培养基、Lee's培养基、YPD培养基;固体或液体培养基;含血清或不含血清培养基等)对化合物抗真菌活性的影响。还要注意培养基中钙离子、钾离子、铁离子及不同碳源等对药物抗真菌活性的影响。
1.2 抑制真菌菌丝形成的浓度测定
菌丝态真菌具有侵袭感染的能力,因此,除了要观察化合物对酵母态真菌生长繁殖的影响外,还要观察化合物在不同浓度下对真菌菌丝生长的抑制作用,分别测试化合物在Spider培养基(包括固体/液体)、Lee's培养基(包括固体/液体)、含血清1640培养基上对真菌菌丝形成的抑制作用,显微镜下观察菌丝的形成情况,判定化合物抑制菌丝形成的最低浓度[23]。
1.3 抑制生物被膜的浓度测定
生物被膜形成是导致真菌多重耐药的重要机制,也是导管相关真菌体内感染迁延不愈的重要原因,因而,抗生物被膜形成的药物具有重要的临床意义。要测试化合物对真菌生物被膜形成的抑制作用,先将一定数量的真菌在塑料培养板中按照生物被膜形成条件培养24 h,采用XTT法[24]或激光共聚焦显微镜观察生物被膜形成的方法,观察不同浓度化合物对真菌生物被膜生成的抑制作用和对已形成成熟生物被膜的破坏作用。
1.4 真菌耐药性研究
抗真菌藥物在临床广泛应用于治疗多种真菌感染,但随着药物长时间大范围的应用,真菌产生耐药性问题也日趋严重,在新药临床前评价中也要求进行耐药性方面的研究[18]。①与临床常用的结构类似的药物比较,分别测定对临床分离耐药真菌的最低抑菌浓度MIC、MBC等,比较它们的体外抗耐药真菌活性,了解同结构类似物有没有交叉耐药性。②应用防耐药突变选择窗理论[25],测定药物对临床分离真菌的防耐药突变浓度(mutation preventive concentration,MPC)及突变选择窗(mutant selection windows,MSW为MIC与MPC之间的浓度范围)[26],比较新的药物与同类药物抗耐药突变真菌株选择的能力[18]。③选用3株敏感真菌株,分别与递增浓度的测试药物共培养30 d,观察真菌MIC值的变化,评价药物诱导真菌耐药性产生的能力[27-28]。
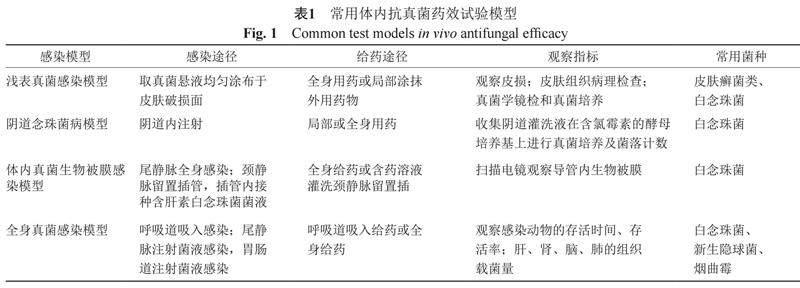
2 体内抗真菌试验(表1)
2.1 浅表真菌感染模型
一般选用健康豚鼠建立皮肤真菌感染模型,实验前也可全身用免疫抑制剂抑制动物的免疫功能。用脱毛剂去除豚鼠背部局部区域的毛发,用无菌砂纸打磨脱毛皮肤,以出现点状出血为宜,用75%乙醇消毒干燥后,取预先制备的真菌悬液均匀涂布于皮肤破损面[29-30]。动物感染5~7 d后,皮损局部出现红斑、脱屑、糜烂和结痂,皮损取材直接镜检可见菌丝和孢子,皮损取材能培养出原感染真菌,皮损组织病理学检查显示在角质层内或在毛发周围可见菌丝和/或孢子[30]。在感染的次日开始口服给药或局部涂抹外用药物治疗,设阳性对照和阴性对照组。每日观察皮损并拍照,连续观察14 d,并在第5、8、11和14天进行皮肤组织病理检查、真菌学镜检和真菌培养。比较指标包括皮损打分和真菌镜检及真菌培养结果[31]。
2.2 阴道念珠菌病模型
用于评价治疗阴道念珠菌病药物的疗效。采用成年雌性大鼠或小鼠,皮下注射戊酸雌二醇和/或腹腔注射环磷酰胺使动物易感。制备白念珠菌混悬液,采用阴道内注射的方法造成阴道念珠菌感染。在感染造模的第2天给予药物治疗(局部或全身用药,设高中低3个剂量),设阳性对照药物和阴性对照组,在药物治疗后的不同时间点,采用无菌PBS 缓冲液进行阴道灌洗,收集灌洗液稀释后在含氯霉素的酵母培养基上进行真菌培养及菌落计数。比较阴性对照组、阳性药对照组、试验药物治疗组菌落计数的差异,并行显著性检验[32-33]。
2.3 体内真菌生物被膜感染模型
可采用导尿管模型,雌性小鼠或大鼠,留置导尿管后,通过尾静脉全身感染白念珠菌,尿中可查到白念珠菌,10~20 d后导尿管内可见到白念珠菌生物被膜形成,可通过全身给药或含药溶液灌洗导尿管膀胱,观察药物的抗生物被膜作用。也可采用静脉内置导管模型,采用大鼠或家兔,颈静脉留置插管,插管内接种含肝素白念珠菌菌液形成生物被膜,可采用全身给药或插管内灌注含药溶液的方法观察药物的体内抗生物被膜作用。药物治疗结束后,在无菌环境中取出导管,用扫描电镜观察导管内生物被膜[34-35]。
2.4 全身真菌感染模型
用来研究抗真菌药物对动物全身感染的保护作用, 观察药物保护作用的量效关系、最低起效剂量和最强药效(效能),必要时可计算药物保护作用的ED50(median effective dose)。一般体内试验,是用小鼠真菌感染模型,造模后2 h或24 h再给予药物治疗,观察药物对感染动物的保护存活率[18]和体重变化。在进行体内试验时,注意给药途径一般要与临床拟给药途径一致;最好同时观察比较药物口服,注射时的保护作用,小鼠不便多次尾静脉注射给药时,可用腹腔注射或皮下注射途径替代参考[18]。动物体内感染模型应与临床适应症尽量一致,如临床拟用于肺部真菌感染,需要提供真菌经呼吸道肺部感染的模型[18,36];如临床拟用于全身系统性真菌感染,需经小鼠尾静脉注射致死量的真菌造成全身系统性感染模型,进行相关试验[37-38]。人体胃肠道内常有白念珠菌定植,当人体免疫力受损或胃肠道功能紊乱时,白念珠菌可通过胃肠道经血液向全身侵袭感染,在研究抗白念珠菌药物的药效时,可提供白念珠菌在免疫抑制状态下经胃肠道感染模型,考察药物的保护作用[39]。在申报材料中,一般要求拟申请的适应症,有相应体内药效学试验的支持[18]。
在体内药效学试验中,除了观察感染动物的死亡率外,还要测定重要靶器官如肺、脑、肝和肾等的组织载菌量,观察药物降低重要靶器官组织载菌量的作用,至少设计3个给药剂量,观察药物作用的量效关系。一般在小鼠感染模型上,同时考察药物对感染死亡率和组织载菌量的影响。
3 药动学与药效学(PK/PD)的研究
体外试验虽能在一定程度上反映抗真菌药物的抗真菌活性,但由于其活性是将真菌置于固定的抗真菌药物浓度中测得的,而体内抗真菌药物浓度需要经过机体的吸收、分布、代谢和排泄过程,给药后, 药物浓度在各器官组织分布随时间发生变化。要体现药物在体内的动态抗真菌作用,可通过PK/PD研究[40],将药效学参数MIC和药动学参数AUC(area under curve)、Cmax(peak concentration)、T(血药浓度维持时间)等结合, 找出最能反映量效关系的PK/PD参数,为制定后续临床试验方案、指导临床合理用药提供参考[18]。这部分内容可参考抗菌药物的PK/PD研究[41]。
具体来说,由于不同种类的药物的抗菌行为不同,因此疗效评价的指标也有所不同。以上PK/PD参数之间有时高度相关,例如大剂量给药时,不仅Cmax/MIC提高,AUC0~24/MIC和T>MIC也同样增加,因此很难区分高剂量情况下疗效改变最相关的参数。为了使3个PK/PD参数相互独立,一些研究采用剂量分层的方法,例如将每日给药剂量分成q1 h、q3 h、q6 h、q12 h和q24 h间隔给药, AUC0~24/MIC不变的情况下Cmax/MIC逐渐增加,将抗菌效果和这些参数进行曲线回归,得到与抗菌效果最为相关的PK/PD参数。如果各给药间隔的疗效无差异,则AUC0~24/MIC是评价疗效的关键指标;如果给药间隔加大疗效升高,则Cmax/MIC是重要的评价指标;如果给药间隔加大疗效反而降低,则药物的主要PK/PD参数是T>MIC
不同抗菌藥物抗菌行为存在较大差异,根据上述PK/PD研究结果,抗菌药物可以分为3类。第一类称为浓度依赖性抗菌药物,有较长的抗菌药物后效应(PAE),药物浓度越高,杀菌速度和程度越大,临床可以大剂量长间歇给药。AUC0~24/MIC和Cmax/MIC是预测疗效的主要指标,对每日一次给药者,该参数可简化为Cmax/MIC。
第二类为时间依赖性抗菌药物,当给药剂量增加到一定程度,这类药物杀菌效果不再增加,临床疗效也不随药物浓度的增加而增加,且当体内药物浓度低于MIC时细菌很快恢复生长。其中一部分药物抗菌药物后效应(post antibiotic effect, PAE)不明显,该类药物制定给药方案时需保证足够的有效药物浓度持续时间,预测该类药的主要指标是T>MIC。
第三类为时间依赖性抗菌药物且PAE持续时间较长,抗菌药物低于MIC后仍可以在一定时间内抑制给药间歇细菌恢复生长,AUC0~24/MIC是评价疗效的主要PK/PD指标[42]。
4 抗真菌作用机制研究[43]
研究药物作用机制的目的是了解药物发挥药效作用的本质,对新抗真菌药物进行作用机制的研究,可为抗真菌药物的临床合理应用、联合使用提供依据[18]。新抗真菌药物如果是已知作用机制药物的结构类似物,只需进行验证性作用机制研究,但仍要做出量效关系并与阳性药进行对比,考察其效价、效能的差异。如果是作用机制不明的新结构类型的化合物,则要通过观察药物对真菌细胞结构、功能、生化代谢的影响,探索其可能的作用机制或作用通路,最好是通过化学生物学或化学基因组学[44]的方法、基因表达谱分析和信号通路分析的方法、小分子结合靶蛋白或抑制靶蛋白功能的分析方法阐明其作用靶点,为进一步的优化改造和新药研究奠定基础。
5 本技术指南的目的及应用范围
本技术指南为满足药物临床试验的要求,阐明了抗真菌药物非临床试验的基本技术要求,部分内容参照了抗细菌药物的技术要求[45],有区别的地方主要是真菌生物学特点不同,真菌常现的感染部位不同,真菌有菌丝形成的特征,抗真菌药物的作用机制不同等。本技术指南不能完全覆盖抗真菌药物非临床研究可能会遇到的各种具体问题,但意在为药品注册申请人和非临床试验研究者在规划、设计、实施和监督试验,收集和分析试验数据时提供必要的技术指导,使安全有效的抗真菌药物得以更好更早地用于临床治疗。本技术指南适用于全身用药或局部用药的创新性抗真菌药物的临床前评价[46]。
参 考 文 献
Brown G D, Denning D W, Gow N A, et al. Hidden killers: Human fungal infections[J]. Sci Transl Med, 2012, 4(165): 165rv13.
Quindós G, Marcos-Arias C, San-Millán R, et al. The continuous changes in the aetiology and epidemiology of invasive Candidiasis: From familiar Candida albicans to multiresistant Candida auris[J]. Int Microbiol, 2018, 21(3): 107-119.
Ahmad A, Spencer J E, Lockhart S R, et al. A high-throughput and rapid method for accurate identification of emerging multidrug-resistant Candida auris[J]. Mycoses, 2019, 62(6): 513-518.
Greenblatt H K, Greenblatt D J. Liver injury associated with ketoconazole: Review of the published evidence[J]. J Clin Pharmacol. 2014, 54(12): 1321-1329.
Jenks J D, Salzer H J F, Prattes J. Spotlight on isavuconazole in the treatment of invasive aspergillosis and mucormycosis: Design, development, and place in therapy[J]. Drug Des Devel Ther, 2018, 12(default): 1033-1044.
孫青龑, 刘超美. 抗真菌药物的研究与开发[J]. 药学进展, 2001, 25(4): 213-219.
Gray K C, Palacios D S, Dailey I, et al. Amphotericin primarily kills yeast by simply binding ergosterol[J]. Proc Natl Acad Sci U S A, 2012, 109(7): 2234-2239.
陈宏, 温海, 徐红, 等. 两性霉素B和5-氟胞嘧啶的体外联合药敏试验[J]. 第二军医大学学报, 2003, 24(4): 453-454.
张诗琪, 程德云. 棘白菌素类抗真菌药物的临床应用进展[J]. 医学综述, 2020, 26(5): 986-990.
余凡, 朱晓芳. 皮肤癣菌感染的治疗进展[J]. 皮肤性病诊疗学杂志, 2020, 27(1): 57-60.
Xiao M, Sun Z Y, Kang M, et al. Five-year national surveillance of invasive candidiasis: species distribution and azole susceptibility from the china hospital invasive fungal surveillance net (CHIF-NET) study[J]. J Clin Microbiol, 2018, 56(7): e00577-18.
Park B J, Wannemuehler K A, Marston B J, et al. Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS[J]. AIDS, 2009, 23(4): 525-530.
K?hler J R, Hube B. Fungi that infect humans[J]. Microbiol Spectr, 2017, 5(3): 1-29.
Cleare L G, Zamith-Miranda D, Nosanchuk J D. Heat shock proteins in histoplasma and paracoccidioides[J]. Clin Vaccine Immunol, 2017, 24(11): e00221-17.
Ribes J A, Vanover-Sams C L, Baker D J. Zygomycetes in human disease[J]. Clin Microbiol Rev, 2000, 13(2): 236-301.
Kauffman C A, Pappas P G, Patterson T F. Fungal infections associated with contaminated methylprednisolone injections[J]. N Engl J Med, 2013, 368(26): 2495-2500.
孫培培, 童朝晖. 肺孢子菌肺炎的诊断和治疗进展[J]. 中华结核和呼吸杂志, 2012, (10): 775-776.
胡晓敏, 孙涛. 抗菌药物非临床研究的考虑[J]. 中国临床药理学杂志, 2008, (4): 382-384.
王庆利. 我国药物非临床研究评价指导原则体系构建与发展[J]. 中国新药杂志, 2014, 23(22): 2607-2610, 2658.
杨万镇, 涂杰, 盛春泉, 等. 体外抗真菌活性测试[J]. Bio-protocol, 2021, doi: 10.21769/BioProtoc.1010851.
The Clinical and Laboratory Standards Institute(CLSI), Performance Standards for Antimicrobial[S]. Susceptibility Testing, 31st. Edition. https://clsi.org/about/press-releases/clsi-publishes-m100-performance-standards-for-antimicrobial-susceptibility-testing-31st-edition.
国家食品药品监督管理总局. 抗菌药物药代动力学/药效学研究技术指导原则[EB/OL]. (2017-08-21)[2022-3-1].https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20170821170301371.html.
Li P, Zou J, Dong Y, et al. Tetrandrine, a potent antifungal agent, inhibits mycelial growth and virulence of botrytis cinerea[J]. Phytopathology, 2021, 111(7): 1152-1157.
Loures F V, Levitz S M. XTT assay of antifungal activity[J]. Bio Protoc, 2015, 5(15): e1543.
Blondeau J M. New concepts in antimicrobial susceptibility testing: the mutant prevention concentration and mutant selection window approach[J]. Vet Dermatol, 2009, 20(5-6): 383-396.
Fujiwara N, Murakami K, Yoshida K, et al. Suppressive effects of 2-methacryloyloxyethyl phosphorylcholine (MPC)-polymer on the adherence of Candida species and MRSA to acrylic denture resin[J]. Heliyon, 2020, 6(6): e04211.
Carolus H, Pierson S, Munoz J F, et al. Genome-wide analysis of experimentally evolved Candida auris reveals multiple novel mechanisms of multidrug resistance[J]. mBio, 2021, 12.
Barchiesi F, Calabrese D, Sanglard D, et al. Experimental induction of fluconazole resistance in Candida tropicalis ATCC 750[J]. Antimicrob Agents Chemother, 2000, 44: 1578-1584.
吴燕, 孔健, 袁海龙, 等. 复方盐酸特比萘芬凝胶抗皮肤癣菌感染的组织病理学疗效观察[J]. 中国真菌学杂志, 2017, 12(5): 283-287.
李曼, 殷中琼, 魏琴, 等. 姜射栀提取物涂膜剂对家兔人工感染真菌皮癣病的疗效观察[J]. 中国兽医科学, 2014, 44(3): 313-319.
Pfaller M A, Diekema D J. Epidemiology of invasive candidiasis: A persistent public health problem[J]. Clin Microbiol Rev, 2007, 20(1): 133-163.
刘颖, 孙爱军. 雌激素与外阴阴道念珠菌病[J]. 中国妇幼保健, 2005, 20(20): 3.
刘道凡, 伍启康. 日舒安洗液联合克霉唑治疗小鼠外阴阴道念珠菌病的疗效观察[J]. 中国真菌学杂志, 2019, 14(1): 32-36.
Andes D, Nett J, Oschel P, et al. Development and characterization of an in vivo central venous catheter Candida albicans biofilm model[J]. Infect Immun, 2004, 72(10): 6023-6031.
李瑞莲, 王倬, 杜昱光. 白色念珠菌生物被膜研究进展[J]. 微生物学报, 2017, 57(8): 1206-1218.
Wang J, Zu Q, Wang W. Analysis of factors of pulmonary fungal infection in mice in respiratory medicine department based on logistic regression analysis model and progranulin[J]. Saudi J Biol Sci, 2020, 27(2): 629-635.
王迪, 黃劲, 姚昌昊, 等. 不同品系小鼠侵袭性真菌感染动物模型的构建[J]. 贵州医科大学学报, 2021, 46(10): 9.
Tucey T M, Verma J, Harrison P F, et al. Glucose homeostasis is important for immune cell viability during candida challenge and host survival of systemic fungal infection[J]. Cell Metab, 2018, 27(5): 988-1006.
Koh A Y, K?hler J R, Coggshall K T, et al. Mucosal damage and neutropenia are required for Candida albicans dissemination[J]. PLoS Pathog, 2008, 4(2): e35.
Craig W A. Pharmacokinetic/pharmacodynamic parameters: Rationale for antibacterial dosing of mice and men[J]. Clin Infect Dis, 1998, 26(1): 1-12.
沈爱宗, 张圣雨, 陈泳伍, 等. 抗菌药物PK/PD理论及其临床应用研究进展[J]. 药学进展, 2019, 43(11): 880-884.
肖永红. 利用抗菌药物PK/PD优化感染治疗[J]. 中国抗生素杂志, 2017, 42(12): 1033-1039.
Odds F C, Brown A J, Gow N A. Antifungal agents: Mechanisms of action[J]. Trends Microbiol, 2003, 11(6): 272-279.
De Backer M D, Van Dijck P. Progress in functional genomics approaches to antifungal drug target discovery[J]. Trends Microbiol, 2003, 11(10): 470-478
Roemer T, Boone C. Systems-level antimicrobial drug and drug synergy discovery[J]. Nat Chem Biol, 2013, 9(4): 222-231.
《抗菌药物临床试验技术指导原则》写作组. 抗菌药物临床试验技术指导原则[J]. 中国临床药理学杂志, 2014, 30(9): 844-856.
作者简介:高路,男,生于1998年,在读博士研究生,主要研究方向为免疫学与病原微生物,E-mail: 2031283@tongji.edu.cn
