尾吊模拟失重对小鼠过敏性哮喘的影响及其机制研究
2023-04-26宋锦苹李悠悠杜锐凯凌树宽胡利明李英贤
甄 珍 宋锦苹 李悠悠 杜锐凯 凌树宽 胡利明* 李英贤*
(1.北京工业大学环境与生命学部, 北京 100124;2.中国航天员科研训练中心航天医学基础与应用国家重点实验室, 北京 100094)
1 引言
航天飞行中,由于免疫功能的变化给航天员的健康带来一系列风险[1],如发生罕见性感染,潜伏病毒激活[2]和过敏性疾病等。在长期飞行的深空探测任务中,若免疫系统失调状况持续存在,极有可能会增加乘组人员的不良临床风险,对航天任务的顺利实施造成巨大威胁。观察空间飞行对免疫功能的影响及其与疾病发生之间的相关性,对制定和采取相应措施保障航天员健康至关重要。空间飞行条件有限,因此常采用地面模拟失重模型进行相关研究[3]。小鼠尾吊是常用的地面模拟失重动物模型[4-5],由于其后肢模拟了空间飞行中的去负荷,整体模拟了血液的头向分布、应激等,因此能较好地模拟失重条件下的骨质丢失、肌肉萎缩、免疫系统和心血管等效应。
过敏性哮喘是一种过敏性疾病的主要模型[6],它是一种由于过敏源刺激发生的由多种细胞特别是肥大细胞、嗜酸性粒细胞和T 淋巴细胞参与的慢性气道炎症,在易感者中此种炎症可引起反复发作的喘息、气促、胸闷和咳嗽等症状。目前很少有关于尾吊模拟失重对过敏性疾病发生程度影响的研究。
本文旨在研究尾吊模拟失重对小鼠免疫细胞及其亚群和过敏性哮喘的影响,并通过肺组织学、肺炎性细胞渗出、脾细胞及Th 细胞分布阐明尾吊模拟失重所致的免疫失衡在过敏性哮喘中的作用机制。
2 方法
2.1 实验动物与分组
选择6~8 周龄、体重18 ~22 g 的BALB/c 雌性小鼠28 只,购自北京维通利华实验动物技术有限公司,生产许可证SCXK(京2021-0006)。饲养于中国航天员科研训练中心SPF 级动物房,适应性喂养1 周后进行实验。
实验分为4 组,每组7 只小鼠。A 组:正常对照组(Ctrl);B 组:单纯OVA 组(Ovalbumin,卵清蛋白);C 组:单纯尾吊组(Hindlimb Unloading, HU,后肢去负荷);D 组:尾吊+OVA 组(HU+OVA)。
2.2 试剂与仪器
主要试剂:OVA, 佛波醇肉豆蔻酸酯(Phorbol Myristate Actetate,PMA), 离子霉素, 布雷菲德菌素A (Brefeldin-A, BFA) 购自Sigma 公司,红细胞裂解液购自北京索来宝科技有限公司,CD4-PerCP-cy5.5, 干扰素(IFN)-γ-FITC, 白细胞介素(IL)4 -PE, IL17-APC, CD4-FITC, CD25-APC,Foxp3-PerCP-cy5.5 抗体, Foxp3 转录因子染色套装(Foxp3/ Transcription Factor Staining Buffer Set)购自eBioscience 公司。
主要仪器:BD FACS AriaⅡ流式细胞仪,Nikon ECLIPSE TS100 倒置显微镜,Nikon ECLIPSE Ni 正置显微镜,Eppendorf 5810R 离心机。
2.3 小鼠过敏性哮喘模型的诱导
小鼠用OVA 加佐剂氢氧化铝造模,造模周期28 d,在第1 天用20 μg OVA 混悬液(含2 mg 氢氧化铝)腹腔注射致敏,在第7、14 天再次用20 μg OVA 混悬液(含2 mg 氢氧化铝)腹腔注射加强,在第21 ~28 天期间,每天用40 μg OVA 混悬液滴鼻刺激,对照组用磷酸盐缓冲液(Phosphate Buffer Saline, PBS)代替OVA 混悬液进行同样处理,观察小鼠外观、精神和呼吸情况。第29 天处死小鼠。
2.4 小鼠尾吊模拟失重
在过敏性哮喘造模第15 ~28 天,小鼠头低位尾部悬吊,保持躯干与地面夹角为30°,共尾吊14 d。
尾吊步骤如下:将医用胶布剪成条状,两端粘贴于小鼠尾部两侧,形成一个可通过挂钩的环状结构,约0.5 cm 左右,再用医用胶布缠绕固定,将之固定于小鼠尾部中间靠后位置,以防止医用胶布脱落。将铁链上的钩子穿过医用胶布环,完成后将铁链的末端悬挂在尾悬吊装置的转轮上,并且视小鼠躯干与水平面的角度(保证头低位30°尾悬吊)来调整铁链的长短,每天定时检查悬挂情况,随时调整保持角度不变。小鼠尾吊模拟失重实验图见图1。

图1 小鼠尾吊模拟失重实验图Fig.1 Experimental diagram of tail-suspended mouse
2.5 小鼠肺部灌洗与肺组织切片染色
颈椎脱臼处死小鼠,小心剪开胸部,结扎左侧支气管,0.5 mL 磷酸盐缓冲液PBS 灌洗右侧肺组织,共3 次,合并3 次灌洗液,取灌洗液细胞进行计数。取未灌洗侧肺组织用4%多聚甲醛固定,石蜡包埋,切片成3 μm 厚,采用苏木精和伊红(Hematoxylin-eosin Staining, HE)染色,显微镜下观察炎症细胞浸润等组织学变化。
2.6 小鼠脾细胞计数及淋巴细胞亚群检测
取出脾脏,研磨制备单细胞悬液,经红细胞裂解液裂解红细胞后,计数脾细胞。取1×107个细胞用50 ng/mL PMA+ 1 μg/mL 离子霉素混合液激活4 h, 同时5 μg/mL BFA 阻断, 经表面分子CD4-PerCP-cy5.5 抗体(后续胞内细胞因子染色)或CD4-FITC, CD25-APC 抗体(后续核内Foxp3染色)染色后,经Foxp3 转录因子染色套装破膜破核,胞内分别进行IFNγ-FITC、IL4-PE 和IL17-APC 及核内Foxp3-PerCP-cy5.5 抗体染色,荧光抗体用量均为5 μL。其中,CD4+细胞为Th 细胞群,CD4+IFN γ+细胞群为Th1 细胞亚群,CD4+IL4+细胞群为Th2 细胞亚群,CD4+IL17+细胞群为Th17 细胞亚群,CD4+CD25+Foxp3+细胞群为Treg细胞亚群。流式细胞仪检测Th1、Th2、Th17、Treg细胞占CD4+细胞比。
2.7 统计学处理
利用软件GraphPad Prism 9.0.0 对实验数据进行统计分析,采用双因素方差分析,数值以平均值±标准误(ˉ±sˉx)表示,P<0.05 认为差异具有统计学意义。
3 结果
3.1 整体状况变化
在用OVA 混悬液滴鼻刺激后,单纯OVA 组小鼠表现体形消瘦、毛发竖起、烦躁不安、呼吸困难、擦鼻,尾吊+OVA 组小鼠同样有上述表现,症状显著较单纯OVA 组减轻。
正常对照组和单纯尾吊组小鼠均精神正常、无消瘦、毛发无竖起、无呼吸困难和擦鼻。
3.2 肺组织学变化
图2 为肺组织切片HE 染色图,与正常对照组相比,单纯尾吊组小鼠肺组织学无明显炎性细胞渗出和肺泡壁增厚现象;而OVA 诱导小鼠肺组织炎性细胞大量增加,以支气管周围更为显著。肺泡壁增厚,细胞间质渗出增加,尾吊条件下OVA 诱导小鼠与OVA 相比,肺组织特别是支气管周围炎性细胞明显减少,肺泡壁变薄,细胞间质渗出减少。

图2 代表性肺组织切片HE 染色图(200×,比例尺=50 μm)Fig.2 Representative histological section of lung stained with HE(200×,scale bar=50 μm)
3.3 支气管肺泡灌洗液细胞数变化
支气管肺泡灌洗液细胞总数的变化如图3 所示。与正常对照组相比,单纯尾吊组小鼠支气管肺泡灌洗液细胞数量无显著性变化(P>0.05)。OVA 诱导小鼠较对照显著增加(P<0.001),与之相比,尾吊条件下OVA 诱导小鼠的肺泡灌洗液细胞数量大为下降,且差异具有显著性(P<0.001)。
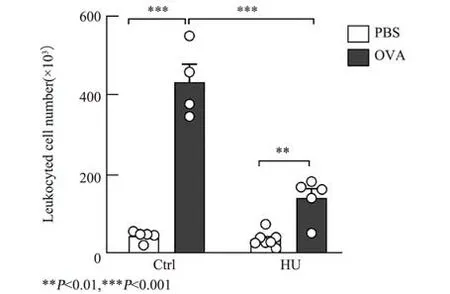
图3 支气管肺泡灌洗液细胞总数的变化Fig.3 Changes of total cell numbers in BALF
3.4 脾细胞和淋巴细胞亚群的变化
脾细胞总数与Th 细胞亚群分布结果如图4所示。与正常对照组相比,单纯尾吊组小鼠脾细胞总数和Th 细胞各亚群分布无显著变化。而OVA 诱导小鼠的脾细胞总数显著升高,与正常对照组和尾吊条件下OVA 诱导组均有显著性差异(P<0.001,P<0.01)。Th1 细胞亚群百分比较对照组显著升高(P<0.05),Th2 和Th17 细胞亚群百分比较对照有升高趋势。尾吊条件下OVA 诱导小鼠的脾细胞总数、Th1、Th2 和Th17 亚群百分比较单纯OVA 组均下降。OVA 诱导小鼠Treg 细胞亚群百分比明显升高,尾吊条件下OVA 诱导小鼠的Treg 百分比较单纯OVA 组升高幅度更大,且差异具有显著性(P<0.05)。
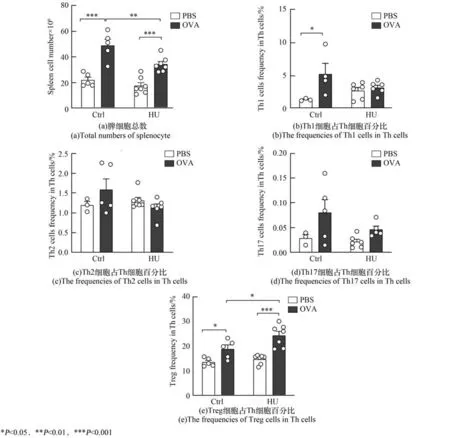
图4 脾细胞总数与Th 细胞亚群分布的变化Fig.4 Changes in the total numbers of splenocyte and the distribution of Th cell subsets
4 讨论
大量研究表明,航天飞行可导致航天员免疫功能显著变化[1,7-9],表现为白细胞分布及细胞因子分泌改变,NK 细胞、单核细胞和粒细胞功能下降。正常的免疫系统是机体健康的保障,免疫系统的改变会增加疾病的易感性。已有研究报导航天飞行中航天员感染性疾病[7]、自身潜在病毒激活[10-11]、过敏性疾病的发生[11-13];过敏性疾病的发病与免疫失衡密切相关;航天飞行中T 淋巴细胞亚群Th1、Th2、Th17、Treg 分布失衡[7,14]。
小鼠尾吊是常见的地面模拟失重动物实验模型,但其对Th 淋巴细胞亚群的分布报导尚不明确,对过敏性疾病的影响研究也仅见一例[15]。
采用OVA 诱导过敏性哮喘的小鼠模型,观察尾吊模拟失重对过敏性哮喘的作用,发现OVA 刺激后,整体上表现体形消瘦、毛发竖起、烦躁不安、呼吸困难、擦鼻。组织上能造成肺组织发生显著的炎性渗出和炎性反应,尤其以支气管周围更加显著,间质增厚,支气管肺泡灌洗液炎性细胞大量增加,表明了支气管和肺组织的炎症发生,这些变化影响正常行使肺脏通气换气功能。而与正常对照组相比,单纯尾吊小鼠无整体上体形消瘦、毛发竖起、精神正常、无呼吸困难和擦鼻等表现,同时无支气管和肺组织的明显变化,支气管肺泡灌洗液细胞也没有增加,说明尾吊模拟失重对小鼠的呼吸系统包括支气管和肺组织无明显损伤。但尾吊能明显改善OVA 造成的过敏性哮喘症状、支气管和肺组织炎性变化及灌洗液中炎性细胞的渗出。
同时,OVA 刺激后,小鼠脾细胞总数明显升高,Th1、Th2 和Th17 亚群占Th 细胞百分比升高,表明炎性反应能力增强,促进了过敏性哮喘的发生发展。Treg 细胞主要具免疫抑制作用,能够抑制Th1、Th2、Th17 细胞的炎性反应,起到维持免疫平衡的作用,能减少免疫炎性的损害[16-18]。而Treg 细胞亚群百分比在OVA 刺激后均有升高,但尾吊条件下,Treg 细胞亚群升高更为显著,说明尾吊对OVA 刺激的炎性反应产生了抑制作用,尾吊本身对脾细胞总数和Th1、Th2、Th17 淋巴细胞亚群分布无明显影响,但尾吊能明显改变OVA 造成的脾细胞总数变化和Th 淋巴细胞亚群分布,表明尾吊模拟失重减轻了OVA 造成的免疫炎性反应。
本文研究表明,尾吊模拟失重减缓OVA 所致小鼠过敏性哮喘的病症,而这与小鼠Treg 细胞数目升高有关。表明免疫功能的平衡程度与过敏性哮喘发生与发展具有一定相关性。
真实飞行中,航天员的免疫功能对航天环境非常敏感,过敏性疾病发生可能性增加,2016 年,一名国际空间站航天员的个案研究记录了太空飞行期间出现皮疹和非典型过敏症状[12]。
随着飞行条件和飞行时长不同,航天员免疫功能呈动态变化,免疫系统是否发生失衡,采取何种对抗措施来维持其平衡,与航天员是否发生过敏性疾病有重要关联性。本文研究结果尾吊模拟失重减轻了过敏性疾病的程度,与预想不一致。这可能是由于不同的尾吊时间对小鼠免疫功能的影响不同,导致了对过敏性哮喘的不同调节。也有可能与OVA 通过鼻饲致敏的过程有关,头低位尾吊减缓了OVA 对肺的直接刺激。在下一步的研究中,应观察不同尾吊时间对免疫功能和过敏性疾病的影响,再者也需要同时观察其他过敏性模型对尾吊模拟失重的反应,以更全面地阐明在在未来太空飞行中,过敏性疾病的发生以及与免疫功能的相关性,更准确地来保障航天员健康工作。
5 结论
在整体水平上,尾吊模拟失重显著改善OVA诱导的过敏性哮喘小鼠的外观、精神和呼吸变化;在组织水平上,尾吊模拟失重明显减少OVA 诱导造成的支气管肺组织炎性变化,支气管肺泡灌洗液中炎性细胞的渗出明显下降;在细胞水平上,尾吊模拟失重减缓了OVA 诱导的机体免疫炎性细胞的增加,相反进一步促进了免疫抑制性T 细胞比例的升高。因此,OVA 刺激条件下,模拟失重将导致机体免疫功能发生改变,对过敏性哮喘的病情有一定影响。
