仓储片烟中优势霉菌的分离鉴定及其霉变挥发性代谢产物研究
2023-04-22王宇栋周红审王凯悦闫铁军
王 林,王宇栋,朱 宝,李 虎,周红审,王凯悦,闫铁军,周 平,夏 海,周 敏,4
(1.湖北中烟工业有限责任公司 技术中心,湖北 武汉 430048;2.武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;3.武汉轻工大学 生命科学与技术学院,湖北 武汉 430023;4.湖北省生鲜食品工程技术研究中心,湖北 武汉 430023)
烟叶在制丝与卷包之前需要在一定条件下进行自然醇化,这一过程通常持续12~30 个月[1-2]。烟叶中含有丰富的营养物质,如蛋白质、葡萄糖、有机酸[3-4]、烟碱等[5-6],为烟叶本身带有的真菌孢子提供了生存条件。片烟在醇化过程中,受环境湿度的影响,烟叶容易吸潮,从而导致发霉[7]。烟叶发霉后其内含物分解,使烟叶的色、香、味等感官质量下降,造成较大的经济损失[8-9]。
目前,烟叶中霉菌检测方法的相关研究已取得了一定的进展。芯片级非对称离子迁移谱技术可以根据霉变特征物质吡啶和1-戊醇的离子电流值大小来进行霉变烟叶的无损快速鉴别[10]。杨蕾[11]对正常及霉变烟叶进行了近红外光谱扫描,利用优劣比值法(GBA)提取了4 个特征波长,并建立了霉变情况的监测模型。上述方法的样品前处理过程比较复杂,对操作人员的要求较高。
气相色谱离子迁移谱联用仪(Gas chromatography-ion mobility spectrometry,GC-IMS)具有响应快速、灵敏度高和检测周期短等优势,现已广泛应用于包括粮油、果蔬、水产品等在内的农产品的研究中,涵盖食品成分分析、产地溯源、掺假检测等方面[12]。黎家奇等[13]采用GC-IMS 对花生中黄曲霉侵染过程的挥发性有机化合物进行分析,通过挥发性物质的指纹图谱分析侵染过程中各阶段挥发性物质的变化规律和相对含量的变化,得到花生早期霉变的潜在生物标志物。田楠等[14]通过顶空气相色谱-离子迁移谱技术分析不同品牌卷烟之间挥发性物质的差异,并以此区分不同品牌卷烟,为不同品牌卷烟的风格分析和品质评定提供一定的理论依据和技术支持。
目前,缺少一种简单明了的方式快速判别仓储片烟是否霉变或者是否有发霉的趋势,导致不能及时做出处理以减少相应的损失。为此,以霉变片烟为研究对象,分离纯化优势霉菌,通过GC-IMS 检测结合聚类分析比较霉变与未发生霉变的片烟中挥发性组分的差异,识别出霉变特有挥发性物质,旨在为实现仓储烟叶霉菌的实时监控、提高烟叶品质和安全性奠定基础。
1 材料和方法
1.1 材料与试剂
1.1.1 片烟样品 按照5 点3 层法,从武汉乐道烟叶仓库中抽取产地为湖南的片烟,每个样品采集点的采集量至少为500 g,采集到的样品4 ℃保存备用。
1.1.2 培养基与试剂 霉菌的分离培养利用马铃薯葡萄糖琼脂(PDA)培养基、马丁氏培养基和查氏培养基[15]。霉菌的液体培养利用马铃薯葡萄糖液体(PDB)培养基。DNA 的提取及18S rDNA 的鉴定利用TaKaRa 的真菌DNA 提取试剂盒和DNA 回收试剂盒。
1.2 仪器与设备
霉菌的分离、纯化、初步鉴定利用无菌操作台(SW-CJ-2FD)、恒温振荡培养箱(DDHZ-300)、恒温恒湿培养箱(HWS-150)和无菌均质机(HBW-400D)。18S rDNA 鉴 定 利 用 电 泳 仪(BIO-RAD PowerPac)、凝胶成像系统(BIO-RAD MP)、紫外分析仪(UVG20)及PCR 仪(BIO-RAD T100)。片烟挥发性化合物的测定利用FlavourSpec 气相色谱离子迁移谱联用仪(德国G.A.S公司)。
1.3 方法
1.3.1 霉菌的分离、纯化和初步鉴定
1.3.1.1 分离 称取1 g 霉变烟叶[16],在无菌水中将孢子洗脱,配成孢子悬浮液,将霉菌孢子悬液进行适当梯度稀释,采用倒置平板法检测孢子,28 ℃恒温培养2~3 d。然后挑选形态各异、长势良好的单个菌落进行划线分离,重复2~3 次。筛选用马丁氏培养基,分离培养用查氏培养基和PDA培养基。
1.3.1.2 纯化 用无菌枪头挑取在PDA 培养基平板上的单菌落,并在新的PDA 培养基平板上划线培养,重复3 次。挑取多次纯化后的单菌落于PDB 培养基中,在(28±1)℃、150 r/min下摇床培养10~12 h。
1.3.1.3 形态学鉴定 参考GB 4789.16—2016《常见产毒霉菌的形态学鉴定》[17]综合观察菌落和镜检特征,反复比对结果,对霉菌进行鉴定。
1.3.2 霉菌DNA提取与18S rDNA鉴定
1.3.2.1 霉菌DNA 的提取 将分离纯化的霉菌保存于-80 ℃冰箱中,液体培养后离心获得菌丝等沉淀。在研钵中加入液氮和菌丝沉淀物进行研磨来破除真菌的细胞壁[18],将研磨后的菌丝及沉淀物采用真菌DNA提取试剂盒提取其总DNA。
1.3.2.2 18S rDNA 的扩增 参考李再新等[19]的方法扩增霉菌18S rDNA 的序列。根据GenBank 上公布的霉菌18S rDNA 序列,采用DNAMAN 分析软件设计 引 物,F:5′-GAACCTGCGGAAGGATCA-3′ ;R:5′-TGATACTGAAGCAGGCGT-3′。以霉菌的基因组DNA 为模板,PCR 扩增霉菌18S rDNA,目的片段长度为400 bp 左右。取1 μL PCR 产物进行1%琼脂糖凝胶电泳,利用紫外凝胶成像系统检测目的基因扩增情况。
1.3.2.3 18S rDNA 的序列分析 通过琼脂糖凝胶电泳检测发现在400 bp 处出现目的条带,在紫外分析仪下切下包含目的片段的琼脂糖凝胶,利用DNA回收试剂盒回收DNA 片段。将纯化产物送往武汉擎科有限公司进行测序,测序结果利用NCBI 的GenBank数据库进行比对。
1.3.3 米根霉的致霉性测定 参考向东红[15]的方法进行致霉性测定,取0.2 mL 制备好的米根霉孢子悬液,接种到经湿热灭菌的片烟上(1.0 g),使烟叶中的孢子浓度达到1.0×104cfu/mL,对照组(CK)接种等体积的0.85%的无菌生理盐水。将样品放置于28 ℃的恒温恒湿箱中培养,观察霉菌对烟叶有无致霉性。
1.3.4 片烟的人工污染和霉菌数量的变化分析片烟样品经湿热灭菌处理后,装入顶空瓶中,将片烟水分调整到13%左右,接种500 μL米根霉孢子悬液于0.25 g 烟叶上,使烟叶中的孢子浓度达到1.0×104cfu/mL,对照组接种等体积的0.85%的无菌生理盐水。装烟叶样品的顶空瓶用无菌棉花封口,避免杂菌污染的同时保持空气流通[15]。随后,将样品分别放置在25、30、35 ℃,相对湿度70%的恒温恒湿培养箱中培养18 d。每隔3 d 取一次烟叶样品,测定霉菌数量。米根霉侵染0、9、18 d 的样品分别标记为P0、P1、P2。
1.3.5 片烟挥发性化合物的GC-IMS 测定 在上述35 ℃、相对湿度70%的恒温恒湿培养条件下,0、9、18 d时取烟叶样品进行GC-IMS检测。
1.3.5.1 GC-IMS 检测样品 取经米根霉人工污染的试验组烟叶和对照组烟叶,经顶空进样,用GCIMS联用仪进行测试。
1.3.5.2 顶空进样条件 孵化温度90 ℃,孵化时间10 min,进样方式为顶空进样,加热方式为振荡加热,进样针温度85 ℃。
1.3.5.3 GC-IMS 条件 色谱柱温度60 ℃;载气为高纯度N2,载气流速:初始流速2.0 mL/min,保持2 min,8 min 内线性升至10 mL/min,10 min 内线性升至100 mL/min,5 min 内线性升至150 mL/min,保持2 min,总运行时间27 min;漂移管温度45 ℃,漂移气为高纯度N2,漂移气流速150 mL/min。
利用GC-IMS 技术进行霉变烟叶特殊挥发性物质检测,并对不同处理的烟叶中挥发性化合物进行分析和鉴别[20]。
1.4 数据处理
使用软件LAV 和GC-IMS Library Search 对样品进行分析。使用LAV 分析软件中Reporter、Gallery 和Dynamic PCA 插件程序以及GC-IMS Library Search 构建挥发性有机物的指纹图谱。使用R 软件包pheatmap 程序构建热图,进行样本聚类分析。
2 结果与分析
2.1 片烟中霉菌的分离纯化以及优势霉菌的鉴定
对产地湖南的片烟样品进行了霉菌的分离纯化,根据GB 4789.16—2016《常见产毒霉菌的形态学鉴定》[17]的判定标准以及18S rDNA 的测序结果,发现烟叶样品中根霉数量最多(73.8%),其次是曲霉(6.0%)和毛霉(5.5%),青霉较少(1.7%)。对根霉进一步鉴定表明,湖南片烟中出现频率最高的根霉菌株与GenBank 基因库中米根霉18S rDNA 序列(MT279283.1)间的覆盖率为95.0%,同源性为99.73%,确定其属于米根霉,其次为代氏根霉和葡枝根霉。
2.2 米根霉致霉性测定结果
将米根霉孢子悬液接种到湿热灭菌的湖南片烟上,对照组接种等体积的0.85%的无菌生理盐水,于28 ℃培养并观察菌落生长情况,来判断米根霉的致霉性。结果显示,对照组烟叶未出现霉菌菌落,接种米根霉孢子悬液的烟叶生长情况如图1 所示,菌落直径为3 cm。
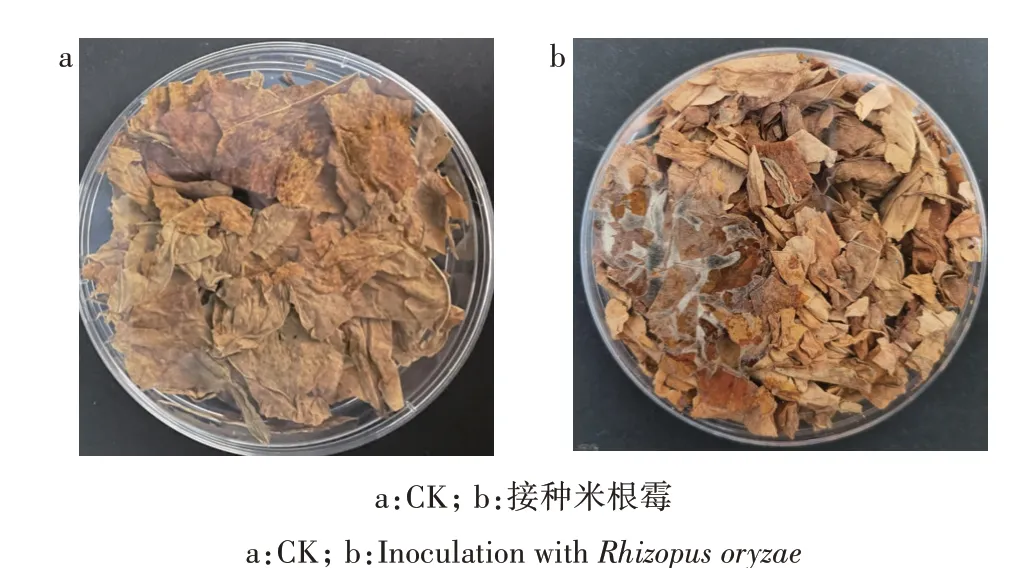
图1 接种米根霉后的烟叶生长情况Fig.1 Tobacco inoculated with Rhizopus oryzae
2.3 人工污染片烟中霉菌数量的变化
将湖南片烟样品放入顶空进样瓶,经湿热灭菌后进行米根霉的人工污染,分别放置在25 ℃、30 ℃和35 ℃,相对湿度70%的恒温恒湿培养箱中培养。如图2 所示,在25 ℃和30 ℃的烟叶上没有出现霉斑,且烟叶中的霉菌数量至18 d 时一直维持在1.0×104cfu/mL 以下。35 ℃培养条件下,烟叶中的霉菌数量在9 d 以内没有太大变化,一直维持在1.0×104cfu/mL 以下。10~18 d,烟叶中的霉菌数量缓慢上升,在18 d 超过5.0×104cfu/mL,达到轻度霉变。整个过程中,烟叶中的霉菌数量一直都在1.0×105cfu/mL以下。
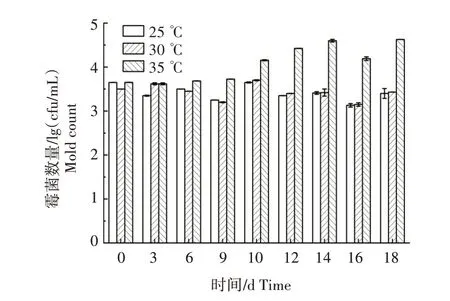
图2 不同储存温度下片烟中霉菌数量随时间的变化Fig.2 Changes of the number of mold in tobacco under different storage temperatures
2.4 米根霉侵染不同阶段烟叶样品中挥发性成分的差异
在35 ℃、相对湿度70%条件下的人工污染试验中,培养0、9、18 d 时,取烟叶样品进行GC-IMS 检测。对照组(接种同体积生理盐水)经18 d 无霉变现象,试验组P1(9 d)样品未出现明显霉变现象,试验组P2(18 d)样品出现轻度霉变现象。经顶空进样,用GC-IMS 联用仪进行测试,结果如图3 所示。反应离子峰(Reaction ion peak,RIP)两侧的每个点代表从片烟中提取的挥发性化合物,通过颜色的深浅来判断物质的含量。大多数挥发性物质在米根霉侵染过程中的迁移时间在1.0~1.9 s,保留时间在200~1 000 s。相比于P0(0 d),烟叶样品P1、P2在米根霉侵染过程中的挥发性化合物具有较大的差异,主要表现在离子峰的位置、数量及强度上。通过GC-IMS 的Library Search 软件进行数据比对,共识别出42种挥发性化合物(表1)。

表1 米根霉侵染阶段挥发性化合物的鉴定Tab.1 Identification of volatile compounds in the infection stage of Rhizopus oryzae
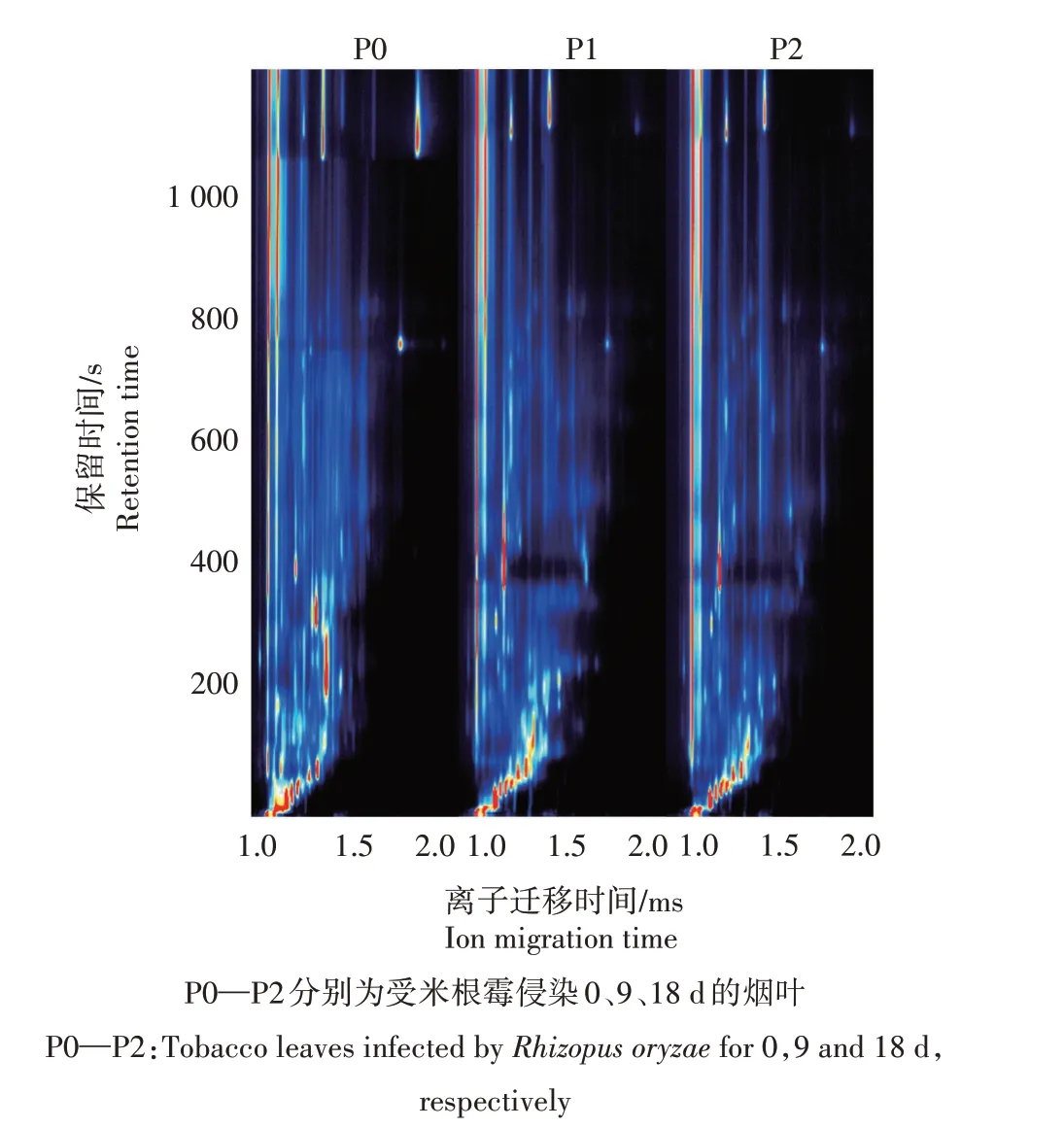
图3 米根霉侵染不同阶段的烟叶样品GC-IMS图谱Fig.3 GC-IMS spectra of tobacco leaves samples infected by Rhizopus oryzae at different stages
为进一步比较烟叶样品中挥发性物质的差异,采用LAV 软件,选取图3 中分析区域,自动生成指纹图谱(图4)。结果显示,a 区域P0 烟叶样品中1-辛烯-3-酮、3-辛酮、3-乙基-苯丙酸、2-呋喃甲硫醇、松油醇、戊酸、正辛醇、蒎烯的信号强度较高,其中2-呋喃甲硫醇是存在于烤烟烟叶中的棕色化反应产物[21]。这8 种化合物在米根霉侵染阶段(P1、P2)含量明显降低,可见霉变导致了烟叶本身具有的色、香、味的流失;b 区域庚2 酮、蒎烯为发霉过程的中期过渡挥发性物质;c区域顺式-3-己烯-1-醇、丁酸甲酯、2-戊酮、乙基丙酸、戊酸乙酯、苯乙醛、苯乙烯、2,4,5-三甲基噻唑、反式-2,4-庚二烯醛、2,6-二甲基吡嗪、3-戊酮含量高于P0,其中顺式-3-己烯-1-醇、丁酸甲酯、2-戊酮、乙基丙酸这4 种化合物含量明显升高。

图4 烟叶样品中挥发性化合物的指纹图谱Fig.4 Fingerprint of volatile compounds in tobacco samples
通过对挥发性化合物进行热图聚类分析,可以更加直观地比较不同处理样品之间的异同,结果如图5 所示。其中b、c 区域的挥发性物质主要存在于P0 样品中,e 区域的挥发性物质主要存在于中期阶段P1 样品中,a、d、f 区域中的挥发性物质主要存在于P1 和P2 中。P0 中1-辛烯-3-酮、3-辛酮、3-乙基-苯丙酸、2-呋喃甲硫醇等的信号强度高于米根霉侵染的P1,说明烟叶中本来具有的一些挥发性物质随着霉变过程的进行而减少。随着米根霉侵染的时间延长,烟叶样品中顺式-3-己烯-1-醇、戊酸乙酯、苯乙醛、苯乙烯、2,4,5-三甲基噻唑、反式-2,4-庚二烯醛等挥发性物质含量逐渐增大。a、d、f区域11 类化合物可以作为霉变预警的重要特征性物质。
3 结论与讨论
已有研究表明,片烟在储存期间表面存在大量的微生物,张成省等[22]研究发现,产地为河南、福建、山东、四川、云南等地的片烟主要霉菌类群为黄柄曲霉、黑曲霉、黄曲霉、桔青霉、纯绿青霉、产黄青霉、总状毛霉、匍枝根霉,以曲霉、青霉检出率较高;刘强[23]从云南、贵州等产地的烟叶中分离到的主要霉变菌株为米曲霉、黑曲霉、黄曲霉、葡枝根霉、总状毛霉、桔青霉、扩展青霉;宋嘉宝等[24]研究发现,引起海南雪茄烟叶霉变的微生物主要为篮状菌属、帚霉属和曲霉属。本研究中,产地湖南的片烟中根霉检出率最高,其次为曲霉,在根霉中米根霉检出率最高,表明受地理、环境的影响各地烟叶中优势种群不尽相同。
霉菌侵染烟叶的过程中,会消耗烟叶中自身的营养物质,代谢出其他多种有机化合物,从而对烟叶的品质造成影响。杨蕾[11]在烟叶霉变预测研究中发现,由曲霉和青霉引起发霉的烟叶中新产生的7种化合物有丁醇、2-甲基-丁醇、戊醇、己醇等,含量变化程度较大的11种化合物有棕榈酸乙酯、棕榈酸甲酯、3-甲基-丁醇、4-甲基苯酚等。本研究利用GC-IMS 结合指纹图谱分析,发现受米根霉污染的仓储片烟中挥发性有机化合物的成分、含量存在差异,识别出霉变烟叶中11 种特征挥发性化合物,其中顺式-3-己烯-1-醇、丁酸甲酯、2-戊酮、乙基丙酸的含量在烟叶发生轻度霉变时明显升高,这4 种挥发性化合物可作为烟叶轻度霉变的潜在标识分子。
综上,在米根霉不同的侵染阶段,片烟样品中的挥发性化合物组成和含量差异显著,霉变早期的特征性气体可作为潜在的检测靶点。本研究为仓储片烟早期霉菌污染的气体监测传感器研制提供了一定的数据支撑,为片烟霉变预警监测提供了新思路。
