大豆细胞色素P450 家族GmCYP78A71 固氮功能解析
2023-04-18杨占武杜汇邢馨竹李文龙孔佑宾李喜焕张彩英
杨占武 杜汇 邢馨竹 李文龙 孔佑宾 李喜焕 张彩英

摘要:大豆可与根瘤菌互作进行共生固氮,有效缓解其对土壤氮素的依赖。细胞色素P450(cytochromeP450,CYP450)是一种血红素单加氧酶,参与植物信号分子、植物激素和黄酮类等多种次生代谢物的合成,为探究其在大豆结瘤固氮中的生物学功能,分析了该家族GmCYP78A71 基因的结构,并对其表达模式及生物学功能进行了深入解析。qRT-PCR和转启动子大豆毛根的根瘤GUS染色表明,GmCYP78A71 在根瘤中特异表达,且随着根瘤的发育表达量逐渐增高,在成熟根瘤中达到峰值;与对照相比,超表达复合植株的根瘤个数、鲜重、固氮酶活性等显著提高,而RNAi 毛状根的根瘤个数、鲜重、固氮酶活性等显著降低。上述结果表明GmCYP78A71 对根瘤的生长发育和固氮发挥重要作用。
关键词:大豆;共生固氮;根瘤;细胞色素单加氧酶;优异种质doi:10.13304/j.nykjdb.2021.0843
中圖分类号:Q78;S565.1 文献标志码:A 文章编号:10080864(2023)01005008
大豆(Glycine max)起源于我国,是人类最重要的食用油和植物蛋白来源,同时大豆在食品加工、饲料和燃料制造等领域也具有举足轻重的作用[1]。大豆需氮较多,过量施用氮肥会导致土壤板结和水体富营养化等问题[2-5]。大豆与根瘤菌(rhizobial bacteria)互作形成根瘤,根瘤菌在根瘤中形成类菌体,在固氮酶作用下高效固定空气中氮气使其转变为可被大豆吸收利用的氨。根瘤生物固氮可提供大豆生长发育所需氮素的50%~60%[6-10],是实现农业绿色环保的有效途径。
细胞色素P450(cytochrome P450, CYP450)广泛存在于自然界,是由超基因家族编码的血红素单加氧酶[11],其分为包含CYP51、CYP74、CYP97、CYP710、CYP711、CYP727、CYP746的单家族簇和由CYP71、CYP72、CYP85、CYP86 组成的多家族簇[12]。CYP450参与植物多种代谢途径,所产生的次生代谢产物在植物体信号传导以及应对生物和非生物胁迫中发挥着重要作用[1314]。CYP78A家族含有1个高度保守的单加氧酶结构域,是CYP71多家族簇的重要成员[14]。模式植物拟南芥的CYP78A家族包含6个成员(CYP78A5~CYP78A10),主要调控植物种子大小及油分含量[1516];水稻的CYP78A家族不仅表现出对赤霉病的抗性还能调控籽粒大小和生长速度[17];拟南芥中超表达CYP78A5可导致茎扭曲以及花器官发育缺陷[18];CYP78A7调控拟南芥叶绿体和叶片大小,CYP78A6 和CYP78A9 在调控叶片衰老过程中发挥重要作用[19];CYP78A家族成员在苔藓中参与配子体形成[20];大豆GmCYP78A70 和GmCYP78A57 表达量分别与叶片大小和百粒重呈正相关[21];大豆CYP450家族成员共有332个,其中CYP78A 家族部分成员在根瘤中特异表达[22],但其他基因对根瘤发育及固氮影响鲜有报道。
本课题组对大豆根瘤不同发育时期转录组数据分析发现,CYP78A家族成员GmCYP78A71 在大豆根瘤中特异表达,且表达量随着根瘤的生长发育逐渐增高,28 d成熟根瘤中表达量达到峰值。为此,本研究克隆了GmCYP78A71 基因,并对其表达量和启动子进行表达分析和功能验证等,以明确GmCYP78A71 在大豆结瘤固氮中的生物学功能,为高固氮优异新种质创制及新品种培育提供基因资源并奠定理论基础。
1 材料与方法
1.1 试验材料与试剂
大豆栽培品种Williams 82 和发根农杆菌K599均由河北农业大学大豆课题组提供,慢生型根瘤菌Bradyrhizobium diazoefficiens USDA110 由中国科学院遗传与发育生物学研究所馈赠。大肠杆菌感受态细胞TOP10购自北京博迈德生物技术有限公司;琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒以及RNAprep Pure 多糖多酚植物总RNA提取试剂盒均购自天根生化科技有限公司;2×SYBR qRT-PCR 定量染料、限制性内切酶、T4DNA 连接酶和cDNA反转录试剂盒均购自宝生物工程有限公司。引物由金唯智生物科技有限公司合成。
YMB 培养基:K2HPO4·3H2O 0.66 g·L-1、MgSO4·7H2O 0.2 g·L-1、NaCl2 0.1 g·L-1、Mannitol10 g·L-1、Yest extract 0.4 g·L-1。
无氮营养液:2.5 mmol·L-1 K2SO4、2 mmol·L-1MgSO4·7H2O、1 mmol·L-1 KH2PO4、0.15 mmol·L-1FeCl2、1.5 mmol·L-1 CaSO4·2H2O、4.6×10-2 mmol·L-1H3BO3、9.1×10-3 mmol·L-1 MnCl2·4H2O、7.5×10-4mmol·L-1 ZnSO4、5×10-4 mmol·L-1 CuSO4、1.1×10-4mmol·L-1 MoO3、9.4×10-5 mmol·L-1 CoCl2·6H2O。
1.2 试验方法
1.2.1 根瘤菌液制备及接种 将-80 ℃保存的大豆慢生根瘤菌Bradyrhizobium diazoefficiens USDA110接种到YMB液体培养基,28 ℃、180 r·min-1摇床震荡培养5 d,用蒸馏水稀释至OD600为0.08备用。
挑选饱满均匀的大豆种子用氯气(盐酸∶次氯酸钠=1∶24)消毒4 h,在装满蛭石的花盆中播种2粒。待大豆2片子叶完全展开时,每盆保留1株长势较好的植株,并接种5 mL稀释的根瘤菌液,定期浇灌无氮营养液。分别在接种根瘤菌10、17、21、28、35 d取大豆根瘤;接菌28 d取根、茎和叶,用液氮速冻-80 ℃保存。大豆培养在人工气候室:16 h光照/8 h黑暗,光强6 000~6 500 lx,湿度50%~60%,昼温28 ℃,夜温23 ℃。
1.2.2 GmCYP78A71 生物信息学分析 在植物基因组网站Phytozome(https://phytozome-next.jgi.doe.gov/)调取GmCYP78A71(Glyma.11G250200)基因信息,将氨基酸序列在NCBI(https://www.ncbi.nlm.nih.gov/)进行Blast比对,明确基因分类及家族成员。根据Phytozome数据库调取家族成员在大豆不同组织的表达量数据,利用HemI软件作图。
1.2.3 GmCYP78A71 克隆及qRT-PCR 提取28 dpi(days post infection,接菌后天数)成熟根瘤的总mRNA,反转录成cDNA,以cDNA 为模板利用GmCYP78A71 特异引物(表1)扩增目的基因全长ORF。PCR程序:98 ℃ 5 min;98 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 5 min,12 ℃保存。琼脂糖凝胶电泳回收目的片段,用T4 DNA连接酶将回收的目的片段与pMD19-T载体16 ℃连接过夜并转化TOP10感受态细胞。在含有氨苄青霉素的LB固体培养基上37 ℃过夜培养,挑取单克隆进行PCR检测,将阳性单克隆送金唯智生物科技有限公司测序分析,测序无误命名为T-GmCYP78A71。
利用RNA 提取试剂盒分别提取10、17、21、28、35 dpi 根瘤以及接菌28 dpi 的根、茎、叶的mRNA并反转录为cDNA,以反转录的cDNA为模版,利用GmCYP78A71 qRT-PCR特异引物和大豆内参引物(Actin11-F/R,表1)进行qRT-PCR。qRT-PCR 程序:98 ℃ 30 s;98 ℃ 15 s,58 ℃ 15 s,72 ℃ 15 s,30 个循环;12 ℃保存。采用2-ΔΔCT 方法[23]计算基因相对表达水平。
1.2.4 GmCYP78A71 启动子克隆及表达模式分析 以大豆Williams 82基因组DNA为模板,利用GmCYP78A71 启动子特异引物(Promoter-F/R,表1)扩增启动子并进行琼脂糖凝胶电泳,用琼脂糖凝胶DNA回收试剂盒回收目的片段;利用限制性内切酶PstⅠ和BamHⅠ双酶切(37 ℃、30 min)目的片段和PcamG载体,酶切产物利用T4 DNA连接酶16 ℃过夜连接并转化TOP10感受态细胞,阳性克隆送金唯智生物科技有限公司进行测序分析,命名为pCYP78A71::GUS。利用质粒小提试剂盒提取pCYP78A71::GUS 质粒转化发根农杆菌K599并侵染大豆下胚轴诱导转基因毛根[24],K599诱导的幼苗在蛭石培养12 d,根部只保留1条阳性毛状根,同时每棵接种5 mL USDA110菌液,每盒15 棵阳性苗,每周定期浇灌4 L 无氮营养液。分别取10、17、21、28 dpi 根瘤进行GUS染色[19],分析GUS着色部位。
1.2.5 GmCYP78A71 生物学功能解析 用XbaⅠ、BamHⅠ双酶切T-GmCYP78A71 质粒,回收目的片段与相同酶切处理的超表达载体pCAMBIA1304通过T4 DNA连接酶连接,构建GmCYP78A71 基因超表达载体;以T-GmCYP78A71 质粒为模板利用RNAi 特异引物(表1)扩增目的片段,分别用KpnⅠ、SpeⅠ和SacⅠ、BamHⅠ酶切目的片段和pTCK303载体,随后用T4 DNA连接酶连接以构建RNAi载体(方法同1.2.4)。
GmCYP78A71 超表达和RNAi 载体分别转化K599并侵染大豆诱导毛根,GUS染色,保留1条阳性根并接种根瘤菌USDA110,利用qRT-PCR检测28 dpi转基因根瘤中GmCYP78A71 表达量。采用乙炔还原法测定转基因根瘤的固氮酶活性,将转基因根瘤放入气密性良好的10 mL采血管中,用注射器从采血管中抽出2 mL空气,随后向采血管中注入2 mL 乙炔气体,将采血管于150 r·min-1、28 ℃摇床孵育3 h,抽取1 mL气体进行气相色谱检测。色谱柱为安捷伦GS-ALUMINA 115-3532毛细管柱,载气为N2,进样量为1 uL,进样口温度120 ℃,柱温60 ℃,检测器温度为200 ℃。统计每条转基因毛状根上根瘤的个数及鲜重,利用GraphPad Prism 7软件进行数据分析和作图。
2 结果与分析
2.1 GmCYP78A71 基因序列及家族分析
利用植物基因组数据库在线网站Phytozome分析大豆GmCYP78A71(Glyma.11G250200)基因序列,結果显示,该基因位于11号染色体且含有2个外显子和1个内含子,其基因组序列全长为2 248 bp,其中CDS(Coding sequence)序列1 569 bp,5-UTR98 bp,3-UTR 245 bp,内含子336 bp(图1A)。以大豆28 d根瘤cDNA为模板利用GmCYP78A71 基因CDS特异引物进行扩增,所得CDS测序结果与参考序列完全一致。GmCYP78A71 基因编码522个氨基酸,含有1个CYP450家族保守结构域,属于细胞色素P450单加氧酶CYP78A家族(图1B)。在大豆中该家族有11个成员, GmCYP78A71 在根瘤中特异表达(图1C),推断GmCYP78A71 在大豆根瘤中发挥功能。
2.2 GmCYP78A71 表达模式分析
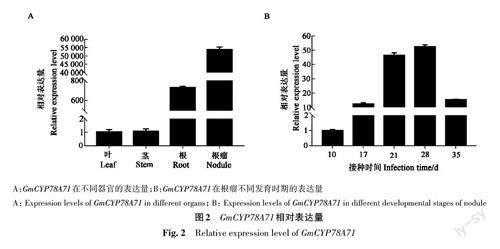
利用qRT-PCR 进一步验证GmCYP78A71 在根、茎、叶及根瘤不同发育时期的表达模式,结果显示,GmCYP78A71在大豆根瘤的表达量显著高于其他器官且随着大豆根瘤发育表达量逐渐增高,在28 dpi成熟的根瘤中表达量达到峰值(图2)。上述结果表明GmCYP78A71 在根瘤中的高效表达与根瘤生长发育相关。
2.3 GmCYP78A71 啟动子表达模式分析
GmCYP78A71 启动子融合GUS 载体通过K599 转化大豆毛状根,GUS 染色结果显示,GmCYP78A71 启动子在大豆根瘤中活性最高,且随着根瘤发育着色逐渐加深直至根瘤成熟,这与qRT-PCR 结果一致(图3),表明GmCYP78A71 基因在大豆根瘤生长发育和生物固氮中发挥重要功能。
2.4 GmCYP78A71 在大豆根瘤中的生物学功能解析
将超表达载体pCAMBIA1304-GmCYP78A71、RNAi载体pTCK303-GmCYP78A71分别转化K599发根农杆菌并诱导大豆毛状根,根据GUS染色结果筛选阳性毛状根,测定28 dpi成熟瘤的生物学功能,结果显示,超表达根瘤中GmCYP78A71 的表达量较对照提高2.94倍,固氮酶活性、根瘤个数、根瘤鲜重较对照分别增加28.5%、31.9%和39.6%;RNAi根瘤中GmCYP78A71的表达量较对照降低46.1%,固氮酶活性、根瘤个数、根瘤鲜重分别降低33.5%、16.3%和22.8%(图4)。以上结果进一步表明,GmCYP78A71调控大豆根瘤生长发育和生物固氮。
3 讨论
CYP450是植物基因组中较大的家族之一,该家族成员在植物根、茎、叶、花、果实、种子中均有分布,并参与萜类、脂肪酸、信号分子、植物激素和黄酮类等多种次生代谢物的合成与代谢,在植物生长发育过程中发挥着重要作用[2526]。CYP78A隶属于CYP71多家族簇,是CYP450家族的重要组成部分,参与植物体的多种生物学功能。CYP78A成员在植物不同器官特异性表达并行使不同生物学功能,拟南芥的CYP78A5 在荚中特异表达调控种子生长发育 [1516];甜樱桃的PaCYP78A9 在花和果实中通过介导中果皮细胞扩张和增殖调控甜樱桃果实大小[27];Zhao 等[1] 研究发现,GmCYP78A72 在大豆荚中表达量最高,超表达GmCYP78A72 可显著增加种子大小。
近年来,随着植物全基因组测序和组学分析技术的不断发展为全面解析CYP450功能奠定了基础。Guttikonda等[22]通过对大豆全基因组分析发现,大豆基因组中有332个细胞色素P450家族成员,CYP78A亚家族共有11个成员,其中GmCYP78A71在大豆根瘤中高表达;Hayashi等[28]通过对大豆结瘤相关转录组分析发现CYP450受结瘤因子诱导表达;Appleby等[29]发现,CYP450可显著影响大豆根瘤固氮酶活性;Jung等[30]发现,苯丙烷代谢途径的关键酶CYP450参与黄酮类物质的形成,能够调控大豆与根瘤菌的互作进程。尽管前人通过组学等手段初步判断CYP450可能参与大豆结瘤固氮过程,然而并未进行深入研究和验证。本研究进一步证实GmCYP78A71 在根瘤中优势表达;同时发现GmCYP78A71 表达量随着根瘤的发育逐渐升高,在根瘤成熟期达到峰值,表明GmCYP78A71在大豆根瘤生长发育中具有重要作用。
同时,本研究利用GmCYP78A71 转基因复合植株进一步表明,超表达GmCYP78A71 可有效增加大豆根瘤个数及根瘤鲜重,RNAi 转基因毛状根的根瘤个数和根瘤鲜重则显著降低,证明GmCYP78A71 表达量能够调控根瘤个数和根瘤发育,进而影响植株固氮量和生长发育,Jung等[30]研究证实CYP450能够调控大豆与根瘤菌的互作进程,与本研究结果相一致。固氮酶活性是衡量根瘤固氮效率最直接的生理指标,超表达GmCYP78A71的根瘤中固氮酶活性显著高于空载体对照,而转基因RNAi根瘤的固氮酶活性显著低于空载体对照,由此说明GmCYP78A71 表达量可显著影响根瘤固氮酶活性,与Appleby等[29]研究结果一致。综合分析表明,GmCYP78A71 在调控大豆结瘤固氮过程中扮演着重要角色,该研究结果为转基因育种创制高效固氮新种质提供了功能基因。
参考文献
[1] ZHAO B T, DAI A H, WEI H C, et al .. Arabidopsis KLU
homologue GmCYP78A72 regulates seed size in soybean [J].
Plant Mol. Biol., 2016, 90(1-2): 33-47.
[2] 杨红旗,郝仰坤.我国大豆产业回顾、现状与发展对策[J].
广东农业科学, 2010, 37(1):188-191.
YANG H Q, HAO Y K. Histroical review current situation and
development countermeasure of Chinese soybean [J]. Guangdong
Agric. Sci., 2010, 37(1): 188-191.
[3] 姚玉波,马春梅,张磊,等.施氮水平对大豆吸收利用氮素及
产量的影响[J].东北农业大学学报. 2009, 40(4): 6-10.
YAO Y B, MA C M, ZHANG L, et al .. Effect of nitrogen levels
on absorption and utilization and utilization of nitrogen and yield
of soybean [J]. J. Northeast Agric. Univ., 2009, 40(4): 6-10.
[4] CONLEY D J, PAERL H W, Howarth R W, et al .. Controlling
Eutrophication: Nitrogen and Phosphorus [J]. Science, 2009,
323(5917): 1014-1015.
[5] TILMAN D, FARGIONE J, WOLFF B, et al .. Forecasting
agriculturally driven global environmental change [J]. Science,
2001, 292(5515): 281-284.
[6] KIERS E T, HUTTON M G, DENISON R F. Human selection
and the relaxation of legume defences against ineffective
rhizobia [J]. Proc. Biol. Soc., 2007, 274(1629): 3119-3126.
[7] YAN A M , WANG E T , KAN F L, et al .. Sinorhizobium
meliloti associated with Medicago sativa and Melilotus spp. in
arid saline soils in Xinjiang, China. [J]. Int. J. Syst. Evol.
Microbiol., 2000, 50(5): 1887-1891.
[8] PROVOROV N A, TIKHONOVICH I A. Genetic resources for
improving nitrogen fixation in legume-rhizobia symbiosis [J].
Genet. Resour. Crop Evol., 2003, 50(1): 89-99.
[9] 慈恩,高明.生物固氮的研究進展[J].中国农学通报, 2004,
20(1): 25-28.
CI E, GAO M. Research progress on biological nitrogen
fixation [J]. Chin. Agric. Sci. Bull., 2004, 20(1): 25-28.
[10] 关大伟,李力,岳现录,等.我国大豆的生物固氮潜力研究[J].
植物营养与肥料学报, 2014, 2(6): 1497-1504.
GUAN D W , LI L I , YUE X L, et al .. Study on potential of
biological nitrogen fixation of soybean in China [J]. J. Plant
Nutr. Fert., 2014, 20(6): 1497-1504.
[11] NEBERT D W, NELSON D R, ADESNIK M, et al .. The P450
superfamily: updated listing of all genes and recommended
nomenclature for the chromosomal loci [J]. DNA, 1989, 8(1): 1-13.
[12] NELSON D, WERCK-REICHHART D. A P450-centric view of
plant evolution [J]. Plant J., 2011, 66(1): 194-211.
[13] RENSING S A, LANG D, ZIMMER A D, et al .. The
physcomitrella genome reveals evolutionary insights into the
conquest of land by plants [J]. Science, 2008, 319(5859):
64-69.
[14] NELSON D R. Plant cytochrome P450s from moss to poplar
[J]. Phytochem. Rev., 2006, 5(2-3): 193-204.
[15] ANASTASIOU E, KENZ S, GERSTUNG M, et al .. Control of
plant organ size by KLUH/CYP78A5-dependent intercellular
signaling [J]. Dev. Cell, 2007, 13(6): 843-856.
[16] FANG W J, WANG Z B, CUI R F, et al .. Maternal control of
seed size by EOD3/CYP78A6 in Arabidopsis thaliana [J]. Plant
J., 2012, 70(6). 929-939.
[17] MAEDA S, DUBOUZET J G, KONDOU Y, et al .. The rice
CYP78A gene BSR2 confers resistance to Rhizoctonia solani
and affects seed size and growth in Arabidopsis and rice [J/OL].
Sci. Rep., 2019, 9(1), 587 [2021-08-10]. https://doi.org/
10.1038/s41598-018-37365-1.
[18] ZONDLO S C, IRISH V F. CYP78A5 encodes a cytochrome
P450 that marks the shoot apical meristem boundary in
Arabidopsis [J]. Plant J., 1999, 19(3): 259-268.
[19] TAKASHI N, MISAKI K, HIROAKI U, et al .. Highly pleiotropic
functions of CYP78As and AMP1 are regulated in non-cellautonomous/
organ-specific manners [J]. Plant Physiol., 2021,
186(1): 767-781.
[20] KATSUMATA T, FUKAZAWA J , MAGOME H, et al ..
Involvement of the CYP78A subfamily of cytochrome P450
monooxygenases in protonema growth and gametophore
formation in the moss Physcomitrella patens [J]. Biosci.
Biotechnol. Biochem., 2011, 75(2): 331-336.
[21] DAI A H, YANG S X, ZHOU H K, et al .. Evolution and
expression divergence of the CYP78A subfamily genes in
soybean [J/OL]. Genes, 2018, 9(12): 611 [2021-08-10]. http://
doi.org/10.3390/genes9120611.
[22] GUTTIKONDA S K, TRUPTI J, BISHT N C, et al .. Whole
genome co-expression analysis of soybean cytochrome P450
genes identifies nodulation-specific P450 monooxygenases [J].
BMC Plant Biol., 2010, 10(1): 243-243.
[23] KENNETH J L, THOMAS D S. Analysis of relative gene
expression data using real-time quantitative PCR and the
2-ΔΔCT method [J]. Methods, 2000, 25(4): 402-408.
[24] 邢馨竹,杨占武,孔佑宾,等.大豆类胡萝卜素裂解双加氧酶
GmCCD8 固氮功能解析[J].中国农业科技导报,2022,24(1):
46-53.
XING X Z, YANG Z W, KONG Y B, et al .. Fuctional analysis
of carotenoid cleavage dioxygenases GmCCD8 in soybean
nodulation [J]. J. Agric. Sci. Technol., 2022,24(1):46-53.
[25] ZHAO Y J, CHENG Q Q, SU P, et al .. Research progress
relating to the role of cytochrome P450 in the biosynthesis of
terpenoids in medicinal plants [J]. Appl. Microbiol.
Biotechnol., 2014, 98(6): 2371-2383.
[26] HULL A K, VIJ R , CELENZA J L. Arabidopsis cytochrome
P450s that catalyze the first step of tryptophan-dependent
indole-3-acetic acid biosynthesis [J]. Proc. Natl. Acad. Sci. USA,
2000, 97(5): 2379-2384.
[27] QI X L, LIU C L , SONG L L, et al .. PaCYP78A9, a
cytochrome P450, regulates fruit size in sweet cherry (Prunus
avium L.) [J/OL]. Front. Plant Sci., 2017, 8:2076 [2021-08-10].
http://doi.org/10.3389/5pls.2017.02076.
[28] HAYASHI S , REID D E , LORENC M T , et al .. Transient
Nod factor-dependent gene expression in the nodulationcompetent
zone of soybean (Glycine max [L.] Merr.) roots [J].
Plant Biotechnol. J., 2012, 10(8): 995-1010.
[29] APPLEBY C A, TURNER G L, Macnicol P K. Involvement of
oxyleghaemoglobin and cytochrome P-450 in an efficient
oxidative phosphorylation pathway which supports nitrogen
fixation in Rhizobium [J]. Biochim. Biophys. Acta, 1975, 387
(3): 461-474.
[30] JUNG W, YU O, LAU S M C, et al .. Identification and
expression of isoflavone synthase, the key enzyme for
biosynthesis of isoflavones in legumes [J]. Nat. Biotechnol.,
2000, 18(2): 208-212.
(責任编辑:温小杰)
