甘薯PHB基因家族的全基因组鉴定和表达分析
2023-04-12梅玉琴朱国鹏杨新笋
梅玉琴 刘 意 王 崇 雷 剑 朱国鹏 杨新笋,*
研究简报
甘薯PHB基因家族的全基因组鉴定和表达分析
梅玉琴1,2,**刘 意1,**王 崇2,3雷 剑2朱国鹏1,*杨新笋2,*
1海南大学园艺学院 / 海南省热带园艺作物品质调控重点实验室, 海南海口 570228;2湖北省农业科学院粮食作物研究所, 湖北武汉 430064;3长江大学农学院, 湖北荆州 434025
蛋白质抑制素(prohibitin, PHB)是在原核生物到真核生物中发现的含有SPFH结构域的蛋白质。植物PHB基因家族参与多种不同生物过程的重要功能, 包括生长发育以及对生物和非生物胁迫的响应。目前PHB蛋白在拟南芥、水稻、玉米、大豆、番茄和陆地棉等多种植物中被鉴定。但对甘薯中PHB家族的系统分析仍未确定。本研究鉴定出甘薯11个PHB基因, 且对这些保守的蛋白质基序和基因结构的分析显示它们在系统发育亚群中具有高度的保守性。此外, 启动子区域预测出与多种激素调节及胁迫相关的顺式作用元件, 同时研究发现基因在植物不同部位及受到不同的非生物胁迫时的表达模式存在差异。本研究系统分析了甘薯中基因的一般特性, 为甘薯及其他植物中PHB基因的功能特性研究提供了理论基础。
甘薯; PHB基因家族; 系统进化; 生物信息学; 表达分析
抑制素(prohibitin, PHB)是一类从原核生物到真核生物物种中普遍存在的高度保守蛋白, 也被称为 band_7结构域或SPFH (stomatin/prohibitin/flotillin/HflK/C)结构域蛋白[1-2]。PHB家族是植物特有的一类转录因子家族, 广泛存在于绿色植物中, 调控植物生长发育、信号转导及响应非生物胁迫等多种生理过程[3]。PHB基因是1995年在哺乳动物细胞中发现, 由于其具有抗细胞增殖的作用, 是一种潜在的肿瘤抑制基因, 因此被命名为抑制素基因[4]。后在人类中, PHB基因被发现与乳腺癌表型相关[5-6], 其中PHB定位于一些乳腺癌细胞系的细胞核中, 作为一个转录调控因子, 与E2F、P53和视网膜母细胞瘤(Rb)相互作用, 以调节下游基因的表达[7]。因此, PHB基因可以作为一种肿瘤抑制因子, 调节细胞周期进程和细胞凋亡。现已有研究发现, PHB基因在植物发育和衰老中也起着重要作用。和是拟南芥中研究最广泛的PHB基因, 它们主要在根和茎的增殖组织中表达[8]。拟南芥突变体表现出严重的生长表型迟缓, 茎部、根部增殖减少, 根尖和根尖细胞分裂下降。过表达拟南芥PHB基因(/)表现出不规则的叶形和广泛的分枝表型。值得注意的是,/双敲除突变体不能存活, 这表明PHBs在植物发育中发挥了重要作用。在烟草中也得到了类似的结果,和在衰老过程中表达下调。基因沉默导致植株严重的生长延迟、叶片变黄变和细胞死亡[9]。一些研究表明, PHB蛋白不仅在植物发育和衰老中发挥关键作用, 而且在响应盐度、防御和植物激素中也发挥关键作用。例如, 拟南芥()突变体在乙烯暴露后表现出黄化的幼苗表型, 各种乙烯诱导基因(拟南芥乙基响应元件结合蛋白(), 植物防御素())的表达受到抑制, 表明在拟南芥中具有双重作用[10-11]。目前, PHB基因家族已在拟南芥(17)、水稻(19)[3]、大豆(24)[12]、番茄(16)[13]、陆地棉(28)[14]和玉米(16)[15]中得到了鉴定。
甘薯((L.) Lam.)属旋花科番薯属, 营养丰富, 是世界第七大粮食作物, 也可用作饲料、工业原料和生物质能源[16-17]。中国是世界上最大的甘薯种植及生产国, 年种植面积稳定在4×106hm2左右, 占全球总种植面积的57%, 产量高达22,500 kg hm–2 [18]。随着全球甘薯产业的飞速发展, 甘薯的产量和品质也受到低温、高温、高盐及干旱等非生物胁迫和各种病害的严重威胁, 造成较大的经济损失[19]。但甘薯中PHB基因家族的研究鲜有报道, 本试验通过生物信息学方法系统分析了甘薯PHB基因的理化特性、亚细胞定位、基因结构、蛋白质结构域、启动子顺式元件、在不同组织中的表达和在非生物胁迫下的表达量, 为进一步分析甘薯PHB基因提供理论依据。
1 材料与方法
1.1 甘薯PHB基因家族鉴定
根据PHB保守Pfam序列(https://pfam.xfam.org/), 在甘薯((L.) Lam.)基因组数据库(https:// ipomoea-genome.org/)中筛选甘薯PHB家族成员。在甘薯基因组数据库(https://ipomoea-genome.org/)下载甘薯全基因组数据及基因结构注释文件, 用TBtools软件进行BLAST序列比对、去冗余, 将得到的蛋白序列用NCBI-CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/ bwrpsb/bwrpsb.cgi/)进行蛋白保守结构域分析, 删除不含共同结构域或含不完整结构域的蛋白序列。从甘薯基因组注释文件中提取基因家族成员的染色体位置信息, 利用MapChart软件绘制基因的染色体定位图[20]。
1.2 甘薯PHB家族成员基因序列分析
使用ExPASy Proteomics Server (http://www.expasy. org/proteomics)分析氨基酸长度、分子量、理论等电点、不稳定系数、脂肪系数和平均疏水指数[21-22]; 利用Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行亚细胞定位预测[23-24]; 使用MEME网站(http://meme-suite.org/)分析保守基序Motif[25]。
1.3 甘薯PHB基因家族系统发育及顺式作用元件分析
从甘薯基因组网站获得IbPHB基因家族成员启动子序列(转录起始位点上游1.5 kb), 并利用 PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测IbPHB基因家族基因启动子顺式作用元件[26]; 利用MEGA7软件邻近法对氨基酸序列构建系统进化树, Bootstrap值设定为500。
1.4 试验材料与处理
本研究所用的甘薯品种为‘鄂11’, 选取若干生长健壮、长势一致的‘鄂11’植株, 用清水培养2周后, 分别进行非生物胁迫处理, 盐胁迫处理采用200 mmol L–1的NaCl溶液[27]替代清水继续培养; 干旱胁迫处理采用200 g L–1的PEG-6000[28]替代清水模拟干旱继续培养, 每组处理3次重复, 每个重复3个植株。胁迫处理后, 采集0、1、3、6、12、24 h甘薯的叶片[29-30], 经液氮速冻后于–80℃保存。
采集同一时期(发根缓苗期)甘薯的须根、茎和叶, 经液氮速冻后于–80℃保存, 用作后续IbPHB基因家族成员的组织特异性表达分析。
1.5 总RNA提取与cDNA合成
使用Up试剂盒(北京全式金生物技术有限公司)提取植物总RNA, 使用NanoDrop-2000 (Thermo Fisher, 美国)测定RNA浓度和质量。使用反转录试剂盒(北京全式金生物技术有限公司)反转录成cDNA, –20℃保存备用[31]。
1.6 实时荧光定量PCR
利用NCBI primer blast 网站和Primer 5软件设计IbPHB基因家族的荧光定量特异性引物(表1), 采用作为qRT-PCR的内参基因。参照TransStart Tip Green qPCR SuperMix试剂盒说明书(北京全式金生物技术有限公司), 在荧光定量PCR仪(Bio-Rad CFX96)上进行扩增, 每个反应3次重复。荧光定量PCR 扩增条件为94℃预变性30 s; 94℃变性5 s, 56℃退火30 s, 40个循环; 溶解曲线设置为65℃ 5 s到95℃, 增量为0.5℃。检测~基因在不同组织间的表达模式, 利用2–ΔΔCt法[32]计算出基因的相对表达量。
1.7 数据处理
利用Microsoft Excel和DPS软件分析数据, 进行单因素方差分析(ANOVA), 多重比较采用Duncan’s法分析[33-34]。
2 结果与分析
2.1 甘薯PHB基因家族成员鉴定及系统进化分析
经blast序列比对、去冗余和蛋白结构域筛选后, 在甘薯中共挖掘出11个IbPHB家族成员。由表2可知, IbPHB基因家族编码氨基酸276~474个, 分子量在30,402.86~52,238.60 kD之间, 等电点为5.30~9.23, 在1号、5号、6号、7号、8号、12号、13号、15号染色体均有基因分布。亚细胞定位预测显示, 甘薯、、、、、、位于线粒体膜上,、位于细胞核上,在细胞质、线粒体、细胞核上均有分布,在线粒体和细胞核上均有分布。
将甘薯11个IbPHB家族基因与拟南芥PHB基因家族的蛋白质序列构建系统发育进化树, 如图1所示, 进化树中聚类关系可以反映基因功能的相似程度, 基因功能相似则聚类关系近。根据进化树聚类关系以及基因在染色体上的位置(图2), 将甘薯IbPHB家族的11个基因分别命名为~。
2.2 甘薯PHB家族结构和保守基序分析
通过MEME在线工具对基因进行保守基序Motif分析发现, 11个IbPHB基因家族成员所包含的保守基序数量和分布存在差异, 范围为0~5个(图3-B)。和的保守基序数量为0, 可能是因为这2个成员的蛋白序列所含氨基酸数较少;和含有的motif最多, 且均含有motif 6、motif 7、motif 8、motif 9和motif 10;、和含有相似的motif, 均含有motif 3和motif 4;、、和含有相似的motif, 均含有motif 1、motif 2、motif 5和motif 8。利用NCBI-CDD数据库对基因进行蛋白保守结构域分析(图3-C)发现, IbPHB基因家族成员有0~8个内含子, 3~11个外显子。

表1 试验所用引物

表2 甘薯PHB基因家族
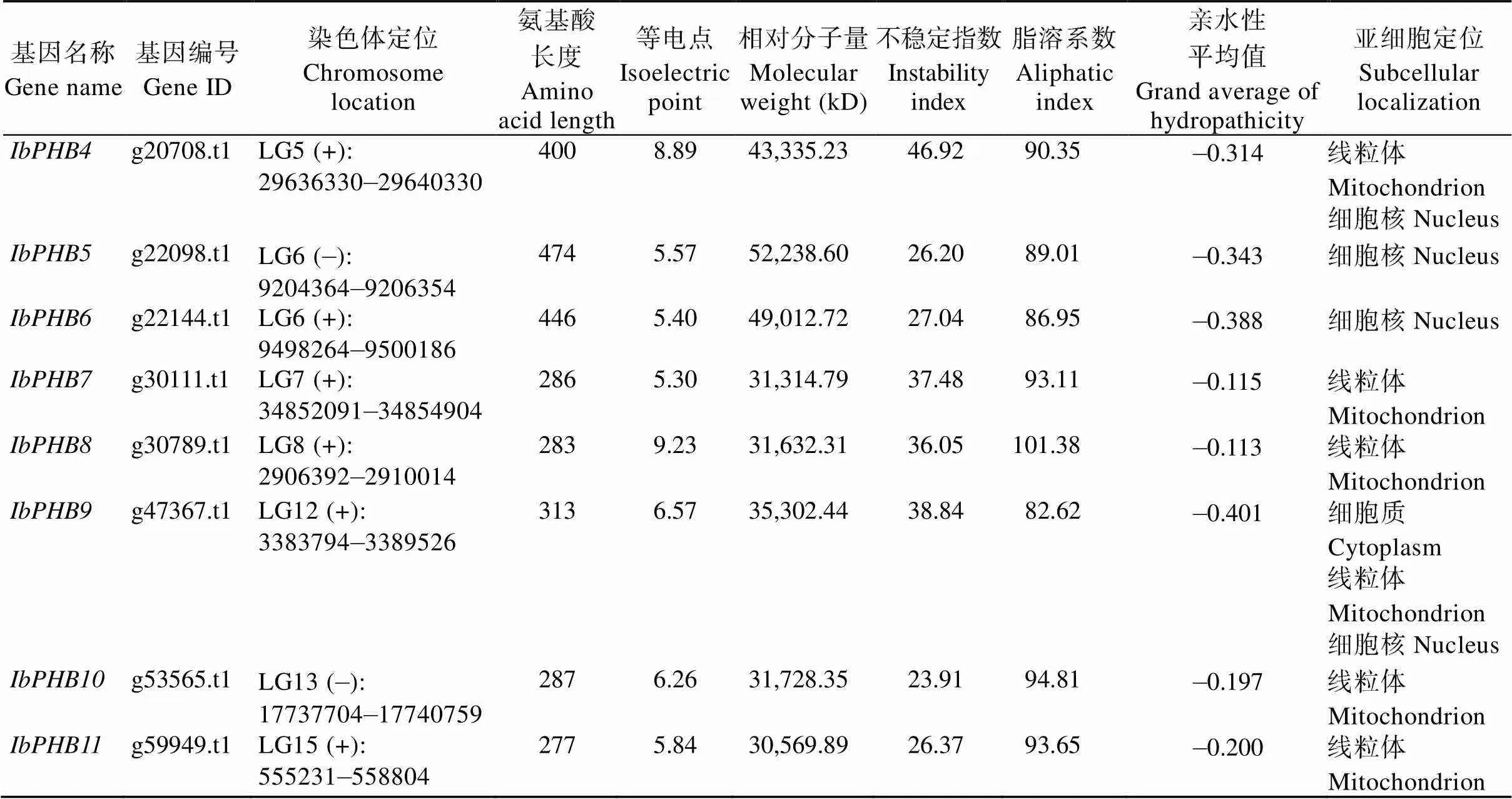
(续表2)

图1 甘薯和拟南芥的PHB基因家族蛋白系统发育树
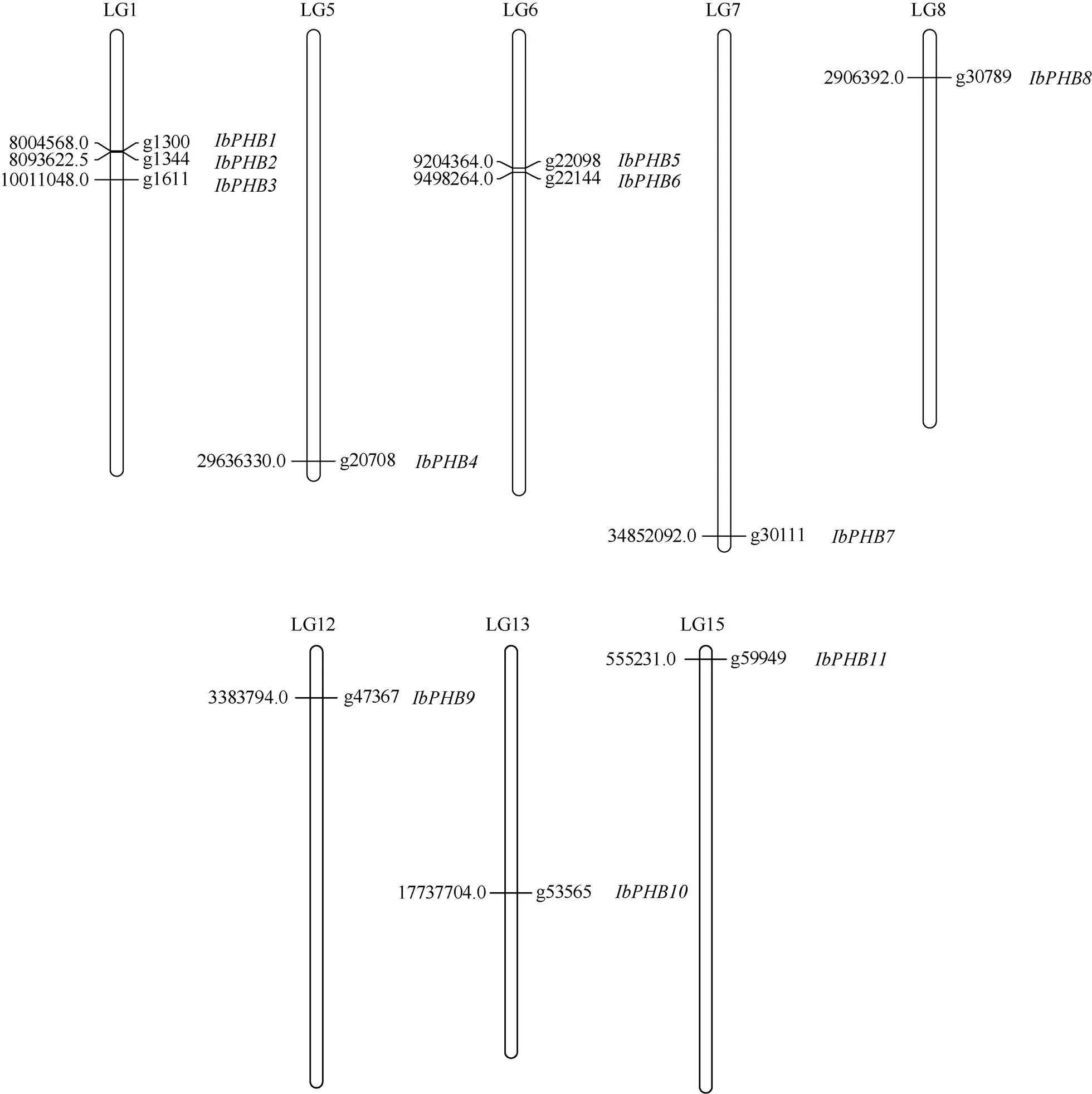
图2 甘薯PHB基因家族在染色体上的分布
2.3 甘薯PHB基因家族启动子顺式作用元件分析
利用PlantCARE网站对IbPHB基因家族基因启动子进行顺式作用元件预测分析(图4)发现, 11个IbPHB基因家族成员的启动子序列中, 除真核生物基因转录最基本的元件TATA-box、CAAT-box外, 还含有光响应元件(AE-box、CAG-motif、G-box、GA-motif、GATA-motif、GT1-motif、Gap-box、I-box、TCT-motif等)、逆境响应元件(干旱诱导元件MBS、厌氧诱导元件ARE、低温响应元件LTR、防御和应激反应元件TC-rich repeats等)、激素响应元件(脱落酸响应元件ABRE、生长素响应元件AuxRR-core和TGA-element、赤霉素响应元件GARE- motif、水杨酸响应元件TCA-element、茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif等)和生长发育调节元件(AACA_motif、GCN4_motif、AACA-motif、HD-Zip1、O2-site)。表明,基因与甘薯的生长发育和生物及非生物胁迫等生物过程密切相关, 它的转录表达调控与多种因素有关, 这些顺式作用元件能够响应外界环境的变化, 从而调控基因的表达。

图3 甘薯PHB基因家族进化树与基因结构
A: 甘薯PHB家族基因系统进化树; B:保守基序; C: 保守结构域分布。
A: the phylogenetic tree of PHB family genes in sweet potato; B:conservative motif; C: the distribution of conservative domains.
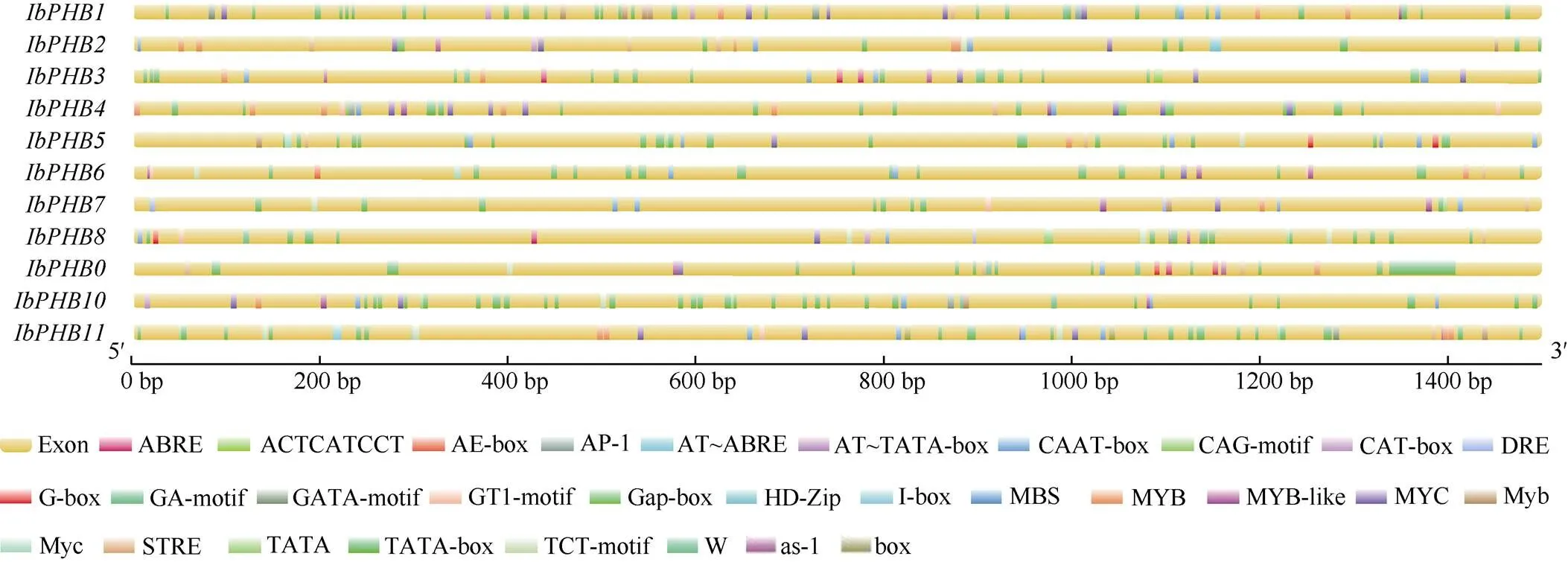
图4 甘薯PHB基因家族启动子预测
2.4 甘薯PHB家族基因的表达分析
2.4.1基因不同组织部位表达分析 由图5可知,基因的表达具有组织特异性, 除、、、外, 其他基因在甘薯叶片中的表达量最高。和在茎中的表达量高于根, 其他基因则是在根中的表达量高于茎。、、、的表达量均为根>茎>叶,在茎和根中的表达量约为叶片中的1/15,在茎和根中的表达量约为叶片中的1/4,在茎和根中的表达量约为叶片中的1/8,在茎和根中的表达量约为叶片中的1/6,在茎和根中的表达量约为叶片中的1/12,在茎和根中的表达量约为叶片中的1/10,在茎和根中的表达量约为叶片中的1/7。
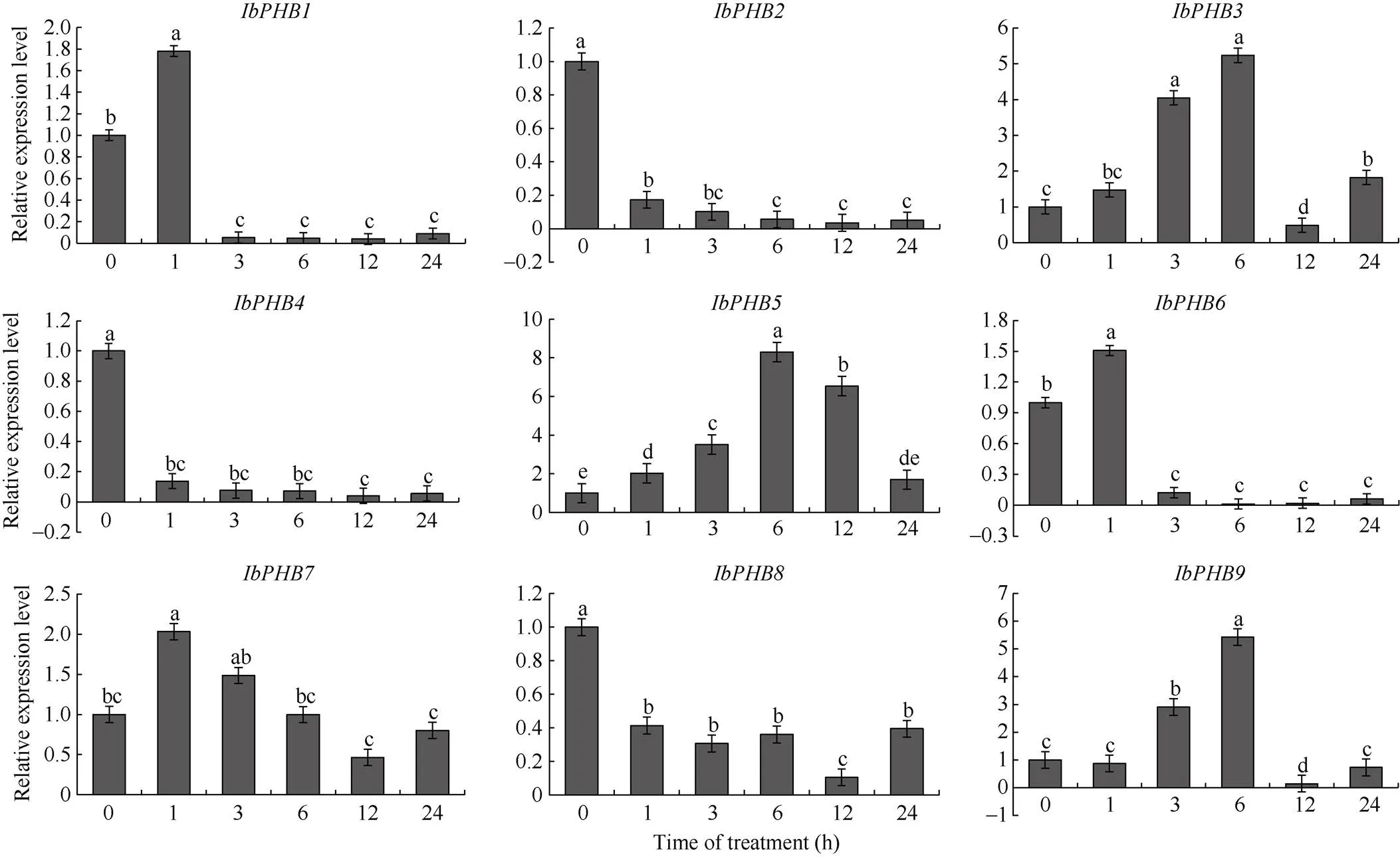
2.4.2基因在高盐胁迫下的表达分析 qRT- PCR分析基因对高盐胁迫处理的响应(图6)发现,在12 h达到高峰, 呈现先下降后上升再下降的趋势;和在3 h达到高峰;在3 h达到高峰, 呈现先上升后下降的趋势;和呈现先下降再上升再下降的趋势;在6 h达到高峰, 呈现先下降再上升再下降的趋势;在3 h达到高峰,呈现先上升后下降的趋势;在3 h达到高峰, 呈现先下降后上升再下降的趋势;在3 h达到高峰, 呈现先下降后上升再下降再上升的趋势;在1 h达到高峰, 呈现先上升后下降再上升的趋势。
图中标以不同字母表示数据间在0.05概率水平差异显著。
Different lowercase letters in the figure indicate significant differences between the data at the 0.05 probability level.

(图6)
图中标以不同字母表示数据间在0.05概率水平差异显著。
Different lowercase letters in the figure indicate significant differences between the data at the 0.05 probability level.
2.4.3基因在干旱胁迫下的表达分析 由图7可知,、和在1 h表达量最高, 经处理后均呈现先上升后下降再上升的趋势;和在0 h表达量最高, 在干旱处理后均出现下降的趋势;、、、和在6 h表达量最高,在干旱处理后出现先上升后下降再上升的趋势,和经处理后呈现先上升后下降的趋势,和经处理后呈现先下降后上升再下降再上升的趋势;经处理后呈现先下降后上升的趋势。
(图7)
图中标以不同字母表示数据间在0.05概率水平差异显著。
Different lowercase letters in the figure indicate significant differences between the data at the 0.05 probability level.
3 讨论
PHB是一个高度保守的基因家族, 已在人类和各种植物物种的许多生物体中被发现, 在生长发育的各个方面发挥着重要作用[35-37]。在植物中, PHB基因家族已在拟南芥(17)、水稻(19)[3]、大豆(24)[12]、番茄(16)[13]、陆地棉(28)[14]和玉米(16)[15]中报道。然而, 在甘薯基因组中尚未发现PHB基因家族的全基因组鉴定。本研究在甘薯基因组中共鉴定出11个PHB基因, 并全面分析了它们的理化性质、保守基序、基因结构、顺式作用元件以及有关组织特异性和在非生物胁迫下的表达量。
全基因组鉴定结果显示, 甘薯PHB基因分布在甘薯90条染色体中的8条上。基因复制或片段或串联在基因组的扩展中起着重要的作用[33,38]。PHB基因家族在拟南芥、水稻和大豆中的扩增是由片段重复引起的[38-40], 而串联重复是导致拟南芥中PHB基因数量增加的另一个原因[13], 但在甘薯中缺失, 且基因间不存在共线性, 这说明在甘薯中PHB基因家族的基因复制是与拟南芥不同的。
PHB基因参与了植物生长发育的各个方面。本研究对顺调控序列进行了预测。结果表明,基因的启动子区域包含各种生长发育、非生物胁迫和植物激素响应元件。11个IbPHB基因家族成员的启动子序列中, 除真核生物基因转录最基本的元件TATA-box、CAAT-box外, 还含有光响应元件(AE-box、CAG-motif、G-box、GA-motif、GATA-motif、GT1-motif、Gap-box、I-box、TCT-motif等)、逆境响应元件(干旱诱导元件MBS、厌氧诱导元件ARE、低温响应元件LTR、防御和应激反应元件TC-richrepeats等)、激素响应元件(脱落酸响应元件ABRE、生长素响应元件AuxRR-core和TGA-element、赤霉素响应元件GARE-motif、水杨酸响应元件TCA-element、茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif等)和生长发育调节元件 (AACA_motif、GCN4_motif、AACA-motif、HD-Zip1、O2-site)。这证实了PHB基因参与了植物生长发育、激素信号转导途径和非生物胁迫反应。已有研究也证明了该点, 如拟南芥可引起根和茎部组织的增殖[11]。同样, 烟草能够促进叶片衰老[39]。
本研究还对甘薯组织和非生物胁迫进行表达分析, 结果表明, 本试验中的基因在各个组织中的表达量不同。基因的表达具有组织特异性, 且均在甘薯叶片中的表达量最高。qRT-PCR分析基因对高盐和干旱胁迫处理的响应发现,基因在不同时间及不同胁迫处理下的表达量不同。这表明IbPHB基因家族成员参与了甘薯应激反应过程。且本研究中的基因存在逆境响应元件(干旱诱导元件MBS、厌氧诱导元件ARE、低温响应元件LTR、防御和应激反应元件TC-rich repeats等), 以及多个MYB、MRE转录因子结合位点, 这些转录因子会诱导的表达, 从而提高甘薯对非生物胁迫的抗性。综上可知, PHB基因家族参与了植物胁迫响应调控, 这为全面系统地研究PHB 基因对非生物胁迫的反应机制提供了一定的理论支撑。
[1] Duncan T B, Maja B H, Stephen M R. The SPFH domain- containing proteins: more than lipid raft markers., 2007, 17: 394–402.
[2] Morrow I C, Parton R G. Flotillins and the PHB domain protein family: rafts, worms and anaesthetics., 2005, 6: 725–740.
[3] Di C, Xu W Y, Su Z, Yuan J. Comparative genome analysis of PHB gene family reveals deep evolutionary origins and diverse gene function., 2010, 11: S22.
[4] McClung J K, Danner D B, Stewart D A, Smith J R, Schneider E L, Lumpkin C K, Dell’Orco R T, Nuell M J. Isolation of a cDNA that hybrid selects antiproliferative mRNA from rat liver., 1989, 164: 1316–1322.
[5] Sato T, Sakamoto T, Takita K, Saito H, Okui K, Nakamura Y. The human prohibitin (PHB) gene family and its somatic mutations in human tumors., 1993, 17: 762–764.
[6] 黄浩浩. PHB基因对胶质瘤干细胞的调控研究. 中国人民解放军军事医学科学院硕士学位论文, 北京, 2017. Huang H H. The Roles of PHB on the Regulation of Glioma Stem Cell. MS Thesis of PLA Academy of Military Medical Sciences, Beijing, China, 2017 (in Chinese with English abstract).
[7] Wu Y W, Yang S H, Hwangbo M, Chu K H. Analysis ofZD1 draft genome: genes and gene clusters responsible for high polyhydroxybutyrate (PHB) production from glycerol under saline conditions and its CRISPR-Cas system., 2019, 14: e0222143.
[8] Van Aken O, Pecenková T, Van De Cotte B, De Rycke R, Eeckhout D, Fromm H, De Jaeger G, Witters E, Beemster G T S, Inzé D, Van Breusegem F. Mitochondrial type-I prohibitins ofare required for supporting proficient meristem development., 2007, 52: 850–864.
[9] Ahn C S, Lee J H, Reum H A, Kim W T, Pai H S. Prohibitin is involved in mitochondrial biogenesis in plants., 2006, 46: 658–667.
[10] Christians M J, Larsen P B. Mutational loss of the prohibitinresults in an extreme constitutive ethylene response phenotype coupled with partial loss of ethylene-inducible gene expression inseedlings., 2007, 58: 2237–2248.
[11] 王晓萍, Amber R, Kati W, Albert Y, Nigel M C, 王勇. 拟南芥抑制蛋白基因PHB3在NO介导反应和H2O2诱导NO积累过程中的功能研究. 见: 诸葛健, 李华钟主编. 山东植物生理学会第七次代表大会暨植物生物学与现代农业研讨会论文集. 山东泰安: 山东省科学技术协会, 2012. pp 51–61. Wang X P, Amber R, Kati W, Albert Y, Nigel M C, Wang Y. The function ofinhibitor protein gene PHB3 in NO mediated reaction and H2O2induced NO accumulation. In: Zhu G J, Li H Z, eds. Shandong Plant Physiology Association Seventh Congress and Workshop on Plant Biology and Modern Agriculture. Tai’an, Shandong, China: Shandong Science and Technology Association, 2012. pp 51–61 (in Chinese).
[12] Song M, Peng X Y, Du C F, Lei L, Zhang T, Xiang Y. Genome-wide analysis of the PHB gene family in(L.) Merr., 2017, 39: 1095–1106.
[13] Huang F Y, Ye X W, Wang Z J, Ding Y, Cai X J, Yu L, Waseem M, Abbas F, Ashraf U, Chen X L, Ke Y G. The prohibitins (PHB) gene family in tomato: Bioinformatic identification and expression analysis under abiotic and phytohormone stresses., 2021, 12: 535–550.
[14] 章妮, 陈克龙. 陆地棉PHB基因家族鉴定与表达分析. 分子植物育种, 2021. https://kns.cnki.net/kcms/detail/46.1068.S.20211216.1051.007.html. Zhang N, Chen K L. Identification and expression analysis of PHB gene family in upland cotton., 2021, https://kns.cnki.net/kcms/detail/46.1068.S.20211216.1051.007.html (in Chinese with English abstract).
[15] Wen X J, Niu T T, Kong X P. In silico analysis of PHB gene family in maize., 2014, 73: 181–191.
[16] 王欣, 李强, 曹清河, 马代夫. 中国甘薯产业和种业发展现状与未来展望. 中国农业科学, 2021, 54: 483–492. Wang X, Li Q, Cao Q H, Ma D F. Current status and future prospective of sweetpotato production and seed industry in China., 2021, 54: 483–492 (in Chinese with English abstract).
[17] Yang J, Moeinzadeh M H, Kuhl H, Helmuth J, Xiao P, Haas S, Liu G L, Zheng J L, Sun Z, Fan W J, Deng G F, Wang H X, Hu F H, Zhao S S, Fernie A R, Boerno S, Timmermann B, Zhang P, Vingron M. Haplotype-resolved sweet potato genome traces back its hexaploidization history., 2017, 3: 696–703.
[18] 刘振雷, 潘家荃, 周桦楠, 刘冠求, 于涛. 甘薯耐冷组学及分子生物学研究进展. 江苏农业科学, 2021, 49(24): 45–48. Liu Z L, Pan J Q, Zhou H N, Liu G Q, Yu T. Research progress on cold tolerance omics and molecular biology of sweet potato., 2021, 49(24): 45–48 (in Chinese with English abstract).
[19] 陈璐, 周淑倩, 李永新, 陈刚, 陆国权, 杨虎清. 甘薯解偶联蛋白基因家族鉴定与表达分析. 作物学报, 2022, 48: 1683–1696. Chen L, Zhou S Q, Li Y X, Chen G, Lu G Q, Yang H Q. Identification and expression analysis of uncoupling protein gene family in sweet potato., 2022, 48: 1683–1696 (in Chinese with English abstract).
[20] 饶莉萍. 甘薯基因的克隆与功能鉴定. 长江大学硕士学位论文, 湖北荆州, 2021. Rao L P. Cloning and Functional Identification ofGene from(L.) Lam. MS Thesis of Yangtze University, Jingzhou, Hubei, China, 2021 (in Chinese with English abstract).
[21] 梁璇, 李鹏, 杨哲, 贾小云, 王文斌. 甘薯近缘二倍体野生种TPS家族全基因组鉴定及表达分析. 山西农业科学, 2022, 50: 605–612. Liang X, Li P, Yang Z, Jia X Y, Wang W B. Identification and expression analysis of genome of TPS family of wild relative diploid species of sweet potato., 2022, 50: 605–612 (in Chinese with English abstract).
[22] 张文杰, 辛曙丽, 黄哲瑞, 祝志欣, 司成成, 陈艳丽, 朱国鹏, 刘永华. 甘薯块根发育过程中关键蔗糖分解酶及其基因家族成员的鉴定. 热带作物学报, 2022, 43: 1535–1544. Zhang W J, Xin S L, Huang Z R, Zhu Z X, Si C C, Chen Y L, Zhu G P, Liu Y H. Identification of key sucrose-degrading enzymes and the relevant gene family members in the development of sweetpotato storage roots., 2022, 43: 1535–1544 (in Chinese with English abstract).
[23] 黄小芳, 毕楚韵, 陈其俊, 刘江洪, 胡韵卓, 黄碧芳, 陈选阳, 林世强. 甘薯α-淀粉酶基因的全基因组鉴定和分析. 分子植物育种, 2022, 20: 8035–8042. Huang X F, Bi C Y, Chen Q J, Liu J H, Hu Y Z, Huang B F, Chen X Y, Lin S Q. Genome-wide identification and analysis of α- amylase gene family of., 2022, 20: 8035–8042 (in Chinese with English abstract).
[24] 黄小芳, 毕楚韵, 黄伟群, 刘江洪, 胡韵卓, 黄碧芳, 林世强, 陈选阳. 甘薯β-淀粉酶家族基因的全基因组鉴定和表达分析. 华南农业大学学报, 2021, 42(5): 50–59. Huang X F, Bi C Y, Huang W Q, Liu J H, Hu Y Z, Huang B F, Lin S Q, Chen X Y. Genome-wide identification and expression analysis of the β-amylase gene family in., 2021, 42(5): 50–59 (in Chinese with English abstract).
[25] 黄小芳, 毕楚韵, 石媛媛, 胡韵卓, 周丽香, 梁才晓, 黄碧芳, 许明, 林世强, 陈选阳. 甘薯基因组NBS-LRR类抗病家族基因挖掘与分析. 作物学报, 2020, 46: 1195–1207. Huang X F, Bi C Y, Shi Y Y, Hu Y Z, Zhou L X, Liang C X, Huang B F, Xu M, Lin S Q, Chen X Y. Discovery and analysis of NBS-LRR gene family in sweet potato genome., 2020, 46: 1195–1207 (in Chinese with English abstract).
[26] 许光龄, 王建伟, 陈玥, 陈艳丽, 祝志欣, 朱国鹏. 甘薯NRT基因家族成员鉴定及其在不同氮素条件下的表达模式分析. 分子植物育种, 2022, 20: 7316–7331. Xu G L, Wang J W, Chen Y, Chen Y L, Zhu Z X, Zhu G P. Identification of sweetpotato NRT gene family members and expression patterns analysis under different nitrogen conditions., 2022, 20: 7316–7331 (in Chinese with English abstract).
[27] 毕楚韵, 黄小芳, 王和寿, 陈其俊, 胡韵卓, 黄碧芳, 许明, 杨志坚, 林世强, 陈选阳. 甘薯全基因组WRKY转录因子的基因鉴定与逆境胁迫表达分析. 西北农林科技大学学报(自然科学版), 2021, 49(9): 30–44. Bi C Y, Huang X F, Wang H S, Chen Q J, Hu Y Z, Huang B F, Xu M, Yang Z J, Lin S Q, Chen X Y. Identification of WRKY transcription factor genes ingenome and expression analysis under stresses.(Nat Sci Edn), 2021, 49(9): 30–44 (in Chinese with English abstract).
[28] 黄小芳, 毕楚韵, 王和寿, 陈其俊, 胡韵卓, 陈选阳, 林世强. 甘薯NAC转录因子家族的全基因组鉴定与分析. 热带作物学报, 2021, 42: 1831–1840. Huang X F, Bi C Y, Wang H S, Chen Q J, Hu Y Z, Chen X Y, Lin S Q. Genome-wide identification and analysis of NAC transcription factor family of., 2021, 42: 1831–1840 (in Chinese with English abstract).
[29] Zhang H, Gao X R, Zhi Y H, Li X, Zhang Q, Niu J B, Wang J, Zhai H, Zhao N, Li J G, Liu Q C, He S Z. A non-tandem CCCH-type zinc-finger protein,, functions as a nuclear transcriptional activator and enhances abiotic stress tolerance in sweet potato., 2019, 223: 1918–1936.
[30] 宋小锋, 原增艳. 甘薯水通道蛋白基因家族的全基因组鉴定和表达分析. 分子植物育种, 2022, 20: 1452–1461. Song X F, Yuan Z Y. Genome-wide identification and expression pattern profiling of aquaporin gene family in., 2022, 20: 1452–1461 (in Chinese with English abstract).
[31] 宋天晓, 刘意, 饶莉萍, Soviguidi D R J, 朱国鹏, 杨新笋. 甘薯细胞壁蔗糖转化酶基因家族成员鉴定及表达分析. 作物学报, 2021, 47: 1297–1308. Song T X, Liu Y, Rao L P, Soviguidi D R J, Zhu G P, Yang X S. Identification and expression analysis of cell wall invertasegene family members in sweet potato., 2021, 47: 1297–1308 (in Chinese with English abstract).
[32] 周淑倩, 陈璐, 陈惠云, 李永新, 陈刚, 陆国权, 杨虎清. 甘薯交替氧化酶基因家族生物信息学与表达分析. 核农学报, 2022, 36: 270–281. Zhou S Q, Chen L, Chen H Y, Li Y X, Chen G, Lu G Q, Yang H Q. Bioinformatics and expression analysis of alternative oxidase genes in sweetpotato., 2022, 36: 270–281 (in Chinese with English abstract).
[33] 毕楚韵, 黄小芳, 黄伟群, 刘江洪, 胡韵卓, 黄碧芳, 林世强, 陈选阳. 甘薯基因组BBX转录因子基因鉴定与逆境胁迫表达分析. 四川农业大学学报, 2021, 39(2): 157–165. Bi C Y, Huang X F, Huang W Q, Liu J H, Hu Y Z, Huang B F, Lin S Q, Chen X Y. Identification of BBX transcription factor genes ingenome and expression analysis under stresses., 2021, 39(2): 157–165 (in Chinese with English abstract).
[34] 邵正伟, 曾志鹏, 陈彦竹, 何敏红, 张毅, 陈善兰, 朱宏波. 甘薯全基因组SBP-box基因家族鉴定及表达分析. 分子植物育种, 2021. https://kns.cnki.net/kcms/detail/46.1068.S.20210722.1407. 014.html. Shao Z W, Zeng Z P, Chen Y Z, He M H, Zhang Y, Chen S L, Zhu H B. Genome-wide identification and expression analysis of the SBP-box gene family in sweet potato ()., 2021. https://kns.cnki.net/kcms/detail/46.1068.S. 20210722.1407.014.html (in Chinese with English abstract).
[35] 夏梦, 徐畅, 王吉, 王玲, 孙丹. 植物Prohibitins基因(PHBs)的研究进展. 中国农学通报, 2016, 32(35): 24–29. Xia M, Xu C, Wang J, Wang L, Sun D. Research progress of plant Prohibitins gene (PHBs)., 2016, 32(35): 24–29 (in Chinese with English abstract).
[36] 熊炤成, 屈春凤, 沈开元, 刘庆友, 王英群, 石德顺, 李湘萍. 水牛PHB基因克隆与表达模式. 中国兽医学报, 2016, 36: 1422–1428.Xiong Z C, Qu C F, Shen K Y, Liu Q Y, Wang Y Q, Shi D Y, Li X P. Cloning and expression pattern of buffalo PHB gene., 2016, 36: 1422–1428 (in Chinese with English abstract).
[37] 王晗, 闫敏, 许晔, 王仁雷, 刘少华. 芸薹属物种(.,.,.) PHB基因的生物信息学分析. 分子植物育种, 2021, 19: 4232–4241. Wang H, Yan M, Xu Y, Wang R L, Liu S H. Bioinformatics analysis of PHB gene inspecies (.,.,.)., 2021, 19: 4232–4241 (in Chinese with English abstract).
[38] 张佳宇. 黄瓜CsPHB基因功能的初步分析. 西北农林科技大学硕士学位论文, 陕西杨凌, 2020. Zhang J Y. A Preliminary Analysis of the Function of the CsPHB Gene in Cucumber (L.). MS Thesis of Northwest A&F University, Yangling, Shaanxi, China, 2020 (in Chinese with English abstract).
[39] 徐丽. 利用基因工程进行PHB相关基因的克隆和烟草转化. 山东师范大学硕士学位论文, 山东济南, 2000. Xu L. Cloning and Transformation of PHB Related Genes in Tobacco by Genetic Engineering. MS Thesis of Shandong Normal University, Jinan, Shandong, China, 2000 (in Chinese with English abstract).
[40] 张瑜. 条斑紫菜PHB基因克隆及生物信息学分析. 辽宁师范大学硕士学位论文, 辽宁大连, 2014. Zhang Y. Molecular Cloning and Bioinformatics Analysis of Prohibitin from. MS Thesis of Liaoning Normal University, Dalian, Liaoning, China, 2014 (in Chinese with English abstract).
Genome-wide identification and expression analysis of PHB gene family in sweet potato
MEI Yu-Qin1,2,**, LIU Yi1,**, WANG Chong2,3, LEI Jian2, ZHU Guo-Peng1,*, and YANG Xin-Sun2,*
1Horticulture College, Hainan University / Key Laboratory for Quality Regulation of Tropical Horticultural Plants of Hainan Province, Haikou 570228, Hainan, China;2Food Crops Institute, Hubei Academy of Agricultural Sciences, Wuhan 430064, Hubei, China;3College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China
The prohibitins (PHB) are SPFH domain-containing proteins found in the prokaryotes to eukaryotes. Plant PHB gene family is involved in many important functions in a variety of different biological processes, including growth and development and responses to biotic and abiotic stresses. At present, PHB proteins have been identified in, rice, maize, soybean, tomato, upland cotton, and other plants. However, the systematic analysis of PHB family in sweet potato is still uncertain. In this study, 11 PHB genes in sweet potato were identified, and the analysis of these conserved protein motifs and gene structures showed that they were highly conserved in phylogenetic subgroups. In addition, the cis-acting elements related to various hormone regulation and stress were predicted in the promoter region and the relative expression patterns ofgenes were different in different parts of plants and under different abiotic stresses. This study systematically analyzed the general characteristics ofgene in sweet potato, and provided a theoretical basis for the study of functional characteristics ofgene in sweet potato and other plants.
sweet potato; PHB gene family; phylogenetic evolution; bioinformatics; the relative expression level
10.3724/SP.J.1006.2023.24142
本研究由财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-10-C13-2021), 国家重点研发计划项目“双子叶杂粮抗性种质创制”(2019YFD1001303-4), 湖北省农业科技创新中心湖北省农科院领军人才培养计划项目(L2018005)和湖北省重点研发计划项目“中贝鄂薯系列新品种与新技术示范”(2020BHB024)资助。
This study was supported by the China Agriculture Research System of MOF and MARA (CARS-10-C13-2021), the National Key Research and Development Program of China “Creation of Resistant Germplasm for Dicotyledonous Grains” (2019YFD1001303-4), the Leading Talent Training Plan of Hubei Academy of Agricultural Sciences (L2018005), and the Hubei Province Key Research and Development Program Project “China and Benin Eshu Series New Varieties and New Technology Demonstration” (2020BHB024).
朱国鹏, E-mail: guopengzhu@163.com; 杨新笋, E-mail: yangxins013@163.com
**同等贡献(Contributed equally to this work)
梅玉琴, E-mail: 20095131210148@hainanu.edu.cn; 刘意, E-mail: 15549421602@163.com
2022-06-16;
2022-10-11
2022-10-21.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20221021.0821.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
