甜荞FeSGT1基因克隆及抗旱功能解析
2023-04-12朱旭东杨兰锋陈媛媛侯泽豪罗旖柔熊泽浩方正武
朱旭东 杨兰锋 陈媛媛 侯泽豪,2 罗旖柔 熊泽浩 方正武,*
甜荞基因克隆及抗旱功能解析
朱旭东1杨兰锋1陈媛媛1侯泽豪1,2罗旖柔1熊泽浩1方正武1,*
1长江大学农学院/ 主要粮食作物产业化湖北省协同创新中心, 湖北荆州 434025;2中国农业科学院作物科学研究所, 北京 100081
SGT1 (suppressor of the G2 allele of skp1)作为skp1-4的抑制因子, 在植物的非生物胁迫响应中具有重要作用。根据甜荞干旱胁迫下的转录组学和蛋白质组学分析, 我们克隆出一个与甜荞耐旱性状相关的候选基因。生物信息学分析表明包含一个1086 bp开放阅读框(ORF), 编码361个氨基酸, 具有3个(TPR、CS和SGS)保守结构域。进化分析表明, FeSGT1与藜麦CqSGT1 (XP_021726759.1)、甜菜BvSGT1 (XP_010671588.1)和菠菜SoSGT1 (XP_021839743.1)亲缘关系较近。亚细胞定位初步显示FeSGT1蛋白定位于细胞膜上。qRT-PCR分析发现在干旱胁迫24 h内表达呈现上调趋势。在盐、低温(4℃)胁迫和ABA处理下,基因表达在12 h达到高峰, 24 h后开始下降。在拟南芥中过表达基因发现, 在干旱和盐胁迫下, 转基因植株的发芽率、根长、鲜重和存活率显著提高, 丙二醛(MDA)和过氧化氢(H2O2)含量明显降低, 而过氧化氢酶(CAT)活性显著升高。过表达显著增强了转基因拟南芥植株的耐旱和耐盐能力, 为深入研究基因调控甜荞抗旱分子机制奠定了基础。
甜荞;; 转基因拟南芥; 抗旱性
荞麦是廖科(Polygonaceae)荞麦属()的一种药食两用型作物, 具有生育期短、抗逆性强和适应性广等特点[1], 但其根系不发达, 因此, 干旱成为了制约荞麦生长发育的主要因素之一[2]。目前已报道的甜荞耐旱基因主要包括转录因子、离子转运类基因和分子伴侣三大类。研究表明, CBF/DREB转录因子家族基因受干旱胁迫诱导, 在干旱胁迫下可以提高转基因拟南芥的萌发率, 并通过介导ABA信号转导途径增强转基因拟南芥的耐旱性[3]。Na+/H+交换系统NHX家族基因可通过调节芦丁的生物合成途径增强转基因荞麦的耐旱和耐盐性[4]。此外, 研究发现在干旱胁迫下HSP70和HSP90伴侣蛋白的积累, 能够保护甜荞花的正常发育, 提高植株的耐旱性[5]。因此, 挖掘耐旱基因对培育优良抗逆性荞麦品种和解析荞麦响应干旱胁迫的分子调控机制具有重要的意义。
干旱、高盐等非生物胁迫是影响作物生长发育和产量的重要因素[6]。干旱导致植物脱水和渗透失衡[7], 干扰土壤养分有效性[8]。盐胁迫主要导致植物发生生理干旱和离子毒害[9-10]。因此, 渗透应激和氧化应激成为了干旱和盐胁迫的常见防御机制。干旱引起的渗透应激有利于最大限度地减少气孔和角质层的水分流失和最大限度地增加水分吸收[11]。在盐胁迫中, 渗透调节在维持渗透稳态中发挥着重要作用[12]。此外, 基因表达调控作为植物逆境响应的一部分, 也涉及大量基因转录水平的变化[13]。SGT1作为一类共伴侣蛋白[14-15], 与、、和等抗逆基因形成蛋白复合物, 主要参与SCF E3泛素连接酶依赖的信号通路、LRR蛋白的折叠以及介导植物对生长素(IAA)和茉莉酸(JA)等激素的反应, 在植物的非生物胁迫响应中起着重要的调控作用[16]。
SGT1在真核生物中高度保守, 参与调控着丝粒的装配, 并调节泛素对靶蛋白的修饰, 位于不同应激反应的信号传导的交叉位置上, 参与不同应激相关调控基因的信号传导途径[17]。研究发现植物SGT1蛋白一般由5个结构域组成: SGT1特异性基序(SGS)、四肽重复结构域(TPR)、两个可变区域(VR1和VR2)和CS基序[14]。其中, SGS基序与HSP70相互作用[18], TPR区与HSP90发生互作[19], CS基序则可以和RAR1的CHORDⅡ基序发生互作[20], 从而在蛋白折叠和信号转导方面发挥调控作用。研究表明, SGT1能够增强植物的抗氧化系统和调节渗透平衡[17]。在甘蓝中发现BolSGT1与HSC70-1、ATHSP90.1、SRFR1、PBS2、RPM1和AFB5等调控因子构成一个相互作用网络, 提高了植株对高温、低温、干旱、盐和ABA胁迫适应性[21]。在水稻中发现可参与褪黑激素介导的信号转导, 提高了等抗氧化系统相关基因的表达, 从而改善干旱胁迫适应性[22]。在大豆中SGT1蛋白与RAR1和HSP90之间相互作用, 参与调节植物体内的渗透稳态, 提高了植株的耐旱和耐盐性[23]。在拟南芥中SGT1与胞质热激同源蛋白70(HSC70)结合, 参与蛋白质的组装和折叠, 从而增强了植株的高温耐受性[24]。SGT1还参与植物的生长发育[17]。在番茄中, 用VIGS (virus- induced gene silencing)沉默基因后, 导致植株株高变矮, 根尖茎分生组织坏死[25]。而这种现象是由于突变体植株中生长素(IAA)和茉莉酸(JA)等植物激素的生物合成和信号转导途径被破坏[26]。SGT1还通过调节SCF E3连接酶等26S蛋白酶体介导的信号通路, 来参与到植物的生长发育过程中[27-28]。本研究根据前期转录组分析[29], 从甜荞中克隆到一个响应干旱胁迫的基因, 在确定了该基因的亚细胞定位及干旱胁迫下的表达模式后, 通过在拟南芥中超表达基因来进一步探讨该基因的抗旱性功能, 为深入研究基因参与调控甜荞抗旱分子机制, 挖掘新耐旱基因奠定基础。
1 材料与方法
1.1 FeSGT1基因克隆与序列分析
使用EASY spin plant RNA Extraction Kit (Aidlab, 中国)试剂盒从甜荞品种西农9976叶片中提取总RNA。根据反转录试剂盒(TaKaRa, 日本)合成第一链cDNA。以Fes_sc0000108.1.g000012.aua.1序列为参考序列设计特异性引物(表1)扩增的全长编码区。在NCBI (https://www.ncbi.nlm.nih.gov/)在线网站中进行blast比对, 确定序列的同源性。从GenBank数据库中检索不同植物SGT1蛋白序列, 使用MEGA 7.0软件(Kumar, STempe, 美国)构建系统发育树。使用DNAMAN软件(Lynnon Biosoft, San Ramon, 美国)进行SGT1的多序列比对分析。最后使用Phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/)在线网站分析FeSGT1蛋白的3D结构。
1.2 亚细胞定位
利用双酶切的方法将无终止密码子的的CDS序列融合到GFP的N端区域。将重组质粒PHZM27--通过农杆菌(GV3101)侵染法转化到烟草叶片中。以空PHZM27质粒为对照。转化的烟草植株在24℃下培养2~3 d后, 使用激光共聚焦显微镜(TCS SP8, 徕卡, 德国)观察烟草叶片中的绿色荧光信号。
1.3 非生物胁迫下的定量分析
甜荞(西农9976)种子经0.1% HgCl2消毒5 min, 用蒸馏水洗涤3次后, 在玻璃培养皿(直径15 cm, 每培养皿30株)中水培生长。在16 h/8 h (光/暗, 25℃/ 15℃)的光周期和60%的相对湿度条件下, 将萌发的幼苗转移到人工气候培养箱条件下继续培养(宁波科技有限公司, 中国宁波)。对培养15 d的甜荞幼苗进行胁迫处理, 将幼苗分别置于4℃的人工气候培养箱内进行低温处理, 将幼苗分别转移到含有15% PEG-6000、200 µmol L–1ABA和200mmol L–1NaCl溶液中进行干旱、ABA和盐处理[30], 在处理后的0、3、6、12、24和48 h进行取样, 立即用液氮冷冻, 并在–80℃下储存备用。
提取不同胁迫处理的样品的总RNA, 反转录合成cDNA。使用Primer 5.0设计的qRT- PCR特异性引物,(HQ398855.1)作为内参基因(表1)。使用TB Green (TaKaRa)试剂盒在CFX 96实时PCR系统(BioRad, 美国)上进行qRT-PCR分析。PCR扩增体积为20 μL, 含约100 ng cDNA模板, 每条引物0.6 μL, PCR混合液10 μL (2×)。反应程序为:在95℃ 30 s; 95℃ 10 s (40×); 55℃ 30 s。设置3次生物学重复, 使用2–∆∆Ct法计算基因的相对表达水平。
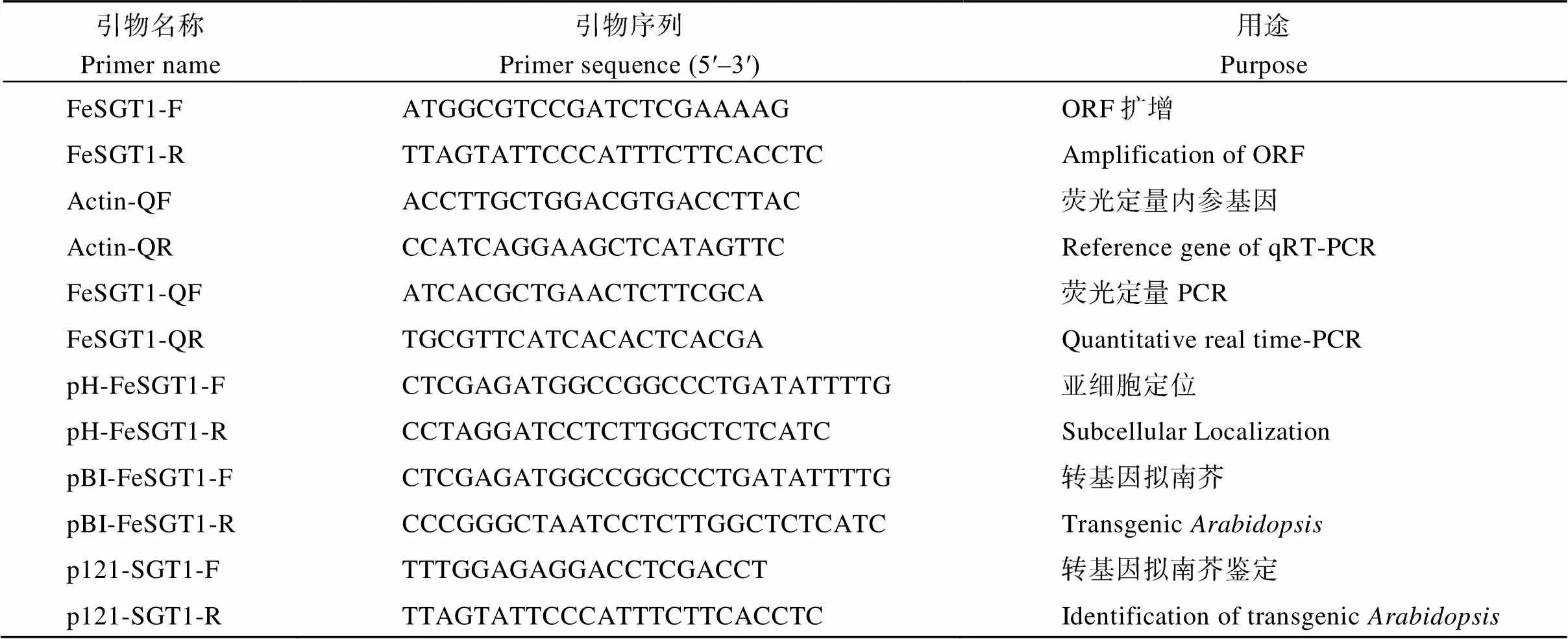
表1 引物序列汇总
1.4 拟南芥的遗传转化及阳性植株鉴定
利用双酶切的方法将的全长CDS融合到空载体pBI121 (BD Biosciences Clontech)中。构建的35S::重组质粒和pBI121空质粒(WT)分别通过农杆菌浸花法转化到野生型拟南芥(Columbia-0)中, 共侵染2次, 每次间隔7 d, 待成熟后收获种子。种子经消毒灭菌后, 播种在含有35 μg mL–1卡那霉素(kanamycin)的固体1/2 MS培养基上, 4℃培养3 d后, 转移到25℃的光周期为16 h光照/8 h黑暗的人工气候培养箱中培养10 d, 移栽到土壤中。设计特异性引物对转基因拟南芥进行PCR鉴定来筛选阳性植株(表1)。最后选择3个过表达纯合T3转基因品系(OE株系)和用pBI121空质粒转基因的纯合T3株系作为野生型(WT)对照进行后续的生理生化分析。
1.5 转基因拟南芥的非生物胁迫处理
将3个OE株系和WT的T3代种子播种在添加200 mmol L–1甘露醇、300 mmol L–1甘露醇、100 mmol L–1NaCl和125 mmol L–1NaCl的1/2 MS培养基上进行发芽试验。种子先在4℃放置72 h后转移到25℃ (60%相对湿度)的光周期为16 h光照/8 h黑暗的人工培养箱中。待胚根从种皮伸出1 mm时开始统计发芽情况, 共统计5 d, 并计算发芽率。为了进行根生长试验, 将5日龄的幼苗转移到添加200 mmol L–1甘露醇、300 mmol L–1甘露醇、100 mmol L–1NaCl和125 mmol L–1NaCl的1/2 MS培养基中培养7 d, 然后测量总根长和鲜重。以1/2MS培养基为对照, 所有实验包含3个独立的生物学重复。
选择3周龄的OE株系和WT拟南芥植株进行盆栽条件下的干旱和盐胁迫处理。干旱胁迫通过于22℃生长条件下为期2周不浇灌进行, 并计算各株系的存活率。盐胁迫则使用250 mmol L–1NaCl溶液灌溉3周龄的幼苗, 每周浇灌100 mL, 直到分别在WT和OE株系植物之间观察到显著差异, 照相并统计存活率, 所有实验包含3个独立的生物学重复。
1.6 MDA、CAT和H2O2的检测
分别在干旱处理2周和盐处理1周后, 对拟南芥叶片进行取样。拟南芥叶片中的MDA、H2O2含量和CAT活性按照试剂盒(Cominbio, 中国苏州)分别进行检测。每次测量包括3次重复。
2 结果与分析
2.1 FeSGT1基因鉴定及序列比对分析
采用同源克隆技术, 获得的全长CDS序列, 包含一个1086 bp的开放阅读框, 编码361个氨基酸, 与CqSGT1 (XP_021726759.1)具有77.41%相似性, 将其命名为, GenBank登录号为MW145503。根据预测的氨基酸序列分析, FeSGT1包含3个(TPR、CS和SGS)保守结构域(图1-A)。系统发育分析显示, FeSGT1蛋白与藜麦SGT1 (XP_ 021726759.1)、甜菜SGT1 (XP_010671588.1)和菠菜SGT1 (XP_021839743.1)亲缘关系较近(图1-B)。FeSGT1的3D结构显示仅存在多个α-螺旋和β链结构(图1-C)。
2.2 亚细胞定位分析
为了研究FeSGT1的亚细胞定位, 将含有FeSGT1-GFP融合蛋白的重组质粒通过农杆菌介导的瞬时表达方法侵染烟草叶片, 使用激光共聚焦显微镜观察叶片中绿色荧光蛋白的表达。GFP蛋白在细胞核和细胞膜上表达, 而仅在细胞膜中检测到FeSGT1-GFP融合蛋白的绿色荧光信号(图2), 表明FeSGT1定位在细胞膜上。

图1 甜荞FeSGT1的鉴定和结构分析
A: FeSGT1与其他植物SGT1蛋白的多重比对; B: FeSGT1蛋白系统进化树分析; C: FeSGT1蛋白三级结构分析。
A: multiple alignment of FeSGT1 with other plant SGT1 proteins; B: Phylogenetic tree analysis of FeSGT1 protein; C: 3D structure analysis of FeSGT1 protein.
2.3 FeSGT1基因在非生物胁迫下的表达模式分析
通过qRT-PCR分析基因在低温(4℃)、盐(200 mmol L–1NaCl)、干旱(15% PEG-6000)胁迫和200 μmol L–1ABA处理下的表达模式。结果显示, 干旱、盐、低温和ABA均诱导了的表达(图3-A, B)。干旱胁迫下,在甜荞叶片中的转录水平在24 h内缓慢增加, 且幅度很小, 48 h后逐渐降低(图3-A)。在盐、低温和ABA处理下, 转录在12 h达到峰值, 24 h后开始下降(图3-A)。然后, 根部中的转录水平与叶中存在较大差异。在根部中, 干旱胁迫下的转录在48 h内持续增加, 48 h的表达量为对照的20.8倍。在盐胁迫和ABA处理下, 转录水平在3 h达到峰值, 6 h后持续下降, 且转录水平低于对照。而低温胁迫下, 根部中的转录情况与叶片中大致相同。推测参与了不同的胁迫应激信号转导通路, 并在增强植物的抗非生物胁迫方面发挥作用。

图2 FeSGT1的亚细胞定位
FeSGT1蛋白在烟草叶片中的亚细胞定位。绿色表示GFP信号, 红色表示叶绿体自身荧光。
Subcellular localization of FeSGT1 protein in tobacco leaves. The green indicates GFP signals, and the red indicates chloroplast autofluorescence.
*、**分别表示在0.05和0.01概率水平差异显著。数据表示为平均值±SD (= 3)
* and ** indicate significantly different at the 0.05 and 0.01 probability levels, respectively. The error bars indicate ± SD (= 3).
2.4 过表达FeSGT1增强拟南芥的耐旱性
选择3个独立的过表达纯合T3转基因拟南芥进行干旱胁迫下的表型分析。结果表明, WT与OE株系的发芽率无显著差异(图4-A, B)。在200 mmol L–1甘露醇处理下, WT和OE株系的萌发均受到抑制, 但转基因株系的萌发率显著高于WT (图4-A, B)。300 mmol L–1甘露醇处理对WT和OE系的发芽率的抑制程度更大。其中, OE株系第5天的发芽率约为85%, 显著高于WT的发芽率(约56%) (图4-A, B)。根系生长测定发现, 对照组的根长和鲜重均无显著差异(图4-C, D)。在200 mmol L–1甘露醇处理下, WT和OE株系植株的生长均受到抑制; 然而, OE株系比WT表现出更小的生长抑制, 具有更长的根和更高的鲜重(图4-C, D)。在300 mmol L–1甘露醇中的结果与200 mmol L–1甘露醇处理结果相似, 但拟南芥植株的生长受到更为严重的抑制(图4-C, D)。
A: 干旱胁迫下WT和OE株系的种子萌发分析。B: 干旱胁迫下WT和OE株系的发芽率; 计算后5 d的发芽率。C: 干旱胁迫下WT和OE株系的根长测定。D: 干旱胁迫下WT和OE株系的总根长和鲜重; *表示在0.05概率水平差异显著。
A: seed germination assays of WT and OE lines under drought stress. B: the germination rates of WT and OE lines under drought stress; the germination rate was calculated for the next 5 days. C: root length assays of WT and OE lines under drought stress. D: The total root lengths and fresh weights of WT and OE lines under drought stress; * indicates significantly different at the 0.05 probability level.
为了检验转基因拟南芥的耐旱性, 将3周龄的拟南芥盆栽植株进行干旱处理。结果表明, 干旱处理前, WT与OE株系在形态上无显著差异。干旱处理后, 转基因植株的耐旱性显著提高, 而WT植株严重枯萎, 转基因植株的存活率显著高于WT (图5-A, B)。通过对过表达拟南芥中MDA和H2O2的含量以及CAT的活性进行测定, 发现OE株系的MDA和H2O2含量及CAT活性显著高于WT (图5-C, D, E)。

图5 FeSGT1基因的异位表达增强了转基因拟南芥的抗旱性
A: 干旱胁迫下3周龄WT和OE株系的表型分析。B: 复水7 d后WT和OE株系在干旱条件下的存活率。C~E: 对照和干旱处理下WT和OE株系的MDA (C) H2O2(D)含量和CAT (E)活性。*、**分别表示在0.05 和0.01概率水平差异显著。
A: phenotypes of 3-week-old WT and OE lines under drought stress. B: the survival rates of WT and OE lines under drought condition was monitored 7 days after rewatering. C–E: the physiological indicators of WT and OE lines under normal and drought treatments, including MDA (C), H2O2(D) contents, and CAT (E) activities. * and ** indicate significantly different at the 0.05 and 0.01 probability levels, respectively.
2.5 过表达FeSGT1增强拟南芥的耐盐性
在1/2 MS培养基上进行了盐胁迫的发芽和根生长试验, 盐处理下的OE株系表现出比WT更长的根和更高的鲜重(图6)。在土壤中盐处理1周后, 植物表现出生长迟缓。当盐处理持续2周时, 植物叶片变黄并死亡, 但WT植物表现出更严重的过敏症状(图7-A, B)。对盐胁迫下过表达拟南芥叶片中MDA和H2O2的含量以及CAT的活性测定, 结果表明, OE株系的MDA、H2O2含量和CAT活性均显著高于WT (图7-C, D, E)。

图6 盐处理下FeSGT1转基因植株表型分析
A: 盐胁迫下WT和OE株系的种子萌发分析。B: 盐胁迫下WT和OE株系的发芽率; 计算后5 d的发芽率。C: 盐胁迫下WT和OE株系的根长测定。D: 盐胁迫下WT和OE株系的总根长和鲜重; *表示在0.05概率水平差异显著。
A: seed germination assays of WT and OE lines under salt stress. B: the germination rates of WT and OE lines under salt stress; the germination rate was calculated for the next 5 days. C: root length assays of WT and OE lines under salt stress. D: the total root lengths and fresh weights of WT and OE lines under salt stress; * indicates significantly different at the 0.05 probability level.

图7 FeSGT1基因的异位表达增强了转基因拟南芥的耐盐性
A:盐胁迫下3周龄WT和OE株系的表型分析。B: WT和OE株系在盐胁迫下的存活率。C~E: 对照和盐处理下WT和OE株系的MDA (C)、H2O2(D)含量和CAT (E)活性。*表示在0.05概率水平差异显著。
A: phenotypes of 3-week-old WT and OE lines under salt stress. B: the survival rates of WT and OE lines under salt stress. C–E: the physiological indicators of WT and OE lines under normal and salt treatments, including MDA (C), H2O2(D) contents, and CAT (E) activities; * indicates significantly different at the 0.05 probability level.
3 讨论
SGT1作为胁迫感应途径中的信号转导元件, 广泛参与植物受体调节、信号诱导、重折叠和维持蛋白平衡以应对环境胁迫[17]。在前期对甜荞干旱胁迫下的转录组学和蛋白质组学分析中, 我们发现在干旱胁迫下被显著诱导[29]。本研究从甜荞中克隆了基因, 其具有家族特有的TPR、CS和SGS结构域。亚细胞定位情况显示, FeSGT1蛋白定位于细胞膜上, 这与SGT1蛋白在小麦[31]内的亚细胞定位结果类似。在甜荞苗期基因的表达受低温(4℃)、盐、干旱和ABA胁迫的诱导。组织特异性分析表明在植物早期发育阶段起作用, 在根和叶有不同的表达量, 参与不同的发育阶段。
近年来, 研究表明SGT1作为信号转导正调控因子在植物非生物胁迫应答方面发挥重要作用[17]。在拟南芥中基因通过与HSP90相互作用促进IAA、JA等植物激素的生物合成和信号转导, 从而正向调节植株的生长和茎分生组织的发育[26], 提高了拟南芥植株的耐旱和耐盐性[24,32]。其中HSP90是一类广泛参与蛋白质合成与降解, 维持渗透稳态的伴侣蛋白[32]。在大豆中SGT1蛋白与RAR1和HSP90之间相互作用, 通过介导应激防御信号来调节植物体内的渗透稳态, 从而提高了大豆植株的耐旱和耐盐性[27]。此外水稻的突变显著抑制了抗氧化系统相关基因的表达, 参与褪黑激素介导的信号转导来改善了水稻植株的干旱胁迫适应性[26]。这些研究证实了基因通过参与植物的氧化应激和渗透应激来提高植物的耐旱和耐盐性。还有研究发现SGT1与SCF E3泛素连接酶的一部分skp1发生相互作用[23], 因此SGT1可能参与蛋白质的泛素化, 而以泛素为基础的蛋白质降解途径在植物抗旱性中发挥了关键作用[34]。然而, 在植物耐旱性中, 能够证明特定E3连接酶复合物和SGT1之间存在功能联系的证据尚不充分。此外, SGT1可能是通过对JA和IAA等抗逆相关激素的积累或信号转导途径的改变来参与植物的抗旱性[17]。多项研究表明参与了JA介导的信号转导, 能够调节JA诱导的基因表达[35-36], 而JA在一定程度上能减缓干旱胁迫对植株造成的伤害, 有效地提高植株的抗旱能力[36]。Gray等[26]发现拟南芥突变体因的突变, 改变了植株对生长素的敏感性。而生长素通常需要被生长素运输抑制剂响应蛋白(TIR1)激活后, 从而参与到26S蛋白酶体介导的Aux/IAA蛋白降解[38], 因此有可能在拟南芥中SGT1b与TIR1相互作用, 并协助Aux/IAAs的泛素化过程, 从而参与植物的耐旱性。但是SGT1是否作为JA、IAA等激素诱导基因表达的转录调控因子, 参与植物耐旱性的分子机制仍需进一步研究证实。
SGT1缺失的植物表现出复杂的表型变化, 包括对非生物胁迫的抗性减弱和生长缺陷[17]。为了进一步确定SGT1在植物非生物胁迫中的作用, 本研究发现过表达的转基因拟南芥表现出更强的干旱和盐胁迫耐受性。生理指标检测分析发现其耐受性的提高是通过显著提高CAT活性以及清除MDA和H2O2的能力实现的, 氧化损伤的减少降低了细胞损伤程度[39]。本研究结果表明在提高植物耐旱和耐盐性中发挥着积极作用。此外, SGT1对植物生长相关激素(如JA或IAA)的反应中的调控机制, 以及SGT1是否与泛素化连接酶或HSP90伴侣蛋白相互作用以及如何作用等, 尚需进一步研究。相较前人结果, 本研究证实了基因通过参与抗氧化调节来增强植物的耐旱和耐盐性。为后续深入研究基因调控甜荞抗旱分子机制奠定了基础。
4 结论
甜荞基因的CDS序列全长1086 bp, 其编码蛋白定位于细胞膜。该基因受低温、盐、干旱和ABA胁迫诱导。异源过表达增强了转基因拟南芥的耐旱性和耐盐性。
[1] 万燕, 韦爽, 贾晓凤, 刘曼, 谭茂玲, 宋超, 向达兵, 赵钢. 荞麦抗旱性研究进展. 作物杂志, 2015, (4): 23–26. Wan Y, Wei S, Jia X F, Liu M, Tan M L, Song C, Xiang D B, Zhao G. Advances in drought resistance of buckwheat., 2015, (4): 23–26 (in Chinese with English abstract).
[2] 冯佰利, 姚爱华, 高金峰, 高小丽, 柴岩. 中国荞麦优势区域布局与发展研究. 中国农学通报, 2005, 21(3): 375–377. Feng B L, Yao A H, Gao J F, Gao X L, Cai Y. Study on regional distribution and development of buckwheat in China., 2005, 21(3): 375–377 (in Chinese with English abstract).
[3] Fang Z W, Xu X Y, Gao J F, Wang P K, Liu Z X, Feng B L. Characterization of FeDREB1 promoter involved in cold- and drought-inducible expression from common buckwheat ()., 2015, 14: 7990–8000.
[4] Chen L H, Zhang B, Xu Z Q. Salt tolerance conferred by overexpression ofvacuolar Na(+)/H(+) antiporter gene AtNHX1 in common buckwheat ()., 2008, 17: 121–132.
[5] Płażek A, Hura K, Hura T, Słomka A, Hornyák M, Sychta K. Synthesis of heat-shock proteins HSP-70 and HSP-90 in flowers of common buckwheat () under thermal stress., 2020, 71: 760–767.
[6] Ohta M, Schumaker K S, Zhu J K. Mechanisms Underlying Plant Tolerance to Abiotic Stresses. Boston, MA: Springer US, 2006. pp 360–385.
[7] Xiang X Y, Chen J, Xu W X, Qiu J R, Song L, Wang J T, Tang R, Chen D, Jiang C Z, Huang Z. Dehydration-induced WRKY transcriptional factorofenhanced drought and salinity tolerance in., 2021, 11: 327.
[8] Gong Z, Xiong L, Shi H, Yang S, Herrera-Estrella L R, Xu G, Chao D Y, Li J, Wang P Y, Qin F, Li J, Ding Y, Shi Y, Wang Y, Yang Y, Guo Y, Zhu J K. Plant abiotic stress response and nutrient use efficiency., 2020, 63: 635–674.
[9] Schachtman D, Liu W. Molecular pieces to the puzzle of the interaction between potassium and sodium uptake in plants., 1999, 4: 281–287.
[10] Zhu J K. Salt and drought stress signal transduction in plants., 2002, 53: 247–273.
[11] Forner M Á, Rodríguez J, Primo E, Iglesias D J. Hydraulic and chemical responses of citrus seedlings to drought and osmotic stress., 2011, 30: 353–366.
[12] Patade V Y, Suprasanna P, Bapat V A. Effects of salt stress in relation to osmotic adjustment on sugarcane (L) callus cultures., 2008, 55: 169–173.
[13] Shinozaki K, Yamaguchi-Shinozaki K. Molecular responses to dehydration and low temperature: differences and cross-talk between two stress signaling pathways., 2000, 3: 217–223.
[14] Azevedo C, Sadanandom A, Kitagawa K, Freialdenhoven A, Shirasu K, Schulze-Lefert P. Theinteractor, an essential component ofgene-triggered disease resistance., 2002, 295: 2073–2076.
[15] Austin M J, Muskett P, Kahn K, Feys B J, Jones J D, Parker J E. Regulatory role ofin earlygene-mediated plant defenses., 2002, 295: 2077–2080.
[16] Huang G T, Ma S L, Bai L P, Zhang L, Ma H, Jia P, Liu J, Zhong M, Guo Z F. Signal transduction during cold, salt, and drought stresses in plants., 2011, 39: 969–987.
[17] Meldau S, Baldwin I T, Wu J. For security and stability:in plant defense and development., 2011, 6: 1479–1482.
[18] Zhang X C, Millet Y A, Cheng Z, Bush J, Ausubel F M. Jasmonate signaling ininvolves--chaperone complexes., 2015, 1: 15049.
[19] Shirasu K. The HSP90-SGT1 chaperone complex for NLR immune sensors., 2009, 60: 139–164.
[20] Muskett P, Parker J. Role ofin the regulation of plantgene signaling., 2003, 5: 969–976.
[21] Shanmugam A, Thamilarasan S K, Park J I, Jung M Y, Nou I S. Characterization and abiotic stress-responsive expression analysis ofgenes in., 2016, 59: 243–251.
[22] Li R, Yang R, Zheng W, Wu L, Zhang C, Zhang H. Melatonin promotes-involved signals to ameliorate drought stress adaption in rice., 2022, 23: 599.
[23] Fu D Q, Ghabrial S, Kachroo A.andare required for basal,gene-mediated and systemic acquired resistance in soybean., 2009, 22: 86–95.
[24] Noël L D, Cagna G, Stuttmann J, Wirthmüller L, Betsuyaku S, Witte C P, Bhat R, Pochon N, Colby T, Parker J E. Interaction between SGT1 and cytosolic/nuclear HSC70 chaperones regulatesimmune responses., 2007, 19: 4061–4076.
[25] Bhattarai K K, Li Q, Liu Y, Dinesh-Kumar S P, Kaloshian I. The Mi-1-mediated pest resistance requires HSP90 and SGT1., 2007, 144: 312–323.
[26] Gray W M, Muskett P R, Chuang H W, Parker J E.SGT1b is required for SCF(TIR1)-mediated auxin response., 2003, 15: 1310–1319.
[27] Elsasser S, Gali R R, Schwickart M, Larsen C N, Leggett D S, Müller B, Feng M T, Tübing F, Dittmar G A, Finley D. Proteasome subunit Rpn1 binds ubiquitin-like protein domains., 2002, 4: 725–730.
[28] Lee S S, Cho H S, Yoon G M, Ahn J W, Kim H H, Pai H S. Interaction ofcalcium-dependent protein kinase with NtRpn3 regulatory subunit of the 26S proteasome in:interacts with Rpn3 homolog., 2003, 33: 825–840.
[29] Hou Z H, Yin J L, Lu Y F, Song J H, Wang S P, Wei S D, Liu Z X, Zhang Y X, Fang Z W. Transcriptomic analysis reveals the temporal and spatial changes in physiological process and gene expression in common buckwheat (Moench) grown under drought stress.(Basel), 2019, 9: 569.
[30] 侯泽豪, 卢奕霏, 孙坤坤, 王书平, 张迎新, 刘志雄, 方正武. 甜荞资源萌发期耐旱性鉴定体系建立与种质筛选. 干旱地区农业研究, 2021, 39(1): 95–102. Hou Z H, Lu Y F, Sun K K, Wang S P, Zhang Y X, Liu Z X, Fang Z W. Establishment of buckwheat drought tolerance identification system at germination stage and screening of drought-tolerance germplasms., 2021, 39(1): 95–102 (in Chinese with English abstract).
[31] 蔡坤妍. 小麦抗病相关蛋白TaSGT1靶标鉴定及其功能分析.西北农林科技大学硕士学位论文, 陕西咸阳, 2021. Cai K Y. Identification and function analysis of target of wheat disease-resistance protein TaSGT1. MS Thesis of Northwest A&F University, Xianyang, Shaanxi, China, 2021 (in Chinese with English abstract).
[32] Cazalé A C, Clément M, Chiarenza S, Roncato M A, Pochon N, Creff A, Marin E, Leonhardt N, Noël L D. Altered expression of cytosolic/nuclearmolecular chaperone affects development and abiotic stress tolerance in., 2009, 60: 2653–2664.
[33] Mayor A, Martinon F, De Smedt T, Pétrilli V, Tschopp J. A crucial function ofandin inflammasome activity links mammalian and plant innate immune responses., 2007, 8: 497–503.
[34] Yu Y, Yang S, Bian L, Yu K, Meng X, Zhang G, Xu W, Yao W, Guo D. Identification of C3H2C3-type ring E3 ubiquitin ligase in grapevine and characterization of drought resistance function of VyRCHC114., 2021, 21: 422.
[35] Kawamura Y, Takenaka S, Hase S, Kubota M, Ichinose Y, Kanayama Y, Nakaho K, Klessig D F, Takahashi H. Enhanced defense responses ininduced by the cell wall protein fractions fromrequire SGT1, RAR1, NPR1 and JAR1., 2009, 50: 924–934.
[36] Meldau S, Baldwin I T, Wu J. SGT1 regulates wounding- and herbivory-induced jasmonic acid accumulation and’s resistance to the specialist lepidopteran herbivore., 2011, 189: 1143–1156.
[37] Wang Y, Mostafa S, Zeng W, Jin B. Function and mechanism of jasmonic acid in plant responses to abiotic and biotic stresses., 2021, 22: 8568.
[38] Tan X, Calderon-Villalobos L I, Sharon M, Zheng C, Robinson C V, Estelle M, Zheng N. Mechanism of auxin perception by theubiquitin ligase., 2007, 446: 640–645.
[39] Luna C M, Pastori G M, Driscoll S, Groten K, Bernard S, Foyer C H. Drought controls on H2O2accumulation, catalase (CAT) activity and CAT gene expression in wheat., 2005, 56: 417–423.
Biological functional analysis of common buckwheat ()gene in enhancing drought stress resistance
ZHU Xu-Dong1, YANG Lan-Feng1, CHEN Yuan-Yuan1, HOU Ze-Hao1,2, LUO Yi-Rou1, XIONG Ze-Hao1, and FANG Zheng-Wu1, *
1College of Agriculture, Yangtze University / Hubei Center for Collaborative Innovation of Grain Industry, Jingzhou 434025, Hubei, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
SGT1 (Suppressor of the G2 Allele of skP1) is an inhibitor of skp1-4, which plays an important role in the abiotic stress response of plants. Based on the early transcriptomics and proteinomics analyses of common buckwheat under drought stress, agene was screened and cloned, which contained a 1086 bp open reading frame encoding 361 amino acids and 3 domains including TPR, CS, and SGS. Homologous protein comparison showed that FeSGT1 was closely related to CqSGT1 (XP_021726759.1), BvSGT1 (XP_010671588.1), and SoSGT1 (XP_021839743.1). Besides,gene encoded membrane localization protein. The relative expression levels revealed that FeSGT1 tended to be up-regulated within 24 hours of drought stress. The expression ofgene peaked at 12 hours and began to decline after 24 hours under salt, low temperature (4℃), and ABA treatments. Overexpression ofgene in transgenicnot only conferred drought and salt tolerance, but also significantly increased root length, fresh weight, and survival rate compared with the wild type (WT) plant, accompanied by the elevated activities of catalase (CAT), the lowered malonaldehyde (MDA) and H2O2contents, thus allowing plants to better adapt to adverse environments. Our results provided information in the exploring of the molecular regulation mechanism responding to drought tolerance in common buckwheat.
Common buckwheat ();; transgenic; drought resistance
10.3724/SP.J.1006.2023.21028
本研究由国家自然科学基金项目(31671755)资助。
This study was supported by the National Natural Science Foundation of China (31671755).
方正武, E-mail: fangzhengwu88@163.com
E-mail: 202071604@yangtzeu.edu.cn
2022-04-18;
2022-09-05;
2022-09-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220913.1655.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
