响应槲皮素诱导的美国白蛾P450基因及CYP6ZB2功能分析
2023-04-10邵红扬孟香张涛陈敏
邵红扬,孟香,张涛,陈敏
响应槲皮素诱导的美国白蛾P450基因及功能分析
邵红扬,孟香,张涛,陈敏
北京林业大学林学院/林木有害生物防治北京市重点实验室,北京 100083
【】明确美国白蛾()响应槲皮素诱导的差异表达P450基因及系统发育关系,探究美国白蛾P450基因对槲皮素诱导的剂量效应,以及P450基因在美国白蛾对槲皮素的解毒适应中的作用。【】基于槲皮素诱导的美国白蛾中肠转录组数据,从中筛选显著差异表达的P450基因,应用MEGA X软件对5个P450 基因及其他近缘物种的P450基因进行系统进化关系分析;通过RT-qPCR技术检测5个P450基因在不同槲皮素浓度(0.5%、1.0%、2.0%和4.0%)处理下的表达模式;克隆全长cDNA序列,利用RNA干扰(RNAi)技术探明基因沉默对美国白蛾体重及存活率的影响。【】从转录组的差异表达基因中筛选到5个显著响应槲皮素诱导的P450基因,经P450命名委员会分别被命名为、、、和(GenBank登录号:ON032363—ON032367)。系统发育分析表明,这5个基因被聚类到、、和线粒体CYP进化枝。RT-qPCR结果表明,P450基因响应槲皮素胁迫具有显著的剂量效应,、、和的表达均被不同浓度槲皮素抑制,的表达在0.5%—2.0%的槲皮素诱导下显著上调,而在4.0%的槲皮素浓度下被显著抑制。克隆的全长cDNA序列,具有完整的开放阅读框(ORF),编码500个氨基酸。RNAi结果表明,注射两种剂量(500和1 000 ng)ds均可显著抑制的表达,注射1 000 ng ds48 h后干扰效率达到最高(96.9%)。被干扰的美国白蛾幼虫经0.5%槲皮素处理后体重增长量低于对照组,存活率(53.33%)分别为未处理组的61.5%和注射双蒸水组的72.7%(<0.05)。【】筛选鉴定到美国白蛾响应槲皮素诱导的5个P450基因,槲皮素对5个基因的诱导表达具有明显的剂量效应,说明不同的P450基因对槲皮素的响应模式存在差异。RNAi能高效沉默,0.5%槲皮素对被干扰的美国白蛾幼虫的生长发育具有一定抑制作用,表明在美国白蛾对槲皮素的解毒适应中发挥着重要作用。
美国白蛾;槲皮素;P450基因;表达分析;RNA干扰;基因功能
0 引言
【研究意义】美国白蛾()属鳞翅目(Lepidoptera)目夜蛾科(Erebidae)(原灯蛾科Arctiidae),是典型的多食性食叶昆虫,其寄主植物可达600多种[1]。由于其具有环境适应能力强、寄主种类多、危害性大等特点,被农业农村部和国家林草局列为重点管理的外来入侵物种(农业农村部公告第567号)。目前,美国白蛾在我国已扩展到14个省(直辖市)的611 个县(区)(国家林业和草原局2022年第5号公告),且在我国南方地区扩散加速,这不仅增加了防控难度,还给我国农林业造成了巨大经济损失[2]。槲皮素(quercetin)是黄酮类植物次生代谢物,在美国白蛾寄主植物如桑()[3]、杨树()[4]等植物中广泛存在。研究表明槲皮素对多种昆虫具有抗虫活性,且其抗虫活性与浓度密切相关[5]。植食性昆虫具有完善的解毒酶系以催化分解寄主食物中的有毒次生代谢物从而减少对自身的伤害[6],其中细胞色素P450单加氧酶(P450)在植食性昆虫对寄主植物次生代谢物的解毒适应中发挥了主要作用[7]。因此,研究美国白蛾响应槲皮素诱导表达的P450基因及功能,对于明确美国白蛾对寄主植物中槲皮素的适应机制具有重要意义。【前人研究进展】细胞色素P450单加氧酶(P450)是一个重要的解毒酶基因家族,主要通过羟基化、脱烷基化等方式参与昆虫对内源(如激素等)和外源性化合物(如植物次生代谢物、杀虫剂等)的解毒代谢[8]。在植食性昆虫中,P450基因共分为4个进化枝:、、和线粒体CYP。进化枝由大量昆虫P450基因组成,这些P450基因被细分为11个亚家族:、、、、、、、、、和,这些成员参与昆虫对各种植物次生代谢物以及杀虫剂抗药性相关的解毒作用[9]。目前,多种农林业害虫的P450基因被成功鉴定,如小菜蛾()[10]、斜纹夜蛾()[11]、草地贪夜蛾()[11]和甜菜夜蛾()[12]等。前期研究发现,0.5%槲皮素导致美国白蛾幼虫的发育历期显著延长,幼虫成活率、化蛹率、羽化率以及产卵量等各项指标显著低于对照组,同时,一定浓度的槲皮素能够提高美国白蛾体内多种解毒酶的活性,且对美国白蛾P450酶的诱导作用具有显著的剂量效应[13]。【本研究切入点】不同昆虫响应各种植物次生代谢物质的解毒酶基因存在差异。美国白蛾体内响应槲皮素诱导的P450基因的种类以及这些基因对槲皮素的响应模式和机制尚不清楚。【拟解决的关键问题】基于前期构建的0.5%槲皮素诱导的美国白蛾中肠转录组,从中筛选差异表达的P450基因,通过生物信息学分析,结合RT-qPCR技术,研究这些基因响应槲皮素诱导的剂量效应,进一步克隆响应槲皮素诱导的关键基因,并运用RNA干扰(RNA interference,RNAi)技术验证其在槲皮素的解毒适应中的功能,为阐明美国白蛾对槲皮素的适应性机制提供科学依据。
1 材料与方法
试验于2020年9月至2022年4月在北京林业大学林木有害生物防治北京市重点实验室完成。
1.1 槲皮素人工饲料的配制
依据槲皮素对美国白蛾幼虫的毒力测定[13],以及美国白蛾喜食寄主(如桑叶)的槲皮素含量[14-15],将槲皮素的诱导浓度范围设置为0.5%—4.0%。槲皮素人工饲料的配制参照潘忠玉[13]的方法,以添加等量DMSO溶液的人工饲料作为对照饲料(control)。
1.2 供试昆虫
美国白蛾幼虫为实验室人工饲料饲养的种群,人工饲料的配制参照曹利军等[16]。饲养条件设定为温度(25±1)℃,相对湿度55%—70%,光周期16L﹕8 D。
1.3 主要试剂和仪器
试剂:槲皮素(纯度≥98%;源叶生物,中国上海),二甲基亚砜(DMSO)、50×TAE buffer、DL 2000 DNA Ladder、GelRed核酸染料、6×loading buffer、2×Taq PCR Master MIX(百瑞极,中国北京),琼脂糖(贝晶生物,中国上海),RNeasy®Plus Mini Kit(Qiagen,德国),PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green®TMⅡ、PrimeSTAR®HS DNA Polymerase(TaKaRa,中国大连),TIANgel Midi Purification Kit、TIANprep Rapid Mini Plasmid Kit(天根,中国北京),®-Blunt3 Cloning Kit(全式金,中国北京),T7 RNAi Transcription Kit(诺唯赞,中国南京)。
仪器:恒温培养箱(宁波江南仪器厂,中国),电泳仪(六一生物,中国北京),体视显微镜(徕卡,德国)PCR仪、CFX96型实时荧光定量PCR检测系统(Bio-Rad,美国),凝胶成像系统(Aplegen,美国),超微量紫外分光光度计NanoDrop 8000(Thermo,美国),超净台(苏州净化,中国),台式离心机、摇床、超低温冰箱(Thermo,美国),普通冰箱(海尔,中国青岛),微量注射器(哈美顿博纳图斯,瑞士),恒温水浴锅(上海精宏,中国),电子天平(Sartorius,德国)。
1.4 响应槲皮素诱导的P450基因鉴定与系统发育分析
基于课题组前期构建的槲皮素(0.5%)诱导的美国白蛾中肠转录组(GenBank 登录号:PRJNA798672)以及正常饲养的美国白蛾的中肠转录组,从差异表达基因中筛选美国白蛾显著响应槲皮素诱导的P450基因。通过NCBI的ORF Finder(https://www. ncbi.nlm.nih.gov/orffinder/)预测候选P450基因的开放阅读框(open reading frame,ORF),并翻译成氨基酸序列用于后续构建系统发育树。通过与NCBI的NR数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行BLASTX比对,鉴定候选基因是否为P450基因。将鉴定结果为P450基因的序列信息提交至P450命名委员会(Standardized Cytochrome P450 Nomenclature Committee)进行命名。
使用MEGA X软件将鉴定的P450基因的氨基酸序列与5种鳞翅目昆虫(家蚕、棉铃虫、草地贪夜蛾、斜纹夜蛾、粉纹夜蛾)的氨基酸序列进行多序列比对。使用PhyloSuite软件[17]中的IQ-TREE程序,采用最大似然法构建系统发育树,各分支置信度经由bootstrap 法1 000 次循环检验[18-19]。使用在线工具 iTOL(https://itol.embl.de/)对发育树进行美化。
1.5 P450基因响应槲皮素的表达分析
取刚蜕皮的美国白蛾4龄幼虫,饥饿处理12 h后,分别转入不同浓度的槲皮素人工饲料(0.5%、1.0%、2.0%和4.0%)和对照饲料(control),饲养24 h后收集试虫,解剖中肠,按照RNeasy®Plus Mini Kit试剂盒的说明书提取各样品总RNA,10头幼虫为一个重复,设置3个生物学重复。总RNA的完整性采用1%琼脂糖凝胶电泳检测,浓度和纯度使用超微量紫外分光光度计NanoDrop 8000检测。将完整性、纯度和浓度均合格的总RNA按照PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒的说明书合成cDNA。使用Primer Premier 5.0软件设计P450基因的RT-qPCR引物,和作为内参基因[20],引物均由生工生物工程(上海)股份有限公司合成。通过10倍梯度稀释cDNA模板的方法,计算各引物的扩增效率,RT-qPCR试验所用引物序列见表1。根据TB Green®TMⅡ试剂盒配制RT-qPCR反应体系(25 μL):TB GreenⅡ 12.5 μL,正反引物(10 μmol·L-1)各1 μL,cDNA模板2 μL,灭菌水8.5 μL。热循环条件设定为95℃预变性30 s;95℃ 5 s,60℃ 30 s,循环40次;最后将RT-qPCR产物升温至95℃制作熔解曲线,检测是否有引物二聚体。空白对照以无菌水代替cDNA模板,用于检测体系是否出现污染。RT-qPCR反应在CFX96型荧光定量PCR仪中运行。采用2-ΔΔCT法[21]计算基因的相对表达量。每个处理设置3个生物学重复,每个生物学重复设置3个技术重复。
1.6 CYP6ZB2的功能验证
5个P450基因中仅的表达水平在不同浓度槲皮素下显著升高,因此进一步对该基因进行功能分析。
1.6.1合成 使用Primer Premier 5.0软件设计的全长引物,在全长引物的5′端加上T7启动子序列用于合成dsRNA模板,引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。以常规人工饲料饲养的美国白蛾4龄幼虫cDNA为模板,使用的全长引物进行PCR扩增。50mL PCR反应体系:5×PrimeSTAR Buffer 10mL,dNTP Mixture 4mL,正反向全长引物各1mL,cDNA 2mL,PrimeSTAR HS DNA Polymerase 0.5mL,ddH2O 31.5mL。PCR运行程序设置为98℃ 10 s,55℃ 5 s,72℃ 90 s,30个循环。PCR产物经1%的琼脂糖凝胶电泳验证后,使用TIANgel Midi Purification Kit进行回收纯化,将纯化产物与®-Blunt3 Cloning Kit克隆载体连接,然后转化到-T1 Phage Resistant化学感受细胞,经过蓝白斑筛选后,将阳性单克隆菌液送至北京擎科生物科技有限公司进行测序,将测序正确的单克隆菌液扩大培养,按照TIANprep Rapid Mini Plasmid Kit说明书抽提菌液质粒。
以上一步获得的质粒为模板,使用添加T7启动子序列的全长引物进行PCR扩增,反应体系和程序设置同上。PCR产物经1%的琼脂糖凝胶电泳检测后,进行回收纯化,纯化产物即为合成dsRNA的模板,按照T7 RNAi Transcription Kit的说明书合成dsRNA,将初步得到dsRNA采用磁珠法进行纯化,纯化的dsRNA经电泳验证和浓度测定,稀释至500和1 000 ng·mL-1保存于-20℃冰箱用于后续注射试验。

表1 RT-qPCR、基因克隆和dsRNA合成所用引物
下划线部分为T7启动子序列The underlined letters represent T7 promoter sequence
1.6.2 RNAi验证的功能 为了验证是否参与美国白蛾对槲皮素的解毒代谢过程,根据预试验结果,选择500和1 000 ng作为dsRNA的注射剂量。挑选刚蜕皮1 d的美国白蛾4龄幼虫,使用微量注射器吸取500和1 000 ng的dsRNA分别注射到幼虫腹部倒数第二个节间膜位置,以注射等体积的双蒸水(ddH2O)作为对照(control)。每种剂量注射30头幼虫为一个重复,设置3个重复。将注射后的试虫在不含槲皮素的人工饲料中饲养48和96 h后,通过RT-qPCR检测的沉默效率。RT-qPCR方法同1.5。将注射1 000 ng ds2的美国白蛾转入含有0.5%槲皮素人工饲料中饲养,统计试虫10 d内的体重增长量和存活率,以未处理(CK)和注射等体积双蒸水(ddH2O)的幼虫作为对照,每30头为一个重复,设置3个生物学重复。
1.7 数据分析
试验数据均以平均值±标准误表示,采用Excel统计分析数据,使用SPSS 24.0中的单因素方差分析不同浓度槲皮素诱导P450基因的相对表达量和沉默效率的差异显著性,以及RNAi后美国白蛾幼虫存活率的差异显著性,并使用Duncan氏新复极差检验法进行多重比较(<0.05)。使用独立样本检验分析转录组中P450基因的差异表达验证结果,使用重复检测方差分析RNAi后美国白蛾幼虫的平均体重增长量和差异显著性(<0.05)。采用GraphPad Prism 8.0和Origin 2017作图。
2 结果
2.1 响应槲皮素诱导的P450基因的筛选与鉴定
从0.5%槲皮素诱导的美国白蛾中肠转录组数据中,共筛选出5个显著响应槲皮素诱导的差异表达P450基因,经BLASTX鉴定,除(GenBank登录号:BBD13397.1)基因外,其他4个基因均为美国白蛾物种中新鉴定的P450基因,鉴定结果见表2。转录组的差异表达分析结果显示,在0.5%的槲皮素诱导下,、、和的表达水平显著降低;而的表达水平升至对照的2.69倍。5个P450基因中仅具有完整的ORF,编码500个氨基酸,其余基因均缺失3′端,编码蛋白范围为146—507个氨基酸。P450命名委员会将5个基因分别命名为、、、和。5个P450基因的序列均已提交至NCBI数据库,GenBank登录号为ON032363—ON032367。

表2 响应槲皮素诱导的P450基因的BLASTX结果
Down:表达下调down-regulated expression;Up:表达上调up-regulated expression
2.2 P450基因的系统发育分析
美国白蛾响应槲皮素诱导的5个P450基因的系统发育树见图1。结果表明,5个基因分别聚类到P450家族的4个进化枝,其中,和聚类到进化枝;聚类到线粒体CYP进化枝;聚类到进化枝;聚类到进化枝的亚家族。从系统发育树可知,美国白蛾与棉铃虫和斜纹夜蛾序列同源性较高,美国白蛾与棉铃虫聚为一支,序列同源性较高。

Bmor:家蚕B. mori;Harm:棉铃虫 H. armigera;Sfru:草地贪夜蛾 S. frugiperda;Slit:斜纹夜蛾S. litura;Tni:粉纹夜蛾 T. ni。不同颜色代表不同P450基因进化枝;红色字体基因代表本研究鉴定的5个P450基因;分支上的数字表示1000次重复自举检验值Different colors represent different cytochrome P450 gene clades. The red font genes represent the five cytochrome P450 genes identified in this study. The number at tree node represents bootstrap value from 1000 replicates
2.3 槲皮素诱导5个P450基因的剂量效应
RT-qPCR结果显示,、和的表达均被不同浓度槲皮素抑制,而较低浓度(0.5%—2.0%)的槲皮素诱导的表达显著上调。、和的表达随着槲皮素浓度升高,抑制作用逐渐减弱,3个基因均在0.5%槲皮素浓度下表达水平降至最低,分别为对照组的26%(<0.0001,图2-A)、32%(<0.001,图2-B)和10%(<0.001,图2-C)。的表达随着槲皮素浓度的增高,抑制作用逐渐加强但差异并不显著,在4.0%槲皮素浓度下抑制作用最强,表达水平为对照组的5%(<0.0001,图2-D)。的表达水平在0.5%—2.0%的槲皮素浓度下显著升高,分别为对照组的2.33、2.04和2.31倍,然而在4.0%的槲皮素浓度下被显著抑制,为对照组的11%(<0.01,图2-E)。
将以上5个P450基因在0.5%槲皮素诱导下的表达水平(RT-qPCR结果)与转录组测序(RNA-seq)结果进行比较发现,在0.5%槲皮素诱导水平下,5个基因在RT-qPCR与RNA-seq中的表达水平基本一致(图2-F),验证了RT-qPCR检测结果的准确性。
2.4 CYP6ZB2沉默效率
美国白蛾4龄幼虫的RNA干扰效率检测结果如图3所示,结果表明,合成的ds片段可有效抑制靶基因的表达。注射500和1 000 ng ds48 h后,美国白蛾中肠的相对表达量分别比对照组降低了76.3%和96.9%(<0.001,图3-A);注射96 h后,美国白蛾中肠的相对表达量分别比对照组显著降低了93.9%和95.9%(<0.0001,图3-B)。由此可知,注射48 h后,注射剂量1 000 ng比500 ng的沉默效率稍高,但随着作用时间的延长(至96 h),沉默效率相当。

图3 注射dsCYP6ZB2 48 h(A)和96 h(B)时CYP6ZB2的相对表达量
2.5 0.5%槲皮素胁迫对CYP6ZB2沉默的美国白蛾幼虫体重和存活率的影响
图4为美国白蛾4龄幼虫注射ds后,用0.5%槲皮素人工饲料饲养10 d的单头平均体重变化情况。未处理(CK)组和注射ddH2O组取食含0.5%槲皮素人工饲料第6天体重开始增加,而注射ds的美国白蛾幼虫直到第8天体重才开始增加。沉默的美国白蛾体重增长量第6—10天显著低于未处理(CK)组(<0.05);沉默的美国白蛾在第2、6、8天体重增长量显著低于注射ddH2O组(<0.05),表明的表达被干扰后,美国白蛾幼虫对0.5%槲皮素的解毒适应能力降低,从而导致生长发育受到一定影响,而随着沉默时间延长,第10天ds注射组体重增长量虽小于ddH2O注射组,但二者没有显著性差异,可能是RNAi效果减弱引起的。
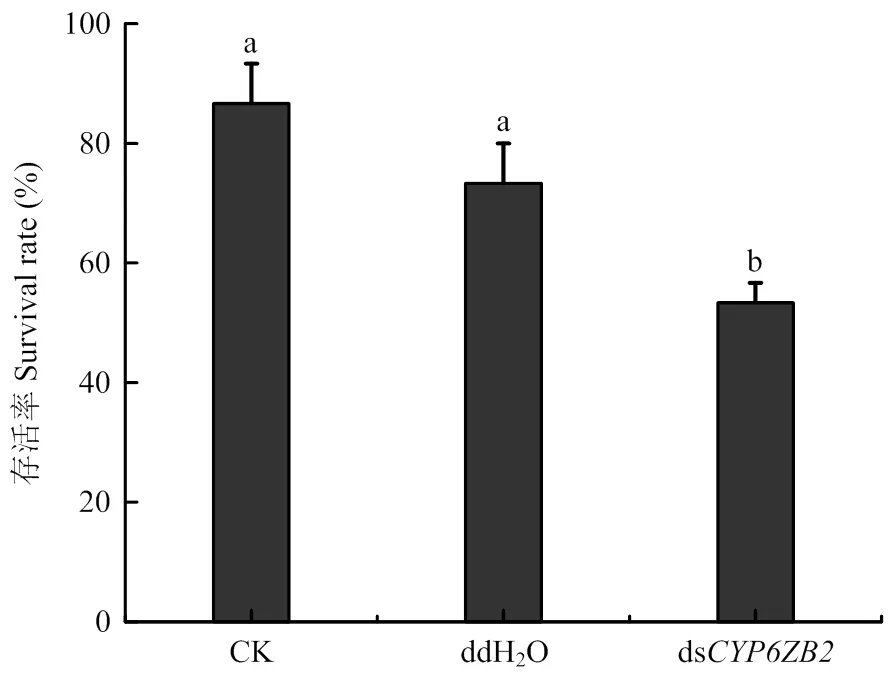
取食0.5%槲皮素人工饲料10 d后,注射ds组存活率(53.33%)显著降低,分别为未处理(CK)组和注射ddH2O组的61.5%和72.7%(<0.05,图5),可见,沉默的幼虫在0.5%槲皮素胁迫下死亡率显著升高,表明在美国白蛾对槲皮素的适应中发挥了重要作用。
3 讨论
3.1 P450在昆虫解毒代谢植物次生代谢物中起重要作用
P450是一类广泛分布于生命有机体的代谢酶系,在植食性昆虫的生长发育、激素生物合成、解毒代谢等过程中发挥着多种生理功能[22-23]。本研究从美国白蛾的中肠转录组中筛选出了响应槲皮素诱导而显著差异表达的5个P450基因,除外,其余均为美国白蛾物种中新鉴定的解毒酶基因。本研究中唯一受槲皮素诱导表达显著上调的,与同样属于亚家族的棉铃虫亲缘关系较近,不同的是棉铃虫的表达会被2-十三烷酮诱导,而经槲皮素诱导后无显著变化[24]。与本研究结果相似,Hafeez等[25]的研究表明0.2%槲皮素可诱导甜菜夜蛾中肠中的表达,最高诱导水平为对照组的6.38倍,且被干扰的甜菜夜蛾在槲皮素处理后死亡率显著增加。因而,可以推测美国白蛾的可能同甜菜夜蛾的一样在槲皮素的解毒代谢中发挥着重要作用。
柱上不同字母表示差异显著
3.2 美国白蛾P450基因的表达具有显著的剂量效应
昆虫P450基因的过表达是对植物次生代谢物和杀虫剂产生抗性的最常见机制之一[23]。本研究中5个P450基因在不同浓度槲皮素诱导后mRNA表达水平显著变化,RT-qPCR结果表示槲皮素对美国白蛾的P450基因的表达具有剂量效应,说明这些差异基因可能参与美国白蛾幼虫对槲皮素的解毒代谢。其中,表现为较低浓度(0.5%—2.0%)被诱导,较高浓度(4.0%)被抑制。其余4个基因在不同槲皮素剂量处理下表达量均下调,表明槲皮素对不同P450基因的诱导作用不同。Li等[26]也发现槲皮素对P450基因的抑制作用比诱导作用更为常见,在其研究的6个家蚕P450基因中,除表达水平保持不变外,其余基因均受到槲皮素的抑制。目前关于槲皮素抑制昆虫P450基因表达的机制还未见明确的研究报道,由于昆虫具有复杂的解毒代谢系统,可能这些表达下调的基因并非美国白蛾应对槲皮素解毒代谢的主要基因,而需要其他相关基因的上调表达以应对槲皮素的解毒代谢。
3.3 沉默CYP6ZB2能有效降低美国白蛾幼虫对槲皮素的适应能力
RNAi是一种通过将双链RNA(dsRNA)引入昆虫来降低目的基因表达的技术,目前已经成功用于多种昆虫P450基因功能的研究[27]。dsRNA引入昆虫体内的方式有口服或注射两种,其中注射法具有注射效率高,容易控制dsRNA的剂量等优势,广泛用于实验室小规模水平的干扰[28-29]。本研究采用注射的方法显著降低了美国白蛾幼虫mRNA的表达水平,且注射剂量越大,沉默效率越高,可见,RNAi可成功用于美国白蛾P450基因功能分析和验证。
槲皮素能抑制昆虫生长、减少化蛹和羽化率,严重时甚至会导致死亡[30]。通常,桑叶中槲皮素含量会随着叶片的不同发育阶段发生变化,最高浓度可达0.06%[15],在这一浓度下美国白蛾能正常生长,完成全部的生命周期,本研究中所使用的槲皮素浓度为自然条件下桑叶中槲皮素最高浓度的8.3倍,在这一浓度下注射ds的美国白蛾幼虫体重增加量和存活率显著低于未处理组和注射ddH2O组,表达降低使美国白蛾对槲皮素的敏感性增加,导致适应性降低。体重增长量结果还显示沉默的美国白蛾幼虫从体重减少恢复到体重增加的时间较对照组时间久,表明沉默会导致幼虫生长发育迟缓。这与课题组前期利用槲皮素对美国白蛾幼虫进行生物测定的结果一致,0.5%槲皮素处理使美国白蛾幼虫发育历期比对照组延长20.75%(<0.05),显著抑制了美国白蛾的生长[13]。这可能是因为较高的槲皮素浓度会使美国白蛾消耗更多的能量用于解毒,相应的也会减少生长发育方面的能量分配,导致幼虫出现体重增加量减少以及死亡率显著升高的现象。但由于本研究设置的槲皮素浓度梯度有限,美国白蛾幼虫对槲皮素耐受的浓度范围还不明确,在将来的研究中可以增加槲皮素饲养试验的浓度梯度设置,对参与槲皮素解毒代谢的多基因进行沉默,以便更好地探究美国白蛾对槲皮素代谢机制和途径。
本试验中基因沉默的美国白蛾幼虫在第6—8天体重增加量显著低于未处理组和注射ddH2O组,但在第10天与注射ddH2O组体重增加量无显著差异,这可能是RNAi效果持续性减弱引起的,研究表明RNAi对基因的干扰方式不是敲除,而是敲低,干扰只能持续一段时间,随后基因抑制的效果会减弱甚至消失[31]。Liu等[32]运用RNAi技术注射dsRNA-经检测在第5天沉默效率最高,为25.3%,随后减弱,至第8天RNAi对mRNA水平的表达无任何影响。本研究中检测了48和96 h的基因沉默效率,但是更长时间的干扰效率未知,为了提高RNAi效果,还可以采用多次注射的措施提高RNAi效率,延长其干扰时间[32]。由于上述因素限制,为了多角度探究对美国白蛾幼虫生长发育以及解毒适应槲皮素的作用,可进一步应用CRISPR/Cas9基因编辑技术探究的功能,以寻求美国白蛾P450基因响应槲皮素的调控元件及其对应的转录因子。
4 结论
在槲皮素诱导的美国白蛾中肠转录组中筛选出的5个P450基因分别属于、、和线粒体CYP进化枝。槲皮素对美国白蛾不同P450基因的诱导模式存在差异。的表达被干扰后美国白蛾幼虫对0.5%槲皮素的适应能力降低,导致幼虫体重增长缓慢,死亡率显著升高,表明该基因在美国白蛾对槲皮素的解毒适应过程中发挥重要作用。
[1] MOJARAB-MAHBOUBKAR M, SENDI J J, MAHMOODI N. The sweet wormwood essential oil and its two major constituents are promising for a safe control measure against fall webworm. Pesticide Biochemistry and Physiology, 2022, 184: 105124. doi: 10.1016/j. pestbp.2022.105124.
[2] NING J, LU P F, FAN J T, REN L L, ZHAO L L. American fall webworm in China: A new case of global biological invasions. The Innovation, 2022, 3(1): 100201. doi: 10.1016/j.xinn.2021.100201.
[3] 蒋立娣, 宣贵达, 吴好好, 李丽萍. 桑叶提取物中槲皮素和山萘酚的含量测定. 浙江大学学报(理学版), 2009, 36(6): 705-707, 713. doi: 10.3785/j.issn.1008-9497.2009.06.023.
JIANG L D, XUAN G D, WU H H, LI L P. Determination of quercetin and kaempferol in folium mori extract after hydrolysis by hydrochloric acid. Journal of Zhejiang University (Science Edition)2009, 36(6): 705-707, 713. doi: 10.3785/j.issn.1008-9497.2009.06.023. (in Chinese)
[4] WANG Z Y, NUR F A, MA J Y, WANG J G, CAO C W. Effects of poplar secondary metabolites on performance and detoxification enzyme activity of. Comparative Biochemistry and Physiology, Part C, 2019, 225: 108587. doi: 10.1016/j.cbpc.2019.108587.
[5] 赖城玲, 张珺, 申屠旭萍, 郝培应, 庞琨, 俞晓平. 植物次生代谢物对植食性昆虫防御作用的研究进展. 应用昆虫学报, 2022, 59(5): 969-978. doi: 10.7679/j.issn.2095-1353.2022.100.
LAI C L, ZHANG J, SHENTU X P, HAO P Y, PANG K, YU X P. Review of how secondary metabolites defend plants against herbivorous insects. Chinese Journal of Applied Entomology, 2022, 59(5): 969-978. doi: 10.7679/j.issn.2095-1353.2022.100. (in Chinese)
[6] HAFEEZ M, LIU S S, YOUSAF H K, JAN S, WANG R L, FERNÁNDEZ-GRANDON G M, LI X W, GULZAR A, ALI B, REHMAN M, ALI S, FAHAD M, LU Y B, WANG M. RNA interference-mediated knockdown of a cytochrome P450 gene enhanced the toxicity of-cypermethrin in xanthotoxin-fed larvae of(Hübner). Pesticide Biochemistry and Physiology, 2020, 162: 6-14. doi: 10.1016/j.pestbp.2019.07.003.
[7] YU H Z, WEN D F, WANG W L, GENG L, ZHANG Y, XU J P. Identification of genes putatively involved in chitin metabolism and insecticide detoxification in the rice leaf folder () larvae through transcriptomic analysis. International Journal of Molecular Sciences, 2015, 16(9): 21873-21896. doi: 10.3390/ijms160921873.
[8] 陈高满, 陈展博, 葛辉, 杨雪清, 王小奇. 苹果蠹蛾细胞色素P450基因和的克隆及表达分析. 昆虫学报, 2020, 63(8): 941-951. doi: 10.16380/j.kcxb.2020.08.004.
CHEN G M, CHEN Z B, GE H, YANG X Q, WANG X Q. Cloning and expression analysis of cytochrome P450 genesand(Lepidoptera: Tortricidae). Acta Entomologica Sinica, 2020, 63(8): 941-951. doi: 10.16380/j.kcxb.2020.08.004. (in Chinese)
[9] FEYEREISEN R. Evolution of insect P450. Biochemical Society transactions, 2006, 34(6): 1252-1255. doi: 10.1042/BST0341252.
[10] YU L Y, TANG W Q, HE W Y, MA X L, VASSEUR L, BAXTER S W, YANG G, HUANG S G, SONG F Q, YOU M S. Characterization and expression of the cytochrome P450 gene family in diamondback moth,(L.). Scientific Reports, 2015, 5: 8952. doi: 10.1038/srep08952.
[11] AMEZIAN D, NAUEN R, GOFF G L. Comparative analysis of the detoxification gene inventory of four majorpest species in response to xenobiotics. Insect Biochemistry and Molecular Biology, 2021, 138: 103646. doi: 10.1016/j.ibmb.2021.103646.
[12] WANG R L, LIU S W, BAERSON S R, QIN Z, MA Z H, SU Y J, ZHANG J E. Identification and functional analysis of a novel cytochrome P450 geneassociated with pyrethroid detoxification inHübner. International Journal of Molecular Sciences, 2018, 19(3): 737. doi: 10.3390/ijms19030737.
[13] 潘忠玉. 3种次生代谢物对美国白蛾幼虫生长发育及解毒酶活性的影响[D]. 北京: 北京林业大学, 2020.
PAN Z Y. Effects of three secondary metabolites on the growth and development and detoxification enzyme activities in(Lepidoptera: Arctiidae)[D]. Beijing: Beijing Forestry University, 2020. (in Chinese)
[14] 王海燕, 杨金龙, 谷山林, 王小燕, 王介平, 周婵, 吕金凤, 曾秀. 桑叶槲皮素提取物抗氧化活性研究. 丝绸, 2018, 55(3): 15-20. doi: 10.3969/j.issn.1001-7003.2018.03.003.
WANG H Y, YANG J L, GU S L, WANG X Y, WANG J P, ZHOU C, Lü J F, ZENG X. Study on antioxidant activity of quercetin extract from mulberry leaves. Journal of Silk, 2018, 55(3): 15-20. doi: 10.3969/j.issn.1001-7003.2018.03.003. (in Chinese)
[15] 孙莲, 孟磊, 陈坚, 马季, 胡瑞, 贾殿增. 毛细管电泳法测定桑叶中的黄酮类成分——芦丁和槲皮素. 色谱, 2001, 19(5): 395-397.
SUN L, MENG L, CHEN J, MA J, HU R, JIA D Z. Determination of rutin and quercetin in mulberry leaves by high performance capillary electrophoresis. Chinese Journal of Chromatography, 2001, 19(5): 395-397. (in Chinese)
[16] 曹利军, 杨帆, 唐思莹, 陈敏. 适合三种鳞翅目昆虫的一种人工饲料配方. 应用昆虫学报, 2014, 51(5): 1376-1386. doi: 10.7679/j.issn. 2095-1353.2014.165.
CAO L J, YANG F, TANG S Y, CHEN M. Development of an artificial diet for three lepidopteran insects. Chinese Journal of Applied Entomology, 2014, 51(5): 1376-1386. doi: 10.7679/j.issn. 2095-1353.2014.165. (in Chinese)
[17] ZHANG D, GAO F L, JAKOVLIĆ I, ZOU H, ZHANG J, LI W X, WANG G T. PhyloSuite: An integrated and scalable desktop platform for streamlined molecular sequence data management and evolutionary phylogenetics studies. Molecular ecology resources, 2020, 20(1): 348-355. doi: 10.1111/1755-0998.13096.
[18] GUINDON S, DUFAYARD J F, LEFORT V, ANISIMOVA M, HORDIJK W, GASCUEL O. New algorithms and methods to estimate maximum-likelihood phylogenies: assessing the performance of PhyML 3.0. Systematic Biology, 2010, 59(3): 307-321. doi: 10.1093/ sysbio/syq010.
[19] MINH B Q, NGUYEN M A, von HAESELER A. Ultrafast approximation for phylogenetic bootstrap. Molecular Biology and Evolution, 2013, 30(5): 1188-1195. doi: 10.1093/molbev/mst024.
[20] 陶蓉, 李慧, 孙宇航, 于晓航, 朱晗, 郝德君. 美国白蛾内参基因的鉴定及筛选. 林业科学, 2019, 55(9): 111-120. doi: 10.11707/j. 1001-7488.20190912.
TAO R, LI H, SUN Y H, YU X H, ZHU H, HAO D J. Identification and screening of internal reference genes of(Lepidoptera: Arctiidae). Scientia Silvae Sinicae, 2019, 55(9): 111-120. doi: 10.11707/j.1001-7488.20190912. (in Chinese)
[21] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262.
[22] 尹飞, 李振宇, SAMINA S, 林庆胜. P450基因在氯虫苯甲酰胺不同抗性品系小菜蛾中的表达及功能分析. 中国农业科学, 2022, 55(13): 2562-2571. doi: 10.3864/j.issn.0578-1752.2022.13.007.
YIN F, LI Z Y, SAMINA S, LIN Q S. Expression and function analysis of cytochrome P450 genes inwith differentchlorantraniliprole resistance. Scientia Agricultura Sinica, 2022, 55(13): 2562-2571. doi: 10.3864/j.issn.0578-1752.2022.13.007. (in Chinese)
[23] WANG R L, XIA Q Q, BAERSON S R, REN Y, WANG J, SU Y J, ZHENG S C, ZENG R S. A novel cytochrome P450gene in(Lepidoptera: Noctuidae) and its potential role in plant allelochemical detoxification. Journal of Insect Physiology, 2015, 75: 54-62. doi: 10.1016/j.jinsphys.2015.02.013.
[24] LIU X N, LIANG P, GAO X W, SHI X Y. Induction of the cytochrome P450 activity by plant allelochemicals in the cotton bollworm,(Hübner). Pesticide Biochemistry and Physiology, 2006, 84(2): 127-134. doi:10.1016/j.pestbp.2005.06.002.
[25] HAFEEZ M, QASIM M, ALI S, YOUSAF H K, WAQAS M, ALI E, AHMAD M A, JAN S, BASHIR M A, NOMAN A, WANG M, GHARMH H A, KHAN K A. Expression and functional analysis of P450 gene induced tolerance/resistance to lambda-cyhalothrin in quercetin fed larvae of beet armyworm(Hübner). Saudi Journal of Biological Sciences, 2020, 27(1): 77-87. doi: 10.1016/j.sjbs.2019.05.005.
[26] LI B, ZHANG H, NI M, WANG B B, LI F C, XU K Z, SHEN W D, XIA Q Y, ZHAO P. Identification and characterization of six cytochrome P450 genes belonging toandgene families in the silkworm,. Molecular Biology Reports, 2014, 41(8): 5135-5146. doi: 10.1007/s11033-014-3379-z.
[27] KATSAVOU E, RIGA M, IOANNIDIS P, KING R, ZIMMER C T, VONTAS J. Functionally characterized arthropod pest and pollinator cytochrome P450s associated with xenobiotic metabolism. Pesticide Biochemistry and Physiology, 2021, 181: 105005. doi: 10.1016/j. pestbp.2021.105005.
[28] JIN M, LIAO C, FU X, HOLDBROOK R, WU K, XIAO Y. Adaptive regulation of detoxification enzymes into different host plants. Insect Molecular Biology, 2019, 28(5): 628-636. doi: 10.1111/imb.12578.
[29] LI H, JIANG W H, ZHANG Z, XING Y R, LI F. Transcriptome analysis and screening for potential target genes for RNAi-mediated pest control of the beet armyworm,. PloS one, 2013, 8(6): e65931. doi: 10.1371/journal.pone.0065931.
[30] CHEN C Y, HAN P, YAN W Y, WANG S Y, SHI X Y, ZHOU X G, DESNEUX N, GAO X W. Uptake of quercetin reduces larval sensitivity to lambda-cyhalothrin in. Journal of Pest Science, 2018, 91(2): 919-926. doi: 10.1007/s10340-017-0933-1.
[31] HUVENNE H, SMAGGHE G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. Journal of Insect Physiology, 2010, 56(3): 227-235. doi: 10.1016/j.jinsphys. 2009.10.004.
[32] LIU S H, DING Z P, ZHANG C W, YANG B J, LIU Z W. Gene knockdown by intro-thoracic injection of double-stranded RNA in the brown planthopper,. Insect Biochemistry and Molecular Biology, 2010, 40(9): 666-671. doi: 10.1016/j.ibmb.2010.06.007.
Analysis of Cytochrome P450 Genes in Response to Quercetin and Function of
SHAO HongYang, MENG Xiang, ZHANG Tao, CHEN Min
College of Forestry, Beijing Forestry University/Beijing Key Laboratory for Forest Pest Control, Beijing 100083
【】The objective of this study is to clarify the differentially expressed cytochrome P450 genes and phylogenetic relationships in response to quercetin in, and to explore the dosage effect of cytochrome P450 genes in response to quercetin, and the role of cytochrome P450 genes in detoxification adaptation to quercetin in.【】Based on the transcriptome data of quercetin-induced midgut of, the significantly differentially expressed cytochrome P450 genes were screened. MEGA X software was used to analyze the phylogenetic relationships of the target genes with cytochrome P450 genes of other related species. RT-qPCR was used to detect the expression of the five cytochrome P450 genes in different quercetin concentrations (0.5%, 1.0%, 2.0% and 4.0%). The full-length cDNA sequence ofwas cloned, and the effect ofgene-silenced on the body weight and survival rate ofwas investigated by RNA interference (RNAi) technique.【】 Five cytochrome P450 genes were identified from the differentially expressed genes in the transcriptome, and were named,,,andby Standardized Cytochrome P450 Nomenclature Committee (GenBank accession numbers: ON032363-ON032367). Phylogenetic tree analysis showed that these five genes were divided into four clades (,,and the mitochondrial CYP clade). RT-qPCR results showed that cytochrome P450 genes had a significant dosage effect in response to quercetin, and the expressions of,,andwere inhibited by different concentrations of quercetin. The expression ofwas significantly increased at 0.5%-2.0% concentration of quercetin, but it was significantly inhibited at 4.0% quercetin. The full-length cDNA sequence ofwas cloned.had a complete open reading frame (ORF) encoding 500 amino acids. RNAi results showed that the expression level ofwas significantly inhibited by injection of two doses(500 and 1 000 ng) ds, andthe maximum reduction inexpression level was 96.9% after injection of 1 000 ng dsfor 48 h. The weight increase ofgene-silencedlarvae fed on 0.5% quercetin was lower than that of the control group. Furthermore, the survival rate (53.33%) was 61.5% of that of the untreated group and 72.7% of that of the ddH2O group (<0.05).【】Five cytochrome P450 genes were identified in the transcriptome data of quercetin-induced midgut of, and quercetin had a significant dosage effect on the five genes, indicating that the response patterns of different cytochrome P450 genes to quercetin were different. RNAi can significantly inhibit the expression level of, and quercetin has a significant negative impact on the growth of, suggesting thatplays an important role in quercetin detoxification in.
; quercetin; cytochrome P450; expression analysis; RNA interference (RNAi); gene function

2022-12-20;
2023-01-31
国家重点研发计划(2021YFD1400300)
邵红扬,E-mail:hongyangshao2021@163.com。孟香,E-mail:1210987080@qq.com。邵红扬和孟香为同等贡献作者。通信作者陈敏,E-mail:minch@bjfu.edu.cn
(责任编辑 岳梅)
