miR-149-3p调控JNK/p38 MAPK信号通路对髓核细胞凋亡、自噬和炎性反应的影响
2023-04-08王惟达蒋林史桂霞
王惟达 蒋林 史桂霞
椎间盘退行性病变是腰椎自然老化、退化的病理过程,严重影响人们日常生活和工作[1]。髓核组织内IL-1β含量增多,研究证实IL-1β能促进髓核细胞凋亡、自噬,导致腰椎间盘发生退化[2]。miR-149家族主要miR-149-3p和miR-149-5p,与疾病发生密切相关[3],如IL-1β处理软骨细胞后miR-149低表达,上调miR-149的表达抑制IL-1β诱导软骨细胞增殖和细胞外基质的降解,促进细胞的凋亡[4]。miRNA是近年研究的热点,介导参与髓核细胞增殖、凋亡、炎性反应等过程,与椎间盘退行性病变发展密切相关[5]。JNK/p38 MAPK信号通路信号通路能参与髓核细胞增殖、凋亡、炎性反应等过程,进而影响椎间盘退行性病变发展[6]。鉴于此,研究采用IL-1β处理髓核细胞,探讨miR-149-3p可能通过JNK/p38 MAPK信号通路对IL-1β诱导髓核细胞增殖、凋亡、自噬和炎性反应的影响。
1 材料与方法
1.1 主要试剂 胰蛋白酶、Ⅱ型胶原酶、胎牛血清、DMEM培养基购于美国Gibco公司;IL-1β购于美国Sigma公司;miR-NC、miR-149-3p、引物购于上海吉玛公司;p38 MAPK通路激活剂Anisomycin购于美国MedChemExpress公司;Lipofectamine 2000转染试剂盒购于美国Invitrogen公司;Trizol试剂盒、逆转录试剂盒、SYBR Green试剂盒购于北京百奥莱博科技有限公司;MTT试剂盒购于碧云天公司;凋亡试剂盒购于凯基生物公司;Bax抗体、Bcl-2抗体、Beclin 1抗体、LC3II抗体、LC3I抗体购于美国CST公司、JNK抗体、p38 MAPK抗体、p-JNK抗体、p-p38 MAPK抗体购于美国Abcam公司;TNF-α试剂盒、IL-6试剂盒、IL-8试剂盒购于南京建成生物研究所。
1.2 髓核分离与培养 SPF级SD大鼠购于上海斯莱克实验动物有限公司,许可证:SCXK(沪)2017-0006。大鼠用10%水合氯醛麻醉处死,对体表进行消毒,将胸腰段脊柱分离暴露椎间盘位置,取出髓核组织,用磷酸盐缓冲液反复冲洗,用无菌剪剪成大小1 mm3块状,加入0.25%胰蛋白酶消化20 min,离心弃上清,然后加入0.02%Ⅱ型胶原酶消化4 h,滤网过筛,离心弃上清,然后将细胞浓度调整至2×107/L接种至培养瓶内,加入含有10%胎牛血清的DMEM培养液,放入培养箱孵育(培养条件37℃、5% CO2)。每天观察细胞生长清情况,细胞融合率为80%可进行传代。取第3代细胞进行后续实验。
1.3 细胞分组与转染 取大鼠髓核细胞接种至6孔板中,取IL-1β浓度为10 ng/ml处理24 h,记为IL-1β组,正常培养的髓核细胞作为Con组;取处理24 h的IL-1β细胞,将miR-NC、miR-149-3p转染髓核细胞内,记为IL-1β+miR-NC组、IL-1β+miR-149-3p组;用IL-1β浓度为10 ng/ml和p38 MAPK通路激活剂Anisomycin浓度为300 ng/ml处理24 h,将miR-149-3p转染髓核细胞内,记为IL-1β+miR-149-3p+Anisomycin组。细胞转染时按照Lipofectamine 2000转染试剂盒进行。
1.4 qRT-PCR检测miR-149-3p相对表达水平 收集各组髓核细胞,将细胞与Trizol试剂混合用于提取细胞中总RNA,将提取的RNA用分光度计检测浓度和纯度。取0.5 μg RNA逆转录合成cDNA,按照SYBR Green试剂盒配置反应体系,通过PCR仪器进行扩增反应。以U6作为内参,用2-ΔΔCT方法分析miR-149-3p相对表达水平。miR-149-3p上游引物:5’-CGGGCGAGGGAGGGACGGGG-3’,下游引物:5’-CAGCCACAAAAGAGCACAAT-3’;U6上游引物:5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物:5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.5 MTT检测细胞活性 收集各组髓核细胞然后接种至96孔板中(3×104个/孔),每孔加入100 μl继续培养48 h,每孔内加入20 μl的MTT试剂,继续培养4 h,倒去培养液,加入150 μl的DMSO试剂,观察结晶溶解情况,完全溶解后置于酶标仪570 nm处检测细胞吸光度值,计算细胞活性=试验组吸光度值/对照组吸光度值×100%。
1.6 流式细胞术检测细胞凋亡 收集各组髓核细胞使用磷酸盐缓冲液冲洗,3 000 r/min离心5 min,用500 μl结合缓冲液重悬细胞,然后与5 μl的Annexin V-FITC、PI混匀,避光反应15~20 min,置于流式细胞仪检测细胞凋亡情况。
1.7 Western blot检测Bax、Bcl-2、Beclin 1、LC3II/LC3I、JNK/p38 MAPK信号通路相关蛋白表达 加入蛋白裂解液提取各组髓核细胞内总蛋白,冰上进行操作,BCA法检测蛋白样品浓度,取蛋白样品加至上样孔内,在SDS-PAGE凝胶分析处理蛋白样品,将样品转移PVDF膜上,使用脱脂奶粉封闭培养1 h,加入Bax(1∶500)、Bcl-2(1∶600)、Beclin 1(1∶500)、LC3II(1∶500)、LC3I(1∶500)、JNK(1∶600)、p38 MAPK(1∶600)、p-JNK(1∶600)、p-p38 MAPK(1∶600)抗体4℃过夜孵育,加入稀释1∶2 000的二抗室温孵育1h,然后在PVDF膜内加入显色试剂,显影、曝光。用Image J软件分析蛋白密度值,以GAPDH作为内参。
1.8 ELISA检测TNF-α、IL-6、IL-8表达水平 收集各组髓核细胞然后3 000 r/min离心5 min后收集细胞上清液,按照TNF-α试剂盒、IL-6试剂盒、IL-8试剂盒说明书步骤,检测TNF-α、IL-6、IL-8表达水平。
2 结果
2.1 上调miR-149-3p在IL-1β处理髓核细胞后的表达 与Con组相比,IL-1β组内miR-149-3p相对表达量显著降低(P<0.05);与IL-1β+miR-NC组相比,IL-1β+miR-149-3p组内miR-149-3p相对表达量显著上升(P<0.05)。见表1。
表1 miR-149-3p在IL-1β处理髓核细胞中的表达
2.2 上调miR-149-3p对IL-1β处理髓核细胞增殖、凋亡和自噬的影响 与Con组相比,IL-1β组内细胞活性、Bcl-2蛋白表达显著降低(P<0.05),凋亡率、Bax、Beclin 1、LC3II/LC3I蛋白表达显著上升(P<0.05);与IL-1β+miR-NC组相比,IL-1β+miR-149-3p组内细胞活性、Bcl-2蛋白表达显著上升(P<0.05),凋亡率、Bax、Beclin 1、LC3II/LC3I蛋白表达显著降低(P<0.05)。见图1,表2。
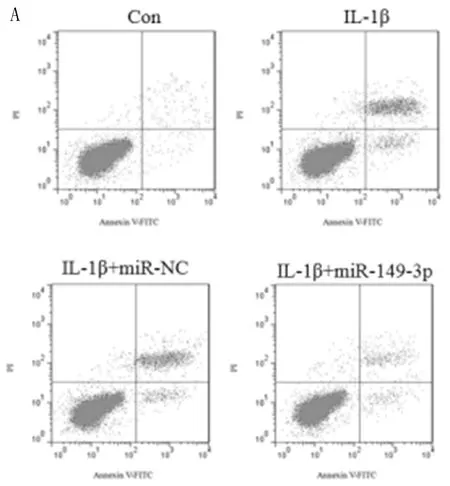
图1 上调miR-149-3p对IL-1β处理髓核细胞凋亡和自噬的影响;A 流式细胞术检测凋亡率;B Western blot检测凋亡、自噬相关蛋白表达
表2 上调miR-149-3p对IL-1β处理髓核细胞增殖、凋亡和自噬的影响
2.3 上调miR-149-3p对IL-1β处理髓核细胞炎性反应的影响 与Con组相比,IL-1β组内TNF-α、IL-6、IL-8表达水平显著上升(P<0.05);与IL-1β+miR-NC组相比,IL-1β+miR-149-3p组内TNF-α、IL-6、IL-8表达水平显著降低(P<0.05)。见表3。
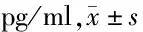
表3 上调miR-149-3p对IL-1β处理髓核细胞炎性反应的影响
2.4 miR-149-3p对JNK/p38 MAPK信号通路相关蛋白表达的影响 与Con组相比,IL-1β组内p-JNK、p-p38 MAPK蛋白表达显著上升(P<0.05);与IL-1β+miR-NC组相比,IL-1β+miR-149-3p组内p-JNK、p-p38 MAPK蛋白表达显著降低(P<0.05);与IL-1β+miR-149-3p组相比,IL-1β+miR-149-3p+Anisomycin组内p-JNK、p-p38 MAPK蛋白表达显著上升(P<0.05)。见图2,表4。
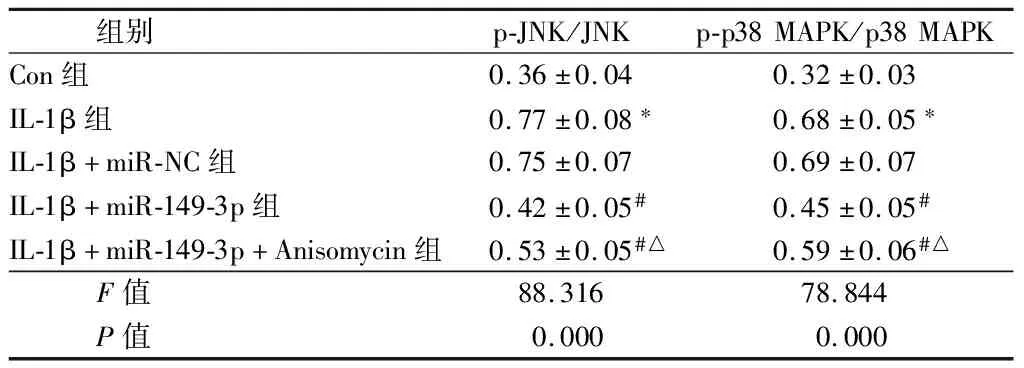
表4 miR-149-3p对JNK/p38 MAPK信号通路相关蛋白表达的影响
图2 Western blot检测miR-149-3p对JNK/p38 MAPK信号通路相关蛋白表达的影响;A Con组;B IL-B组;C IL-1β+miR-NC组;D IL-1β+miR-149-3p组;E IL-1β+miR-149-3p+Anisomycin组
2.5 加入激活剂Anisomycin可以逆转上调miR-149-3p对IL-1β处理髓核细胞增殖、凋亡、自噬和炎性反应的影响 与IL-1β+miR-149-3p组相比,IL-1β+miR-149-3p+Anisomycin组内细胞活性、Bcl-2蛋白表达显著降低(P<0.05),凋亡率、Bax、Beclin 1、LC3II/LC3I蛋白表达、TNF-α、IL-6、IL-8表达水平显著上升(P<0.05)。见图3和表5。
图3 加入激活剂Anisomycin可以逆转上调miR-149-3p对IL-1β处理髓核细胞凋亡、自噬的影响;A 流式细胞术检测凋亡率;B Western blot检测PAX1、凋亡、自噬相关蛋白表达
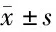
表5 miR-149-3p可能通过JNK/p38 MAPK信号通路对IL-1β处理髓核细胞增殖、凋亡、自噬和炎性反应的影响
3 讨论
炎性细胞因子IL-1β是白细胞介素-1家族成员的主要因子之一,能参与机体内免疫应答和炎症反应,影响炎性疾病的发展[7]。有研究结果显示,IL-1β刺激髓核细胞后能促进细胞凋亡增多,增加炎性因子(TNF-α、IL-6等)的分泌,抑制细胞增殖,加快椎间盘退化的发展[8]。细胞自噬与椎间盘退变发展有关,IL-1β诱导大鼠髓核细胞后,Beclin1、LC3II/LC3I等自噬有关标记基因增加,Beclin1可参与自噬前体形成,可与Bcl-2在细胞内结合调节细胞自噬和凋亡之间的平衡;LC3II/LC3I比值大小可反应自噬情况[9]。Bax和Bcl-2是常见的凋亡相关蛋白,二者相互拮抗可促进细胞发生凋亡[10]。本研究采用10 ng/ml的IL-1β刺激大鼠髓核细胞建立椎间盘退变模型,结果发现,IL-1β抑制髓核细胞活性,增加凋亡率、炎性因子TNF-α、IL-6、IL-8的表达,Bax、Beclin 1、LC3II/LC3I蛋白表达上调,Bcl-2蛋白表达下调,这与之前的报道研究结果一致。
研究结果显示,TNF-α刺进髓核细胞后miR-495-3p表达降低,过表达中miR-495-3p能促进髓核细胞凋亡和炎症反应,抑制细胞增殖[11]。Qin等[12]研究结果显示,miR-149在脂多糖刺激的髓核细胞中表达下调,miR-149通过调控MyD88影响脂多糖诱导的髓核细胞外基质降解、凋亡和炎症反应,但是对IL-1β诱导髓核细胞的研究机制尚不明确。本研究结果显示,IL-1β诱导髓核细胞后miR-149-3p表达下调,上调miR-149-3p能促进L-1β诱导髓核细胞活性,降低凋亡率,并抑制炎性因子TNF-α、IL-6、IL-8,下调Bax、Beclin 1、LC3II/LC3I蛋白表达,上调Bcl-2蛋白表达,提示上调miR-149-3p能促进IL-1β诱导髓核细胞增殖,抑制细胞凋亡、自噬和炎性反应。
JNK/p38 MAPK信号通路信号通路是真核细胞内较为经典的信号通路,在多种生物(增殖、凋亡、炎性反应等)过程中发挥在作用[13]。有研究结果显示,IL-1β刺激髓核细胞后,p38、JNK和NF-κB信号通路被激活进而促进髓核细胞增殖[14]。本研究结果显示,IL-1β诱导髓核细胞p-JNK、p-p38 MAPK蛋白表达上调,上调miR-149-3p能降低p-JNK、p-p38 MAPK蛋白表达,说明上调miR-149-3p可能通过激活JNK/p38 MAPK信号通路影响IL-1β诱导髓核细胞增殖、凋亡、自噬和炎性反应。为探究miR-149-3p是否能通过调控JNK/p38 MAPK信号通路发挥作用,加入信号通路激活剂Anisomycin后将过表达miR-149-3p转染髓核细胞,发现细胞活性降低,增加凋亡率、TNF-α、IL-6、IL-8表达水平,增加Bax、Beclin 1、LC3II/LC3I蛋白表达,降低Bcl-2蛋白表达,说明miR-149-3p通过激活JNK/p38 MAPK信号通路发挥L-1β诱导髓核细胞的发展。
综上所述,miR-149-3p可能通过激活JNK/p38 MAPK信号通路促进IL-1β诱导髓核细胞增殖,并抑制细胞凋亡、自噬和炎性反应,为探究椎间盘退行性病变的研究方向提供新的方向。
