LncRNA Neat1调控miR-128-3p表达对创伤性脑损伤小鼠认知功能和神经炎症的影响
2023-04-08余秋男刘京让宋海龙
余秋男 刘京让 宋海龙
创伤性脑损伤(TBI)是全球死亡率和发病率的主要原因,该疾病造成的全球经济损失约为4 000亿美元,占世界生产总值的0.5%[1]。目前对于原发性头部创伤的有效治疗方案较多,但治疗继发性损伤的治疗方案主要是降低炎性反应、阻止急性期神经元死亡、减少氧化应激损伤以及抗神经兴奋性毒性[2]。长链非编码RNA(LncRNA)最初被认为是转录的副产品,但越来越多的证据表明lncRNA在调节许多生物学过程中发挥着关键作用。核富集转录本1(Neat1)作为LncRNA家族中的一员,在TBI发生后具有显著变化[3]。微小RNA(miRNA)可参与许多疾病的病理生理过程,且脑特异性miRNA的检测可作为TBI的替代标志物。研究表明miR-128-3p有望作为TBI血液中的生物标志物[4]。生物信息学预测到Neat1与miR-128-3p存在结合位点。本实验通过自由落体法建立TBI小鼠模型,探讨LncRNANeat1靶向调节miR-128-3p表达对TBI小鼠认知功能和神经炎症的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物:清华大学提供雄性、BALB/c小鼠80只,要求:8周龄,体重25~28 g,许可证号:SCXK(京)2019-0016。小鼠饲养温度、湿度分别为:22℃~25℃、55%~65%,定时通风、消毒。本研究经动物伦理委员会批准。
1.1.2 试剂与仪器:武汉普诺赛生命科技有限公司提供293T细胞(产品编号:CL-0005);由上海生工生物有限公司构建野生型和突变型Neat1荧光素酶报告基因载体(Neat1 WT、Neat1 MUT);由上海生工生物工程有限公司合成腺病毒空载体组(Ad-NC)、Neat1过表达腺病毒(Ad-Neat1)、miR-128-3p模拟物阴性对照(immics NC)、miR-128-3p抑制物阴性对照(inhibitor NC)、miR-128-3p模拟物(miR-128-3p mimic)、miR-128-3p抑制物(miR-128-3p inhibitor)以及Neat1、miR-128-3p、U6、β-actin引物;上海恪敏生物科技有限公司提供白细胞介素-6(IL-6,货号:BH8273)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:E-EL-M0049);abcam公司提供半胱天冬氨酸蛋白酶-1(Caspase-1,caspase-1,货号:ab179515)、核因子-κB p65(NF-κB p65,货号:ab207297)、磷酸化核因子-κB p65(Phospho-Nuclear factor-κB p65,p-NF-κB p65;货号:ab76302)一抗。上海豫光仪器有限公司提供荧光显微镜;美谷分子仪器有限公司全功能酶标仪。
1.2 方法
1.2.1 TBI小鼠模型的制备[5]:将小鼠随机分为造模组(70只)和假手术组(10只),戊巴比妥麻醉小鼠,对其头皮进行消毒,沿小鼠头顶正中央切开,于右侧顶叶进行开窗手术,之后固定小鼠;在颅骨上方15 cm处自由降落小锤(质量约为20 g),缝合头皮。创伤后取出脑组织,观察小鼠有创伤灶出现,且伴随出血、伤灶周围脑组织挫伤等现象时,表明造模成功。假手术组小鼠仅开窗、缝合,但不敲击。
1.2.2 qRT-PCR检测血清中Neat1、miR-128-3p表达水平:选取各组小鼠,静脉取血,提取总RNA,逆转录为cDNA。以cDNA为模板进行qRT-PCR反应,反应体系、条件参照qRT-PCR试剂盒说明书。分别以U6、GAPDH为内参,采用2-ΔΔCt计算Neat1、miR-128-3p相对表达水平。见表1。

表1 qRT-PCR引物序列
1.2.3 TBI小鼠分组及干预:将70只造模组小鼠随机分为模型组、Ad-NC组、Ad-Neat1组、inhibitor NC组、miR-128-3p inhibitor组、Ad-Neat1+miR-128-3p mimic组、Ad-Neat1+mimic NC组,10只/组,另取10只假手术组小鼠。将小鼠经戊巴比妥钠麻醉后,对头部消毒,于正中切开皮肤、分离骨膜。固定头部于脑立体定位仪中,将Ad-Neat1组、Ad-NC组小鼠分别于侧脑室注射4.5 μl重组腺病毒、空载体腺病毒,注射速度为0.2 μl/min、病毒滴度为4×1010PFU/ml[6];inhibitor NC组、miR-128-3p inhibitor组分别注射40 mg/kginhibitor NC、miR-128-3p inhibitor[7];Ad-Neat1+miR-128-3p mimic组、Ad-Neat1+mimic NC组分别先注射4.5 μl重组腺病毒,再分别注射40 mg/kg miR-128-3p mimic、inhibitor NC;假手术组、模型组小鼠注射等体积的0.9%氯化钠溶液,1次/d,连续1周。
1.2.4 测定小鼠认知功能:干预完成后,对8组小鼠进行Morris水迷宫实验,测定逃避潜伏期、穿越原平台位置的次数,作为小鼠认知功能的评价标准[8]。
1.2.5 ELISA检测小鼠血清中炎性因子水平:水迷宫实验实验结束后,麻醉小鼠,静脉取血,离心取上清,按照ELISA试剂盒步骤进行检测。
1.2.6 HE染色观察小鼠伤灶周围脑组织病变状况:取适量小鼠伤灶周围脑组织,制作切片,行HE染色,脱水,封片,于显微镜下观察病理变化。
1.2.7 双荧光素酶检验Neat1、miR-128-3p关系:生物信息学方法预测到Neat1、miR-128-3p存在结合位点。常规培养293T细胞并分为miR-128-3p mimic+Neat1 WT组、mimic-NC+Neat1 WT组、miR-128-3p mimic+Neat1 MUT组和mimic-NC+Neat1 MUT组,分别将miR-128-3p mimic与突变型、野生型Neat1 3’UTR,mimic-NC与突变型、野生型Neat1 3’UTR,转染48 h后测定荧光素酶活性。
1.2.8 Western blot检测伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达:取适量小鼠伤灶周围脑组织,加入裂解液,测定蛋白总浓度,分离,转膜、封闭。加入caspase-1、NF-κB p65、p-NF-κB p65一抗于4℃孵育过夜,洗膜后,加入二抗室温孵育2 h,显影,曝光,β-actin为内参,分析8组蛋白表达水平。

2 结果
2.1 小鼠血清中Neat1、miR-128-3p表达水平 模型组Neat1表达较假手术组显著降低(P<0.05),而miR-128-3p表达水平显著增加(P<0.05)。见表2。
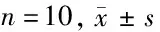
表2 小鼠血清中Neat1、miR-128-3p表达水平比较
2.2 8组小鼠伤灶周围脑组织病理学变化 假手术组小鼠脑组织无病理损伤;模型组、Ad-NC组、inhibitor NC组小鼠伤灶周围脑组织均出现大量炎性浸润、细胞坏死现象;与Ad-NC组比较,Ad-Neat1组炎性浸润、细胞坏死明显降较少;与inhibitor NC组比较,miR-128-3p inhibitor组病理现象均得到改善;与Ad-Neat1+mimic NC组比较,Ad-Neat1+miR-128-3p mimic组炎性浸润、细胞坏死现象加重。见图1。
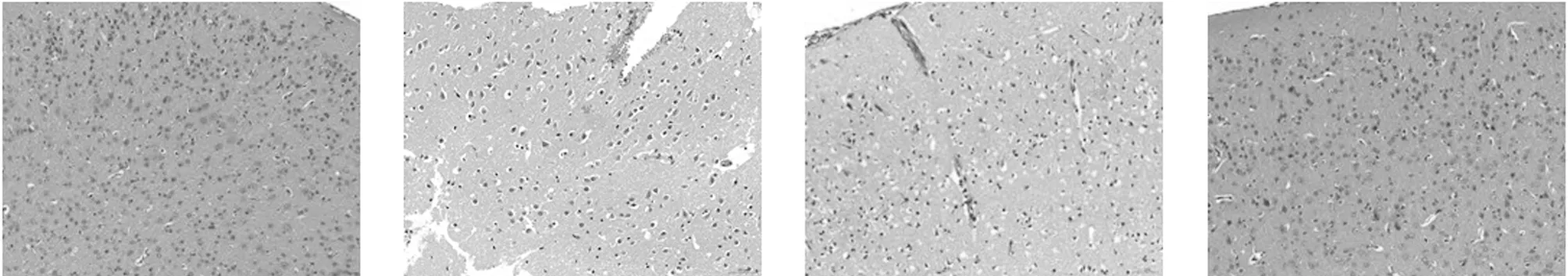
假手术组 模型组 Ad-NC组 Ad-Neat1组
2.3 预测与验证Neat1、miR-128-3p的靶向关系 生物信息学预测Neat1、miR-128-3p存在结合位点。Neat1 WT+mimic NC组比较,Neat1 WT+miR-128-3p mimic组荧光素酶活性显著降低(P<0.05);Neat1 WT+miR-128-3p mimic组、Neat1 MUT+mimic NC组、Neat1 MUT+miR-128-3p mimic组荧光素酶活性无明显变化(P<0.05)。见图2,表3。

图2 生物信息网预测Neat1、miR-128-3p结合位点;WT:wild-type,野生型;MUT:mutant-type,突变型

表3 荧光素酶检测Neat1、miR-128-3p的靶向关系
2.4 Neat1过表达对TBI小鼠血清炎性因子、认知功能及Neat1表达的影响 模型组、Ad-NC组IL-6、TNF-α含量、平均逃避潜伏期较假手术组显著增加(P<0.05),而Neat1表达、穿越平台次数显著降低(P<0.05);Ad-Neat1组IL-6、TNF-α含量、平均逃避潜伏期较Ad-NC组显著降低(P<0.05),而Neat1表达、穿越平台次数显著增加(P<0.05)。见表4。
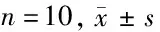
表4 过表达Neat1对TBI小鼠中Neat1表达、炎性因子、认知功能的影响
2.5 沉默miR-128-3p对TBI小鼠血清炎性因子、认知功能及Neat1表达影响 模型组、inhibitor NC组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较假手术组显著增加(P<0.05),而穿越平台次数显著降低(P<0.05);miR-128-3p inhibitor组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较inhibitor NC组显著降低(P<0.05),而穿越平台次数显著增加(P<0.05)。见表5。
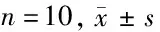
表5 过表达Neat1对TBI小鼠中Neat1表达、炎性因子、认知功能的影响
2.6 Neat1过表达或沉默miR-128-3p对伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达的影响 模型组、inhibitor NC组caspase-1、p-NF-κB p65/NF-κB p65表达较假手术组显著增加(P<0.05);miR-128-3p inhibitor组caspase-1、p-NF-κB p65/NF-κB p65表达较inhibitor NC组显著降低(P<0.05);模型组、Ad-NC组caspase-1、p-NF-κB p65/NF-κB p65表达较假手术组显著增加(P<0.05);Ad-Neat1组caspase-1、p-NF-κB p65/NF-κB p65表达较Ad-NC组显著降低(P<0.05)。见图3,表6。
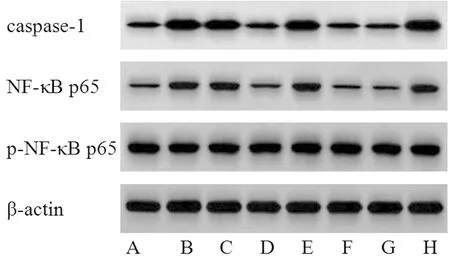
图3 8组小鼠caspase-1、NF-κB p65蛋白表达Western blot图;A为假手术组;B为模型组;C为Ad-NC组;D为Ad-Neat1组;E为inhibitor NC组;F为miR-128-3p inhibitor组;G为Ad-Neat1+mimic NC组;H为Ad-Neat1+miR-128-3p mimic组
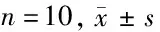
表6 Neat1过表达或沉默miR-128-3p对伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达的影响
2.7 过表达Neat1和miR-128-3p对TBI小鼠炎性因子、认知功能及caspase-1、p-NF-κB p65/NF-κB p65表达的影响 Ad-Neat1+miR-128-3p mimic组IL-6、TNF-α含量、平均逃避潜伏期、caspase-1、p-NF-κB p65/NF-κB p65表达较Ad-Neat1+mimic NC组显著增加(P<0.05),而穿越平台次数显著降低(P<0.05),但各项指标与Ad-Neat1组差异无统计学意义(P>0.05)。见表7。
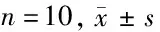
表7 过表达Neat1和miR-128-3p对TBI小鼠中炎性因子、认知功能的影响
3 讨论
TBI可定义为外力引起的脑功能紊乱等一系列脑病理疾病,属于常见的神经系统损伤疾病。据报道全球每年有250多万人受其影响[9]。该疾病的发病率、致残率及致死率均较高,严重影响患者及家庭的生活[10]。因此本实验通过自由落体方法复制TBI小鼠模型,当小鼠有创伤灶出现,且伴随出血、伤灶周围脑组织挫伤等现象时,表明造模成功,可进行关注该病的探索。
lncRNA是一类长度>200个核苷酸的RNA,在人体组织中广泛表达。研究表明,lncRNA 在中枢神经系统中高度表达,影响大脑发育和功能[11]。Chai等[12]研究发现,Neat1上调可以通过抑制PIDD1-caspase-2通路,减少caspase-1的活化,减少细胞色素C的释放,改善脑外伤后继发性脑损伤。Zhong等[13]研究发现贝沙罗汀上调lncRNA Neat1,抑制炎性反应,从而使TBI小鼠的运动和认知功能得到改善。本实验结果表明模型组Neat1表达较假手术组显著降低,表明Neat1下调与TBI关系密切,Ad-Neat1组IL-6、TNF-α含量、平均逃避潜伏期较Ad-NC组显著降低,而Neat1表达、穿越平台次数显著增加。表明过表达Neat1可以减轻炎性浸润,改善小鼠认知功能。
mRNAs转录后参与各种病理生理过程,包括脑损伤的发生。O’Connell等[4]研究发现TBI患者的血清中miR-128-3p水平显著上升,在急性期护理中可作为TBI的生物标志物。本实验研究发现TBI小鼠中miR-128-3p水平显著上升miR-128-3p inhibitor组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较inhibitor NC组显著降低,而穿越平台次数显著增加。表明抑制miR-128-3p表达可以改善小鼠认知功能,降低炎性反应。
生物信息学预测Neat1与miR-128-3p存在结合位点。Chen等[14]研究报道了NEAT1/miR-128-3p/ITGA5轴参与了胶质瘤的发生和进展,并可能为治疗胶质瘤提供一种新的潜在策略。Xian等[15]研究表明NEAT1通过靶向调节miR-128-3p,可降低炎性反应,缓解脊髓损伤诱导的神经性疼痛。另外,Caspase1在细胞凋亡过程中可导致炎性因子的大量释放,而细胞凋亡又与TBI密切相关[16]。NF-κB信号通路广泛参与TBI的发生发展过程,抑制NF-κB信号通路可减轻炎性因子的释放以发挥神经抗炎作用[17]。本实验经荧光素酶实验验证miR-128-3p为Neat1靶向作用点,且研究发现Ad-Neat1+miR-128-3p mimic组IL-6、TNF-α含量、caspase-1、p-NF-κB p65/NF-κB p65、平均逃避潜伏期较Ad-Neat1+mimic NC组显著增加,而穿越平台次数显著降低。表明miR-128-3p mimic可通过调控Caspase1、NF-κB表达逆转LncRNA Neat1发挥的作用。
综上所述,LncRNA Neat1过表达可以靶向抑制miR-128-3p表达,抑制炎性反应,改善TBI小鼠认知功能,为TBI的研究提供新思路,但由于作用机制复杂,还需再探索。
