毛竹ABCG基因鉴定及其表达模式研究
2023-04-07李紫阳杨克彬朱成磊肖晓燕高志民
李紫阳 杨克彬 朱成磊 刘 燕 郭 栋 肖晓燕 高志民
(国际竹藤中心竹藤资源基因科学与基因产业化研究所,国家林业和草原局/北京市共建竹藤科学与技术重点实验室,北京 100102)
ATP 结合盒转运蛋白(ATP-binding cassette transporters,ABC)是生物体中最大的转运蛋白家族[1],该类蛋白利用ATP 水解产生的能量驱动物质运输。ABC 转运蛋白家族包括8 个亚家族,其中ABCG 是最大的亚家族[2],该亚家族又分为白棕色复合体(whitebrown complex,WBC)和多效性耐药复合体(pleiotropic drug resistance,PDR)。WBC 是半分子ABCG 转运蛋白,具有一个核心单位;PDR 是全分子ABCG 转运蛋白,具有两个核心单位[3]。每个核心单位由两个基本结构组成,即ABC 转运蛋白特异性核苷酸结合域(nucleotide-binding domain,NBD)和疏水跨膜结构域(transmembrane domain,TMD)。NBD 是由大约200 个氨基酸残基组成的保守区段,包含Walker A、Walker B、ABC signature 基序以及Q 环和H 环[4],TMD 通常由4~6 个疏水的α-螺旋组成[5]。ABCG 在植物中已有广泛研究,在植物激素运输、表皮角质层形成、次生代谢产物分泌、抵抗生物和非生物胁迫等方面起重要作用[6]。
研究表明,植物通过表面形成角质层来保护自身免受外界侵害,而ABCG 参与植物表面物质形成的运输,其中拟南芥(Arabidopsis thaliana)中的AtABCG1 和AtABCG16 参与花器官相关表皮的角质组分运输[7]。ABCG 介导植株体内重金属离子的外排,减少其对植物的毒害作用,如AtABCG36和AtABCG40可分别参与Cd2+和Pd2+的细胞外排[8-9]。ABCG 还可参与木质素单体的转运,如AtABCG29是H型木质素单体香豆醇的转运蛋白[10]。另外,ABCG 在植物体内广泛参与多种激素的运输,拟南芥中的ABCG25、ABCG30、ABCG31 和ABCG40 是脱落酸(abscisic acid,ABA)的转运体,分别在植物不同组织部位起输入或输出ABA 的作用[11]。拟南芥ABCG36 和ABCG37 是两个在根部高表达的蛋白,参与生长素前体吲哚丁酸(indole-3-butyric acid,IBA)的运输,调控细胞内生长素动态平衡[12-13]。植物激素作为协调植物细胞活动的一类小分子化学信号物质,可通过多种方式调节植物的生长发育,尤其是可以参与抵御逆境胁迫过程,其中ABA 发挥着重要作用[14-15]。另外,ABA可以调节木质素合成调控网络中的遗传调控因子,促进次生壁形成,从而提高抗逆性[16]。
毛竹(Phyllostachys edulis)属于禾本科竹亚科刚竹属,具有生长快、适应能力强的特点,在我国栽培面积大,占全国竹林总面积的72.96%[17],且产量高,物理性能佳,是木材的良好替代品。低温和干旱等胁迫因素是制约毛竹竹材和竹笋产量和质量的主要非生物因素,目前在毛竹中已鉴定到多个基因参与到抗逆过程中,如Phehdz1[18]、PeEXs[19]、NAC[20]、WRKY[21]等转录因子基因均受到低温或干旱胁迫的诱导。然而,激素作为植物响应非生物胁迫的重要信号分子,目前在竹子中关于运输的研究甚少,而ABCG 作为重要的激素转运蛋白在竹子中的研究仍几乎处于空白。因此,本研究以毛竹为对象,在全基因组水平筛选并鉴定ABCG基因成员,综合分析其基因结构、蛋白保守结构域、进化关系以及其启动子中的作用元件,利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术分析不同激素和非生物胁迫处理后ABA 运输相关ABCG基因的表达模式,以期为深入研究ABCG 基因家族在毛竹激素运输以及抗逆过程中的功能提供参考依据。
1 材料与方法
1.1 试验材料
在人工气候室条件下(温度25 ℃,相对湿度80%,光16 h/暗8 h)培养毛竹实生苗,2个月时选择长势一致的幼苗,将其随机分为三组。第一组用100 µmol·L-1的ABA 溶液对叶片进行喷施处理;第二组将实生苗放入4 ℃培养箱中进行低温处理;第三组用20% PEG-6000 溶液浇灌至饱和,模拟干旱处理[22]。每个处理至少有20 株幼苗,且均包含3 次重复。分别在处理后0、3、6 h 后收集各组毛竹自上而下第2 片嫩叶,液氮速冻后存于-80 ℃冰箱备用。
以江西省南昌市野生毛竹林(115°46' E,28°45' N)中的毛竹笋为研究材料,选择长势良好的毛竹笋,采集代表竹笋生长趋势的5 个不同高度(1.0、2.0、4.0、6.0和8.0 m)的笋,选取地上第15 节间(毛竹成竹胸高处),取该节间的上部作为试验材料。样品经液氮处理后,存于-80 ℃冰箱,用于研究关键ABCG基因在不同高度笋中的表达模式。
1.2 试验方法
1.2.1 毛竹ABCG 基因家族成员的鉴定 分别从Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/)和TAIR(https://www.arabidopsis.org/index.jsp)数据库下载水稻和拟南芥ABC 家族成员的氨基酸序列作为诱饵,在毛竹新版本基因组数据库BambooGDB(http://bamboo.bamboogdb.org/)中进行BLASTP 比对分析,利用HMMER(https://www.ebi.ac.uk/Tools/hmmer/)和SMART 数据库(http://smart.embl-heidelberg.de)对获得的候选序列逐条进行蛋白保守结构域的鉴定分析,删除没有典型结构域——ABC transporter(PF00005)以及该结构域不完整的序列,得到毛竹ABC 家族成员。利用MEGA 7.0 软件中的邻接(neighbor-joining,NJ)法构建系统进化树,重复次数为1 000,其他参数使用系统默认值[23]。并以水稻ABC 基因家族分类为依据[24],对毛竹ABC 基因家族进行分类,最终得到毛竹ABCG亚家族成员。
利用ProtParam(http://web.expasy.org/protparam/)网站对毛竹ABCG 蛋白长度、分子量及等电点等理化性质进行分析,并使用Plant-mPLoc 在线网站(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测毛竹ABCG的亚细胞定位,使用TMHMM Server v 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域。利用TBtools 分析毛竹ABCG 亚家族成员的基因结构,利用Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库对基因上游2.0 kb 序列进行顺式作用元件和应答元件分析,通过在线软件MEME(https://meme-suite.org/tools/meme)对毛竹ABCG蛋白的保守基序进行分析。
1.2.2 毛竹ABCG 亚家族成员系统进化分析 利用MEGA 7.0 内置的ClustalW 软件对水稻的ABCG 氨基酸序列进行多序列比对分析,并构建NJ 系统进化树,重复次数为1 000,其他参数使用系统默认值[23]。通过TBtools 内置的BLASTP 程序对毛竹和水稻ABCG 的氨基酸序列进行多向比对,参考文献[25]设置参数,鉴定毛竹中以及毛竹与水稻中具有共线性关系的基因,使用TBtools内置的MCScanX 程序进行可视化。同时,利用TBtools对毛竹ABCG同源基因对之间的同义(Ks)和非同义(Ka)核苷酸替换率进行计算。
1.2.3 毛竹关键ABCG基因的表达模式分析 使用总RNA 提取试剂盒(简石,中国)提取不同处理毛竹叶片、不同高度笋第15 节上部的总RNA,并反转录为cDNA,存于-20 ℃冰箱。利用Primer Premier 5 软件设计毛竹ABCG基因序列特异的定量引物(表1),由北京睿博兴科生物科技有限公司合成。使用qTOWER 荧光定量PCR 仪(耶拿,德国),以PeNTB为内参基因[26],反应体系共10 µL:2×SYBR Ⅱ Green I Master 5.0 µL、正向和反向引物各0.2 µL、cDNA 模板0.8 µL、ddH2O 3.8 µL。PCR 扩增程序:95 ℃预变性5 min;95 ℃变性10 s,62 ℃退火10 s,44 个循环。采用2-ΔΔCT法分析基因的相对表达量[27],并使用OriginPro 软件绘制表达量图。

表1 qRT-PCR和载体构建所用引物Table 1 Primer sequences used in qRT-PCR and vector construction
1.2.4 共表达网络构建与酵母单杂交 根据毛竹木质化调控网络[28],利用现有毛竹不同高度笋的转录组数据,基于加权基因共表达网络分析(weighted correlation network analysis,WGCNA)构建以PeABCG15为核心的共表达网络,筛选与之共表达的转录因子。根据PeABCG15启动子序列以及转录因子基因PeKNAT3(PH02Gene30737)和PeMYB42(PH02Gene08 106)序列,利用Primer Premier 5软件设计引物,用于目的序列扩增,并分别构建到pHIS2 和pGADT7-Rec2 表达载体中,命名为pHIS2-PeABCG15pro、pGADT7-Rec2-PeKNAT3和pGADT7-Rec2-PeMYB42,将pGADT7-Rec2-PeKNAT3 和pGADT7-Rec2-PeMYB42 分 别 与pHIS2-PeABCG15pro共转化到Y187感受态中,同时设置阳性对照(pGADT7-Rec2-53+p53His2)与阴性对照(pGADT7-Rec2-PeKNAT3+p53His2、pGADT7-Rec2-PeMYB42+p53His2),在 筛 选 培 养 基DDO(SD/-Leu/-Trp)上培养后,将其菌液点于含有3-AT 的TDO(SD/-Leu/-Trp/-His)上,倒置培养3~5 d,拍照记录[29]。
2 结果与分析
2.1 毛竹ABCG亚家族成员鉴定与亚细胞定位预测
通过筛选鉴定得到毛竹ABC基因190 个,其中包含ABCG亚家族成员77个,根据BambooGDB数据库中基因组装名称的顺序依次命名为PeABCG1~PeABCG77。PeABCGs 的编码序列(coding sequence,CDS)长度为891~4 866 bp,编码蛋白氨基酸序列长度为296~1 621 aa,其对应分子量为32.93~180.64 kDa,理论等电点介于5.58~9.77之间,平均亲水系数为-0.337~0.414。跨膜结构域预测显示,有74 个PeABCGs编码蛋白具有跨膜结构,跨膜结构域数量为3~14个不等,属于跨膜蛋白。亚细胞定位预测显示,有73个PeABCGs均定位到细胞膜上,同时有6 个(PeABCG1、PeABCG20、PeABCG33、PeABCG33、PeABCG34和PeABCG58)定位到叶绿体,3个(PeABCG30、PeABCG31和PeABCG69)定位到细胞质,1 个(PeABCG54)定位到细胞核。另外4 个PeABCGs(PeABCG3、PeABCG18,PeABCG23和PeABCG24)定位到叶绿体、细胞质或细胞核中。
2.2 PeABCGs基因结构及其编码蛋白的motif分析
基因结构分析结果表明,不同PeABCGs差异明显。外显子数量最多的是PeABCG42(25 个),有3 个基因(PeABCG9、PeABCG62和PeABCG73)不含内含子,且各个成员之间的差异在于内含子和外显子数量及所在位置不同(图1-A)。单个内含子最长为19 736 bp,是位于PeABCG27的第16 个内含子。另外,22 个PeABCGs没有非翻译区(untranslated regions,UTR),剩余55个成员中有36个同时具有5' UTR和3' UTR,5个只有5' UTR,14 个只有3' UTR。Motif 分析结果表明,在PeABCGs 中共鉴定得到10 个motif(motif 1~motif 10)(图1-B),其中motif 1、motif 2 和motif 7 是 共 有motif 基 序,并 按motif 2-motif 7-motif 1顺序共同组成ABC家族的特征保守域——ABC transporter。另外,motif 9只存在于半分子的ABCG(WBC)中,而motif 3、motif 4、motif 6 和motif 8只存在于全分子的ABCG(PDR)中。基因结构和保守基序的差异表明,不同PeABCGs可能具有不同的功能。
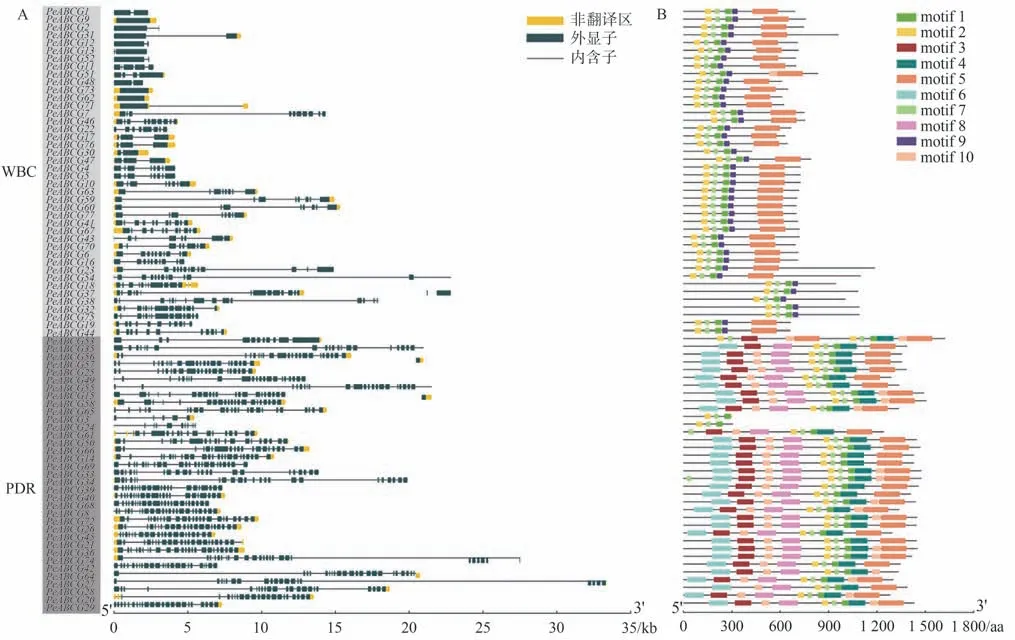
图1 PeABCGs基因结构及其编码蛋白的保守基序Fig.1 Gene structures of PeABCGs and the conserved motifs of their encoded proteins
2.3 PeABCGs的系统进化分析
系统进化树分析表明,所有毛竹和水稻的ABCGs分为WBC 和PDR 两个亚组,毛竹中WBC 成员数量较多,为42 个,PDR 中有35 个(图2-A)。为进一步分析PeABCGs 的进化情况,将PeABCGs 定位到scaffold 上并与水稻基因组进行共线性分析。结果发现PeABCGs共分布在23 个scaffold 上,其中47 个基因组成28 个共线性基因对(图2-B)。Ka/Ks分析发现,毛竹共线性基因对的Ka/Ks均小于1,由此表明PeABCGs 在进化上经历了较强的纯化选择。与水稻基因组进行共线性分析发现,有31 个OsABCGs 与50 个PeABCGs 之间存在共线性,共组成54 个共线性基因对,表明毛竹与水稻在进化上具有较近的亲缘关系。
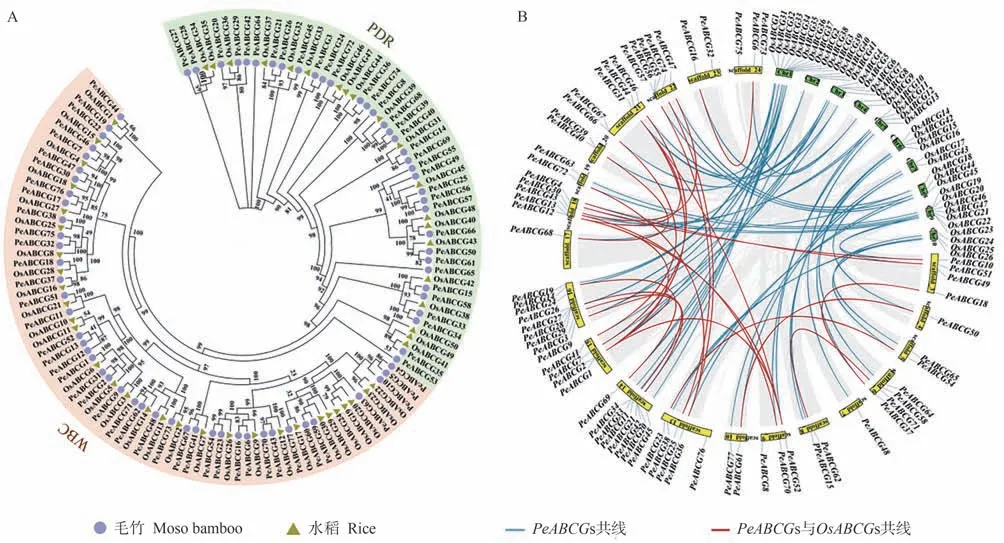
图2 ABCG亚家族成员的系统进化分析Fig.2 Phylogenetic analyses of the members belonging to ABCG subfamily
2.4 PeABCGs启动子序列分析
为进一步研究PeABCGs基因家族成员对植物激素和非生物胁迫的响应,对基因上游启动子中的顺式作用元件和应答元件进行了预测分析。结果显示,有8类作用元件与植物激素响应相关,如脱落酸响应元件ABRE,赤霉素响应元件TATC-box、GARE-motif和P-box,生长素响应元件TGA-element、AuxRR-core,以及茉莉酸甲酯响应元件TGACG-motif、CGTCA-motif等(图3)。其中,ABRE出现在74个PeABCGs的启动子中,且数量最多,如PeABCG3、PeABCG24、PeABCG45、PeABCG60、PeABCG61和PeABCG76具有10 个以上的ABRE。同时,另有3 类作用元件参与胁迫反应,如低温响应元件LTR 和干旱响应元件MBS。由此表明,PeABCGs 的表达可能受到多种植物激素和逆境胁迫的影响,特别是ABA、低温和干旱。另外,在14 个PeABCGs 中发现AC元件(AC-I和AC-Ⅱ),前人研究表明该元件存在于木质素生物合成相关基因的启动子中,且是MYB 转录因子特异结合元件[30],由此推测这些PeABCGs 可能参与了木质素的合成过程。
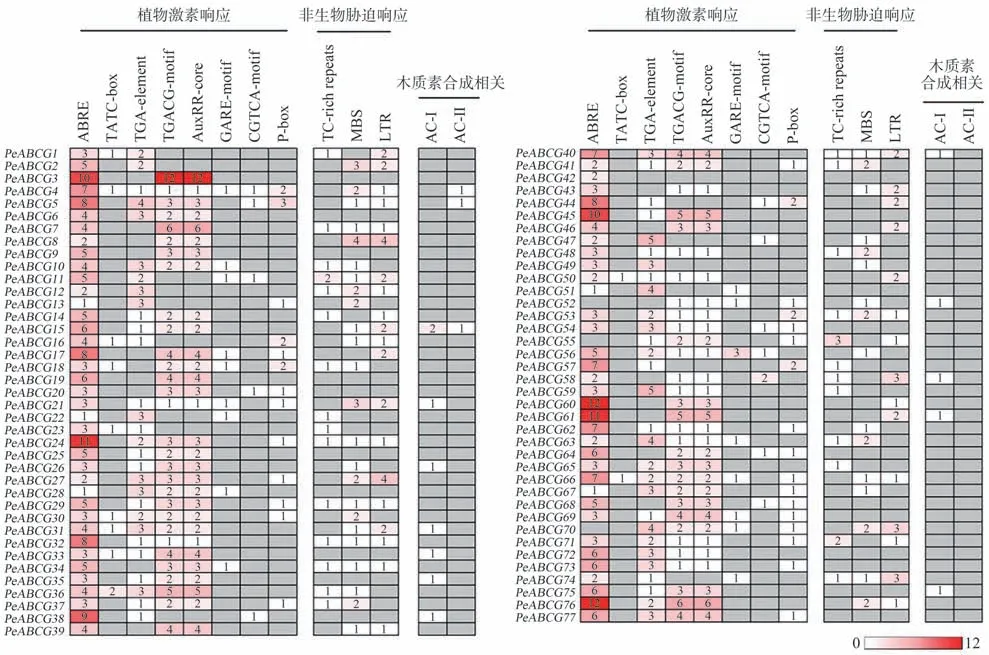
图3 毛竹PeABCGs启动子响应元件种类统计Fig.3 Statistics of response elements in the promoter of PeABCGs
2.5 ABA运输相关PeABCGs的表达模式分析
根据拟南芥、水稻中运输ABA的ABCG,在毛竹中鉴定到7个同源基因,即PeABCG7、PeABCG15、PeABCG17、PeABCG34、PeABCG46、PeABCG58和PeABCG65。qRTPCR 结果表明,在ABA 处理下,除PeABCG34未检测到表达外,其余6 个PeABCGs 均呈上调表达趋势。其中PeABCG7和PeABCG17呈持续上升表达趋势,在处理6 h时表达量分别是处理前(0 h)的106倍和273倍,另外4个基因随时间的延长呈先上升后下降的表达模式,在3 h时与处理前相比均显著上调(P<0.05)(图4-A~G)。在低温处理条件下,7 个PeABCGs 的表达量均受诱导。其 中PeABCG15、PeABCG17、PeABCG34和PeABCG65表达量持续上升,特别是PeABCG34,处理6 h后的表达量达到了处理前的33 倍,而PeABCG7、PeABCG46和PeABCG58则呈先上升后下降的表达模式,在3 h 时与处理前相比均显著上调(图4-H~N)。在干旱处理后,PeABCG17、PeABCG34和PeABCG46的 表 达 量 持 续 上升,且在6 h 时均显著高于处理前,特别是PeABCG46,其上调幅度最明显,表达量约为处理前的34 倍;PeABCG15和PeABCG65呈先上升后下降的表达模式,在处理3 h时其表达量显著升高;而PeABCG7和PeABCG58的表达受到抑制,呈持续下降趋势(图4-O~U)。

图4 不同处理下毛竹叶中PeABCGs的表达分析Fig.4 Expression analysis of PeABCGs in leaves of moso bamboo under different treatments
2.6 木质素合成相关基因PeABCG15表达分析
由上述结果可知,PeABCG15在各个处理下均呈现显著变化,且PeABCG15启动子中存在与木质素合成相关的AC 元件,因此对其进行表达调控研究。利用WGCNA 构建了以PeABCG15为核心基因的共表达网络,并通过相关性分析筛选出与PeABCG15具有较高相关关系的56 个转录因子基因(相关系数大于0.90)(图5-A)。这些转录因子基因分别属于13个转录因子家族(如MYB、NAC、HB等),其中PeKNAT3和PeMYB42与PeABCG15的表达具有高度相关性(相关系数大于0.94),PeKNAT3和PeMYB42的同源基因在拟南芥中均参与调控木质素的生物合成[31-32],分别克隆了启动子序列(798 bp)以及PeKNAT3和PeMYB42的编码区序列(912和795 bp),用于酵母表达载体的构建。
酵母单杂交试验结果表明,阳性对照(pGADT7-Rec2-53+p53His2)、pGADT7-Rec2-PeKNAT3+pHis2-PeABCG15pro 和 pGADT7-Rec2-PeMYB42+pHis2-PeABCG15pro均能在TDO/3-AT培养基上正常生长,而阴性对照(pGADT7-Rec2-PeKNAT3+p53His2和pGADT7-Rec2-PeMYB42+p53His2)无法正常生长(图5-B)。由此说明,PeKNAT3、PeMYB42 能够与PeABCG15启动子相结合。同时qRT-PCR结果显示(图5-C),PeABCG15随着笋高度的增加呈上调的表达趋势,峰值出现在8.0 m 竹 笋 中,PeKNAT3和PeMYB42的 表 达 趋 势 与PeABCG15一致,特别是PeMYB42在8.0 m笋中较1.0 m笋上调了1 000 倍以上。由此推测,PeABCG15的表达可能与木质素的合成密切相关。
3 讨论
在植物中,ABCG 是ABC 转运蛋白家族中最大的亚家族[2],毛竹中同样如此,这表明ABCG 亚家族较其他亚家族的功能更为多样,因此在毛竹生长发育过程中起着关键的作用。本研究鉴定到毛竹中有77 个ABCG 家族成员,明显多于进化关系较近的二穗短柄草(44个)、水稻(50个)以及拟南芥(43个)等物种中的数量[33],这可能与毛竹在进化过程中经历了全基因组复制事件和基因家族扩张事件有关[34]。这两种事件发生的原因很可能是毛竹在适应环境过程中需要更多物质来满足自身的生长发育,进而需要更多的转运蛋白作为支撑。另外,毛竹、水稻和拟南芥中所有无内含子的基因均属于WBC[35],这一结果表明无内含子基因可能是从一个共同的无内含子基因祖先进化而来,且具有相似的功能。
亚细胞定位预测结果表明PeABCGs 大多定位在细胞膜上,这与其他植物中的研究结果一致[1,33]。除此之外,还有个别成员定位到其他位置,如叶绿体上,由此推测这些成员可能运输光合作用相关的底物。有研究表明,当植物处在缺铁环境中时,通过AtABCG37的转运功能可以及时补给含铁的复合物供植物正常生长[36]。OsABCG9 在水稻(Oryza sativa)叶片表皮蜡质(角质层的组成成分)的运输中发挥关键作用,与野生型相比,osabcg9-1突变体叶片上的蜡质总量减少了53%,且在osabcg9-2突变体叶片中完全消失。毛竹中的OsABCG9同源基因PeABCG6在叶片中的表达量较其他组织更高,推测该基因也可能与表皮蜡质的合成相关。
研究表明,植物存在依赖ABA 和不依赖ABA 两种途径响应渗透胁迫[37-38],ABA 可以作为信号因子调控植物中木质素的生物合成[39],高木质素含量能够提高植物的木质化,从而增强植物抵抗胁迫的能力[16,40]。本研究中,6 个与ABA 运输相关的PeABCGs 在ABA 以及低温或干旱处理下均受到诱导,说明上述基因可能通过ABA介导参与抗逆;而PeABCG34经qRT-PCR几乎未检测到表达,且在ABA 处理下表达量未发生明显变化,表明该基因可能不受ABA 调控。PeABCG15在ABA、低温和干旱处理下均受诱导,推测该基因可能依赖ABA 参与毛竹的抗逆过程。研究表明,在拟南芥中AtABCG29 能够转运对香豆醇木质素单体,并影响木质素含量[10]。PeABCG15 是AtABCG29 的同源蛋白,在本研究中PeABCG15的表达随笋高度的增加而显著上升,同时前人研究表明笋单个节间同一位置的木质化程度随笋高度的增加而加深[28],且PeABCG15启动子区域含有MYB 转录因子特异结合元件,推测该基因可能参与毛竹中木质素的生物合成。因此,PeABCG15可能在ABA 诱导下通过促进毛竹的木质化来发挥抵御逆境的作用,这与葡萄叶片木质化程度高抗旱性增强[41],以及棉花中木质素含量增加从而保护细胞壁免受真菌的降解[42]等研究结果一致,但其在竹子中的具体生物学功能有待进一步验证。
4 结论
本研究从毛竹中鉴定了77 个ABCG 家族成员,发现PeABCGs 的启动子区域中含有多种参与激素、非生物胁迫响应的调控元件以及转录因子结合元件。根据各成员具有完整保守结构域的数量,将PeABCGs 分为WBC 和PDR 两个亚组,分别包括42 和35 个成员。在ABA处理、低温和干旱胁迫下,叶片中7个与ABA运输相关的PeABCGs 的表达量变化模式说明,PeABCGs通过ABA 介导型和非介导两种方式参与抗逆,其中PeABCG15的表达受ABA 诱导,且其在毛竹笋中的表达随笋的木质化增加而上升,推测该基因可能通过促进木质素合成参与抗逆过程。
