气体二氧化氯对葡萄杀菌效果及品质的影响
2023-04-06程传松郭凤婷刘斌雄陈登元黄晓燕李长城
江 涛,程传松,郭凤婷,刘斌雄,陈登元,黄晓燕,李长城,方 婷*
(福建农林大学食品科学学院,福建 福州 350002)
葡萄因其果粒饱满、酸甜可口及汁液丰富而深受消费者青睐[1]。作为一种具有极高经济价值和市场价值的水果,据统计,福建福安‘巨峰’葡萄种植面积高达4.5万 亩,年产量4.2万 t,年产值达到2.9亿 元,已然成为南方沿海最大的葡萄生产基地。当前,在冷藏条件下,市售葡萄货架期约为10 d,最佳食用期约为7 d[2]。然而,由于葡萄富含水分和营养成分,采后极易遭受微生物侵染,导致果实腐败变质,甚至造成食源性疾病[3]。此外,葡萄生理代谢旺盛,营养物质消耗较快,极易造成失水软化和风味劣变,大大降低葡萄品质[4]。因此,采用适宜的保鲜技术处理葡萄以实现杀菌保鲜效果显得尤为必要。
目前,壳聚糖、电解水以及ClO2等新型保鲜技术已被应用于果蔬保鲜。壳聚糖可通过涂膜等方式施加于果蔬表面,但其抗菌效果不佳(无法均匀处理),导致保鲜效果参差不齐[5]。电解水法处理果蔬虽然有着不错的抗菌效果,但处理时间相对较长,且受环境因素等影响,无法灵活使用,效率较低[6]。ClO2有着强力的抗菌效力,已作为一种广泛、高效且安全的杀菌剂应用于果蔬清洗、杀菌保鲜等领域[7]。研究已经发现经ClO2气体处理后,果蔬表面微生物可被灭活,从而减少果蔬微生物负荷,提升果蔬抗菌与抗病能力,实现一定的保鲜效果[8]。Sadeghi等[9]开发了一款自释放ClO2薄片,并利用其处理番茄果实,结果表明该薄片能够抑制番茄果实细菌生长繁殖,且番茄果实品质保持良好。Wang Lin等[10]使用5 mg/L ClO2气体处理圣女果5 h,实现了完全灭活沙门氏菌且保持了圣女果感官品质与营养价值。Jin Riya等[11]应用10 mg/m3ClO2气体处理葡萄30 min,灰霉菌、青霉菌及链格孢霉减少超过4(lg(CFU/g)),且能够抑制VC和还原糖含量消耗。
然而,气体ClO2难以制备和控制。气体ClO2通常采用亚氯酸钠(NaClO2)与酸(盐酸、硫酸及草酸等)反应制备,因此会选用大型发生器或发生装置,从而降低了处理的灵活性[12]。NaClO2与干冰反应产生ClO2是一种间接反应。利用过量干冰挥发释放大量CO2,CO2溶于含有NaClO2溶液的吸收垫从而形成H2CO3,H2CO3可电离产生H+,进一步与NaClO2反应产生ClO2和其他无毒化合物(Na2CO3、NaCl和H2O)。由于ClO2极易溶于水,起始ClO2溶解于吸收垫中,当溶液饱和后,ClO2迅速逸出。本研究利用NaClO2与干冰间接反应开发一种气体ClO2处理葡萄的方法,旨在评估气体ClO2的杀菌效果。同时,测定气体ClO2处理前后葡萄相关品质指标,旨在评估气体ClO2对其品质的影响。
1 材料与方法
1.1 材料与试剂
‘巨峰’葡萄购于福建省福安市象环村,挑选无机械损伤、无病害、颜色大小相似及成熟度一致的果实用于研究。
1%蛋白胨水(peptone water,PW) 北京双旋微生物制品厂;脑心浸萃液体培养基(brain heart infusion,BHI)、大豆酪蛋白琼脂培养基(tryptic soy agar,TSA)广州环凯微生物有限公司;利福平(rifampicin,Rif)美国Sigma公司;NaClO2固体(纯度80%) 上海麦克林生化科技有限公司;干冰 福州佰泉生物有限公司;TaKaRa裂解缓冲液(D304) 北京全式金生物技术有限公司;2×TsingKE Master Mix(TSE003) 北京奥维森基因科技有限公司。
1.2 仪器与设备
THZ-92B气浴振荡器 上海博迅医疗生物仪器有限公司;St-16R高速离心机 美国Thermo Fisher Scientific公司;BagMixer400拍打匀浆器 法国Interscience公司;MS-600气体ClO2检测仪 深圳逸云天有限公司;Lc-388立式冷藏冰柜 宁波苏凝制冷电器商行;YP10001B高精度电子天平 上海力辰科技有限公司;CR-20手持色差计 日本柯尼卡美能达公司;XTC-18质构分析仪 上海宝圣实业有限公司;HP-TD1糖度计成都科启力利农业开发有限公司;LRClO2比色计广州环凯微生物有限公司;3730XL测序仪、2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪美国Applied Biosystem公司;5810R板式离心机 德国Eppendorf公司;JY04S-3C凝胶成像装置、JY300C Power Supply电泳仪 济南君意生物科技有限公司。
1.3 方法
1.3.1 优势菌分离与鉴定
取葡萄,用无菌手术刀切取葡萄表皮约10 g,放入无菌采样袋,加入20 mL 1% PW,放入拍打器(约100 r/min)均质2 min,使葡萄表面微生物尽可能被洗下,将葡萄均质液用1% PW进行10 倍体积梯度递增稀释,参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中的平板菌落计数法测定葡萄表面菌落总数,并取适宜浓度的稀释液100 μL涂布于TSA平板,于37 ℃恒温培养箱内培养24~48 h。依据所观察的菌落形态、大小及颜色不同挑取典型的菌落进行划线培养,直至得到单一菌落并于4 ℃冰箱中保存备用。
取适量菌体溶于Takara裂解缓冲液中变性后离心取上清液作为模板(模板DNA),反应条件为80 ℃、15 min。以通用引物27F和1492R作为扩增引物,进行正反测序,扩增引物序列分别为27F:5'-AGAGTTTGATCCTGGCTCAG-3'、1492R:5'-GGTTACCTTGTTACGACTT-3'[10]。经PCR仪扩增,PCR反应体系和条件如表1所示。取2 μL扩增液进行1%琼脂糖凝胶电泳观察扩增产物后,送至北京奥维森基因技术有限公司进行高通量测序,将测序结果用BLAST程序与GenBank数据库中已知菌株的16S rDNA基因序列进行相似性比对分析,并用ClustalX1.83和MEGA4软件的Neighbor-Joining法构建系统发育树。
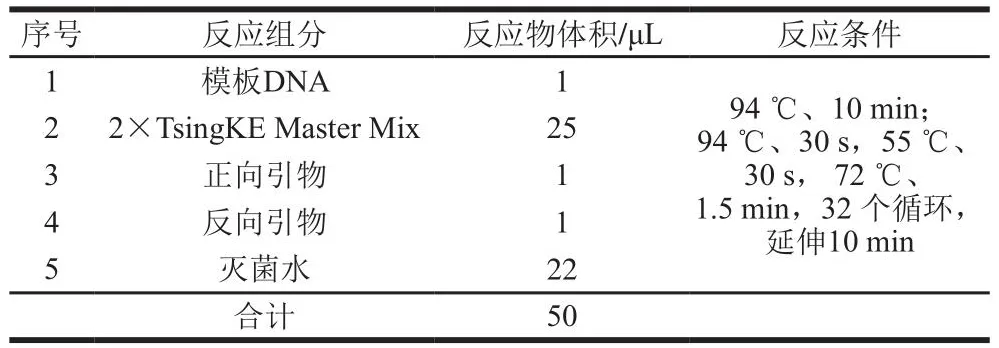
表1 PCR扩增体系组成及条件Table 1 Composition and conditions of polymerase chain reaction system
1.3.2 诱导与菌悬液制备
每一株优势菌依次接种并转移到含有25、50、75 mg/L和100 mg/L Rif的BHI后,置于气浴振荡器,37 ℃振荡培养(约100 r/min)过夜。每株优势菌成功诱导并耐药稳定后,将细菌培养物划线于含有100 mg/L Rif的TSA平板上。两株耐药菌定期在TSA/Rif平板上划线并保存于4 ℃生化培养箱。将每株耐药菌使用无菌接种环挑取单菌落转移至10 mL含有100 mg/L Rif的BHI中,于37 ℃振荡培养18~24 h,使其恢复生长。之后,菌悬液4 ℃、5 000 r/min离心10 min,弃去上清液。用10 mL 1% PW重新悬浮菌细胞,再次重复上述离心过程,弃去上清液。重复洗菌步骤后,用5 mL 1% PW重新悬浮菌细胞,混匀备用。
1.3.3 接种
使用移液枪转移100 μL菌悬液点接于葡萄样本(40 g)表面,在超净工作台干燥1 h,使菌细胞附着于样本表面。葡萄样本表面接种水平为6.0~7.7(lg(CFU/g))。
1.3.4 气体ClO2处理
如图1所示,将NaClO2固体溶于去离子水配制成质量分数28%的NaClO2溶液,将其滴加于吸收垫,吸收垫内部为吸收棉,外部为黏性表面。将吸收垫粘贴至带有顶盖的9 L圆柱形便携式塑料桶(处理室)内部,放入一个网格支架,葡萄样本放置在支架上,投入过量干冰(释放CO2),顶盖立即密封。气体ClO2生成包括两步反应,如式(1)、(2)所示。
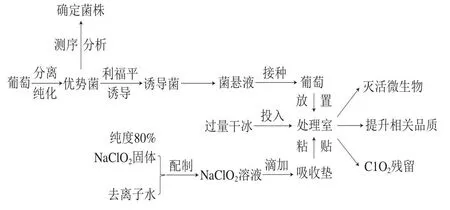
图1 气体ClO2处理方法示意图Fig.1 Schematic diagram of gaseous ClO2 treatment method
处理期间,ClO2浓度由ClO2浓度检测仪测定,单位为μL/L。由于ClO2浓度不稳定,引入ClO2累积浓度[13]以评估气体ClO2的杀菌效果,ClO2累积浓度由ClO2浓度对时间的积分计算所得,如公式(3)所示。处理温度(25 ℃)和相对湿度(60%~70%)由温湿度调节系统控制并由温湿度监测仪监测。
式中:c为测定的ClO2浓度/(μL/L);t为处理时间/h。
1.3.5 杀菌实验
按1.3.4节所述气体ClO2处理方法杀灭接种细菌的葡萄果实。施加于吸收垫的NaClO2用量分别为112、224、336、448、560 mg和672 mg。干冰投入量为5 g。ClO2气体处理葡萄样本3 h后,从桶内撤出。使用无菌手术刀切割样本接种表面(约4 g),放入无菌采样袋,加入20 mL 1% PW,经匀浆器(约100 r/min)拍打2 min,利用已灭菌1% PW进行适宜梯度稀释后涂布于TSA/Rif平板,每个平板2 个平行。将涂布好的平板37 ℃培养24~48 h后计数。每次实验以气体ClO2处理前后葡萄果实样本菌落总数对数值减少量(lg(CFU/g))表征杀菌效果。
1.3.6 贮藏实验
选取NaClO2用量112 mg与672 mg处理组分别为气体ClO2低累积浓度处理组与高累积浓度处理组,记为S1与S2。无处理为对照组,记为S0。葡萄(共1.2 kg,每组约100 g)经ClO2气体处理3 h后,将S0、S1及S2装入1 L食品级塑料保鲜盒,贮藏于4 ℃冷藏冰柜30 d。每5 d测定每组葡萄样本的色泽参数、果实硬度、质量损失率以及可溶性固形物(total soluble solid,TSS)含量。
色泽参数(L*、a*和b*)参照郝燕等[14]的方法,利用手持色差计测定。其中L*值表示亮度,a*、b*值分别表示红绿度和黄蓝度,a*值大于0为红色,a*值小于0为绿色;b*值大于0为黄色,b*值小于0为蓝色,其绝对值越大,颜色越深。
果实硬度参照Zhou Siyuan等[15]的方法,由质构分析仪测定,用直径为2 mm的探针以1 mm/s的速率穿透葡萄样品顶部中心10 mm后得到的数值表示,单位为g。
质量损失率参照张昭等[16]的方法。采用直接称量法,由高精度电子天平称量。按式(4)计算质量损失率。
TSS含量测定参照颜廷才等[17]的方法。将葡萄榨汁,摇匀,取部分汁液利用HP-TD1糖度计测定TSS含量,单位为°Brix。
ClO2残留量测定参照秦惠等[18]的方法。葡萄样本经气体ClO2处理3 h后,放入一个无菌采样袋,添加200 mL去离子水并反复用手揉捏振荡5 min。从采样袋取10 mL溶液,经ClO2比色计测定ClO2残留量,单位为mg/L,经公式(5)计算将单位转换为mg/kg。30 d贮藏期内,每5 d测定每组葡萄样本的ClO2残留量。
式中:ρ为测定的ClO2残留质量浓度/(mg/L);V为去离子水稀释体积/L;m为葡萄样本质量/g。
1.4 数据处理与分析
所有实验均重复3 次,结果以平均值±标准差表示,利用SPSS软件中Duncan法进行显著性分析,P<0.05表示差异显著;采用Excel 2010软件作图。
2 结果与分析
2.1 优势菌分析结果
成功提取2 株优势菌基因组DNA,将其作为模板,以27F和1492R为引物,进行16S rDNA PCR扩增,扩增后得到的产物经琼脂糖凝胶电泳分析,如图2所示,2 株优势菌在1 500 bp处出现单一清晰的荧光条带且无拖尾现象,满足实验需求,通过对目的片段进行琼脂糖凝胶回收,以备后续测序使用。将所测定的优势菌基因序列与GenBank内已知菌株的相应序列进行比对,选取BLAST结果中得分较高菌的16S rDNA序列,使用MEGA5.2.1软件根据Neighbor-Joining进行系统进化树分析,结果如图3所示。根据系统发育树分析,分离所得到的菌株1与大肠杆菌科的2 个菌属埃希氏菌(Escherichia)和志贺氏菌(Shigella)的遗传距离较近,且与菌株E.coli相似度达到99.3%。张俊杰等[19]从夏黑葡萄表面也分离出埃希氏菌属-志贺氏菌属。本研究分离所得到的菌株2与考克氏菌(Kocuria)的遗传距离较近,且与菌株Kocuria indica相似度达到99.3%。张家晨[20]也从葡萄表面分离出考克氏菌。因此,可以确定从葡萄表面分离得到的2 株优势菌为大肠杆菌和考克氏菌。后续将分离得到的优势菌接种到葡萄表面,以测定所应用技术的杀菌效力。
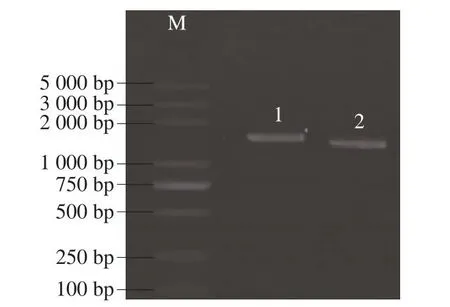
图2 葡萄优势菌16S rDNA基因序列PCR扩增电泳检测图谱Fig.2 Electrophoresis of PCR-amplified 16S rRNA sequence from dominant bacteria in grapes

图3 以16S rDNA基因序列为分子标记的2 株优势菌系统发育进化树Fig.3 Phylogenetic tree of two dominant bacteria based on their 16S rDNA sequences
2.2 气体ClO2的生成
图4A为112~672 mg NaClO2与5 g干冰反应3 h所测得的ClO2浓度;图4B为所计算的ClO2累积浓度。由图4可知,随着反应时间延长,每个NaClO2用量梯度所产生ClO2浓度和累积浓度逐步上升。反应3 h时,112、224、336、448、560、672 mg NaClO2与5 g干冰反应所测得的ClO2浓度分别为86、134、172、223、300、389 μL/L,所计算的ClO2累积浓度分别为131、228、266、378、481、599 μL/(L·h)。显然,随着NaClO2用量增加,ClO2浓度与累积浓度呈现线性上升趋势(图5)。之前的研究表明,气体ClO2处理依赖于大型发生器或处理器,无法灵活处理且操作难度较大[21]。相较之下,本研究所用方法适用于各种便携式处理容器,无需大型发生器且干冰与NaClO2易获取,可随时随地制备气体ClO2,从而提升了气体ClO2处理的灵活性。本研究所开发的气体ClO2处理方法具有安全、灵活便捷、操作简单及成本较低的特点。然而,由于气体ClO2浓度难以控制且具有漂白性,高浓度气体ClO2将导致样本漂白从而影响感官品质。为此,通过投入过量干冰以促进反应式(1)产生H+后,应控制施加的NaClO2用量以控制ClO2浓度与累积浓度防止样本漂白。

图4 NaClO2用量对ClO2浓度(A)与累积浓度(B)的影响Fig.4 Effect of NaClO2 dosage on concentration (A) and cumulative concentration (B) of ClO2
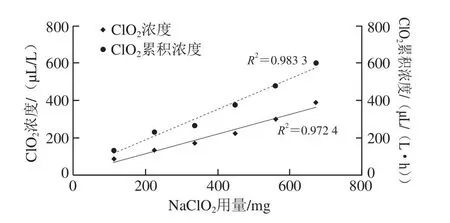
图5 ClO2浓度和累积浓度与NaClO2用量的关系Fig.5 Relationship between ClO2 concentration and accumulative concentration with the amount of NaClO2
2.3 气体ClO2的杀菌效果
由图6可知,随着NaClO2用量梯度上升(112~672 mg),ClO2累积浓度增加(131~599 μL/(L·h)),两株优势菌对数值减少量总体呈现显著上升趋势(P<0.05)。当气体ClO2累积浓度从131 μL/(L·h)提升至599 μL/(L·h)时,葡萄表皮上Escherichia菌落总数对数值减少量从1.6(lg(CFU/g))提升至3.5(lg(CFU/g)),Kocuria菌落总数对数值减少量从1.0(lg(CFU/g))提升至4.5(lg(CFU/g))。同时,当ClO2累积浓度从378 μL/(L·h)提升至599 μL/(L·h)时,Kocuria菌落总数对数减少量明显高于Escherichia,表明Kocuria更易受到ClO2气体的影响而失活。Chai等[13]利用NaClO2与HCl或FeCl3反应产生的气体ClO2处理接种于番茄的沙门氏菌、单核细胞增生李斯特菌及大肠杆菌。结果表明,大肠杆菌比沙门氏菌与单核细胞增生李斯特菌更易受到ClO2气体的影响而失活,这可能归因于接种细菌的不同生理状态、活性以及环境适应性等。Zhou Siyuan等[22]利用番茄呼吸释放的CO2和H2O与NaClO2反应产生ClO2气体处理接种沙门氏菌的番茄果实24 h,实现了每果约减少5(lg(CFU))沙门氏菌,相较之下,本研究所应用的气体ClO2处理方法在较短时间(3 h)内即可有效灭活果实表面的细菌,更适合处理果蔬。研究表明,气体ClO2具有极强的氧化性与穿透性,可以穿透微生物细胞膜,破坏细胞膜并氧化氨基酸,使微生物失活[23]。因此,利用该气体ClO2处理方法,设置适宜的处理时间和浓度,可有效灭活葡萄表面微生物,减少微生物负荷,防止果实腐败。
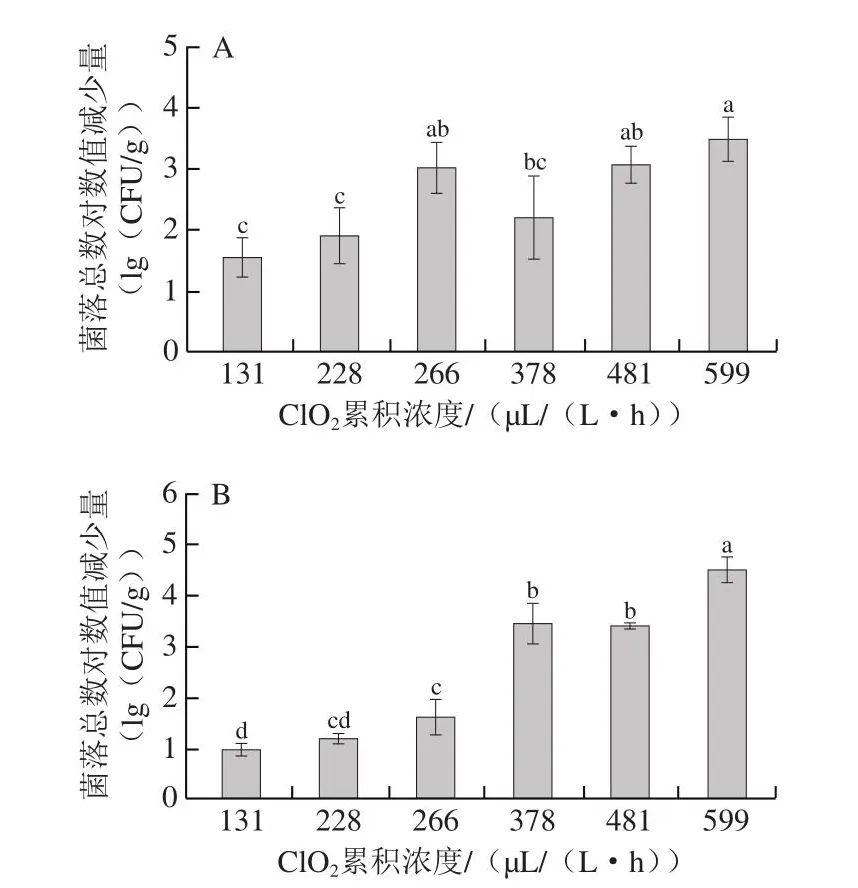
图6 气体ClO2对葡萄优势菌的杀菌效果Fig.6 Effect of ClO2 gas on inactivation of dominant bacteria from grapes
2.4 气体ClO2对葡萄品质的影响
果蔬色泽是最直接的感官评价指标。由表2可知,气体ClO2处理葡萄3 h后,S0、S1及S2组a*、b*与L*值并无显著性差异(P>0.05),但S1与S2组L*值较S0组略有增加,这可能归因于ClO2具有漂白性。总体而言,气体ClO2对葡萄色泽并无影响或影响较小。Mahmoud等[24]应用一种气体ClO2发生器制备0.5~5.0 mg/L气体ClO2以处理生菜,导致生菜L*值随ClO2浓度增加而增加,这与本实验结果相似。此外,随着贮藏时间延长,葡萄果实a*与L*值呈现逐渐降低趋势,这可能是由于葡萄褐变所致[25]。
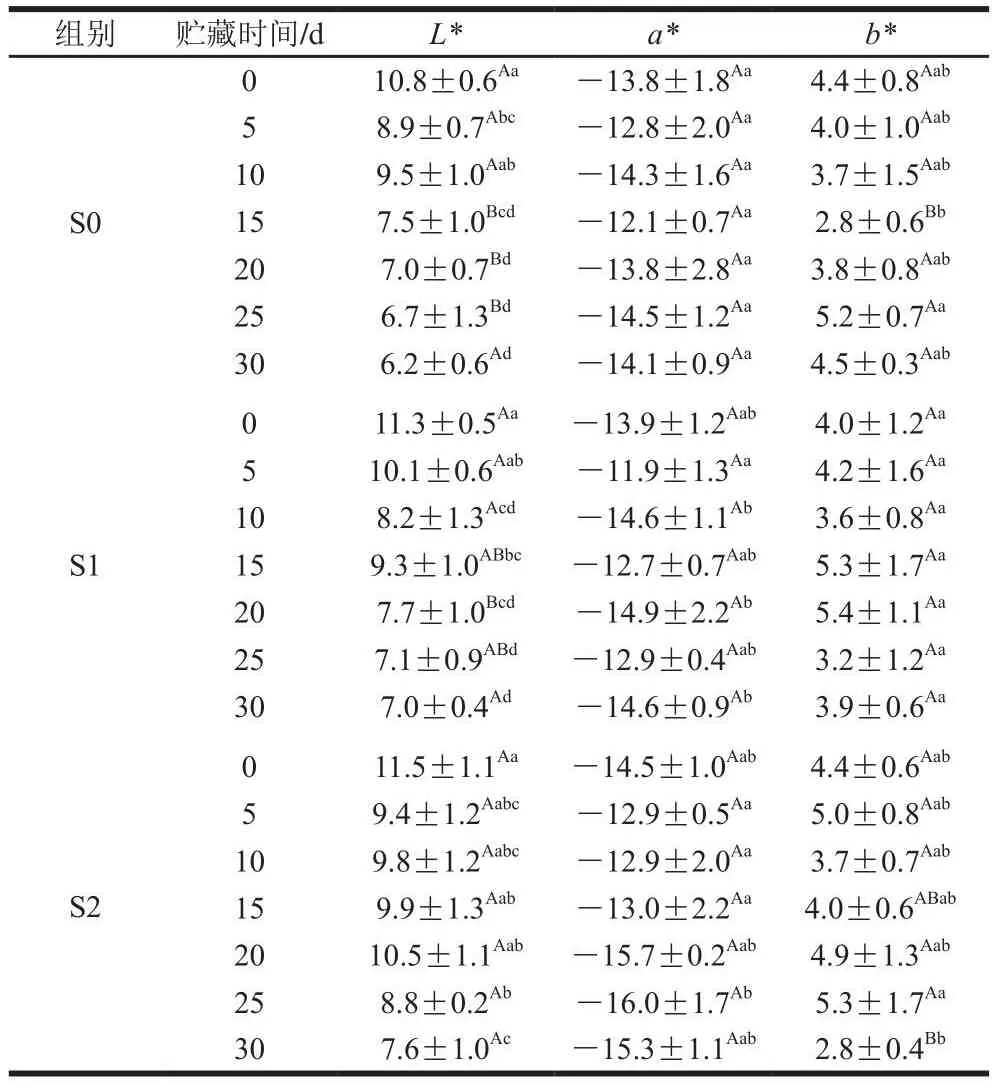
表2 气体ClO2处理下葡萄的色泽参数随贮藏时间的变化Table 2 Changes in color parameters of grapes treated with ClO2 gas during storage
在葡萄贮藏过程中,由于果实细胞壁降解与结构变化,导致果实硬度下降,出现软化现象,降低果实贮藏品质。由图7A可知,随着贮藏时间延长,葡萄硬度逐渐降低,S2组降低最为缓慢,直至30 d贮藏结束,S0、S1及S2组果实硬度分别为141、191 g及298 g。贮藏至15 d后,S2组果实硬度明显高于S0与S1组。池致超[26]以‘巨峰’葡萄为实验材料,评估气体ClO2的保鲜效果,其中高浓度(30 mg/m3)气体ClO2作用葡萄30 min抑制了葡萄硬度降低,本研究结果与之相似。ClO2气体可能通过抑制淀粉水解酶和果胶降解酶活性抑制细胞壁降解与结构变化,从而抑制果实软化[27]。此外,低累积浓度ClO2处理葡萄3 h对硬度影响不显著,表明抑制果实软化可能取决于气体ClO2浓度与作用时间。
由于葡萄贮藏时呼吸作用和蒸腾作用使水分丧失,可能导致果实表皮皱缩,影响果实感官品质[28]。由图7B可知,随着贮藏时间延长,葡萄质量损失率逐渐上升,但S2组上升最为缓慢,直至30 d贮藏结束,S0、S1及S2组果实质量损失率分别为5.15%、5.05%及3.96%。当贮藏25 d后,S2组果实质量损失率明显低于S0与S1组。研究表明,气体ClO2可抑制乙烯生成,促进气孔关闭,降低呼吸作用和蒸腾作用,防止水分的丧失,从而保持果实质量[29]。显然,本研究中经高浓度气体ClO2处理葡萄,其质量损失率明显降低,品质趋于良好。
TSS含量是评价果蔬新鲜度及风味的重要指标。由图7C可知,贮藏期间,葡萄TSS含量呈现先上升后下降趋势。贮藏至第5天,S0、S1及S2组TSS含量分别为16.6、15.7 °Brix及15.8 °Brix,比贮藏前略有增加,这可能是由于果实采收较早,在贮藏过程中其内部淀粉等有机物质仍可转化为还原糖等可溶性物质,而后由于自身呼吸作用使果实内部可溶性物质消耗。此外,第5天时S0组TSS含量明显高于S1与S2组,表明气体ClO2可能抑制葡萄果实内部有机质转化。贮藏20 d后,S2组TSS含量明显高于S0与S1组,这可能是由于气体ClO2抑制果实乙烯释放和呼吸作用,从而抑制可溶性物质的消耗。晋日亚[30]使用实验室装置产生高纯度ClO2气体处理葡萄,结果表明,大于30 mL/m3ClO2气体处理葡萄后,贮藏期间TSS含量得以有效保持,本研究结果与之相似。此外,许萍等[31]开发一款作用于葡萄的固体ClO2保鲜剂,其能显著抑制TSS含量的降低,有助于保持葡萄品质。
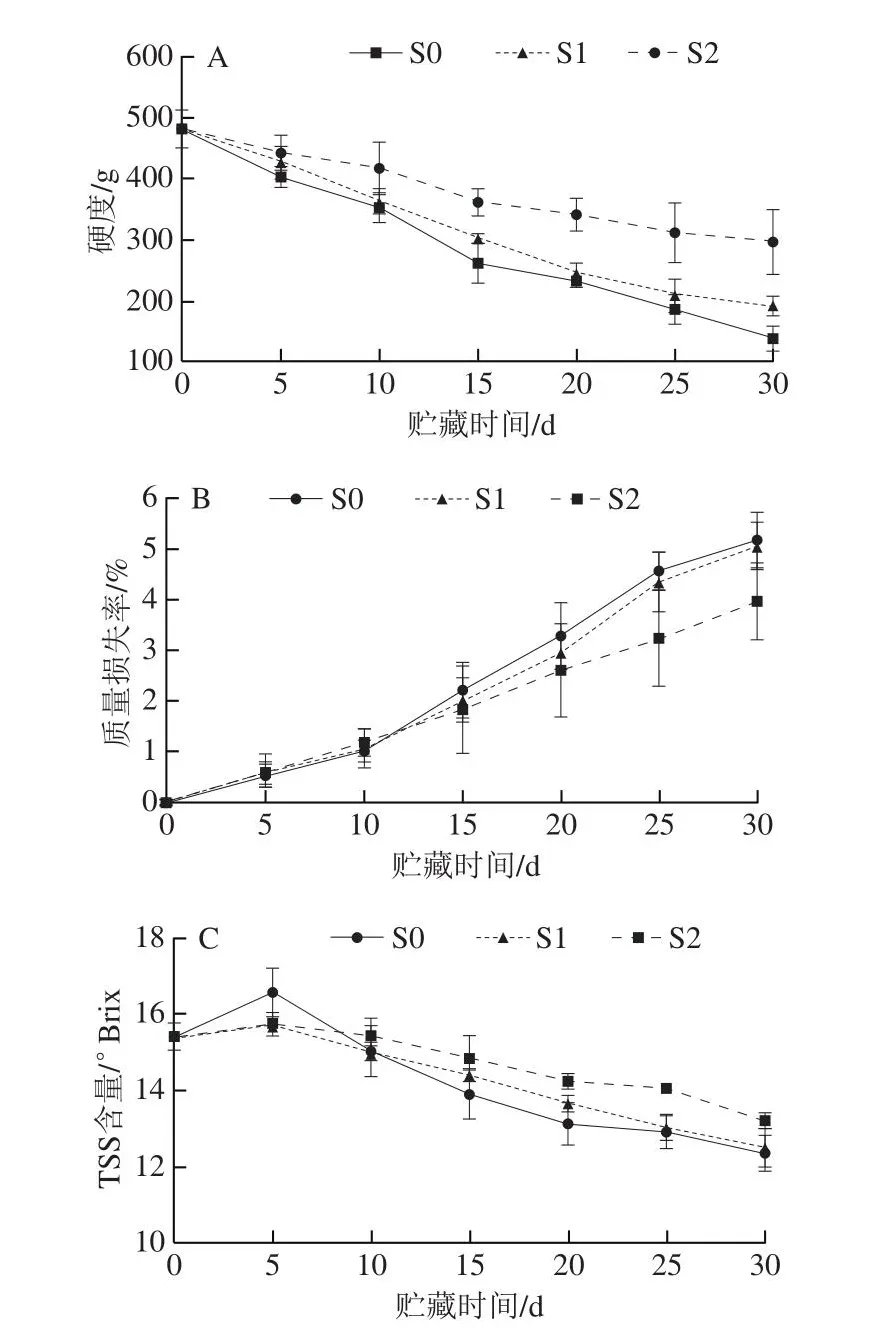
图7 气体ClO2处理葡萄贮藏期内品质的影响Fig.7 Effect of ClO2 gas on the quality of grapes during storage
2.5 ClO2残留量
ClO2气体处理水果后其表面易产生ClO2残留,而高浓度ClO2残留会危害人体健康[32]。由图8可知,气体ClO2处理葡萄3 h后,S1和S2组初始残留分别为0.19 mg/kg和0.31 mg/kg,随着贮藏时间延长残留量逐渐降低。Trinetta等[33]应用0.1~0.5 mg/L ClO2气体处理不同水果,并评估不同水果表面ClO2残留情况。结果表明,不同水果表面ClO2残留量(番茄(0.09 mg/kg)、柑橘(0.08 mg/kg)及苹果(0.28 mg/kg))普遍低于0.5 mg/kg,本研究结果与其相似。参照GB 5009.244—2016《食品安全国家标准 食品中二氧化氯的测定》要求ClO2处理水果和蔬菜,其表面残留量不得高于2 mg/kg,显然本研究结果远低于国家标准规定,进一步提升了该方法商品化应用潜质。在30 d贮藏期内,S2组残留量明显高于S1组,表明ClO2累积浓度增加,果实表面残留也将增加。此外,ClO2残留随贮藏时间延长略有降低,这也与Trinetta等[33]的研究结果相似。
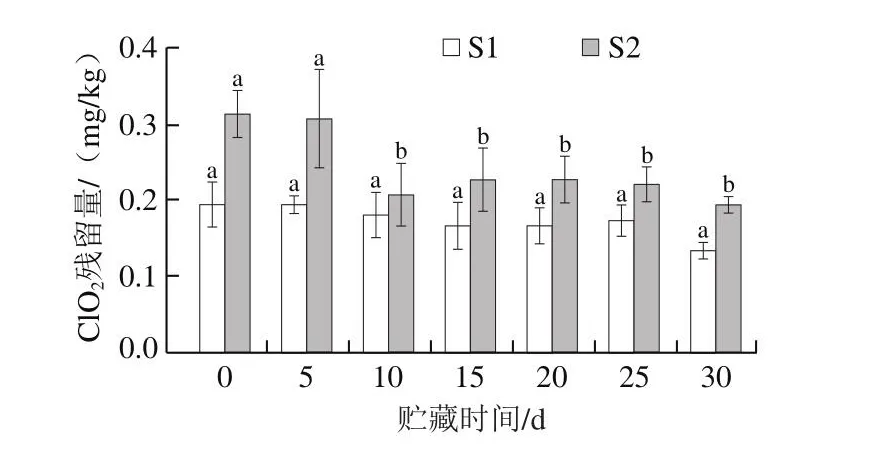
图8 葡萄贮藏期ClO2残留量Fig.8 Residual ClO2 on grapes during storage
3 结 论
本研究证明利用NaClO2与干冰间接反应制备ClO2气体的可行性,所开发的气体ClO2处理方法对葡萄具有良好的杀菌效果且有助于提升葡萄品质。当ClO2累积浓度从131 μL/(L·h)提升至599 μL/(L·h),Escherichia菌落总数对数值减少量从1.6(lg(CFU/g))升至3.5(lg(CFU/g)),Kocuria菌落总数对数值减少量从1.0(lg(CFU/g))升至4.5(lg(CFU/g))。此外,经气体ClO2处理葡萄后,其色泽并无明显变化,贮藏期内果实软化、质量损失及TSS含量损失得以有效抑制,且表面ClO2残留水平较低。未来的研究可进一步调整处理温度,在冷藏期间缓慢释放ClO2气体处理果蔬或者扩大处理容器体积和反应物用量,批量处理果蔬。此外,可进一步开展感官评定,并增加其他品质指标如可滴定酸、抗坏血酸含量等的测定,以提升该处理方法的应用性。
