南极磷虾油对小鼠力竭运动后骨骼肌质膜修复的影响
2023-04-06杨思梦石丽君
杨思梦,贺 庆,石丽君,吴 迎,*
(1.北京体育大学运动人体科学学院,北京 100084;2.艾兰得健康控股有限公司,上海 200120)
力竭运动或长时间耐力运动易诱发运动性骨骼肌损伤(exercise-induced muscle damage,EIMD)[1]。经常进行长距离、长时间力竭训练的运动员,如何加速其EIMD的消除是亟待解决的“痛点”问题。骨骼肌质膜损伤是EIMD的主要诱因,质膜损伤会导致骨骼肌细胞内血清肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)等的外流以及胞外离子、氧化剂的进入,甚至会引起细胞死亡[2]。力竭运动一方面产生机械刺激,破坏骨骼肌质膜完整;另一方面,高强度运动诱导的氧化应激和炎症反应将进一步损伤质膜,改变其通透性。力竭运动后骨骼肌质膜脂质流动性(lipid fluidity,LFU)改变是其“自修复”能力下降的重要诱因,因此,改善骨骼肌LFU是加速质膜损伤修复,促进运动性疲劳消除的重要途径,但目前有效的防治策略研究还不足。
营养策略是促进力竭运动后骨骼肌损伤恢复的重要手段,其中ω-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)作为运动营养补充剂,被认为可促进EIMD的恢复[3-6]。南极磷虾油(krill oil,KO)是一种新型海洋天然ω-3 PUFA来源,除富含二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosapentenoic acid,DHA)外,还含有磷脂、虾青素、类黄酮化合物、VA、VE、钙、铁、锌等多种生物活性物质。其在改善认知功能、降血脂、抑制肥胖、预防骨关节炎和抑制癌细胞生长等方面的作用已被证实[7-11]。因人体缺乏ω-3去饱和酶,EPA、DHA均无法在人体内合成,需要靠摄入食物补充。EPA、DHA与质膜密切相关,其可通过改变细胞膜成分,重塑膜结构[12],从而影响膜功能[13]。
骨骼肌LFU主要表现在膜脂的流动性和膜蛋白的移动两个方面[14]。膜脂分子呈液晶态排列,其流动性与膜脂的分子特性相关,脂肪酸链饱和程度越高,膜的流动性越大。力竭运动导致骨骼肌LFU显著下降,表现为肌质膜荧光偏振度(fluorescence polarization,FP)和细胞膜微黏度(microviscosity,η)的增加[15]。随着运动时间的延长,机体自由基产生增多,当自由基堆积过度时,会攻击肌质膜中PUFA,使肌质膜脂质过氧增多,诱导质膜η增加和弯曲刚性降低[16],从而降低LFU。
KO中EPA、DHA主要与磷脂结合,相较于甘油三酯结合的EPA、DHA,其生物利用度更高[17-18],可更有效地改善质膜重塑[19]。KO能否通过改变骨骼肌质膜中脂肪酸组成成分从而改变LFU,进而促进骨骼肌质膜修复,尚鲜见相关报道。本实验以补充KO对一次性力竭运动后小鼠恢复期骨骼肌质膜损伤修复的影响为切入点,探讨KO是否具有促进力竭运动恢复的作用及可能机制。
1 材料与方法
1.1 动物、材料与试剂
8 周龄健康雄性C57B/6J小鼠购于北京维通利华实验动物技术有限公司,使用许可证号:SYXK(京)2021-0053。
KO(产品名称:SUPERBA SC40TM;批号:12959A)由艾兰得健康控股有限公司提供(供应商:Aker阿克海洋生物公司),KO成分:ω-3多不饱和脂肪酸含量为23 g/100 g、 C20:5n-3(EPA)含量为12 g/100 g、C22:6n-3(DHA)含量为7 g/100 g、虾青素为863 μg/g。
CK、LDH试剂盒 南京建成生物工程公司;质量分数4%多聚甲醛、抗荧光衰减封片剂 北京索莱宝科技有限公司;麦胚凝集素(wheat germ agglutinin,WGA)、山羊血清、Triton、亚麻酸标品、EPA标品、DHA标品、脂肪酸甲醇混标、Hepes粉剂、1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH)、四氢呋喃、伊文氏蓝染液(evans blue dye,EBD) 美国Sigma公司;甲醇、甲基叔丁基醚(methyl tert-butyl ether,MTBE) 美国Honeywell公司。
1.2 仪器与设备
YLS-13A大小鼠抓力测定仪 安徽正华生物仪器设备有限公司;5424R高速低温冷冻离心机 德国Eppendorf公司;CM1850冰冻切片机、TCS SP8共聚焦显微镜 德国Leica显微系统公司;11028500多功能酶标仪 英国EnVision公司;Centrivap真空浓缩仪 美国Labconco公司;Ultimate3000超高效液相色谱系统美国Dionex公司;TSQ Quantiva Ultra三重四极杆质谱仪美国Thermo Fisher公司;BEH C18柱(2.1 mm×50 mm,1.7 μm)、Oasis HLB1cc固相萃取小柱 美国Waters公司;F8组织匀浆机 上海弗鲁克流体机械制造有限公司。
1.3 方法
1.3.1 动物实验设计
60 只8 周龄健康雄性C57B/6J小鼠,随机分为豆油对照(bean oil control,BOC)组、豆油运动(bean oil exercise,BOE)组、磷虾油对照(krill oil control,KOC)组和磷虾油运动(krill oil exercise,KOE)组,每组15 只。小鼠每天自由进食饮水,按照国家标准啮齿类动物固定混合饲料喂养。该实验获得北京体育大学运动科学实验伦理委员会批准(2020146A)。
营养干预方案:适应性饲养后,各组小鼠每日称体质量,KO组按照小鼠体质量灌胃4 周KO(剂量200 mg/(kgmb·d)),灌胃剂量参照Lu Chenyang等[20]实验方法;BO组则按照小鼠体质量灌胃等体积豆油。
运动组运动方案:采用动物跑台进行运动干预,使用一次性力竭运动方案。运动方案参照Rao Zhijian[21]和Ma Sihui[22]等实验方法。所有参与运动的小鼠进行3 d的适应性跑台训练:第1天以10 m/min的速率持续10 min;第2天以10 m/min的速率持续15 min;第3天以15 m/min的速率持续15 min。实验当天,运动组小鼠以10 m/min的速率持续15 min,15 m/min的速率持续15 min,20 m/min的速率持续15 min,最后以24 m/min的速率到力竭。力竭的标准:电击10 s小鼠仍不运动即视为小鼠已达到力竭状态。测定小鼠力竭运动时间,并在运动组中各选取6 只小鼠于力竭运动后0、2、6、24、48、72 h检测四肢抓力。
样本采集和处理:4 周营养干预后对照组进行称质量取材,而运动组于力竭运动后2 h进行称质量取材。对小鼠腹腔注射50 mg/kgmb巴比妥钠溶液,待小鼠进入麻醉状态后,眼眶取血并3 500 r/min离心15 min,此外,取小鼠左右股四头肌。其中,每组取2 只小鼠在取材前24 h每10 g体质量腹腔注射0.1 mL含有1 mg EBD的磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L、pH 7.4)。EBD小鼠取材时,将分离的股四头肌于冰上切取3 mm×3 mm×3 mm大小组织肌肉块,放置于提前准备的胶囊壳,使用OCT包埋剂进行组织包埋,随后投入用液氮预冷的异戊烷速冻。采集的样品均迅速投入液氮,随后保存于-80 ℃冰箱,待测。
1.3.2 小鼠血清相关指标测定
小鼠眼眶取血,血液样本于离心管,静置后高速低温冷冻离心机3 500 r/min离心15 min,取上层血清,利用CK、LDH试剂盒通过比色法检测血清CK、LDH活力。
1.3.3 EBD染色法检测肌质膜完整性
EBD染色后固定于OCT中的股四头肌在冰冻切片机内进行切片,厚度为0.008 μm,用质量分数4%多聚甲醛溶液将切片进行固定,每块组织滴加10 μL WGA(V(WGA)∶V(封闭液)=1∶400)避光孵育2 h,随后加入封片剂后进行封片。在共聚焦显微镜下进行观察,于相同参数下采集相同视野,使用Image Pro Plus软件对图像进行处理分析,统计各组EBD阳性纤维面积。
1.3.4 肌质膜脂肪酸成分检测
股四头肌质膜的制备:参照Dombrowski[23]和Makino[24]等的实验方法,将股四头肌样本以质量体积比为1∶9的比例加入50 mmol/L冰Hepes缓冲液后匀浆,匀浆液以3 000 r/min离心10 min后,取上清液;再以5 000 r/min离心10 min后,取上清液;再以14 000 r/min离心1 h后,弃上清液,取沉淀;用50 mmol/L的Hepes缓冲液吹打至悬浮颗粒状态,再以14 000 r/min离心1 h后,弃上清液,取沉淀,最后于1.2 mL 50 mmol/L的Hepes缓冲液中将沉淀吹打至悬浮颗粒状态,该溶液则为富含股四头肌质膜的膜溶液。
骨骼肌质膜脂类提取:充分离心骨骼肌质膜溶液后,弃上清液,保留沉淀,加入300 μL甲醇,加入研磨珠,利用组织匀浆机进行匀浆,12 000 r/min转速匀浆5 min,重复4 次。加入1 mL MTBE,涡旋后加入250 μL双蒸水进行分层。重复涡旋、静置,反复3 次,使其充分混匀。充分抽提溶液后,以12 000 r/min转速离心30 min,取上层有机溶剂上清液于离心管。在氮气的保护下吹干有机溶剂至透明薄膜状,吹干过程中氮气流速不能过大,避免液体溅出。将吹干的样品于-80 ℃冰箱贮藏,待测。
将脂肪酸标准品配制成质量浓度分别为0.1、0.5、2.5、25.0、250.0 mg/L的混合标准液。氮气吹干的样品重新溶解于二氯甲烷(CH2Cl2)与甲醇(MeOH)的混合溶液(V(CH2Cl2)∶V(MeOH)=1∶1)中,充分混匀,待测。
超高效液相色谱系统与Q-Exactive HF Orbitrap质谱仪耦合,该质谱仪配备了加热电喷雾电离探针。色谱条件:用CORTECS C18(100 mm×2.1 mm,2.7 μm)色谱柱分离脂质提取物。采用二元溶剂体系,流动相A为乙腈与纯水(60∶40,V/V),含10 mmol/L醋酸铵,流动相B为异丙醇与乙腈(90∶10,V/V)。梯度洗脱为18 min,流速为250 μL/min。线性梯度为0 min,30% B;2.5 min,30% B;8 min,50% B;10 min,98% B;15 min,98% B;15.1 min,30% B;18 min,30% B。柱温和样品温度分别保持在40 ℃和10 ℃。质谱分析条件:在负离子模式下采集质量范围为m/z150~600的数据。全扫描采集分辨率为70 000。离子源参数:喷雾电压为3 000 V;传输毛细管温度为320 ℃;干燥器温度为300 ℃;鞘气流量为35 Arb;辅助气体流量为10 Arb。用示踪仪根据精确质点内源性质谱数据库进行数据分析和脂质鉴定。结果分析和定量分析采用Xcalibur 3.0.63软件进行。
1.3.5 荧光偏振检测肌质膜脂质流动性
DPH荧光探针在水中呈顺式结构时几乎不发生荧光,而在疏水环境下如膜脂层呈反式构象,荧光增强1 000 倍,因此也被当作一种经典检测膜流动性的荧光探针。通过用DPH标记骨骼肌质膜,检测其FP、η、LFU,反应骨骼肌LFU。
荧光探针标记溶液的制备:称取4.6 mg DPH溶于粉末10 mL四氢呋喃,制备2×10-3mol/L DPH储备液,吸取250 μL储备液于25 mL容量瓶中,用0.01 mol/L PBS(pH 7.4)定容得到2×10-4mol/L的DPH工作液,现配现用。
取100 μL骨骼肌质膜样品与2.5 mL DPH工作液充分混匀,室温孵育30 min。使用加置偏振装置的多功能酶标仪检测肌质膜FP、η和LFU。偏振装置激发波长为355 nm,发射波长为535 nm,以无标记悬浊液荧光强度为校正值。按公式(1)~(3)分别计算样品的FP、η和LFU。
式中:I1为起偏器和检偏器光轴同为垂直方向时测得的荧光强度;I2为起偏器处于垂直方向、检偏器处于水平方向的荧光强度;G为荧光偏振校正因子;FPmax为常数0.5。
1.4 数据处理与分析
采用SPSS 22.0软件进行数据统计,数据以平均值±标准差表示。两组之间比较采用独立样本t检验;运动后不同时间点组间比较采用重复测量方差分析,事后检验采用简单效应最小显著差异法分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 补充KO对小鼠体质量的影响
如图1所示,KO和豆油补充期间,小鼠体质量随补充时间延长而增加,而KO组小鼠体质量在第3、4周显著低于BO组(P<0.05)。研究发现,KO可上调棕色脂肪细胞特异性基因的表达,使3T3-L1脂肪前体细胞出现棕色脂肪样表型[25],从而有效控制体质量。上述结果表明,4 周KO补充相较于豆油可有效控制体质量增长,KO结合长期运动可否更有效地改善体成分值得关注。
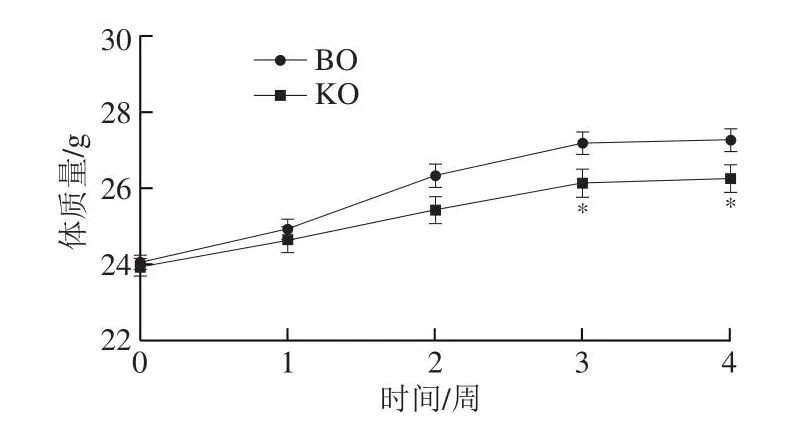
图1 补充KO后小鼠体质量变化Fig.1 Changes in body mass of mice after KO supplementation
2.2 补充KO对小鼠运动表现的影响
如图2所示,KO和豆油补充4 周后,KOE组小鼠力竭时间极显著高于BOE组(P<0.01);KOE组小鼠力竭运动后2、6、24 h和48 h四肢抓力显著高于BOE组(P<0.05)。上述结果表明,补充KO可以提升力竭运动表现并促进运动后骨骼肌功能恢复,其作用在力竭运动后2 h即有体现。虽然BOE组在72 h也可恢复到运动前水平,但补充KO可加速运动后骨骼肌功能恢复。

图2 补充KO对小鼠运动表现的影响Fig.2 Effect of KO supplementation on exercise performance in mice
2.3 补充KO对小鼠运动后骨骼肌损伤的影响
如图3A所示,相较于BOC组,BOE组血清CK活力极显著增加(P<0.01);而相较KOC组,KOE组血清CK活力无显著性差异(P>0.05);KOE组较BOE组血清CK活力极显著降低(P<0.01)。如图3B所示,BOE组较BOC组血清LDH活力显著增加(P<0.05);而KOE组较KOC组血清CK活力无显著性差异(P>0.05);KOE组血清LDH活力显著低于BOE组(P<0.05)。正常情况下,机体血清内CK活力和LDH活力水平较低,但在高强度或长时间运动下,骨骼肌细胞膜通透性增加,骨骼肌释放到血液中的CK和LDH增加,因此,血清CK活力和LDH活力与骨骼肌肉损伤密切相关,被认为是骨骼肌损伤标志物[26]。上述结果表明,KO补充可以降低力竭运动后恢复期血清CK、LDH活力,说明补充KO促进了小鼠力竭运动诱导的骨骼肌损伤的恢复。
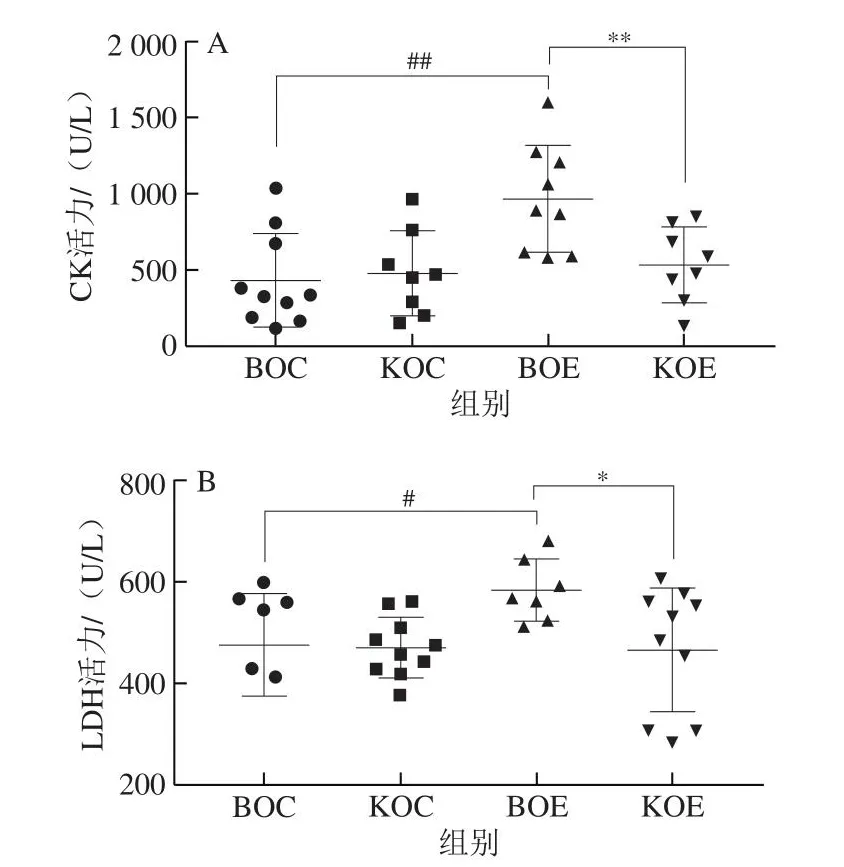
图3 补充KO对小鼠骨骼肌标志物的影响Fig.3 Effect of KO supplementation on skeletal muscle markers in mice
2.4 补充KO对小鼠运动后肌质膜完整性的影响
如图4和表1所示,BOE组较BOC组,骨骼肌EBD阳性纤维面积显著增加(P<0.05);而KOE组较KOC组,骨骼肌EBD阳性纤维面积无显著性差异(P>0.05);KOE组骨骼肌EBD阳性纤维面积显著低于BOE组(P<0.05)。运动诱导骨骼肌质膜损伤,EBD染料进入骨骼肌细胞增多。上述结果表明,补充KO改善了由于力竭运动诱导的质膜完整性破坏,促进了运动后骨骼肌质膜修复。
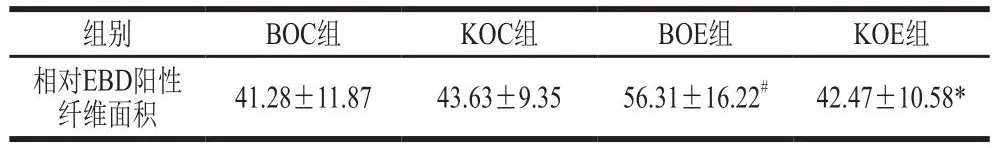
表1 补充KO对小鼠骨骼肌EBD阳性纤维面积的影响Table 1 Effect of KO supplementation on the area of EBD positive skeletal muscles in mice
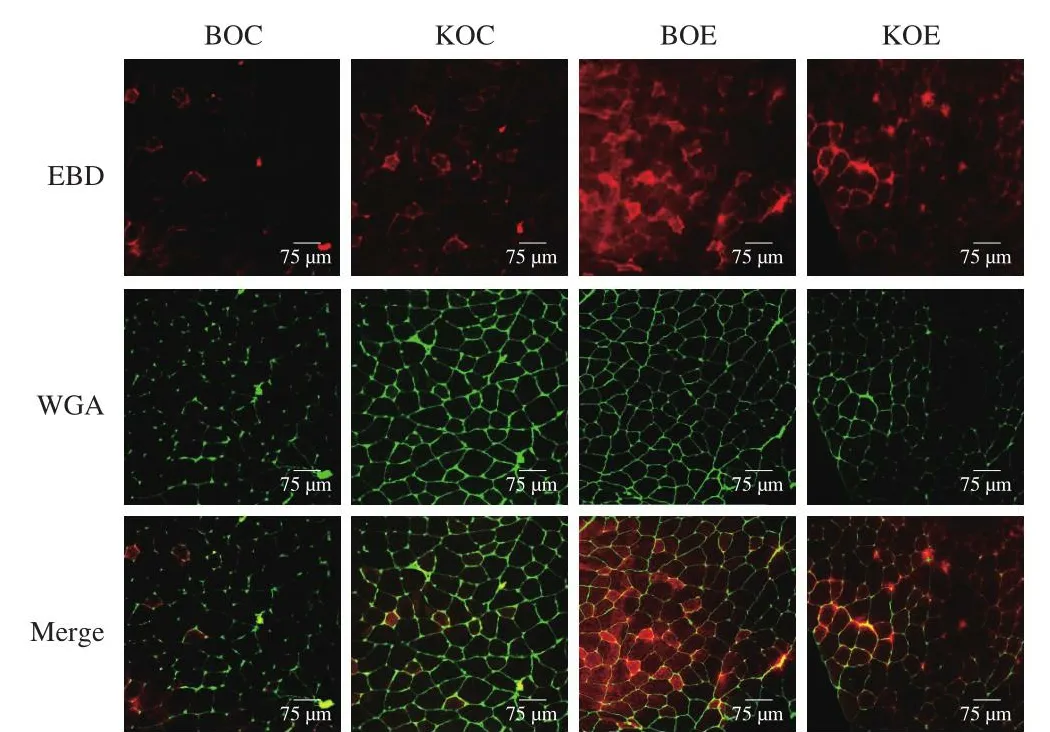
图4 股四头肌EBD阳性纤维面积Fig.4 Area of EBD positive quadriceps femoris
2.5 补充KO对小鼠肌质膜脂肪酸成分的影响
如表2所示,BOE组较BOC组,骨骼肌质膜不饱和脂肪酸C18:3显著降低(P<0.05);KOE组较KOC组,骨骼肌质膜饱和脂肪酸C9:0(P<0.01)、C10:0(P<0.01)、C12:0(P<0.05)、C18:0(P<0.05)、C20:0(P<0.05)和不饱和脂肪酸C20:2(P<0.05)质量浓度均显著降低;KOE组骨骼肌质膜不饱和脂肪酸C22:5、C22:6和C24:5质量浓度显著高于BOE组(P<0.05)。上述结果表明,力竭运动导致骨骼肌质膜脂肪酸丢失。这说明KO补充保护了骨骼肌质膜由于力竭运动引起的质膜脂肪酸丢失,有利于运动后质膜重塑,从而促进骨骼肌功能恢复。
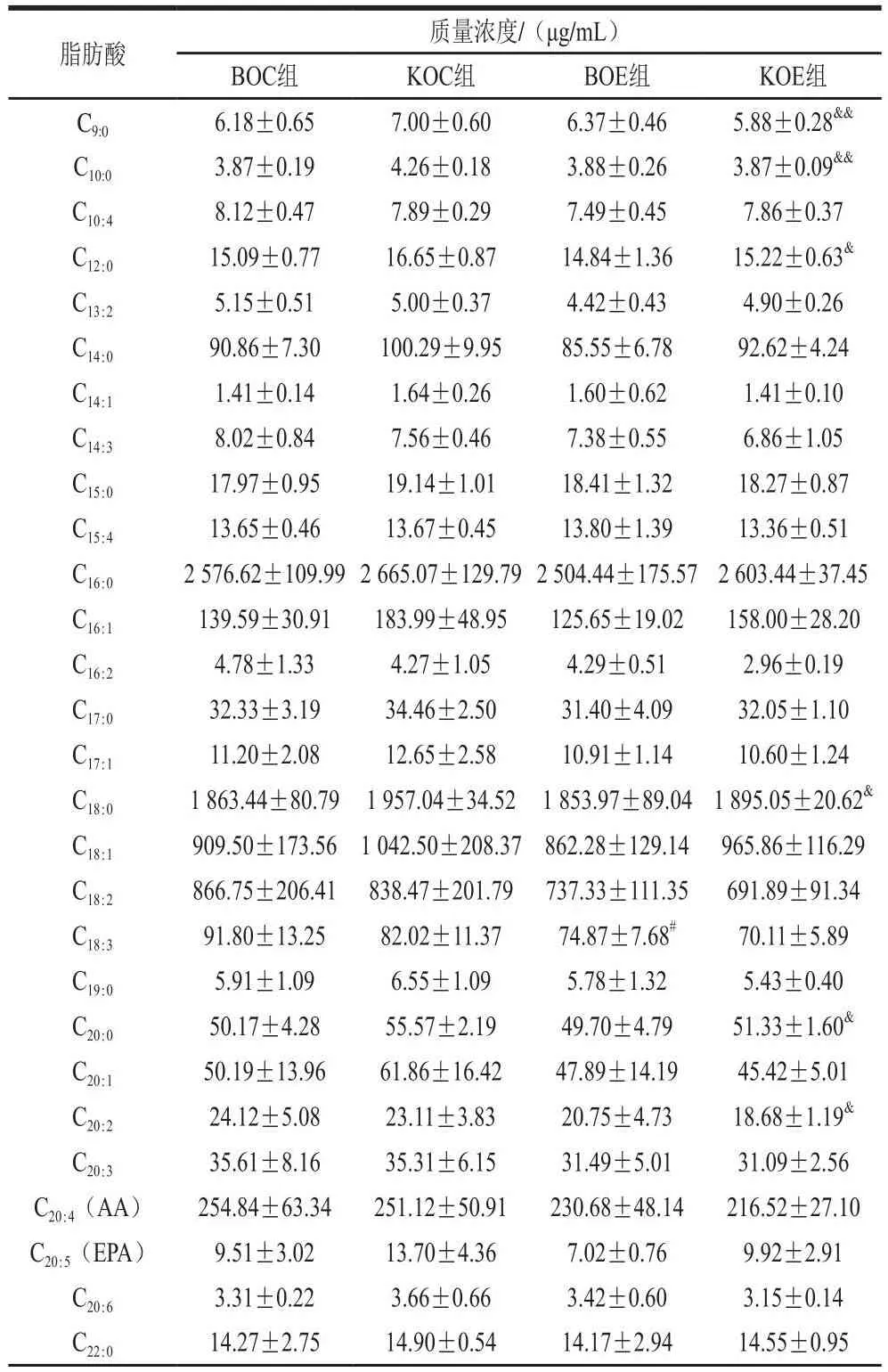
表2 补充KO对小鼠骨骼肌质膜脂肪酸成分的影响Table 2 Effect of KO supplementation on fatty acid composition of skeletal muscle plasma membrane in mice
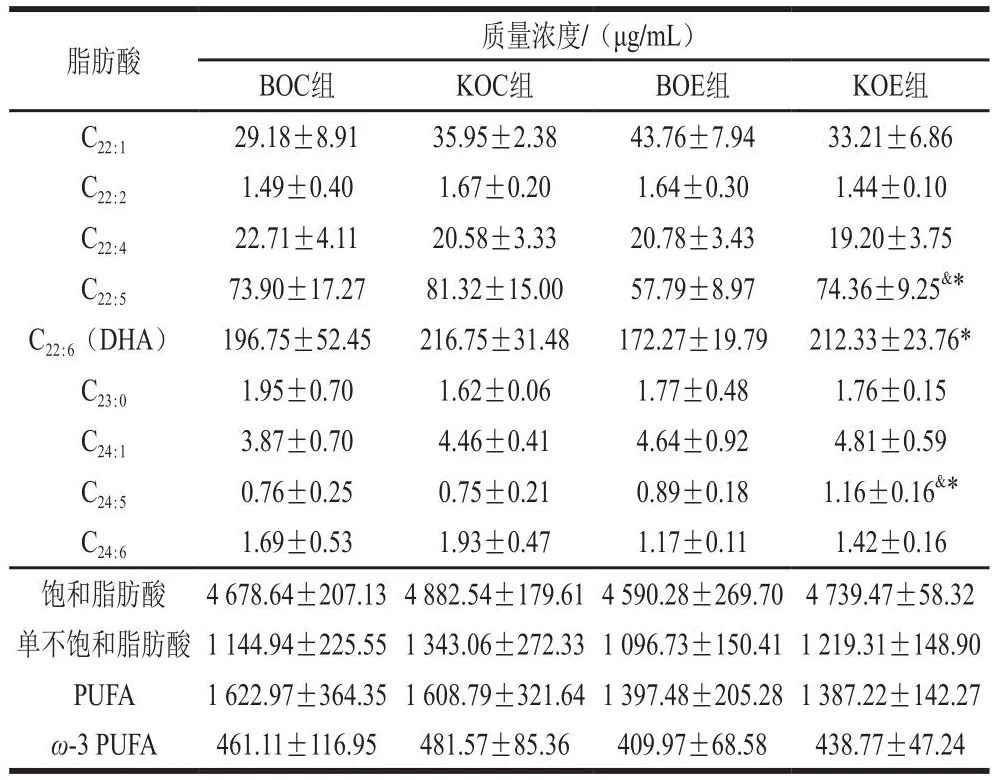
续表2
2.6 补充KO对小鼠LFU的影响
如图5A所示,BOE组较BOC组,骨骼肌质膜FP显著增加(P<0.05);而KOE组较KOC组,骨骼肌质膜FP无显著性差异(P>0.05);KOE组骨骼肌质膜FP极显著低于BOE组(P<0.01)。如图5B所示,BOE组较BOC组,骨骼肌质膜η显著增加(P<0.05);而KOE组较KOC组,骨骼肌质膜η无显著性差异(P>0.05);KOE组骨骼肌质膜η极显著低于BOE组(P<0.01)。如图5C所示,BOE组较BOC组,骨骼肌LFU显著降低(P<0.05);而KOE组较KOC组,骨骼肌LFU无显著性差异(P>0.05);KOE组骨骼肌LFU极显著高于BOE组(P<0.01)。结果显示,力竭运动导致小鼠骨骼肌LFU降低,而KO补充缓解了力竭运动诱导的骨骼肌LFU降低,从而加速骨骼肌的恢复进程。
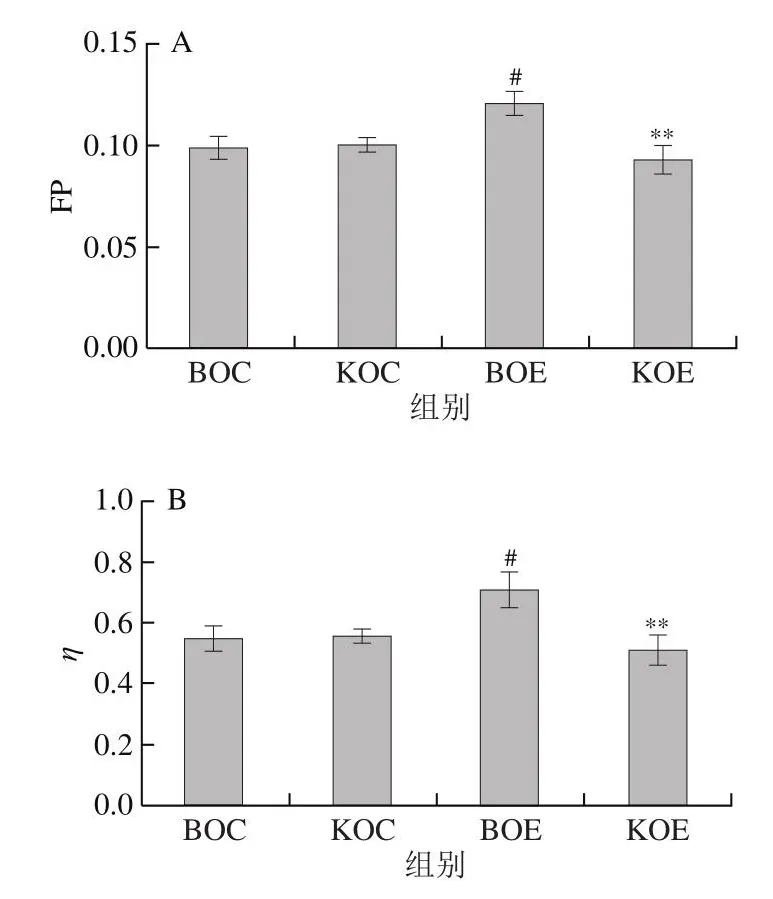
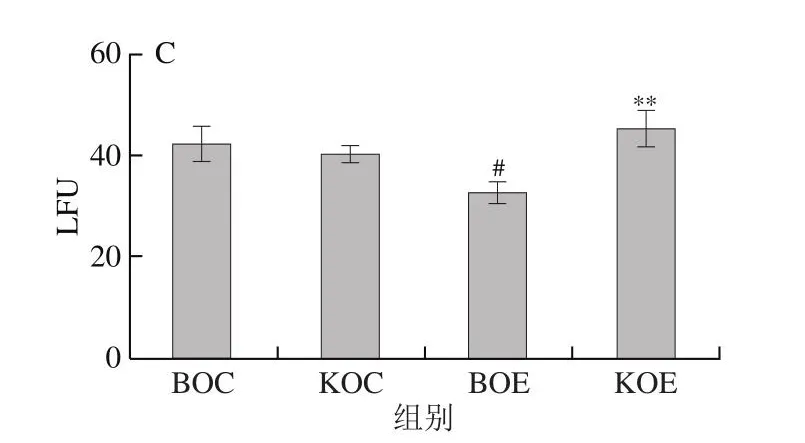
图5 补充KO对小鼠骨骼肌质膜脂质流动性的影响Fig.5 Effect of KO supplementation on the lipid fluidity of skeletal muscle membrane in mice
3 讨 论
近期研究发现,KO在促进运动性疲劳恢复方面具有广泛的应用前景[27-29]。Storsve等[29]研究发现,赛前补充5 周的KO(4 g/d)可有效提高铁人三项运动员比赛前后血清游离胆碱和胆碱代谢产物二甲基甘氨酸浓度,但并没有探究其对运动表现的影响。郑琳等[30]也发现,小鼠补充4 周50 mg/(kgmb·d)和200 mg/(kgmb·d) KO,均可提高小鼠运动后1 h肌糖原、肝糖原水平,降低小鼠运动后1 h血清乳酸水平,缓解运动性疲劳。
EIMD的出现伴随着肌肉功能受损,其中肌力的减退是主要特征[31]。本研究图2结果显示,力竭运动显著降低了BOE组小鼠运动后0、2、6、24 h和48 h的四肢抓力(P<0.05),运动后72 h才恢复到基线水平;而KOE组小鼠力竭运动后2、6、24 h和48 h四肢抓力均显著高于BOE组(P<0.05)。这说明补充KO促进了力竭运动后骨骼肌功能恢复,这种促恢复效果在力竭运动后2 h已体现,并持续到运动后72 h。多项研究表明,急性补充(运动后即刻补充)和长期补充ω-3 PUFA均可改善运动后肌肉功能的恢复。Jakeman等[32]发现,急性补充ω-3 PUFA(剂量为0.1 g/kgmb)可改善受试者大强度运动后恢复期机体蹲跳表现。长期补充ω-3 PUFA(16、21、26 d和30 d)也对大强度运动后骨骼肌功能恢复有促进作用(肌力、灵敏性等)[3-4,6,33]。KO补充一方面可通过促进糖原储备,提高机体对运动疲劳的耐受力[29];另一方面,KO还通过上调脂质氧化酶和下调脂质合成基因表达[34],促进脂联素的表达[35],改善糖代谢和脂肪酸氧化。
本研究发现,KO补充可降低力竭运动后恢复期血清CK、LDH活力(图3),减少由力竭运动导致的EBD染料入侵骨骼肌细胞(图4),这说明KO补充减轻了力竭运动诱导的质膜损伤,促进了骨骼肌质膜修复。Tartibian等[3]对青年男性进行为期30 dω-3 PUFA补充干预,并在营养干预后对受试者进行一次性大强度离心运动干预,结果发现,ω-3 PUFA补充降低了运动后机体血清CK活力。Helge等[36]发现,高脂膳食4 周后,大鼠肌质膜中ω-3 PUFA的总比例显著增加,该研究认为高脂饮食中ω-3 PUFA的补充可增加大鼠肌细胞膜的不饱和脂质含量,进而维持细胞功能[37],从而改善由于外界刺激破坏质膜导致的细胞功能紊乱。与甘油三酯结合的DHA、EPA相比,KO中与磷脂结合的DHA、EPA生物利用度更高[17-18],可更有效地改善质膜重塑[19],这可能是KO补充促进运动后质膜损伤修复的重要原因。
本研究发现,KO补充增加了力竭运动后骨骼肌质膜C22:5、C22:6(DHA)和C24:5含量,而对EPA含量没有影响(表2)。KO补充维持骨骼肌质膜PUFA成分进而维持质膜的稳定性,这可能与ω-3 PUFA改善质膜重塑相关。质膜是细胞在细胞质和细胞外界空间之间形成物理屏障,可通过一系列自我修复维持细胞的稳态,当外界刺激导致细胞质膜损伤时,细胞质膜需要自我修复以避免细胞死亡。脂肪酸作为质膜磷脂双分子层的重要组成成分,具有调节生物膜物理特性的作用。磷脂双分子层中脂肪酸的不饱和链长度、不饱和程度、双键位置和羟基化程度都会影响质膜物理结构和功能(维持质膜完整性)[38]。质膜动力学研究发现,磷脂膜中的PUFA成分的结构由于其顺式双键形成了一个更趋于弯曲的几何构型[39],这一曲率减少了相邻磷脂膜的脂肪酸链之间的分子相互作用,PUFA成分还可增加分子扩散和旋转的速度[13],两者共同增加了细胞膜的流动性。另一方面,磷脂膜中的PUFA成分还会降低其脂质厚度,并在脂质的几何排列上产生小的缺陷,这些不同深度的缺陷有利于某些具有两亲性α-螺旋构象的蛋白质的结合和插入[40],影响膜修复相关蛋白的信号转导,这可能也是KO促进运动后骨骼肌质膜修复的另一个原因。本研究发现,力竭运动导致小鼠骨骼肌LFU降低,补充KO改善了力竭运动引起的骨骼肌质LFU的降低(图5)。质膜修复模式主要包括形成“膜补丁”“修复帽”[41],内吞、细胞外出芽发生,及改善膜流动性等[42]。而补充KO可通过增加力竭运动后骨骼肌质膜PUFA成分,影响膜脂动力学结构和功能[43],促进骨骼肌质膜修复。
综上所述,经4 周200 mg/(kgmb·d)的KO补充可显著提升小鼠耐力运动表现,提高力竭运动后骨骼肌质膜C22:5、C22:6和C24:5含量及LFU,促进骨骼肌质膜修复,从而提升运动后骨骼肌功能恢复。补充KO除影响肌质膜流动性等物理特性外,还可能通过影响质膜修复相关蛋白和修复信号通路等促进骨骼肌损伤修复,有待进一步深入研究。
