山楂原花青素下调Traf6/NF-κB信号通路诱导肝癌细胞凋亡
2023-04-06尹淑英高丽霞石塔拉
宓 伟,尹淑英,高丽霞,李 宁,石塔拉
(1.滨州医学院公共卫生与管理学院,山东 烟台 264003;2.滨州医学院附属医院肿瘤科,山东 滨州 256603)
肝细胞性肝癌(hepatocellular carcioma,HCC)起源于肝脏的上皮或间叶组织,具有易发生早期转移和播散、恶性程度高的特点,传统的化疗和放疗未见生存获益[1-3]。我国每年约11万人死于肝癌,占全世界肝癌死亡人数的45%[4]。HCC是受环境因素和饮食因素双重影响的发病过程复杂的恶性肿瘤,目前确切的分子发病机制尚不完全清楚。随着分子生物学的深入研究和发展,在HCC的发生发展过程中,发现有多条分子信号通路,如磷脂酰肌醇3-激酶/丝苏氨酸蛋白激酶/哺乳动物雷帕霉素靶蛋白(phosphattidylinositol 3-kinase/serine threonine protein kinase/mammalian target of rapamycin,PI3K/Akt/mTOR)、沉默调节蛋白6/核转录因子-κB(recombinant sirtuin 6/nuclear factor kappa-B,SIRT6/NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、血管内皮生长因子受体和血小板衍生生长因子受体等信号通路,其参与肝癌细胞的增殖、分化、侵袭和转移[5-14]。
山楂原花青素(hawthorn procyanidins,HPC)是一类由表儿茶素和儿茶素缩合而成的一种比来源于葡萄籽高聚体原花青素生物活性高的低聚体多酚化合物,具有抗氧化、抗肿瘤、抗微生物等生理活性[15-18]。肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,Traf6)是一种衔接蛋白家族成员,可以介导肿瘤坏死因子(tumor necrosis factor,TNF)受体、白细胞介素1(interleukin 1,IL-1)受体、NF-κB等信号通路[19-24]。NF-κB介导黏附分子、趋化因子和细胞因子等介质的转录。在静息状态下,NF-κB抑制蛋白(inhibitory subunit of NF-κB,IκB)与NF-κB p65结合在细胞浆中调节细胞的正常生理功能,当癌症刺激时,IκB激酶复合体磷酸化IκB被蛋白酶降解,NF-κB p65转运到细胞核与特定的DNA序列结合,抑制细胞凋亡基因Bax、Caspase-3的表达,加速癌细胞增殖[25-28]。但HPC能否下调Traf6/NF-κB信号通路诱导肝癌细胞凋亡的分子机制尚鲜见报道。本研究旨在探讨HPC靶向作用于Traf6/NF-κB信号通路诱导肝癌细胞凋亡的效果,为肝细胞肝癌的分子靶向治疗提供实验基础和新的途径,亦为开发食品中的抗肿瘤成分提供实验依据。
1 材料与方法
1.1 材料与试剂
肝癌细胞株(Huh-7)购于上海康郎科学生物有限公司。
HPC(纯度≥99%)(批号:20200418) 杭州绿盛生物技术有限公司;杜氏高糖培养基(Dulbecco’s modified Eagle medium,DMEM) 美国Life Technology公司;胎牛血清(fatal bovine serum,FBS)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Gbico公司;细胞计数(cell counting kit-8,CCK-8)试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)、RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)试剂盒 武汉优尔生科技股份有限公司;BCA蛋白浓度测定试剂盒 上海碧云天生物技术研究所;Super ECL Plus发光液 北京普利莱基因科技有限公司;Cas9-Puro慢病毒 广州源井生物科技有限公司;嘌呤霉素 上海赛默飞世尔科技有限公司;β-actin多克隆抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体 武汉恒生科技生物公司;Traf6、NF-κB p65、Bax和Caspase-3一抗、二抗羊抗兔免疫球蛋白(immunoglobulin,Ig)G英国Abcam公司;总RNA提取试剂盒、SYBR green试剂盒日本Takara Bio公司;Annexin V-FITC/PI凋亡检测试剂盒美国Caltag公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CO2恒温培养箱 德国Heraeus公司;荧光实时定量聚合酶链式反应仪 澳大利亚Corbett公司;Varioskan LUX多功能酶标仪 美国赛默飞世尔科技有限公司;TDL-40B台式离心机、DYY-12型凝胶电泳仪 北京六一仪器厂;FACSCalibur流式细胞仪 美国Becton Dickinson公司;凝胶成像分析系统 美国Alpha Innotech公司。
1.3 方法
1.3.1 Huh-7细胞传代培养
Huh-7细胞培养于含10% FBS、链霉素和青霉素各100 U/mL的DMEM培养基中培养过夜,然后弃去培养上清液,用10%磷酸盐缓冲液润洗细胞1~2 次,加2 mL 1 mol/L EDTA溶液于培养瓶中,置于37 ℃培养箱中消化1~2 min,待细胞密度达80%进行传代。
1.3.2 CCK-8检测HPC处理后Huh-7细胞增殖情况
取一定量的HPC以甲醇为溶剂配制质量浓度分别为0、5、10、20、40、80 μg/mL的系列溶液[29],用DMEM培养基将Huh-7细胞制成细胞悬液并调整细胞浓度为1×109个/L,以每孔100 µL接种于96 孔板中,待细胞贴壁生长到50%~60%时后,加入不同质量浓度的HPC,设10 个平行孔,继续置于培养箱培养24 h后弃去旧培养基,每孔加入CCK-8试剂10 µL,继续培养2 h后振荡1 min,在450 nm波长处测定各孔吸光度A。细胞存活率按下式[30]计算。
1.3.3 Huh-7细胞Traf6的转染
在慢病毒介导下将Traf6重组质粒转染Huh-7细胞,然后在培养基中加入嘌呤霉素,对稳定转染的Huh-7细胞株进行筛选,获得过表达Traf6的Huh-7细胞,并检测稳定转染的Huh-7细胞中Traf6的表达情况。
1.3.4 实时定量聚合酶链反应检测Huh-7细胞中Traf6、NF-κB p65、Bax和Caspase-3mRNA表达水平
当Huh-7细胞处于对数生长期时,以0.5×106个/孔接种于6 孔板中,细胞贴壁生长到50%~60%后,弃去旧培养基,HPC细胞组和HPC+Traf6过表达组加入2 mL 40 μg/mL HPC处理细胞,空白对照组和Traf6过表达组用等体积DMSO处理,在37 ℃、饱和湿度、5% CO2恒温培养箱中继续培养24 h。按试剂盒说明提取Huh-7细胞总RNA,采用SYBR green试剂盒进行荧光定量检测,按试剂盒说明操作,并选择GAPDH作为内参,通过熔解曲线分析产物的特异性。引物序列见表1。
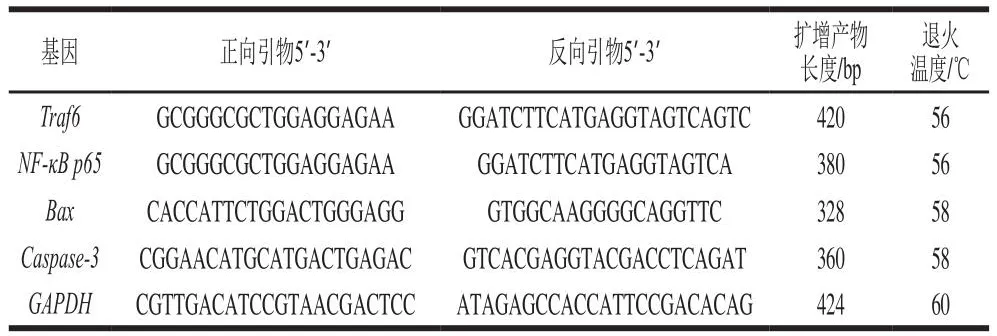
表1 引物序列Table 1 List of primer sequences used this study
1.3.5 免疫印迹法检测Huh-7细胞中Traf6、NF-κB p65、Bax和Caspase-3蛋白表达水平
实验分组同1.3.4节。收集HPC处理后的Huh-7细胞和Traf6过表达的Huh-7细胞,用BCA法检测RIPA裂解液提取的蛋白质量浓度。在提取蛋白液中加入质量分数6% SDS缓冲液,沸水变性5 min,SDS-PAGE后湿移至聚偏二氟乙烯膜上,37 ℃封闭2 h,依次加入羊抗兔Traf6、NF-κB p65、Bax、Caspase-3抗体和β-actin多克隆抗体,4 ℃过夜,滴加ECL发光试剂进行检测,采用Quanlity One软件扫描各条带,获取目的蛋白灰度[31]。
1.3.6 Annexin V-FITC/PI 检测Huh-7细胞凋亡情况
实验分组同1.3.4节。制备Huh-7细胞悬液,浓度为1×106个/L,每孔100 µL接种于6 孔板,培养过夜,细胞贴壁后在HPC细胞组和HPC+Traf6过表达组中加入质量浓度为40 μg/mL HPC 2 mL,空白对照组和Traf6过表达组加入等体积DMSO,继续培养48 h后收集细胞样品检测,按Annexin V-FITC/PI试剂盒说明书利用流式细胞仪上机检测。
1.4 数据处理与分析
2 结果与分析
2.1 HPC对Huh-7细胞增殖的抑制作用
如图1所示,当HPC质量浓度小于10 μg/mL时对Huh-7细胞的增殖无明显抑制作用,0、5、10 μg/mL HPC处理组相对存活率分别为100%、98%、96%。而当HPC质量浓度大于20 μg/mL时对Huh-7细胞的增殖有明显的抑制作用,20、40、80 μg/mL HPC处理组相对存活率分别为84%、75%、62%,且随HPC质量浓度升高Huh-7细胞的相对存活率显著降低(P<0.05)。
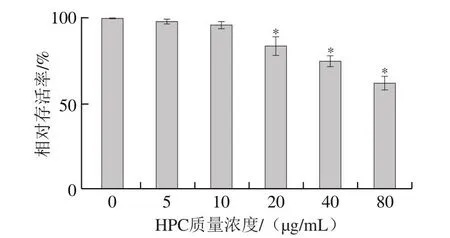
图1 HPC对Huh-7细胞增殖的影响(±s,n=6)Fig.1 Effect of HPC on the proliferation of Huh-7 cells (x± s, n = 6)
2.2 Traf6过表达影响HPC对Huh-7细胞增殖的抑制作用
如图2所示,实验中采用质量浓度为40 μg/mL的HPC处理细胞,结果显示HPC组中Huh-7细胞的相对存活率为73%,显著低于空白对照组相对存活率(100%)(P<0.05);HPC+Traf6过表达细胞组中Huh-7细胞的相对存活率为82%,显著高于HPC细胞组相对存活率(73%)(P<0.05)。
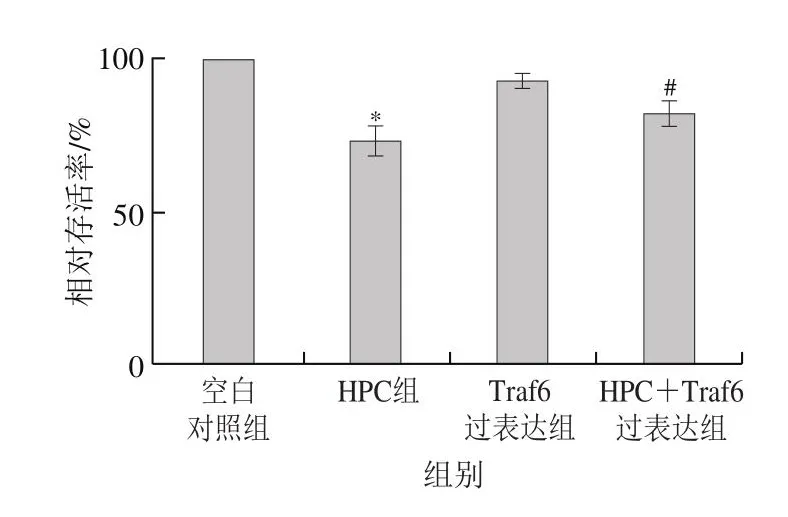
图2 Traf6过表达对HPC抑制Huh-7细胞增殖的影响(±s,n=6)Fig.2 Effect of Traf6 overexpression on inhibitory effect of HPC on the proliferation of Huh-7 cells (x ± s, n = 6)
2.3 HPC对Huh-7细胞中Traf6、NF-κB p65、Bax和Caspase-3 mRNA表达的影响
如图3所示,HPC处理的Huh-7细胞中Traf6和NF-κB p65mRNA表达水平显著低于空白对照组(P<0.05),Bax和Caspase-3的mRNA表达水平显著高于空白对照组(P<0.05)。HPC+Traf6过表达细胞组中Traf6和NF-κB p65mRNA表达水平显著低于Traf6过表达细胞组(P<0.05),Bax和Caspase-3的mRNA表达水平显著高于Traf6过表达细胞组(P<0.05)。
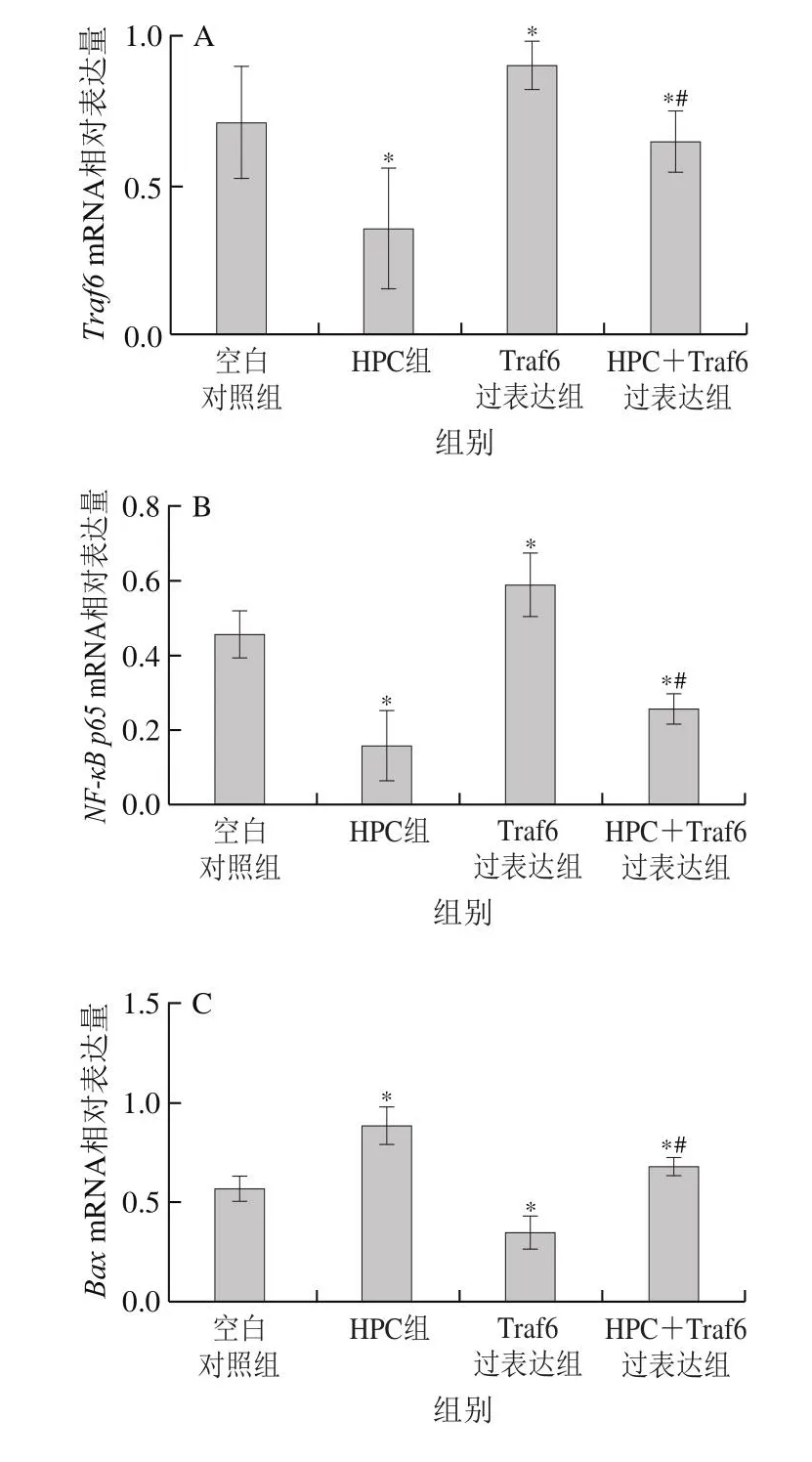
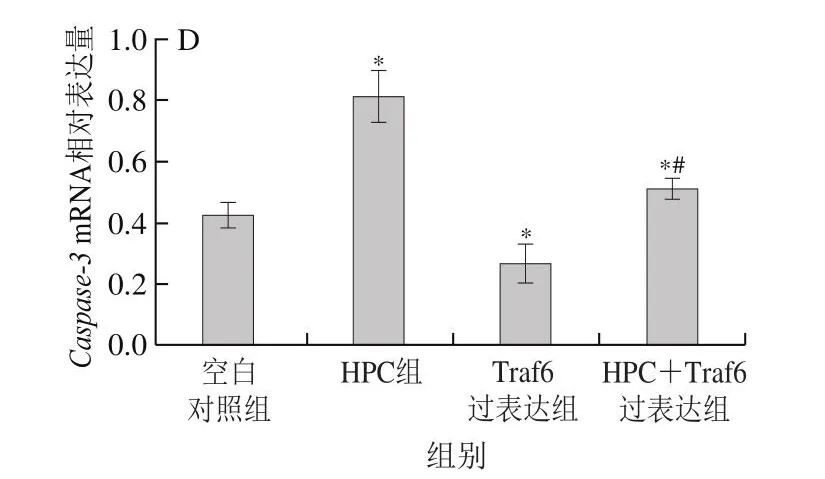
图3 HPC对Traf6、NF-κB p65、Bax和Caspase-3 mRNA表达的影响(±s,n=6)Fig.3 Effect of HPC on the mRNA expression of Traf6, NF-κB p65,Bax and Caspase-3 (x± s, n = 6)
2.4 HPC对Huh-7细胞中Traf6、NF-κB p65、Bax和Caspase-3蛋白表达的影响
如图4所示,HPC组中Traf6和NF-κB p65蛋白表达水平显著低于空白对照组(P<0.05),Bax和Caspase-3的蛋白表达水平显著高于空白对照组(P<0.05)。HPC+Traf6过表达细胞组中Traf6和NF-κB p65的蛋白表达水平显著低于Traf6过表达细胞组(P<0.05),Bax和Caspase-3的蛋白表达水平显著高于Traf6过表达细胞组(P<0.05)。
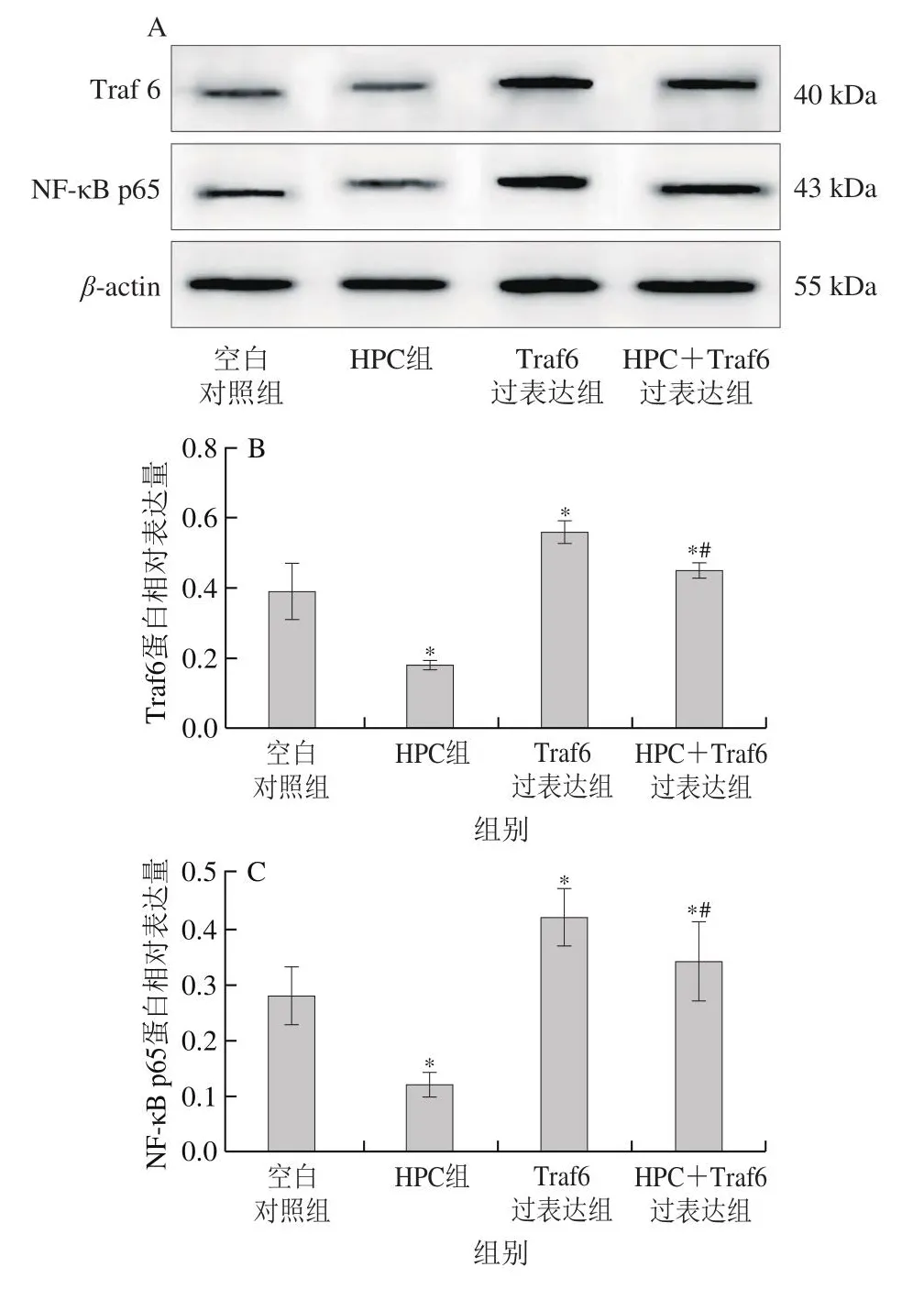
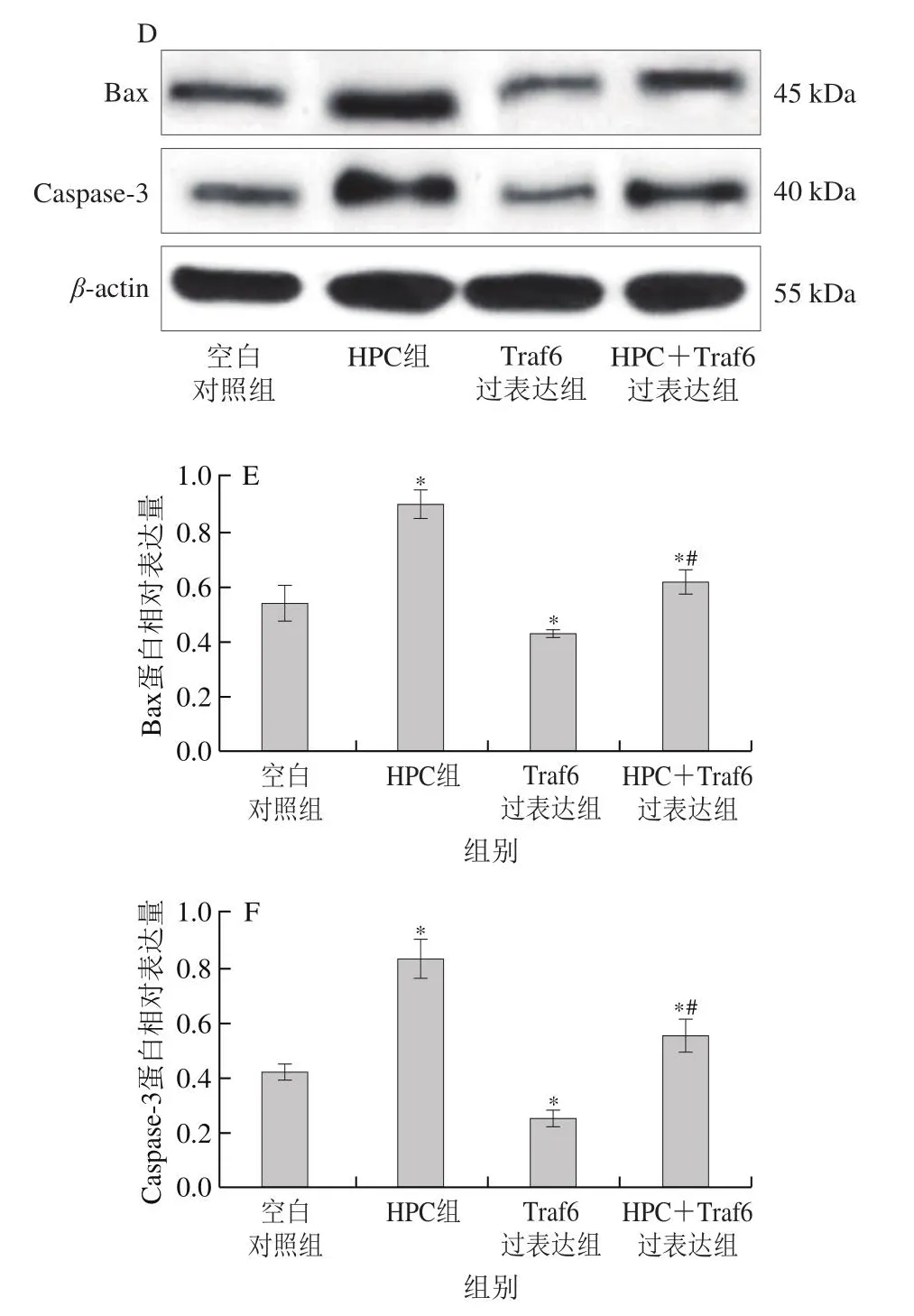
图4 HPC对Traf6、NF-κB p65、Bax和Caspase-3蛋白表达的影响(±s,n=6)Fig.4 Effect of HPC on the protein expression of Traf6, NF-κB p65,Bax and Caspase-3 (x± s, n = 6)
2.5 HPC对Huh-7细胞凋亡的影响
如图5所示,空白对照组、HPC组、Traf6过表达组和HPC+Traf6过表达组Huh-7细胞的凋亡率分别为29%、48.1%、15.5%和41.7%。HPC组的Huh-7细胞凋亡率显著高于空白对照组(P<0.05),Traf6过表达组的Huh-7细胞凋亡率显著低于空白对照组(P<0.05),HPC+Traf6过表达组的Huh-7细胞凋亡率显著高于Traf6过表达组(P<0.05)。
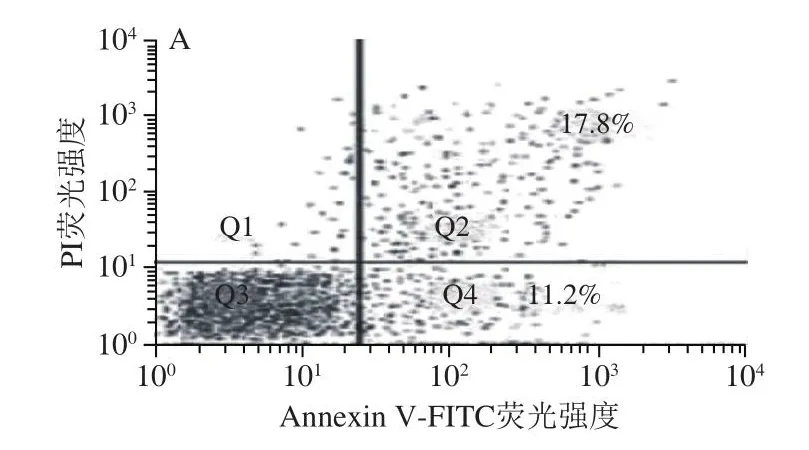
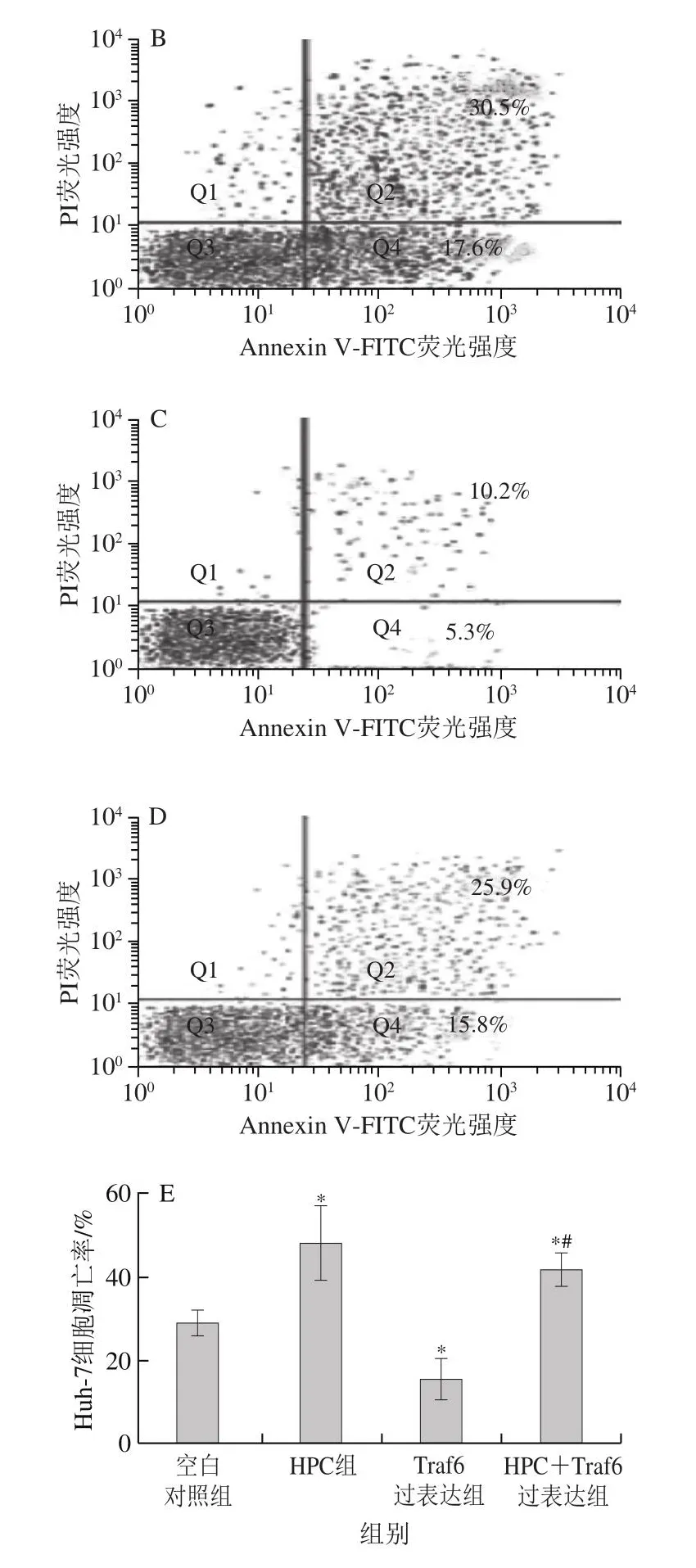
图5 HPC对Huh-7细胞凋亡的影响(±s,n=6)Fig.5 Effect of HPC on apoptosis of Huh-7 cells (x ± s, n = 6)
3 讨 论
HPC是具有开发价值的食品和药物成分[32]。很多流行病学实验、动物实验、细胞实验和临床研究证实HPC具有广谱抗肿瘤作用,HPC可通过多条信号通路作用于癌细胞的凋亡,并影响肿瘤血管的形成[33-36]。手术和化疗是肝癌的常用临床治疗手段,但患者对其耐受性差[37-39]。因此,探索毒副作用小的天然植物药对肝癌的治疗和预后十分重要[40]。本研究从细胞水平和基因水平初步证实HPC具有靶向抗肝癌细胞增殖的作用,期望为研究食品成分作为开发药物方面提供理论参考。
NF-κB信号通路可调节多种恶性肿瘤的发生与发展,癌症发生时往往Traf6蛋白表达量会增加,肝癌细胞中过表达的Traf6蛋白可以上调NF-κB信号通路,使其细胞质中的IκB磷酸化并被降解,释放的NF-κB p65转运到细胞核与靶点结合,能使促进细胞凋亡的Bax和Caspase-3蛋白表达量降低,促进肝癌细胞增殖并抑制癌细胞凋亡[41-42]。本实验探讨了不同质量浓度HPC对Huh-7细胞增殖的影响,结果显示当HPC质量浓度大于20 μg/mL时对Huh-7细胞的增殖有明显的抑制作用,且该作用存在剂量依赖性,与孙思明等[43]研究发现HPC抑制人肝癌细胞SMMC-7721的增殖具有剂量依赖性结果一致。利用40 μg/mL的HPC处理Huh-7细胞,结果表明HPC可以通过下调Traf6的表达起到抑制肝癌细胞的作用。Roy等[44]的研究证明,葡萄籽原花青素通过p53、Bax和Caspase 3诱导细胞凋亡,本研究结果显示,HPC处理的Huh-7细胞中Traf6和NF-κB p65mRNA表达水平下降,同时Traf6和NF-κB p65蛋白表达水平亦下降,HPC可以通过NF-κB信号通路调控p65的基因和蛋白表达,诱导肝癌细胞凋亡。Jeelani等[45]研究表明Caspase-3蛋白与癌细胞凋亡有关,本研究结果表明HPC可通过下调Traf6/NF-κB信号通路、活化Caspase-3从而抑制Huh-7细胞增殖,同时促进Huh-7细胞凋亡。
综上所述,HPC可以下调Traf6/NF-κB信号通路、抑制肝癌细胞增殖和促进肝癌细胞凋亡,但本实验没有研究HPC是否通过阻止Huh-7细胞周期来抑制其增殖并促进其细胞凋亡,后续尚需进一步研究。同时,实验质量浓度40 μg/mL HPC真正进入机体后,是否会被机体免疫系统或内分泌系统弱化,能否在机体内发挥抗肿瘤作用,也需进一步的临床试验来验证。
4 结 论
本研究结果初步表明,NF-κB信号通路是HPC作用的潜在靶点,HPC通过下调Traf6/NF-κB信号通路,抑制Traf6和NF-κB p65的表达,促进Bax和Caspase-3的表达,诱导Huh-7肝癌细胞凋亡,HPC为食物中的植物活性成分,可经小肠黏膜细胞直接吸收进入血液循环,且无毒副作用,值得进一步开发利用。
