基于高通量测序天麻土壤细菌群落结构分析
2023-03-31杨德强赵长林
陈 瑞 杨德强 赵长林
(1. 西南林业大学生物多样性保护学院,云南 昆明 650233;2. 云南国诚农业发展有限公司,云南 昭通 657000)
天麻(Gastrodia elata)又名赤箭、离母、独摇草,为兰科天麻属多年生共生草本植物,主产于中国云南、贵州、湖南、湖北、陕西、四川等省,其中云南省昭通市彝良县、永善县、绥阳县等地区所产天麻为特色道地药材。天麻性平,味甘,归肝经,“此草独茎而叶攒其端,无风自动,故曰鬼独摇草,天麻可用于头痛眩晕、肢体麻木、癫痫抽搐等症的治疗”[1]。此外,天麻广泛应用于食品领域,其块茎中主要化学成分有天麻素、香荚兰醇、酚性化合物[2],能增强细胞免疫和机体非特异性免疫[3-5]。然而,天麻栽培存在连作障碍,目前研究表明药用植物连作产生的化感自毒物质引起的土壤微生态变化是其发生连作障碍的重要原因[6]。连作障碍是指在同一块土地上连续栽培同种作物时,尽管在正常的栽培管理条件下,也出现长势变弱、产量减少、品质降低、病虫害加重的现象,其主要原因包括:土传病害的影响、土壤微生物的影响、植物化感自毒作用、土壤酶活性变化、理化性质的改变。随着天麻栽培面积的不断扩大及中药材规范化种植的推行,药用植物栽培中主要是土壤环境恶化导致连作障碍进而严重影响中药材规范化种植及种植基地建设,连作障碍已成为限制天麻生产发展和体系构建的重要因素[7-12]。
引起药用植物连作障碍的原因主要有三方面,一是土壤微生物引起的病害,二是根际化感作用,三是土壤养分不足或营养元素缺失[13]。前人研究证实,作物根系分泌物、植株残茬腐解物为病原菌营造了良好的繁殖条件,丰富的营养和寄主使病原菌快速增殖,导致土壤病原菌的不断积累造成重茬问题,由于植物残渣分解物和植物根系分泌物改变了根际微生物群落组成致使土壤微生物的比例失调引起连作障碍[14-15];导致连作障碍发生的原因并非单一因素,不同作物连作产生的主导因素也有所不同,因此如何解决作物连作障碍一直是农林领域世界性的难题[16]。
近年来,我国药用植物与作物连作障碍研究逐渐受到重视,该领域快速发展,科研水平不断提升[10]。但我国天麻连作障碍研究较少,仍有许多卡脖子问题困惑麻农,本研究基于在云南省昭通市彝良县荞山镇开展天麻种植前后及方竹修复后土样的采样,用宏基因组测序方法揭示天麻种植土壤细菌群落结构变化,进而为后期搞清天麻连作障碍成因及破障菌剂开发提供参考。
1 材料与方法
1.1 材料
供试土样采集于云南省昭通市彝良县荞山镇,该镇属于昭通地区天麻主产地,位于104°16′14″ E,27°39′33″ N,平均海拔1 650 m,年均气温11 ℃,年均降水量860 mm。山高坡陡,常年多雾,土壤为酸性或微酸性土,含有丰富的腐殖质,适宜于天麻的生长。本研究分批次采样,采样过程中土样设置3 个重复,使用50 mL康宁离心管进行分装,确保土样完整无污染。取样完成后低温保藏,每个样本置于-80 ℃冰箱中保存。本次采样区域为麻农开展林下种植天麻片区的天麻原始土、天麻1 年土和方竹轮作土。采集土壤样品名称编号分组见表1。
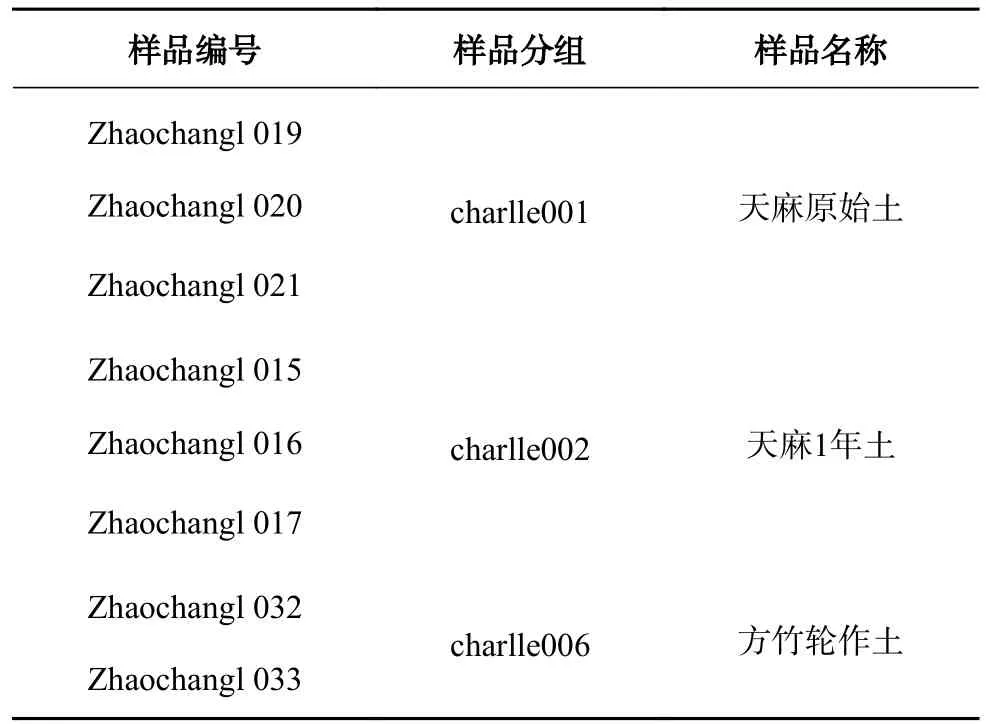
表1 土壤样品编号及分组Table 1 Soil sample number and assigned group
1.2 试验方法步骤
1.2.1 基因组DNA 提取
使用特定的DNA 提取试剂盒,提取样本的总基因组,DNA 提取后使用0.8%琼脂糖凝胶电泳检测DNA。
1.2.2 PCR 扩增
引物:16S 引物V3 + V4 区域;
341F: CCTACGGGNGGCWGCAG;
806R: GGACTACHVGGGTWTCTAAT。
1.2.3 PCR 产物检测、纯化和定量
电泳检测,使用Thermo Scientific 公司Gene-JET 试剂盒纯化并回收产物。
1.2.4 建库测序
用illumina 测序平台进行测序,主要有如下3 个步骤:1)PE reads 拼接:使用FLASH v1.2.7软件;2)Tags 过滤:使用Trimmomatic v0.33 软件;3)去除嵌合体:使用UCHIME v4.2 软件。
1.2.5 数据分析
划分OTU(Operational taxonomic units)、多样性及差异性分析,利用Qiime2[17]进行数据处理:拼接(vsearch)[18],去除引物(cutadapt)[19],过滤低质量数据[20],基于有效数据进行去噪和物种分类分析,形成扩增子序列变屏(Amplicon Sequence Variants,ASV)和物种分类等级的物种特征表(Feature table)。
1.2.6 聚类分析
使用QIIME(Version 1.8.0)软件[17]中的UCLUST[21]对Tags 在97%的相似度水平下进行聚类、获得OTU,基于Siva (细菌)分类学数据库,用柱形图显示各样品的分类学注释和OTU个数。
1.2.7 物种组成分析
利用相关软件绘制样本各分类学水平下的群落结构图,用特定的物种分类树进行研究,利用Venn[22]图展示样本之间共有、特有ASV 数目,直观地表现出样本间ASV 的重合情况,结合 ASV所代表的物种,找出不同环境中的核心微生物。
1.2.8 物种差异分析
通过统计分析,找出分组间丰度变化差异显著的物种,比较组内差异和组间差异的大小,判断不同分组间的群落结构差异是否具有显著意义。在门、纲、目、科、属、种水平下进行组间物种差异显著性分析和物种Metastat 差异分析;用软件STAMP[23]做组间的Welch's t-test 检验,找出差异显著的物种。
1.2.9 物种多样性分析
进行Alpha、Beta 多样性分析,并对物种注释在各个分类水平上进行群落结构的统计分析。通过UniFrac 分析[24]利用系统进化的信息来比较样本间的物种群落差异,主要有:
1)主成分分析:主成分分析(Principal Component Analysis,PCA)将多组数据的差异反映在坐标图上,通过分析不同样品OTU(97%相似性)组成反映样品的差异和距离。
2)主坐标分析:主坐标分析(Principal coordinates analysis,PCoA)与PCA 类似,基于binary jaccard, bray curtis, unweighted unifrac 和weighted unifrac 距离进行分析,选取贡献率最大的主坐标组合进行作图展示。
3)主加权组平均分析:通过非加权组平均法( Unweighted Pair-group Method with Arithmetic Mean,UPGMA),所产生的聚类树聚类分析,树枝的距离和聚类的远近可以观察样本间相似性。
4)基于OTU-Table 和上述4 种距离矩阵绘制样本聚类热图,从聚类中了解样本之间的相似性,进行多样性指数与环境因子的相关性分析。
2 结果与分析
2.1 土样细菌OTU 组成与分析
基于有效OTU 数据进行去噪和物种分类得到各个样本细菌ASV(图1),由图1 可知Zhaochang l 021 细菌ASV 最大,为2 034;Zhaochangl 019 细菌ASV 最小,为1 038,样本的细菌总ASV 为3 004。
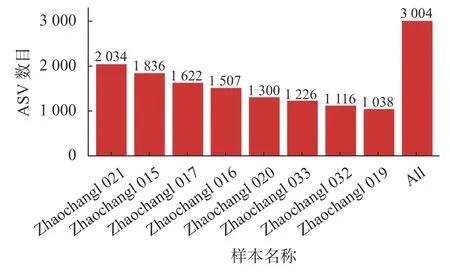
图1 各样本ASVFig. 1 ASV number per sample
将丰度小于0.001 的ASV 过滤掉,比较3 组样本细菌ASV(图2),由图2 可知3 组样本共有细菌ASV 为95,从charlle001、charlle002 和charlle006 特有细菌ASV 可知,原壤charlle001 特有细菌数量最多,其次为方竹壤charlle006,二者均高于一麻壤charlle002 所含有的特有细菌数量。结果表明:天麻原壤具有最多的特有细菌,但种植1 年天麻后土壤种特有细菌减少,随后将地方经济作物方竹种植于一麻壤后,土壤中特有细菌数量呈现回升趋势。

图2 3 组样本ASV 花瓣图Fig. 2 ASV petal maps of 3 groups of samples
3 组样本细菌系统发育树结果见图3,不同颜色的扇形表示3 个不同的样品,扇形的大小表示该样品在该分类上相对丰度的比例大小。饼图下方的拉丁名代表相应的分类阶元,从系统发育分类树上可明确3 组样本细菌按门主要可分为Acidobacteria、Chloroflexi、Firmicutes、Proteobacteria、Planctomycetes 和Verrucomicrobia;按纲主要可分为Actinobacteria、Alphaproteobacteria、Anaerolineae、Chloroflexi、Gammaproteobacteria、Holophagae、 Ktedonobacteria、 Pedosphaerae、 Phycisphaerae、 Planctomycetia 和Verrucomicrobiae; 按目主要可分为Bryobacterales、Burkholderiales、Chthoniobacterales、Ktedonobacterales、Pedosphaerales、Lachnospirales、Rhizobiales、Solibacterales 和Tepidisphaerales;按科主要可分为Bacteoidales、Bryobacteraceae、Chthoniobacteraceae、Koribacteraceae、Ktedonobacteraceae、Lachnospiraceae、Muribaculaceae、Nitrosomonadaceae、Pedosphaeraceae 和Solibacteraceae;按属主要可分为Acidibacter、Acidothermus、Bryobacter、Clostridia、Koribacter、Solibacter和Udaeobacter。

图3 样本细菌分类学系统发育树Fig. 3 The taxonomic phylogenetic tree of the sample bacteria
2.2 土样细菌群落结构及相对丰度
本研究将丰度低的部分物种合并为Others 在图4 中显示,图5 中Unknown 代表未得到分类学注释的ASV,一种颜色代表一个物种,色块长度表示物种所占相对丰度比例。单个样本在门水平分析的样本丰度(图4)和种水平分析的样本丰度(图5)分析结果表明:样本丰度按门等级主要可分为Acidobacteria、Actinobacteriota、Bacteroidota、Chloroflexi、Firmicutes、Gemmatimonadota、Latescibacterota、Myxococcota、Nitrospirota、Patescibacteria、Planctomycetota、 Proteobacteria、 SAR324、 Verrucomicrobiota 和WPS-2,其中Acidobacteria 丰度占比最大;按种等级主要可分为Bellilinea 和Holophaga;其中未得到分类学注释的细菌物种Unknown 丰度所占比例较大。
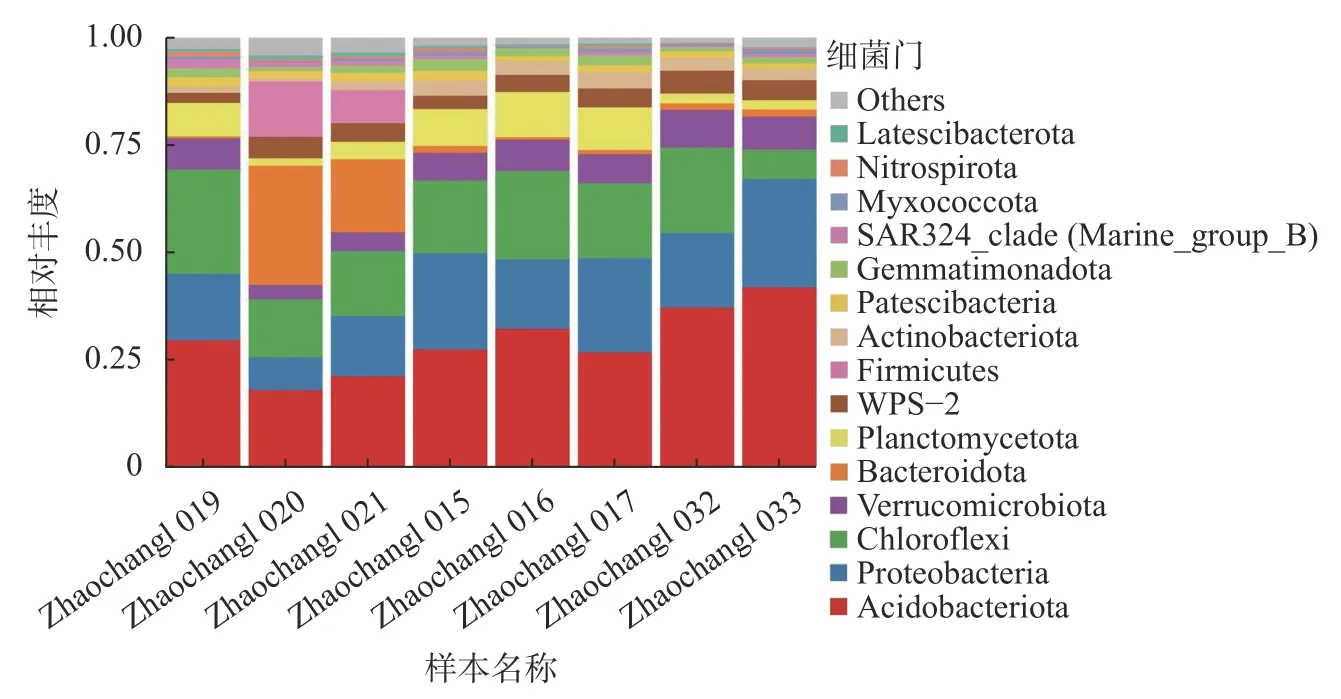
图4 单个样本在门水平上的相对丰度Fig. 4 Relative abundance of a single sample
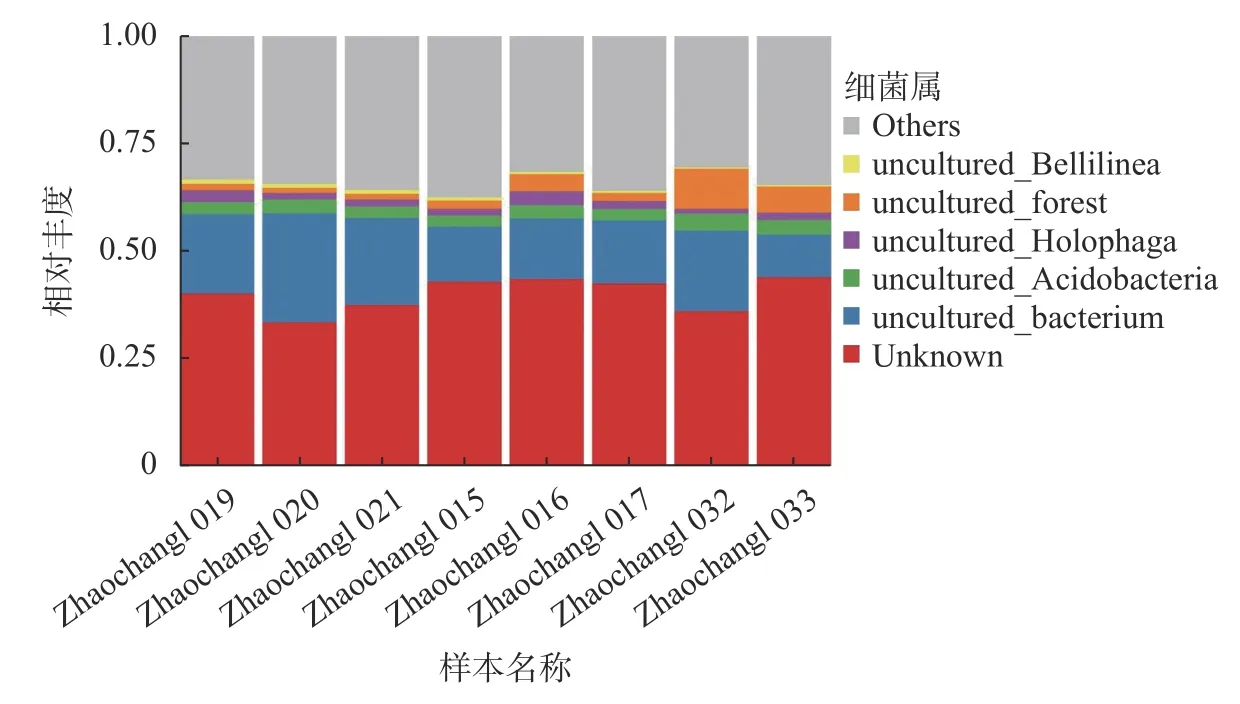
图5 单个样本在种水平上的相对丰度Fig. 5 Relative abundance of a single sample
组间样本丰度门水平分析(图6)表明:3 个组中Acidobacteria 细菌丰度最大,charllle006 >charllle002 > charllle001;Proteobacteria 细 菌 丰 度charllle006 > charllle002 > charllle001;Gemmatimonadota 细 菌 丰 度 charllle001 > charllle002 >charllle006;Verrucomicrobiota 细菌丰度charllle006 >charllle002 > charllle001。
通过circos[25]绘制物种丰度与样本相互关系(图7),揭示各分组样本中不同物种所占的比例以及物种在不同分组中的比例关系。筛选相对丰度大于0.01 的物种以目水平绘图,第1 圈左半边为物种,右边为样本分组,第2 圈左边一半为物种中各样本的比例,右边一半为样本中各物种的比例,内2 圈与外2 圈标注相同,最里面连线为物种丰度与样本分组之间的连线。在系统分类的细菌目中,3 组优势菌组成较为相似,均以Acidobacterales、 AD3、 Bacteroidales、 Burkholderiales、 Bryobacterales、 Ktedonobacterales、 Pedosphaerales、 Rhizobiales、 Subgroup-2、 和WPS-2 细菌为优势菌,但各优势菌相对丰度有一定差异。其中,charlle001 目水平相对丰度较大的主要优势菌依次为:Bacteroidales > Subgroup-2 >Ktedonobacterales > AD3 > Acidobacterales > WPS-2 >Bryobacterales > Burkholderiales > Rhizobiales > Pedosphaerales;charlle002 目水平相对丰度较大的主要优势菌依次为:Subgroup-2 > Acidobacterales >AD3 > Ktedonobacterales > Rhizobiales > WPS-2 >Burkholderiales > Pedosphaerales > Bryobacterales >Bacteroidales;charlle006 目水平相对丰度较大的主要优势菌依次为:Subgroup-2 > Acidobacterales >Ktedonobacterales > Pedosphaerales > WPS-2 >Rhizobiales > Burkholderiales > Bryobacterales >Bacteroidales > AD3。Bacteroidales 细 菌 丰 度 在charlle001 中 最 大( 20%), 在 charlle002 和charlle006 中几乎没有;Subgroup-2 细菌丰度在charlle006 中最大(20%),在charlle001 中最小(10%);Acidobacterales 细菌丰度在charlle006中最大(18%),在charlle001 中最小(8%);Ktedonobacterales 细菌丰度在charlle006 中最大(14%),在charlle001 和charlle002 中较小。上述结果表明,3 组土样主要优势菌属大致相同,但各组优势菌相对丰度存在较大差异;原壤charlle001 中Bacteroidales 细菌较多,但通过种植1 年天麻后,一麻壤charlle002 中Bacteroidales 细菌急剧减少,且细菌物种数量也呈减少趋势;方竹壤中Subgroup-2、Ktedonobacterales 细菌丰度呈现回升态势,均在10%以上。进而可以得出结论:该地区原壤通过种植天麻导致土壤中细菌物种总数和总丰度呈降低趋势,通过种植方竹,一麻壤得到修复,物种总数和总丰度再次回升,进而推测天麻连作障碍与土壤中细菌物种总数和丰度密切相关。
通过门水平Heatmap 热图聚类分析 (图8)显示物种丰度与不同物种的相似情况,图8 中包含物种信息及样本信息。2 个物种丰度越相似,距离越近,枝长越短;横向聚类表示不同样本的各物种丰度的相似情况,默认最多展示丰度最高的前35 个物种。研究结果显示:1)Zhaochangl 019、Zhaochangl 020、Zhaochangl 021 聚至charlle 001; Zhaochangl 015、 Zhaochangl 016、Zhaochangl 017 聚至charlle 002;Zhaochangl 032、Zhaochangl 033 聚至charlle 006;2)全部样本聚为两个大类:charlle001 与charlle 006(group I)、charlle002(group II),结果揭示两类细菌物种总丰度存在差异;3)原壤中Zhaochangl 020 和Zhaochangl 021 样 品 内4 门Bacteroidales、Campilobacterota、Cyanobacteria 和Firmicutes 细菌丰度极高,而一麻壤和方竹壤样品内该4 门细菌丰度极低;原壤中Zhaochangl 019, Zhaochangl 020 和Zhaochangl 021 样品内3 门Actinobacteriota,Myxococcota, Proteobacteria 细菌丰度较低,而一麻壤和方竹壤样品内该3 门细菌丰度较高。该结果揭示天麻原壤经过种植1 年天麻,细菌群落发生变化,有益细菌减少,再次种植天麻将导致连作障碍,如一麻壤种植方竹后,其方竹壤内有益细菌再次增加,待方竹丰收后,该样地还可继续种植天麻,进而提升土地利用效率。样品Zhaochangl 019 内4 门Bacteroidales、Campilobacterota、Cyanobacteria、Firmicutes 细 菌 丰 度 较 低,推测主要原因为该采样点附近有可能种植过天麻。
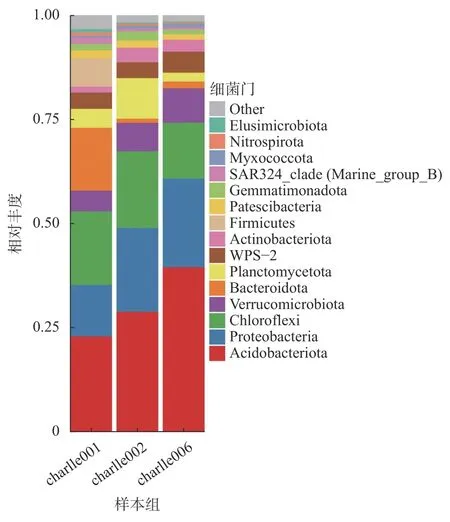
图6 组间样本在门水平的相对丰度Fig. 6 Relative abundance of samples among groups
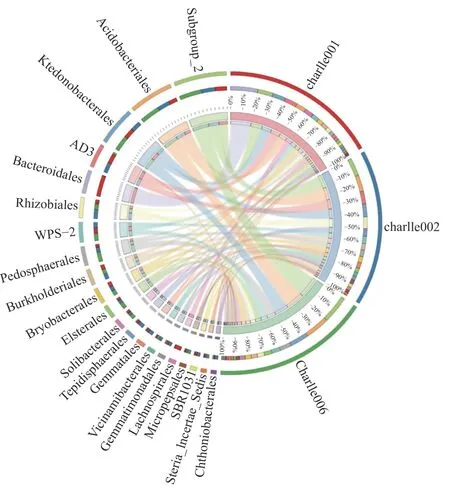
图7 样本与物种丰度circos 图Fig. 7 Circos plots of samples and species abundance
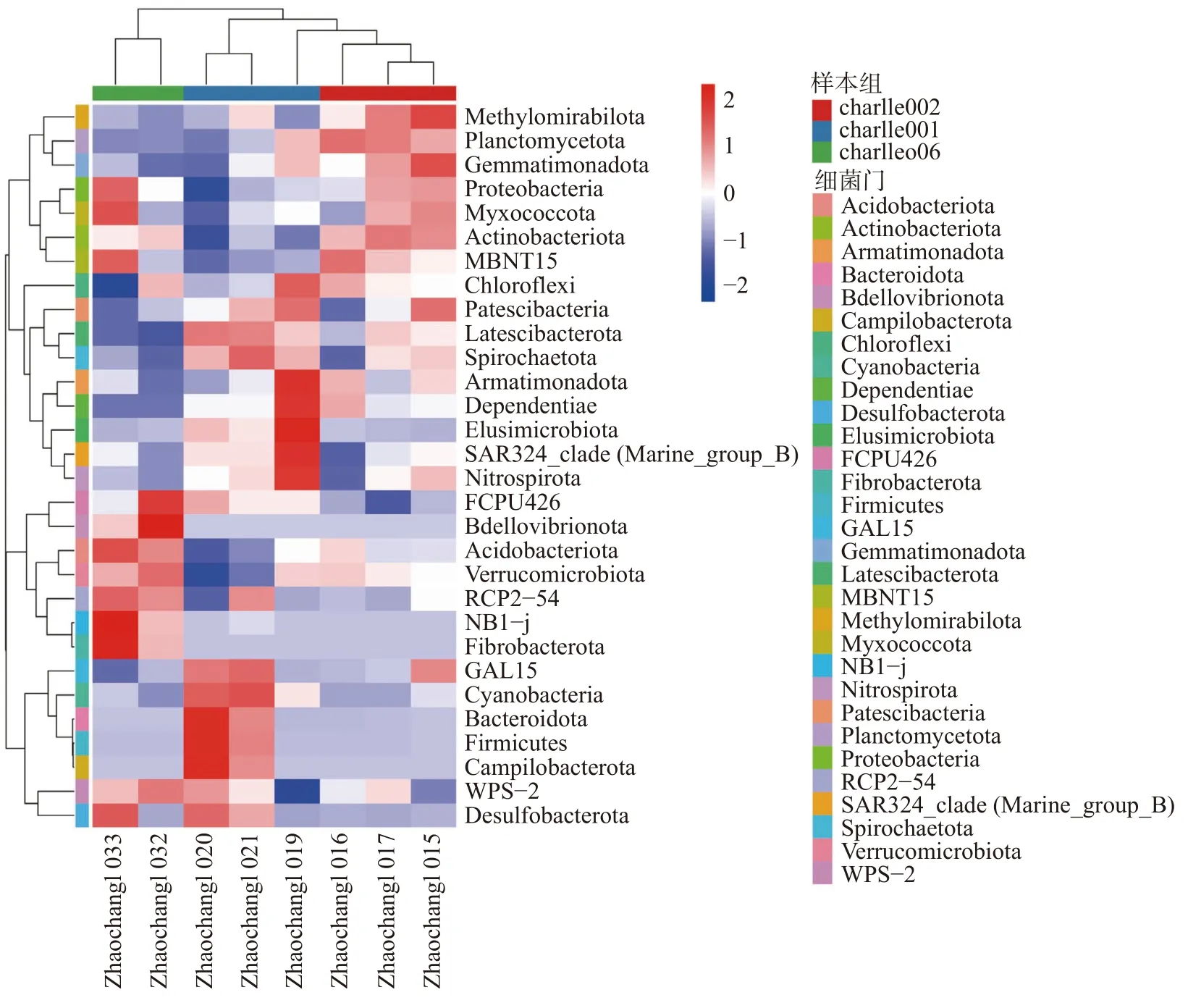
图8 物种相对丰度聚类热图Fig. 8 Clustering heatmap of relative species abundance
2.3 土样细菌多样性分析
使用Qiime2 软件,对样本Alpha 多样性指数进行评估。为比较样本间的多样性指数,分析时将Feature table 先均一化之后再计算多样性指数。Alpha 多样性是反映丰富度和均匀度的综合指标,丰富度表示物种的有无和群落中物种分配上的均匀性,即物种丰度大小是否均匀,群落丰富度的指数主要包括Richness、Chao1 和Ace 等指数。既考虑丰富度又考虑均匀性的指数包括Shannon 和Simpson 等指数,各样本Alpha 多样性指数值统计如表2 所示。
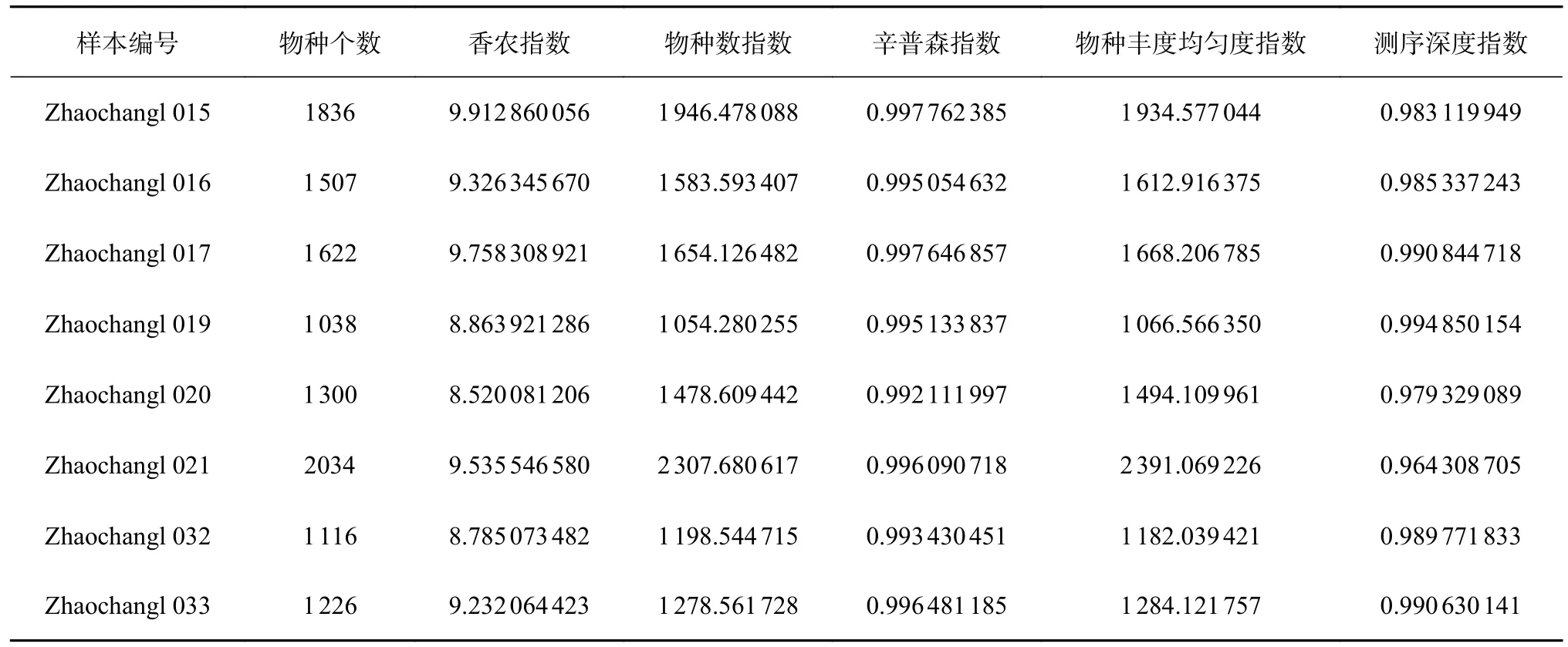
表2 样本细菌 Alpha 多样性指数统计Table 2 Statistical analysis of bacterial Alpha diversity index of the samples
表2 中各样本细菌物种数及Alpha 多样性指数揭示样本Zhaochangl 015、 Zhaochangl 016、Zhaochangl 017 物种数较均衡, 原壤样本Zhaochangl 021 物种数最大,Zhaochangl 019 物种数最小。辛普森指数越大,对应样本中细菌群落多样性越小,Zhaochangl 015 的辛普森指数最大,其次是Zhaochangl 017,表明这两种样本中细菌群落多样性较小。
使用R 语言ggplot2 包绘制 PCA 散点图(图9),组间PCA 分析结果表明:纵坐标水平显示方竹壤charlle006 介于原壤charlle001 和一麻壤charlle002 之间,3 组样本中各样本离散程度不同,其原因可能与采样点距离不同有关。PCoA 分析(图10)结果表明:charlle002 和charlle006 样本聚类较近,charlle001 样本较分散,该结果与细菌群落聚类分析结果一致。
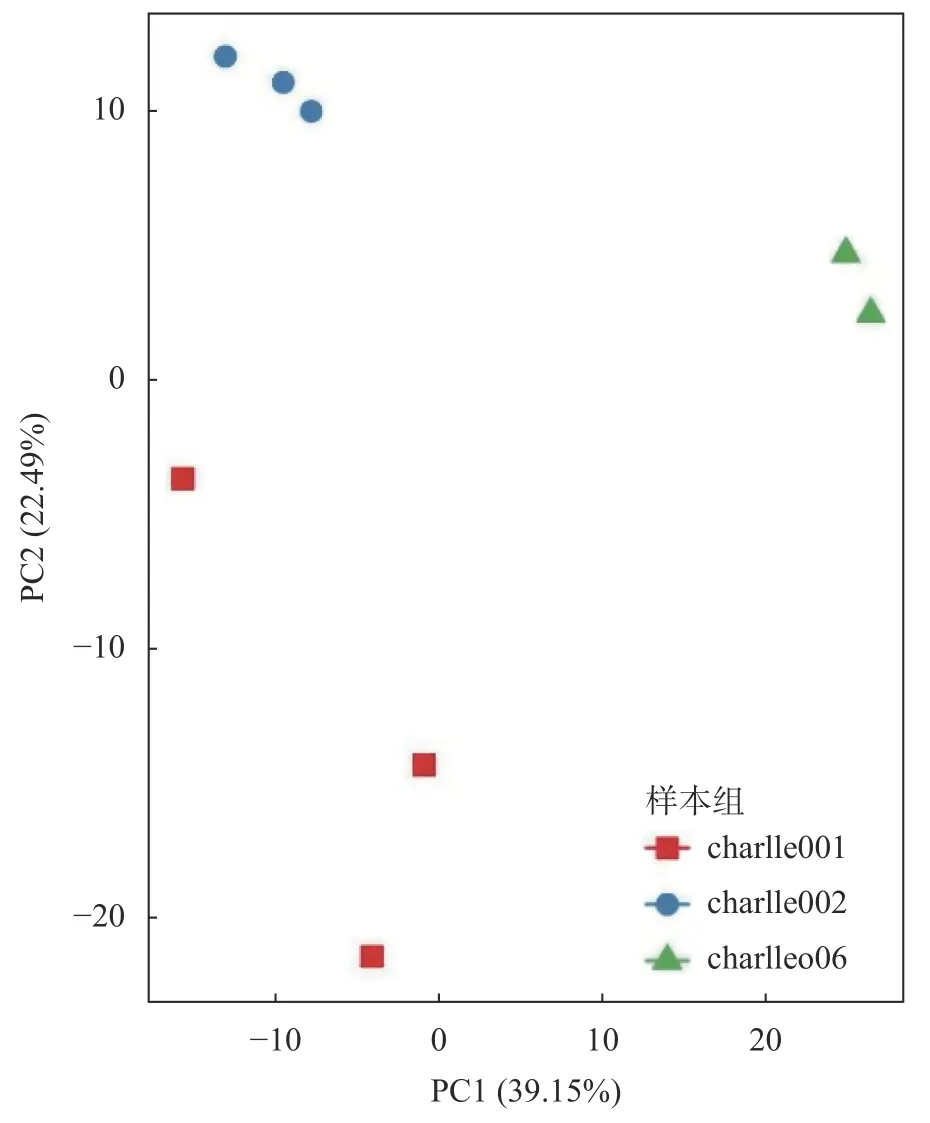
图9 样本PCA 散点图Fig. 9 Sample PCA scatter plot
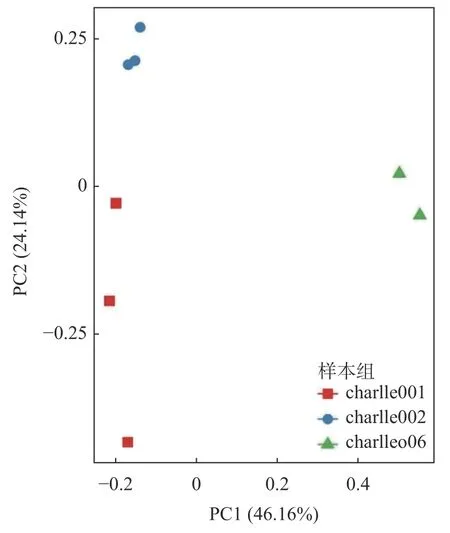
图10 样本PCoA 分析图Fig. 10 Sample PCoA analysis graphics
通过R 语言ggplot2 采用非加权配对平均法对样本进行层次聚类,以判断各样本间物种组成的相似性。样本层次聚类树和相对丰度(图11)分析表明: Acidobacteriota、Chloroflexi 和Proteobacteriota 细菌为样本主要优势菌,样本Zhaochangl 020 和Zhaochangl 021 中Acidobacteriota 细菌丰度明显较低,原壤Zhaochangl 020、Zhaochangl 021中Bacteroidota 和Firmicutes 细菌丰度较高,而一麻壤和方竹壤中几乎没有,推测Bacteroidota 和Firmicutes 细菌可能是天麻种植土壤中的有益菌。一麻壤的3 样本聚类为一支,表明样本细菌组成与丰度较相似。方竹壤两样本Zhaochangl 032 和Zhaochangl 033 聚为一类,样本中Acidobacteriota 丰度最大,同时Verrucomicrobiota 丰度也较大。

图11 UPGMA 样本聚类树分析Fig. 11 UPGMA sample cluster tree analysis
2.4 样本细菌差异分析
通过R 语言pheatmap 绘制样本聚类热图(图12),根据颜色梯度的变化可直观地看出样本间的差异性。图12 中左侧和上方展示了样本的聚类关系,中间颜色梯度变化代表各样本表达量,红色越深表示样本表达量越高。图12 中颜色梯度变化明显,同组样本聚类在一起表明样本间具相似性;charlle006 两个样本与charlle002 的3 个样本距离较远,揭示两组间细菌群落组成差异较大。
LDA Effect Size[26]分析能够在组与组之间寻找具有统计学差异的Biomarker,即组间差异显著的物种。不同组中丰度差异显著物种包括细菌的门、纲、目,柱状图的长度代表差异物种的影响大小。图13 表明:charlle001 中显著差异细菌为p-Bacteroidota、 c-Bacteroidia 和 o-Anaerolineales;charlle002 中显著差异细菌为o-Tepidisphaerales、c-Holophagae、o-Nitrospirales、p-Nitrospirota 和c-Nitrospiria;charlle006 中 显 著 差 异细 菌 为 c-Acidobacteria、 p-Acidobacteriota、o-Acidobacteriales、 c-Ktedonbacteria、 o-Ktedonbacterales、o-Elsterales和o-Solibacterales。
在目水平做组间Welch's 检验,3 组样本charlle001、charlle002 和charlle006 两两比较做组间物种差异分析(图14),图14 左边为组间差异物种丰度展示,右边为组间差异置信度展示。图14a 表明:原壤charlle001 和方竹壤charlle006组间细菌Pedosphaerales 和Acidobacteriales 相对丰度差异显著,且两目细菌在charlle006 中丰度更高,其余各目细菌差异不明显。
原壤charlle001 和一麻壤charlle002 组间图14b 表明:Rhizobiales、Chthoniobacterales、Pirellulales、 Holophagales、 Xanthomonadales、 Gaiellales、Fankiales 和Solirubrobacterales 细菌相对丰度差异显著,其中Rhizobiales 最为突出,该目细菌在charlle002 中丰度极高。
图14c 表明:一麻壤charlle002 和方竹壤charlle006 组 Tepidisphaerales、 Gemmatales、 Pedosphaerales 和Chthoniobacterales 细菌相对丰度差异显著,Pedosphaerales 在charlle006中丰度更高,而 Tepidisphaerales、 Gemmatales 和 Chthoniobacterales 在charlle002 中丰度更高,其余细菌无显著差异。

图12 样本聚类热图Fig. 12 Sample clustering heatmap
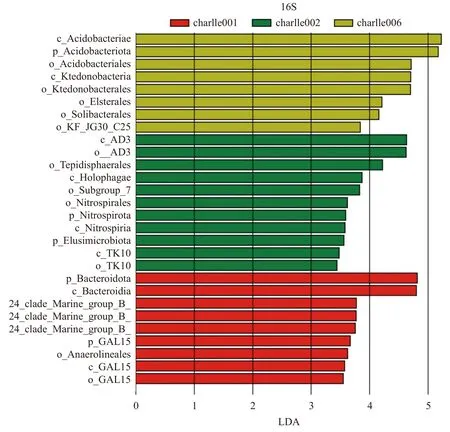
图13 差异物种LDA 柱状图Fig. 13 LDA histogram of different species

图14 样本微生物群落差异比较Fig. 14 Comparison of microbial community differences in samples
3 结论与讨论
本研究共分析8 个土样Zhaochangl 015、Zhaochangl 016、Zhaochangl 017、Zhaochangl 019、Zhaochangl 020、 Zhaochangl 021、 Zhaochangl 032,Zhaochangl 033,分为3 组原壤charlle001、一麻壤charlle002、方竹壤charlle006。土壤高通量测序分析结果揭示了各个土样细菌种类与物种丰度,并通过各样本细菌组成和群落结构数据搞清了彝良县荞山镇天麻种植区土样优势细菌为Acidobacteria、Actinobacteriota、Bacteroidota、Chloroflexi、Firmicutes、Gemmatimonadota、Latescibacterota、 Myxococcota、 Nitrospirota、 Patescibacteria、Planctomycetota、Proteobacteria 和Verrucomicrobiota。
3 组样本群落结构比较表明:1)Acidobacteria 为优势细菌,其次是Proteobacteria 和Chloroflexi;2)Firmicutes、Bacteroidota 细 菌 在 原 壤中丰度最高,而在一麻壤和方竹壤中几乎没有;3)组内各样本细菌群落组成较相似,但不同样本中各细菌丰度不同。
各组间细菌数比较:3 组样本共有细菌ASV为95 个,基于charlle001、charlle002 和charlle006特有细菌ASV 分析表明:原壤charlle001 特有细菌数量最多,其次为方竹壤charlle006,二者均高于一麻壤charlle002 特有细菌数量。原壤与一麻壤优势细菌比较分析显示:优势细菌Acidobacteria、Planctomycetota 和Proteobacteria 在 原 壤 中丰度明显低于一麻壤中,且原壤中Bacteroidota、Firmicutes 两门细菌丰度显著高于一麻壤;一麻壤与方竹壤优势细菌比较分析显示:Chloroflexi 和Planctomycetota 在一麻壤中丰度明显高于方竹壤,但方竹壤优势细菌Acidobacteria 丰度最大且Bacteroidota 细菌丰度高于一麻壤;原壤与方竹壤优势细菌比较分析显示:方竹壤中Acidobacteria、Proteobacteria 丰度显著高于原壤。云南省内关于森林及农田土壤细菌多样性的测序研究表明,正常土壤中优势细菌门主要为Proteobacteria、 Actinobacteria、 Acidobacteria、 Firmicutes 和Gemmatimonadetes[27-28],土壤细菌群落的多样性和丰度越高,越有利于植株生长,土壤微生物的相对丰度发生改变,其功能也发生相应变化[29],基于上述分析推断Firmicutes、Bacteroidota 细菌是天麻种植土壤中重要有益菌;猜测天麻连作障碍原因与其土壤微生物群落结构和丰度变化有紧密的关联,而连作菌塘种植方竹能缓解并一定程度修复天麻连作土壤。
连作障碍是农业生产中普遍存在的问题,连作导致农作物减产和病虫害等问题的发生,故称“障碍”,对很多农作物[30-36]造成不可估量的经济损失。由于大部分药用植物特别是栽培根类药材的连作障碍问题较突出,药材品质和产量均大幅下降[16,37-47]。天麻是我国特有的名贵中药材,也是近年发展迅速的中药大品种之一,因其对气候、土壤、真菌等环境有特殊要求,因此传统上云南省以昭通市境内为主要种植地。近年来,中药材已规范化种植,栽培土壤环境恶化及连作障碍问题备受关注,随着社会需求量不断增加,天麻栽培面积扩大,天麻价格不断上涨,连作障碍己成为限制天麻生产的重要因素。天麻产业发展与产品质量提升和连作障碍的矛盾,已成为制约现代云药产业健康持续发展的主要屏障。因此,明确天麻土壤微生物群落结构是揭开连作障碍的第一层面纱。
引起药用植物连作障碍因素较多,其中植物根际土壤以及根际微生物是重要的环境和生物因子[48-49]。邓文祥等[50]通过对白及(Bletilla striata)根部内生真菌的筛选,揭示土壤理化性质影响白及根部内生真菌物种组成。土壤微生物研究对探讨植物生长有重大意义,土壤微生物结构的多样性,加强了土壤自肥作用[51],但连作常引起植物根际微生物变化,引起土壤病原菌增多肥力下降等问题,使作物产量和品质下降[52],如随着灵芝栽培年数增加,灵芝种植土壤中优势菌多样性降低,病原菌增多[53]。大部分研究表明细菌与土壤肥力相关,冯金玲等[54]试验5 种栽培模式说明土壤细菌可作为判断土壤肥力状况的生物学指标。研究土壤微生物群落结构均表明:土壤中真菌数量、真菌与细菌数量比值越低,土壤生态系统稳定程度越高,抑制病害能力越强,在连作障碍土壤微生物研究中常见细菌型土壤转变为真菌型土壤[55-58]。
作物连作后根际土壤微生态发生改变,主要表现在有益菌数目减少、病原菌数目增多,基于研究连作土壤微生物菌群演替规律,明确引入特殊土壤功能菌和有益微生物,可抑制病原菌增殖,同时恢复稳定的微生物群落并防控连作障碍[58]。基于Illumina Hi Seq 高通量测序技术,探讨植物与微生物的互作关系,研究连作土壤中细菌群落或真菌群落多样性及丰度,提高有益菌群在土壤中的比例,降低有害菌群在土壤中的相对含量,研究结果推动了人类对连作障碍的认知[59]。本研究通过高通量测序技术揭示3 种类型天麻土壤细菌在种群组成、数量和分布上存在差异性,并明晰了连作前后及修复后细菌物种数量及组成的变化,与前人对连作白术(Atractylodes macrocephala)根际土壤变化[44]和连作土壤微生物区系分析、调控及高通量研究分析结果相似[60],但大部分细菌的分类仅限于属的水平,测序分析无法定位到特定细菌物种,且同一属的不同细菌种在土壤中可能会行使不同的功能,不同属的细菌也可能在土壤中行使同样的功能,研究所得到的结果可能会有偏差。
天麻连作障碍一直被视为该领域的卡脖子问题,其连作机制与修复方案未曾问世,只因其基础研究一直搁浅,因此研究天麻土壤中微生物结构组成及丰度变化,便于接下来对天麻种植土壤更深层次的研究和探索。
