利用流式细胞术鉴定桦木染色体倍性和DNA 含量
2023-03-31黄茂根刘雪羽吴兴盛陈爱平胡现铬童再康黄华宏楼雄珍
黄茂根 沈 凝 刘雪羽 吴兴盛 陈爱平 孟 岩 胡现铬 童再康 黄华宏 楼雄珍
(1. 罗卜岩自然保护区管理站,福建 三明 365050;2. 浙江农林大学亚热带森林培育国家重点实验室,浙江 临安 311300;3. 官庄国有林场,福建 三明 365050;4. 信阳市林业科学研究所,河南 信阳 464000)
如何有效评估植物基因组大小是开展植物遗传改良和分子遗传学研究的关键问题之一。目前,鉴定植物基因组大小的主要方法有流式细胞术(FCM)、Feulgen 光密度测定法(FDM)和全基因组测序法(WGS)[1],其中FCM 操作简单、检测结果准确、检测成本低,是最常用的测定方法。例如,通过对山茶属和山茶亚属株的DNA 含量进行测定,识别出普洱茶(Camellia sinensisvar.assamica)的基因组大小[2];通过对蓝莓(Vacciniumspp.)个体的测定,发现其倍性丰富,包含从2 倍体到6 倍体等不同的种[3];通过对香蕉(Musa nana)的倍性检测,发现其至少含2 倍体、3 倍体和4 倍体[4]。物种基因组大小的预估,可以提前预测解析其基因组所需要的成本,为后续的测序组装等分析提供重要的理论参考,同时也为遗传学和基因组学研究奠定基础。
桦木属(Betula)的适宜生态位主要分布于北半球亚热带、温带以及寒温带地区,约有100 个种[5],我国自然分布约31 个种和6 个变种[6],分布于我国的横断山区、四川盆地、滇南和新疆等地[7]。桦木属植物包含很多重要的用材树种,例如光皮桦(Betula luminifera)木材被我国列为一类木材,生长快、抗性强,具有很高的经济价值和广阔的开发前景。桦木属植物倍性丰富,从2 倍体到12 倍体不等,1C 值在0.44 pg(430 Mb)到2.67 pg(2 611 Mb)之间,2Cx 值在371 Mb 到616 Mb 之间[8]。当前,桦木属植物的基因组信息还不丰富[9-10],且缺乏针对桦木属植物的基因组评估测定方法。因此,建立有效的评估体系对桦木属植物的倍性进行鉴定,可快速鉴定桦木种间杂交后代的倍性,可为未来选育出适应性强,生长速度快,材质优良的桦木新品种提供重要的技术支撑。然而,目前国内对桦木属植物的研究大部分集中在其基因功能解析,而对于桦木属植物倍性与DNA 含量的研究相对较少,这也限制了我国桦木属植物的研究和快速发展。本研究利用FCM 检测不同种类桦木属植物的细胞染色体的倍性,并针对不同材料、试剂先进行优选,筛选适合桦木属植物的FCM 检测体系,为未来的桦木属植物的倍性育种和全基因组测序分析以及多倍体植物的形成机制探索提供研究基础和参考依据。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
7 种桦树:河桦(Betula nigra)、光皮桦、光皮桦 × 河桦(Betula luminifera×Betula nigra)、垂枝桦(Betula pendula)、黑桦(Betula dahurica)、岳 桦(Betula ermanii)、坚 桦(Betula chinensis)均为浙江农林大学苗圃地所栽培。毛果杨(Populus trichocarpa)组培苗和光皮桦组培苗均为浙江农林大学亚热带森林培育国家重点实验室组培室培养,其中毛果杨与垂枝桦为本实验的对照。
1.1.2 仪器与试剂
流式细胞仪型号为CytoFLEX9(美国贝克曼库尔特有限公司);荧光染料为碘化丙啶(PI,SIGMA,美国);RNaseA 购于天根生化科技(北京)有限公司;滤膜、鞘液等试剂均购于美国贝克曼库尔特有限公司;0.22 μm 微孔滤膜购于密理博(中国)有限公司。
1.2 实验方法
1.2.1 裂解液与染料配制
实验所需细胞核裂解液的配方见表1,除Otto II 常温下保存,其余裂解液均使用0.22 μm微孔滤膜进行过滤后冷藏保存。为去除双链RNA可能带来的干扰,PI 染液中可以加入适量RNA酶。由于见光易分解,PI 染液配制和保存方法参照弓娜等[11]制定的FCM 在植物学研究中的应用方法,终浓度为50 μg/mL。

表1 细胞核裂解液配方Table 1 Formula of nuclear dissociation fluid
1.2.2 细胞核悬浮液制备
选取60 mg 植物新鲜叶片放入9 cm 的一次性培养皿中,加入1 mL 预冷的细胞裂解液与500 μL浓度为1% PVP 溶液,用锋利的双面刀片快速切碎。利用3 mL 塑料吸管将悬浮液吸取并通过500 目的滤膜将悬浮液过滤,滤液收集至2 mL 离心管中,冰上静置5 min。1 000 r/min 离心5 min,弃上清,加入100 μL 预冷的裂解液重悬,再加入150 μL 预冷的含RNase 的PI 染液对细胞核进行荧光染色,4 ℃避光孵育5 min。用500 目的滤膜再过滤,移至上样管,上机检测,低速收集记录10 000个颗粒。
1.3 叶片状态与保存方式处理
叶片状态分为3 种:嫩叶为2 个月的组培苗从上往下数第1 或2 片叶片,幼叶为野外1 a 生枝条从上往下数的第1 至2 片叶,成熟叶为野外1 a 生枝条上第5 片叶片。
当天采集幼叶的保存方式分为4 种:保存方式1,将其放入保鲜袋中常温保存;保存方式2,将其放入保鲜袋中冷藏保存;保存方式3,放入含有1% PVP 的PE 管中常温保存(3 h);保存方式4,放入含有1% PVP 的PE 管中常温保存24 h。
1.4 数据分析
1.4.1 倍性及DNA 含量计算
对已知DNA 含量的对照样本进行测定,根据通过PI 染色的细胞核的相对荧光强度比值来计算出待测样本的DNA 含量[12],再通过已知倍性为2 倍体的垂枝桦的荧光强度来计算出未知桦木属植物的DNA 倍性。
1.4.2 数据收集及分析
PI 荧光激发波长为488 nm,上机后收集通道585/42BP 的荧光,检测PI 发射的荧光强度。变异系数(CV)值控制在5%以内。使用CyExpert软件进行数据收集与分析。参照Huang 等[2]提供的计算公式计算样本的1C 值。每个样本检测3 次,利用SPSS 22 软件进行数据的显著性分析。
2 结果与分析
2.1 裂解液种类对检测效果的比较
由于目前植物还没有通用的细胞核裂解液,因此筛选出对该物种细胞核提取效果最佳的裂解液对于流式细胞检测而言至关重要。本实验利用光皮桦组培苗嫩叶为材料进行实验,结果如图1 所示,Galbraith's、GPB、LB01、Marie's 裂解液杂质多,均出现明显杂质峰,其中Marie's 裂解液收集的有效细胞核数最少(不足160),通过散点图发现颗粒分布并不集中,大部分为细胞杂质碎片,表明这些裂解液不能较好的提取细胞核。图1c、i 中发现HEPES 与Tris-MgCl2裂解液所得直方图虽看起来杂质干扰较少,但HEPES 裂解液的CV 值大于5%,结果不可信,Tris-MgCl2裂解液所得直方图出现G1+ G2期峰,说明出现了细胞核黏连的情况。图1h 发现OTTO 裂解液显示G1期峰左右不对称,对光皮桦而言不是最佳裂解液。图1f、g 中mGb裂解液与MgSO4裂解液所得G1期峰左右对称,G2期峰明显,无杂峰干扰,mGb 裂解液提取速率为311 个/秒,MgSO4裂解液提取速率为485 个/秒,提取速率高,均可作为制备光皮桦组培苗单细胞悬浮液的裂解液。但MgSO4裂解液提取效果略高,因此,选择MgSO4裂解液进行进一步实验。

图1 光皮桦样品不同裂解液流式细胞分析直方图Fig. 1 Histograms of Betula prepared from different nuclear dissociation solutions
2.2 叶片成熟度对检测效果的影响
由图2c 可知,由于成熟叶次生代谢旺盛,产生大量多糖多酚物质易被氧化,使提取液变得浓稠,无法通过500 目的滤膜,从而干扰MgSO4裂解液的提取效率,使得收集有效颗粒数极少,不到20 个,G1期峰出峰困难,杂峰明显。图2b 中幼叶G1期出峰明显,G2期清晰,收集有效细胞核数比嫩叶稍低,结果清晰可靠。虽然嫩叶的直方图最好,但由于外植体杀菌进行组培培养时间长,培养程序复杂,而幼叶来源简单,采摘方便,更适合野外样品的快速检测,可替代嫩叶制备细胞核悬浮液进行流式检测。
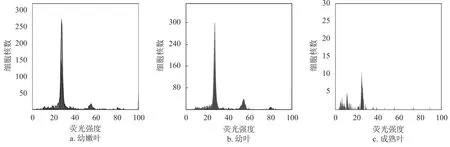
图2 MgSO4 裂解液制备嫩叶、幼叶与成熟叶Fig. 2 The preparation of tender, young and old leaves with MgSO4 buffer
2.3 叶片保存方式对检测效果的影响
由图3a 可知,常温保存的G1期峰明显,杂峰干扰较大。由于常温保存会使叶片中多糖多酚类物质氧化干扰裂解液提取细胞核而产生较大的杂质峰,CV 值为5.00%。图3b 为冷藏保存, G1和G2 期峰明显,杂峰较少,CV 值小于5.00%,这种保存方式较好,但野外采样携带冰盒不便。由图3c 可知,叶片放入1%PVP 液体中也可以减少叶片中多糖多酚物质氧化,从而使细胞核悬浮液检测所得直方图杂质峰较小,G1期峰左右对称,G2期峰明显,能得到冷藏保存的检测效果,且细胞核提取量较高。由图3d 可知,保存时间对提取效果影响巨大,G1期峰左边出现明显杂质峰,CV 值为6.84%,大于5%,一般情况下CV值在5%以下为可信,所以结果不可靠。野外采样为了减少负重,增加样品量将待测幼叶放入1%PVP 中浸泡常温保存并及时上机检测比较好。
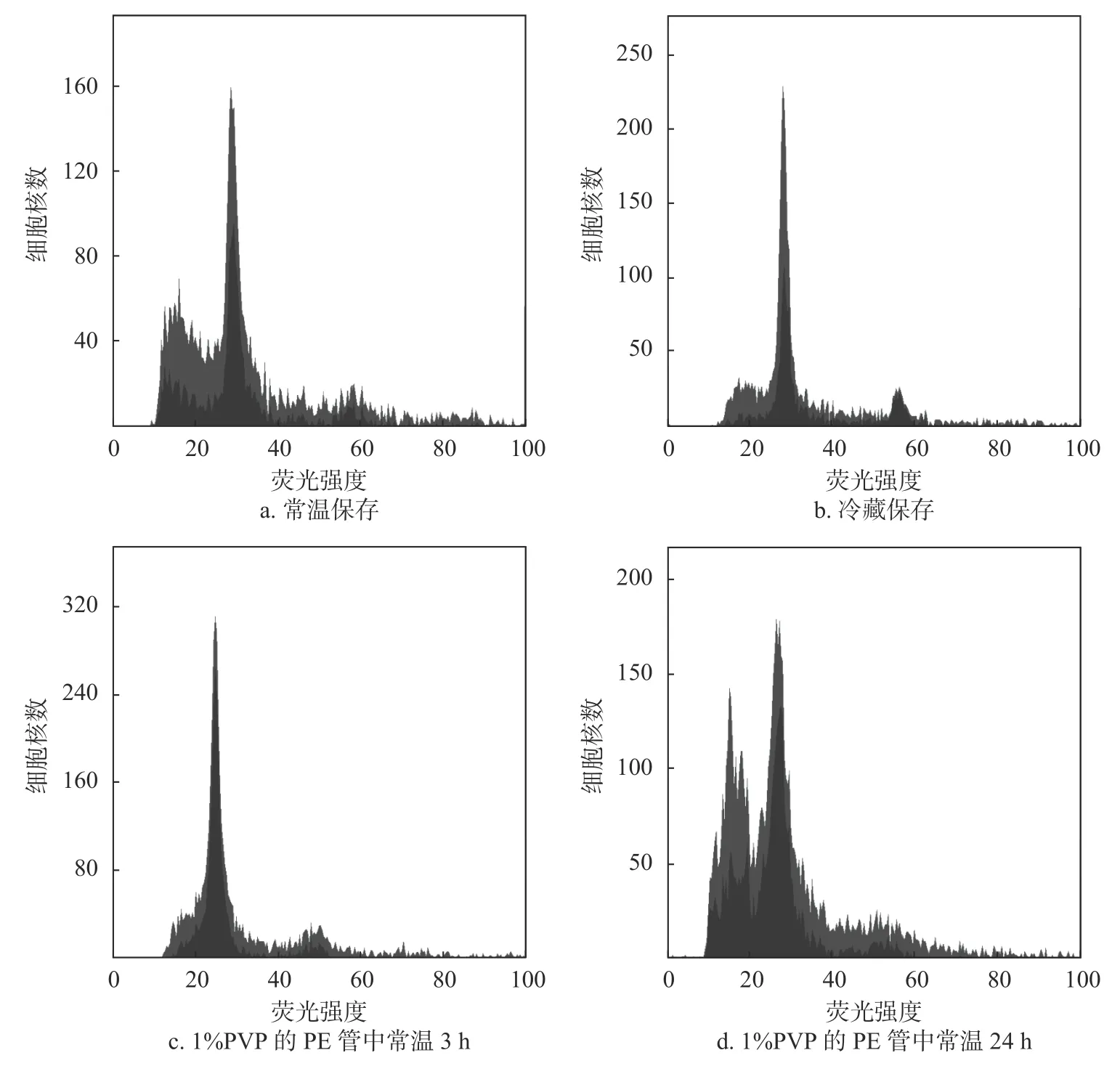
图3 不同保存方式对检测效果的影响Fig. 3 The effect of different preservation methods on detection effect
2.4 桦木属植物不同倍性间荧光强度比较
利用光皮桦筛选所得的流式细胞术体系检测对其余桦木属植物的适用性。由于对照样本杨树(Populussp.)与垂枝桦的基因组大小相近,所以采用外标法进行检测。用已知基因组大小的毛果杨作为对照,检测已知倍性和基因组大小的2 倍体桦木垂枝桦,初步确定对照与待测样本的荧光强度范围,设定检测模板,在同一个模板下对其余6 个桦木属植物进行倍性鉴定。PI 染液可以非特异性结合碱基,适用于基因组大小测定与倍性鉴定,为防止RNA 干扰加入RNaseA,此时的荧光强度可以代表DNA 相对含量[13]。因此,根据DNA 含量计算公式[1]可算出待测样品DNA 含量。以毛果杨为参照估测其余桦木属植物DNA含量,并以垂枝桦为对照估测其余桦木属植物DNA 倍性。结合图4 与表2 发现河桦与垂枝桦的DNA 倍性均为2 倍体,光皮桦 × 河桦DNA 倍性为3 倍体,光皮桦与岳桦的DNA 倍性为4 倍体,坚桦DNA 倍性为6 倍体,黑桦DNA倍性为8 倍体。光皮桦基因组为 (889.29 ± 48.94) Mb,河桦基因 组 大 小 为 (519.78 ± 12.18) Mb,光 皮 桦 × 河桦的DNA 含量在河桦与光皮桦之间,为 (670.66 ±21.81) Mb,估计为3 倍体,由此可证明光皮桦与河桦之间无生殖隔离,这可为未来的倍性育种提供新的依据。
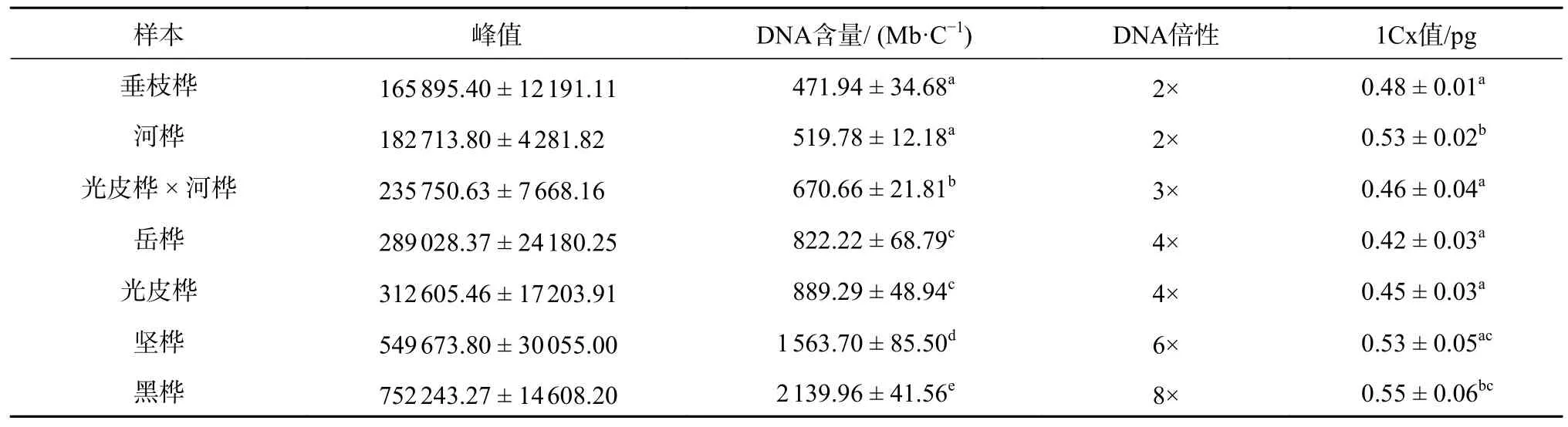
表2 桦木属DNA 含量及倍性估计Table 2 Ploidy and DNA content in Betula
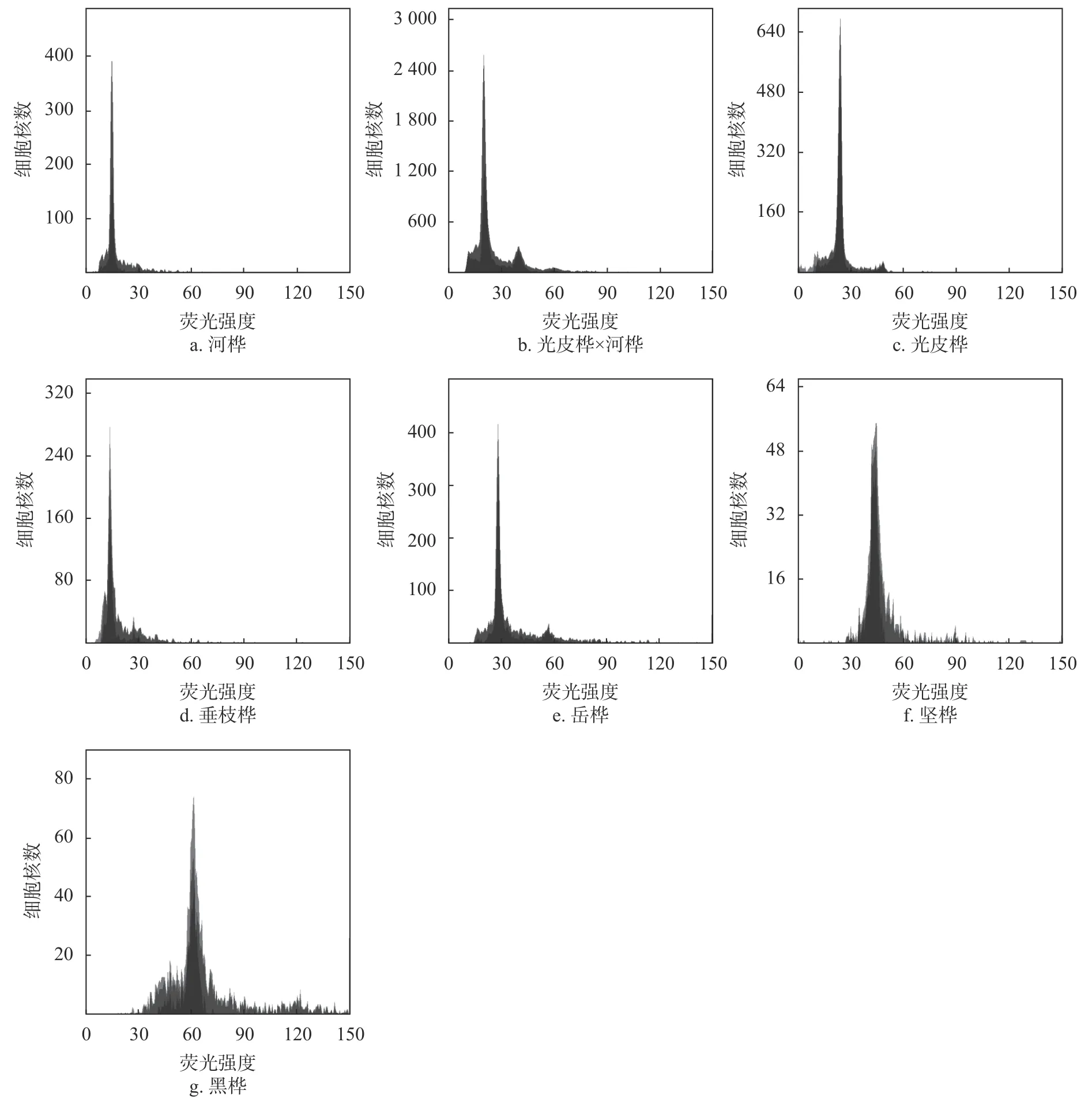
图4 桦木属植物DNA 峰值图Fig. 4 Flow histogram of Betula
分析结果显示,垂枝桦基因组大小为 (471.94 ±34.68) Mb,这与Saloj 等[14]发表的垂枝桦基因组大小(440 Mb)非常相近。此外,岳桦、坚桦、黑桦的基因组大小分别为 (822.22 ± 68.79) Mb、(1 563.70 ± 85.50) Mb、(2 139.96 ± 41.56) Mb。同时,不同倍性桦木的DNA 含量差异显著(P<0.05),相同倍性桦木的DNA 含量差异不显著(表2),由此可以推测桦木属植物多倍体可能是由染色体加倍导致,基因组缩小现象也不明显。为进一步研究桦木基因组大小演变,本研究还计算了1Cx值,其中方差分析发现1Cx 为0.42~0.55 pg,基本分为垂枝桦与河桦两大类,黑桦单独为一类,垂枝桦与光皮桦 × 河桦、岳桦、光皮桦、坚桦的1Cx 值差异均不显著,与河桦、黑桦间1Cx 值差异显著 (P<0.05);河桦与黑桦之间1Cx 值差异不显著;坚桦与黑桦之间1Cx 值差异不显著,黑桦与其余桦木1Cx 值差异均显著(P<0.05)。
3 结论与讨论
FCM 检测具有速度快、重复性好、检测准确等优点,但准确度受植物组织、裂解液、叶片的成熟度和保存方式的影响较大。其中裂解液是FCM 检测倍性实验成功的关键,它决定了细胞核能否完整的被分离出来,细胞核能否被PI 染料染色。目前,还未发现植物的通用裂解液,因此需要筛选甚至优化裂解液来获得最佳的细胞核悬浮液进行上机检测。判断本实验结果可靠性的标准是CV 值[12],CV 值越小,所得峰值结果越可靠,一般来说CV 值小于5%可视为可信。本实验对9 种裂解液进行筛选,最终得出MgSO4裂解液提取效果最佳,CV 值控制在3%以内。FCM 方法鉴定倍性的实验中,不同物种对应的最优裂解液也不同,如对槭属植物解离效果均较好的是LB01 解 离 液[15];Galbraith's 解 离 液 对 莲 瓣 兰(Cymbidium tortisepalum)和墨兰(Cymbidium sinense)样品解离效果最好[16];同时,研究发现使用Galbraith's 解离液对金线莲(Anoectochilus roxburghii)样品的解离效果也较好[17]。桦木属植物叶片含有丰富的多糖与多酚物质,易被氧化,提取时加入500 μL 体积浓度为1%PVP 和裂解液中的TritonX-100 可消除糖类、酚类杂质带来的影响[18],MgSO4裂解液含有稳定核染色体的Mg2+,KCl 可以维持植物细胞渗透压,使细胞不易破碎,减少胞质中的多糖与多酚物质游离出来影响细胞核悬浮液的质量,DTT 的加入使染色质得到保护,进一步消除酚类物质对DNA 染色的影响[11]。选择合适的材料与保存方式可提高FCM 的可行性,通常新鲜幼叶更加容易被检测。叶片的生长状态直接影响到制备的细胞核悬浮液能否用于检测,一般情况下,老叶中的酚类次生代谢产物较多,易被氧化从而破坏细胞核的结构[19],例如栎属植物老叶的细胞核提取产率就远低于幼叶[20]。本研究得出桦木属植物新鲜幼叶在1% PVP 溶液中浸泡常温保存,用MgSO4裂解液制备细胞悬浮液进行检测效果较好。
桦木属植物的材质优良,经济价值高[7],部分种可作为观赏树种,且种间与种内变异丰富,是优良的林木遗传研究材料。然而,桦木属植物的基因组信息还不丰富[9-10],目前在植物DNA C 值数据库中仅包含5 个桦木树种[16]。“1C 值”的概念由Greilhuber 等[21]于2005 年提出,代表一半体细胞DNA 的含量(2C),是统计植物基因组大小的有效指标。本研究发现不同倍性桦木DNA 含量存在显著差异,1C 值在0.42~0.55 pg之间,与Wang 等[8]发现桦木属植物从2 倍体到12 倍体的1C 值在0.42~0.57 pg 之间结果相似。此外,本研究结果中发现垂枝桦与光皮桦倍性不同,但它们之间1Cx 值差异不显著,且坚桦与黑桦也属于类似情况,这可能是由于植物体内多倍化水平由组织器官和发育阶段差异造成。植物不同器官的多倍化水平不一致现象已经在芸薹属[22]、紫薇(Lagerstroemia indica)[23],大麦(Hordeum vulgare)和小麦(Triticum aestivum)[24]等植物中被发现,但桦木属植物中还缺乏类似的研究,未来需要更深入的研究。此外,基因组重复或加倍、DNA 丢失等均是造成基因组C 值差异的重要因素[19],目前国内关于桦木属植物C 值的测定还未展开,还需要更多的研究来分析桦木属植物的基因组变化规律和主要影响因素。
对桦木植物倍性的鉴定中,本实验所测得河桦为2 倍体,但河桦种内变异相对较大,种内存在2 倍体、3 倍体和4 倍体等不同倍性变种[25]。本实验中垂枝桦基因组大小被鉴定为0.48 pg,这与Saloj 等[18]所测基因组0.45 pg 大小相近。光皮桦 × 河桦杂种的倍性为3 倍体,由此可知2 倍体河桦与4 倍体光皮桦间不存在生殖隔离,能通过杂交产生新的桦木种质。大部分情况下,3 倍体植物一般不育,生殖生长所需营养可供给营养生长,使木材的材性更加优良,因此,3 倍体林木的繁育更有利于材质的改良。FCM 鉴定出光皮桦 × 河桦子代倍性为3 倍体,可以为种间杂种鉴定提供一条新的研究道路。此外,FCM 在其他桦木树种上也有成功的应用,如冰岛的沼桦(Betula nana)被鉴定为2 倍体,西伯利亚银色桦(B. pubescens)为4 倍体,沼桦 × 西伯利亚银色 桦(B. nana×B. pubescens)为3 倍 体,平 均1C 值分别为448、666、882 Mb[26],与本研究中的河桦、光皮桦、光皮桦 × 河桦所测结果相似,说明FCM 是鉴定桦木倍性的有效手段,且自然界广泛存在着不同倍性桦木杂交以适应新的环境。相对于传统的染色体计数法来确定植物的倍性,FCM 的研究方法相对简单,工作量较小,对实验室的条件要求也不高,但显微镜以及更先进的扫描电镜对植物染色体进行观察仍然是确定植物倍性最基本的方法,往往多种方法的结合运用才能更精确的鉴定植物倍性。
本研究发现,MgSO4裂解液是提取光皮桦细胞核的最佳裂解液,桦木属植物幼叶次生代谢产物少,适合作为FCM 的检测材料。研究结果分别揭示了垂枝桦、河桦、光皮桦 × 河桦、岳桦、光皮桦、坚桦、黑桦的DNA 倍性和含量,为桦木属植物的基因组学研究、细胞生物学和种质资源研究提供了基础数据。同时,有效的FCM 评估体系的建立,可快速鉴定桦木种间杂交后代的倍性,可为未来选育出适应性强,生长速度快,材质优良的桦木新品种提供重要的技术支撑。
