微小RNA-22对妊娠糖尿病患者糖代谢的影响
2023-03-28曾一文胡可胜
李 伟,曾一文,王 婧,胡可胜,杨 莉
妊娠糖尿病(gestational diabetes mellitus,GDM)是妊娠期常见的并发症之一,危害母体及胎儿健康[1,2]。许多学者认为,胰岛素耐受是发病的关键环节,但是具体机制仍不清楚。糖代谢胰岛素信号通路中最重要的是IRS-PI3K-AKT途径,葡萄糖转运体4(glucose transporter,GLUT4)是该通路的效应因子之一[3]。微小RNA(microRNA,miRNA)是细胞内产生的核苷酸长度18~22 nt的非编码保守RNA,通过结合核苷酸的3′非翻译序列等发挥作用[4]。研究显示,miRNA广泛参与了人体生理病理过程。GDM患者血清miRNA的表达与正常妊娠者的表达谱存在明显差异[5],这些miRNA大多参与调节糖代谢中的胰岛素信号通路[6]。miR-22还可能是调节血糖和脂类代谢的关键因子[7,8],但是调节糖代谢的具体机制并不清楚。本研究对miR-22在GDM胎盘组织和高糖培养HTR8/Svneo细胞的表达情况进行分析,验证miR-22的潜在靶基因。
1 对象与方法
1.1 研究对象 2018-01至2019-01在我院招募志愿者共150人。75例妊娠糖尿病孕妇组(GDM组)的胎盘组织作为观察组,75例正常妊娠孕妇(HC组)作为对照组。排除标准:(1)妊娠前有高血压、糖尿病、甲状腺功能障碍、先天性心脏病、肝炎;(2)双胎妊娠、早产、胎儿畸形或染色体异常;(3)合并急性细菌或病毒感染,应激。本研究经医院伦理委员会批准,伦理审查编号【2018】第012号,所有参与者均签署知情同意书。
1.2 主要仪器与试剂 人绒毛膜滋养层细胞HTR8/SVneo细胞(中原合聚生物科技有限公司);人肝正常细胞(L-02)(尚恩生物);TaKaRa PrimeScript Ⅱ第1链cDNA合成试剂盒和Misccript SYBR PCR试剂盒(日本,TaKaRa);Lipofectamine 2000 转染试剂(赛默飞世尔科技);Opti-MEMI 无血清培养基(上海语纯生物科技);CFX96 Touch实时PCR检测系统(美国,Bio-Rad);分光光度计(美国赛默飞,NanoDropLite)。
1.3 方法
1.3.1 样本采集 在孕中期(20~24周)产检当天空腹采集静脉血测定空腹血糖、空腹胰岛素水平,根据稳态模型法计算胰岛素抵抗指数。组织取样:胎儿分娩后,在胎盘中央带取材,-80 ℃冷冻保存用于后续分析。
1.3.2 细胞培养 人绒毛膜滋养层细胞HTR8/SVneo细胞在普通RPMI-1640培养液(10%胎牛血清,双抗)常规培养。取对数期生长细胞,接种于6孔板(3×105/孔),实验分组:对照组(培养液葡萄糖浓度:5.57 mmol/L),高糖组1(培养液葡萄糖浓度:10.0 mmol/L;HGl),高糖组2(培养液葡萄糖浓度:30.0 mmol/L;HG2),高糖组3(培养液葡萄糖浓度:50.0 mmol/L;HG3)。
1.3.3 miRNA22检测 用TRIZOL试剂从胎盘组织(140 mg),HTR8/SVneo细胞(5×106)提取总RNA。分光光度计(NanoDrop)检测总RNA的量和质量。RT-PCR法检测miR-22,引物:GAAGCUGCCAGUUGAAG;采用cDNA合成试剂盒和PCR试剂盒在PCR检测系统进行QRT-PCR。以U6 snoRNA作为内源性对照,用比较定量循环法(Ct)测定miR-22的相对表达(2-ΔΔCt)。
1.3.4 蛋白表达 (1)细胞转染:HTR8/Svneo细胞转染前1 d,消化HTR8/SVneo细胞,以1∶3的比例各接种3个25 ml培养瓶,转染当天制备ASO-LipofectAmineTM2000复合体。取miR-22类似物、抑制剂稀释至200 μl Opti-MEMI无血清培养液中,混合均匀,转染至高糖处理HTR8/Svneo细胞。(2)Western blot:细胞转染48 h后,提取组织和细胞蛋白,SDS-PAGE10%分离胶电泳分离蛋白,转膜,一抗(羊抗人IRS、羊抗人PI3K、羊抗人AKT和羊抗人GLUT4)室温下孵育2 h,TBS洗涤后二抗(辣根过氧化物酶标记的兔抗羊IgG)孵育1.5 h,化学发光法显影,图象处理系统分析目标带的分子量和净光密度值。
1.3.5 体外葡萄糖消耗实验 (1)构建质粒:查询数据库http://www.targetscan.org,发现通路中有两个基因SLC2A4(Glut4)、AKT1受miR-22调控作用明显,根据3′非翻译序列设计SLC2A4、AKT1野生型和突变型序列,通过Takara酶将野生型和突变型片段克隆至psiCHECK2质粒。(2)质粒转染:质粒用Lipofectamine 2000 转染到细胞中,培养24 h后弃去培养液,用PBS洗涤1遍。(3)葡萄糖消耗实验:HTR8/Svneo细胞质粒转染后继续培养24 h,吸取上清培养液,用葡萄糖试剂盒测定培养液中葡萄糖的浓度,计算葡萄糖的消耗量。
1.3.6 GLUT4基因检测 (1)质粒构建与转染:方法同1.3.5;(2)基因检测:HTR8/Svneo细胞接种到24孔板(细胞浓度为 1×105/ml ),将HTR按顺序将miRN A(20 pmol)、质粒(0.48 μg)和Opti-MEM(50 μl)、lipo2000(2 μl)和Opti-MEM(50 μl)混合后静置孵育,24 h后,加入细胞裂解液100 μl,振荡器上室温裂解。避光条件下分别检测两种荧光素荧光值,计算得到相对荧光素值(RLU)。
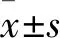
2 结 果
2.1 一般情况 平均年龄:HC组(26.46±2.1)岁,GDM组(27.54±2.8)岁;孕前体重指数(BMI):HC组(24.09±2.31)kg/m2,GDM组(25.17±1.65)kg/m2,差异均无统计学意义。两组胰岛素抵抗指数:HC组1.62±0.71,GDM组3.03±1.06,差异具有统计学意义(P<0.05)。
2.2 miR-22表达 qPCR检测两组胎盘组织中miR-22的转录水平变化情况,发现miR-22在HC组表达明显高于GDM组(P<0.001),并且与胰岛素抵抗指数呈负相关(R=-0.398,P<0.01)(图1 A)。以梯度高糖培养HTR8/Svneo细胞模拟GDM条件下的胎盘组织,qPCR检测miR-22表达变化,发现随着葡萄糖浓度增高细胞miR-22表达降低,HG1组、HG2组、HG3组分别为0.85±0.12、0.73±0.06、0.39±0.16,与对照组比较,差异有统计学意义(P<0.01,图1B)。

图1 miR-22的转录水平表达情况
2.3 蛋白表达 Western blot分析GDM和HC组胎盘组织胰岛素信号通路相关蛋白,发现GDM组织中的IRS、PI3K、AKT和GLUT4表达明显低于HC组(图2A)。转染miR-22类似物的高糖培养HTR8/Svneo细胞的GLUT4表达明显高于HC组,转染miR-22抑制物高糖培养细胞HTR8/Svneo细胞的GLUT4表达明显低于HC组,差异有统计学意义(P<0.01)。在miR-22类似物或抑制物转染HTR8/Svneo细胞中IRS、PI3K、Akt表达均低于HC组,miR-22表达与GLUT4表达呈正相关差异有统计学意义(P<0.01,图2B)。
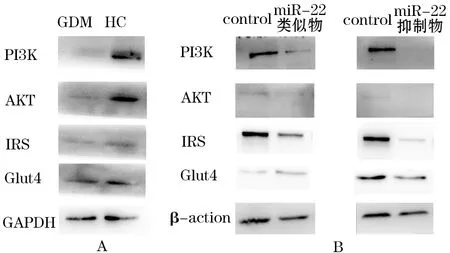
图2 胰岛素信号通路蛋白表达
2.4 GLUT4基因检测 双荧光素酶报告基因系统检测slc2a4(GLUT4基因)、 AKT野生型和突变型质粒与miR-22相互作用,结果显示,miR-22类似物组的荧光值明显低于类似物对照组[(0.68±0.09)vs(1.06±0.25)]、而miR-22抑制剂组明显高于抑制剂对照组[(1.87±0.18)vs(1.06±0.12)](图3),提示miR-22明显降低了野生型slc2a4的荧光素活性,而对AKT没有作用。
2.5 葡萄糖摄取 细胞转染miR-22类似物,miR-22过表达,细胞的体外葡萄糖摄取率(0.89±0.09)%明显高于对照组[(0.76±0.11),P<0.05];miR-22受抑制时,葡萄糖摄取率(0.45±0.06)%明显低于对照组。提示细胞过表达miR-22,有促进体外细胞摄取葡萄糖的作用。
图3 miR-22和SLC2A4相互作用的双荧光素酶
3 讨 论
GDM主要的发病机制是胰岛素抵抗,越来越多的研究发现miRNA表达与胰岛素抵抗密切相关[5,6,9]。本研究首次报道miR-22在GDM胎盘组织中和体外高糖培养细胞中表达均明显降低,并且miR-22表达与胰岛素抵抗指数呈负相关,提示miR-22可能参与了胎盘组织胰岛素抵抗。当胰岛素抵抗发生时,糖代谢IRS/PI3K/AKT通路被阻断。有趣的是,细胞体外高糖处理与miR-22的表达也呈负相关,因此探讨miR-22对胰岛素信号转导中IRS-PI3K-AKT通路蛋白的调控作用具有重要意义。
GLUT4是由SLC2A4基因编码的蛋白,在胰岛素信号激活后可以从胞质转移至细胞膜[10],促进葡萄糖的摄取。GLUT4在胎盘组织主要定位于合体滋养细胞质及细胞膜中[11]。本研究western blot结果显示,在GDM胎盘组织,IRS、GLUT4等表达明显下调,与冯卫红等[12]研究的结果一致。低表达的GLUT4与明显下降的miR-22参与的胰岛素抵抗可能密切相关。miRNA可能同时对多个靶点有调节作用,生信分析提示胰岛素信号通路中的GLUT4和AKT基因可能是miR-22的靶基因,本研究进一步的双荧光素酶报告实验证实miR-22在胰岛素信号通路中主要调节靶点是GLUT4。在GDM中GLUT4 表达下降可能是胰岛素信号转导通路出现障碍的重要原因。体外细胞葡萄糖摄取实验结果提示高表达的miR-22可以促进葡萄糖的摄取,从而在胰岛素耐受中发挥保护作用。传统的观点认为,miRNA在细胞内通过与目标mRNA的3′UTR结合, 导致靶mRNA的翻译受到抑制或降解从而发挥转录后抑制基因表达的作用。Shi等[13]发现, miR-222在GDM妇女产后网膜脂肪组织中表达上调,功能实验发现,小鼠3T3-L1脂肪细胞中miR-222的表达增加抑制了雌激素受体及Glut4的表达,从而表现出糖代谢障碍、胰岛素抵抗。miRNA的作用模式不仅仅限于转录后抑制mRNA翻译,Vasudevan等[14.15]发现 miRNA不总是基因表达的负调控因子,在一些条件下miRNA 也可通过影响mRNA稳定性元件或者结合到mRNA5'UTR而上调基因表达。此外,miRNA还可能通过在细胞核内作用而正向调节基因;Huaping等[16]发现,miR-320在细胞核内以一个小激活RNA的角色促进CD36的转录,从而正向调节基因的表达。据此推测,本研究中miR-22有可能是通过核内和其他的机制调节GLUT4的表达,当然这需要进一步的研究来证实。
本研究发现,GDM胎盘组织和体外高糖培养细胞miR-22表达降低,而细胞过表达的miR-22能够增高GLUT4表达并能增强体外细胞摄取葡萄糖能力,miR-22可能通过调节GLUT4基因表达而参与调控胰岛素抵抗过程,提示miR-22可能在GDM发病机制起重要作用。
