二肽基肽酶家族与恶性肿瘤的研究进展
2023-03-27武洲英
郅 慧 武 婷 武洲英 俞 兰
二肽基肽酶(dipeptidyl peptidase, DPP)是一类通过作用于肽链两端的肽键,切割肽段的N末端,影响蛋白质稳定性的氨基肽酶。DPP家族成员众多,包括DPP1、DPP2、DPP3、DPP4、DPP5、DPP6、DPP7、DPP8、DPP9、DPP10、DPP11,功能各异,广泛分布于全身各系统、组织、器官,参与调节细胞代谢、信号转导。DPP被发现以来,研究大多集中于慢性炎性病变及代谢异常;其中以心血管疾病、糖尿病和自身免疫病为热点方向。近年来研究发现,在恶性肿瘤独特的生长代谢过程中,DPP身影频现,于是DPP开始成为肿瘤研究的关注点之一。本文就近年来DPP家族各成员在恶性肿瘤发生、发展方面的研究进行综述,以期为后续的相关研究梳理思路。
一、DPP1
DPP1又被称作组织蛋白酶,位于染色体11q14.1~q14.3,是一种四聚体形式的半胱氨酸DPP,表达广泛。DPP1在癌细胞中常见高表达,具有促癌作用,通过多种信号通路调节肿瘤的进展。
据报道,原发性乳腺癌中未检测到DPP1或处于低水平表达,并验证了DPP1对原发肿瘤的生长无影响;但在乳腺癌肺转移瘤上却检测出DPP1高表达,DPP1通过酶促中性粒细胞结合蛋白促进IL-1β的加工和NF-κB的激活,促进中性粒细胞的募集,其炎性微环境有助于肿瘤细胞在肺部定植;另一方面,IL-1β激活MAPK途径,促进中性粒细胞外陷阱形成,双重作用下促成了乳腺癌细胞的肺转移,在沉默DPP1后可以抑制肿瘤的肺部转移,为肿瘤的干预提供了又一思路和可能有效的作用靶点[1]。
在结直肠癌细胞中靶向抑制DPP1后,加强自噬小体的形成过程,减缓降解并阻止与溶酶体的融合,诱导依赖caspase的细胞凋亡途径,显著降低结直肠癌细胞的增殖,促进癌细胞死亡。同时使用姜黄素后体内实验观察到肿瘤体积缩小[2]。因此沉默DPP1可能增强了姜黄素诱导结直肠癌细胞的凋亡,即提高了药物的敏感度。
DPP1也能调控细胞周期而促进癌细胞生长,DPP1在胃癌中表达显著上调,其缺失显著降低胃癌细胞的增殖,并诱导细胞阻滞于G0/G1期,幽门螺杆菌感染与胃癌发生率和病死率呈正相关,但在幽门螺杆菌感染患者胃黏膜中DPP1却是低表达,目前该机制还有待于深入探讨[3]。另外DPP1激活TNF-α/p38 MAPK通路和Akt/miR-129-5p通路,分别参与了肝癌和肾细胞癌的发生、发展,敲除DPP1后均可见肿瘤细胞生长抑制[4, 5]。
二、DPP2
DPP2位于9q34.3,与DPP7有78%的同源性,二者作用的底物完全相同,具有非常相似的动力学,被认为是相同的蛋白酶。笔者在这里把两者合并叙述,关于两者在肿瘤方面的研究并不充分。
DPP2最常见的作用是参与细胞凋亡,阻止静止期细胞进入细胞周期,慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)中,滞留在G0期的B淋巴细胞堆积,用DPP2特异性低分子抑制剂干扰DPP2蛋白酶活性后,诱导CLL细胞周期发生紊乱,细胞周期抑制因子损失,使B淋巴细胞活化进入细胞周期[6]。用HBV感染肝癌细胞后发现DPP7的表达水平降低,并观察到细胞出现凋亡;随后将野生型肝癌细胞的DPP7敲除,发现凋亡相关蛋白Bax上调,故DPP7的下降可能是细胞凋亡增加的原因之一。
三、DPP3
DPP3首次发现于牛垂体中,位于染色体11q13.2。DPP3包含上、下两个结构域,锌离子和催化位点处于中间的裂隙中,通过其锌结合基序(HELLGH)与单个锌离子结合,达到最大活性,其中的锌离子可水解含3~10个氨基酸残基的多肽;因此,DPP3被看作是一种锌依赖的金属蛋白酶。DPP3参与多种生理、病理过程,例如炎症、痛觉感受、血压调节等活动,近年来有研究报道,DPP3能保护足细胞足突免受损伤、降低心肌纤维化和炎性细胞浸润的程度,对因糖尿病继发的心脏及肾脏功能损害起缓解、保护作用[7]。因此认为在糖尿病的治疗中有潜在作用。
但有关DPP3在癌症中的作用讨论并不多,最初在子宫内膜癌中发现DPP3表达增高,在卵巢癌中其表达水平与恶性程度呈正相关,但并未做深入机制探讨。近年来研究发现,乳腺癌中DPP3的转录和蛋白水平均高于对照,且与不良预后呈显著正相关[8]。随着基因编辑等技术的飞速发展,DPP3在肿瘤发生和发展进程中的作用逐渐浮出水面。DPP3参与NRF2-KEAP1通路的调节,人们普遍认为氧化应激在肿瘤的发生中有重要的作用。在雌激素受体阳性的乳腺癌、肺鳞癌、肝细胞癌、多发性骨髓瘤中见有过表达的DPP3[9, 10]。有研究者认为,在机制上可能与核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, NRF2)有关,正常情况下Kelch 样 ECH 相关蛋白 1(kelch-like ECH-associated protein 1, KEAP1)与胞质中的NRF2结合,促进NRF2泛素化,保护细胞免受氧化应激损伤,DPP3能通过位于柔性环上的ETGE基序与KEAP1的Kelch结构域竞争性结合,减少NRF2与KEAP1的结合,降低NRF2泛素化,促进NRF2的积累,而新生的NRF2移位入细胞核,与抗氧化反应元件(antioxidant response element, ARE)结合,调控相应靶基因的表达。虽然正常情况下,NRF2的积累激活了细胞防御系统以抵御各种疾病,但在某些癌细胞中,过表达DPP3诱导的NRF2积累可以创造一个氧化环境,导致ROS稳态失衡,促进肿瘤的生长和增加耐药性,异常的KEAP1-NRF2已成为癌症中的关键调控途径,靶向DPP3的催化功能来控制KEAP1-NRF2是非常有可能的(图1)。
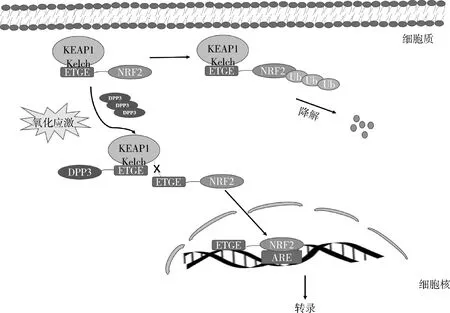
图1 DPP3与NRF2的关系
结直肠癌中DPP3的表达较正常组织明显增高,和不良预后呈正相关,敲除DPP3后,细胞阻滞于G2期,发生凋亡、侵袭和迁移能力明显受到抑制[11]。目前DPP3对其他恶性肿瘤的作用还未见报道。血管紧张素(angiotensin, Ang)(1-7)激活G蛋白偶联受体发挥其抗肿瘤细胞增殖和抗血管生成的有益生物学效应,是一种治疗癌症前景广阔的着力点之一;但DPP3使其生物利用度降低,抗肿瘤生长的作用被大大削弱,因此DPP3在肿瘤中的高表达可能是抗癌治疗中的阻碍。
四、DPP4
DPP4也被称为CD26,位于染色体2q24.3,是具有丝氨酸蛋白酶活性的Ⅱ型跨膜蛋白,以二聚体形式存在,广泛表达于内皮细胞、免疫细胞、肝脏等。DPP4能降解多种肽类物质、趋化因子等,使其失活。在体液中存在可溶性DPP4(soluble DPP4, sDPP4),它缺乏跨膜区,在特定环境中从细胞表面脱落进入循环。DPP4在恶性肿瘤中的作用不尽相同,具有促癌和抑癌双重作用,主要取决于肿瘤部位、类型和肿瘤环境。
干扰素γ诱导的趋化因子CXCL10,在癌症发展过程中起重要作用,它能激活CXCR3和非典型趋化因子受体(atypical chemokine receptors, ACKR)两种受体[12]。DPP4降解CXCL10,使CXCR3+T细胞和NK细胞向肿瘤微环境的募集和迁移减少。对肝细胞癌和HIV感染者的研究证明,使用DPP4抑制剂可保护CXCL10的全长生物活性,增强排斥肿瘤反应,抑制肿瘤生长。ACKR2是新发现的CXCL10受体,可清除炎性趋化因子。CXCL10激活ACKR2,原定位于核周腔的ACKR2迅速被动员到细胞膜上,与配体CXCL10结合使其被摄入细胞内,在胞外的利用度相应下降。DPP4切割CXCL10后,募集至细胞膜的ACKR2减少,对胞外CXCL10的摄取也明显减少,提示未来可利用DPP4的切割作用研发肿瘤免疫治疗的方法。
在恶性肿瘤的研究上发现甲状腺乳头状癌(papillary thyroid cancer, PTC)中DPP4的表达明显增高,并与甲状腺外侵犯、BRAF突变和肿瘤分期呈正相关,当敲除DPP4后肿瘤细胞迁移和侵袭减缓70%~75%[13]。而循环中sDPP4水平和肿瘤晚期、淋巴结转移、分期也呈正相关,可作为PTC诊断和预后的一项标志物[14]。在人恶性间皮瘤(malignant mesothelioma, MM)中,DPP4上调使MM细胞分泌一种促进肿瘤扩散和转移的细胞外基质蛋白,用抗DPP4单克隆抗体治疗后,使细胞周期阻滞于S/G1期,诱导MM细胞裂解,并抑制增殖[15]。DPP4在乳腺癌中同样高表达,尤其是转移性乳腺癌,乳腺癌细胞中过表达DPP4后克隆形成数量显著增加,而敲除后上述作用减弱甚至消失[16]。但近年来也有研究报道,DPP4在乳腺癌中相较于正常组织下调,与不良预后有关[8]。考虑到肿瘤的异质性以及微环境的差异,还需大样本量的临床分析验证。
长期抑制DPP4可能是有害的,尤其是使用一些特异性、高选择性的抑制剂,有关研究指出DPP4抑制剂导致罹患乳腺癌的风险增高和细胞耐药,敲除后小鼠乳腺癌模型的原发肿瘤进展加快并出现肺转移[17]。因此虽DPP4在恶性肿瘤中作用逐渐明朗,但目前还没有任何DPP4抑制剂用于抗癌,综合比对其有效性和风险后,是否有合适的治疗方式值得进一步研究和探讨。
DPP4在肿瘤中的不同作用因肿瘤实体和微环境的不同而各有差异,脑胶质瘤中DPP4的抑癌作用可能与降解能诱导细胞生长、增加侵袭的CXCL12有关[18]。而且,近年来研究发现,侵袭性和转移性前列腺癌的DPP4表达降低,使CXCL12的降解减少,增加了前列腺癌的侵袭和转移能力,该研究提示了DPP4的潜在抗肿瘤效应[19]。鉴于DPP4在恶性肿瘤中相互矛盾的表达,接下来还需从肿瘤微环境、免疫多层面和更多的临床样本来进行更深入的探索和验证。
五、DPP8/9
DPP8/9和DPP4归为一类家族成员,与DPP4有很高的同源性,但只在细胞内表达。正常状态下,DPP8/9直接与caspase激活和募集结构域蛋白8(caspase activation and recruitment domain-containing protein 8, CARD8)和NLR家族Pyrin域蛋白1(NLR family pyrin domain containing 1, NLRP1)的FIIND结合,抑制炎性小体的自发激活。使用DPP8/9的低分子抑制剂后,破坏复合物之间介导自身抑制的ZU5亚域,诱导炎性小体活化,这为DPP8/9的低分子抑制剂的抗肿瘤作用提供了理论依据。在人类急性髓系白血病中,DPP8/9低分子抑制剂诱导CARD8 的N端含160个氨基酸残基的无序区降解,诱导焦亡,发挥抗肿瘤能力[20]。此外,DPP8/9抑制剂也能诱导多发性骨髓瘤产生细胞凋亡,为多发性骨髓瘤的治疗提供了又一靶疗的思路[21]。
DPP9在不同肿瘤中扮演的角色也并不相同。DPP9蛋白参与细胞信号转导,具有肿瘤抑制功能,如诱导凋亡、抑制增殖和阻止癌基因Akt的激活,在部分高分化的浆液性卵巢癌中,DPP9表达下调。Marianne等[22]研究发现,存在DPP9的重排,导致其抑制肿瘤功能丧失。而在一项非小细胞肺癌的研究中发现,肿瘤组织中的DPP9表达增高,在敲除DPP9后抑制癌细胞增殖、迁移和侵袭,与之前不同的是,有研究发现,DPP9功能丧失的患者常患有肺癌,但机制尚未阐明。同样,肝癌和结直肠癌中的DPP9高表达代表了不良预后和生存期的缩短,DPP9在睾丸癌中的表达也显著增加,但是,在口腔鳞状细胞癌的患者中,DPP9的低表达与低存活率相关,DPP9的敲低在体内和体外都加速了癌细胞的生长[23, 24]。由此可见,DPP9在不同肿瘤中的表达各异,由于目前缺乏分别针对DPP8和DPP9的高度特异性抑制剂,用于临床还需进行更深入的研究和观察。
六、DPP家族其他成员
目前对于DPP5和DPP11在肿瘤方面的作用鲜有研究,两者目前研究主要在牙龈卟啉单胞菌引起的牙周疾病上,在其他疾病上还未见报道[25]。
DPP6是一种Ⅱ型跨膜蛋白,作为电压门控A型Kv4.2钾通道复合体的调节亚单位,促进细胞表面钾通道KCND2的表达。肺腺癌中位于DPP6上的甲基化标记可将肺腺癌从正常细胞中区分出来。虽然有报道称DPP6可能参与胰腺癌的恶性进展,但机制也尚不清楚[26,27]。
DPP10结构与DPP4相似,但由于丝氨酸被甘氨酸残基取代,其活性位点发生点突变而缺乏DPP4酶活性。部分结直肠癌的病例中DPP10缺失,然而在非甾体类抗炎药使用的人群中,DPP10表达越高,患大肠癌的风险越低[28]。虽然DPP10和肿瘤之间研究不多,但DPP10调节钠、钾通道的功能很可能对肿瘤细胞的增殖、周期或凋亡等产生影响。
七、展 望
综上所述,DPP家族各成员活跃在各系统的肿瘤,但不同DPP在肿瘤中的作用不同,即使同一个DPP,在同一肿瘤的不同阶段也观察到相反的结果,可能与不同的通路、肿瘤的异质性、伴随其它基因的异常调控谱不同、肿瘤微环境均有关。DPP家族成员在糖尿病等疾病中机制和药物治疗趋于成熟,但在不同类型和分期的肿瘤中还需进行更深入细化的机制研究,在明确机制的基础上找到有效且不良反应小的治疗靶点可显著提高患病后的生存率,对未来防治、筛查、早诊、精准治疗等方面均潜力巨大,阐明更精准的肿瘤特异性调控机制将为未来肿瘤防治提供思路和实用性方法。
