lncRNA HOTAIR/miR-17-5p/Smad7通路调控激素性股骨头坏死的机制研究
2023-03-27张峥崔泳王翀丁路王武黄涛
张 峥 崔 泳 王 翀 丁 路 王 武 黄 涛
糖皮质激素(glucocorticoids, GC)被广泛用于治疗自身免疫性疾病,但治疗后2年内易出现骨坏死症状[1,2]。糖皮质激素性股骨头坏死(steroid induced necrosis of femoral head,SONFH)已涉及年轻人,严重影响患者的生活质量[2]。然而,激素性股骨头坏死的发病机制尚不清楚。研究显示,人骨髓间充质干细胞(human bone marrow mesenchyml stem cells,hBMSCs)与骨坏死的发生、发展密切相关[3]。因此,研究hBMSCs的异常成骨分化机制在激素性股骨头坏死的治疗中有重要意义。
长链非编码RNA(long non-coding RNA, lncRNA)HOTAIR是一种关键的致癌lncRNA,参与细胞增殖、凋亡与分化的调节[4]。已知lncRNA和微小RNA(miRNA)的相互作用可以影响hBMSCs的成骨分化,且上调miR-17-5p抑制成骨[5,6]。但在激素性股骨头坏死中HOTAIR对miR-17-5p的调控关系鲜有报道。因此,本研究探讨激素性股骨头坏死中HOTAIR的异常表达对hBMSCs的成脂和成骨分化的影响以及对预测靶基因的调控作用。
材料与方法
1.受试者和标本采集:骨髓样本取自2018年4月~2020年3月在笔者医院接受手术的25例激素性股骨头坏死患者和25例股骨颈骨折患者。根据Steinberg或宾夕法尼亚大学的系统,术前X线片和磁共振诊断激素性股骨头坏死。所有服用超过1800mg 糖皮质激素或长期糖皮质激素治疗超过4周的激素性股骨头坏死患者均纳入研究,同时排除心血管疾病、先天性疾病或肿瘤相关疾病的患者。将25例激素性股骨头坏死患者骨髓组织命名为激素性股骨头坏死组;将25例股骨颈骨折患者的骨髓组织命名为正常对照组,股骨颈骨折患者没有糖皮质激素治疗史。将25例激素性股骨头坏死的患者命名为激素性股骨头坏死组。所有参与者均签署了书面知情同意书,本研究获得了笔者医院医学伦理学委员会批准(伦理审批号:20180182-91)。
2.实验试剂耗材:hBMSCs购自武汉普诺赛生命科技公司;地塞米松(dexamethasone,DEX,ID0170)和茜素红染液试剂盒(G8550)购自美国Solarbio科技有限公司;β-甘油磷酸钠(G8100)和抗坏血酸(A8100)购自美国Sigma-Aldrich生物科技有限公司;3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛及油红O染色液(G1262)购自北京索莱宝科技有限公司;丽春红S(3761-53-3)购自上海国药集团化学试剂有限公司;电化学(electrochemiluminescence, ECL)发光液(ECL-0011)购自北京鼎国生物技术有限责任公司;碱性磷酸酶测试盒购自南京建成生物工程研究所有限公司 A059-2;Trizol购自美国英杰生命技术有限公司;SYBRGreen PCR试剂盒购自德国Qiagen公司;real-time检测仪(ABI-7500)购自美国应用生物系统公司。
3.hBMSCs培养:hBMSCs在含10%胎牛血清的低糖DMEM培养基中培养,培养环境为37℃,含5% CO2,每3天更换新鲜培养基。将hBMSCs细胞分为两组,分别命名为对照组和地塞米松组。收集5×105个/毫升正常培养的细胞用于对照组,而地塞米松组hBMSCs则在上述培养基中加入1×10-7mol/L的地塞米松30μl,其余方法不变,收集5×105个/毫升细胞用于检测。
4.细胞转染:过表达HOTAIR载体(过表达HOTAIR组)和空载体(空载组),miR-17-5p的拟似物(miR-17-5p-mimics, mimic组)、miR-17-5p的抑制剂(miR-17-5p-inhibitors, inhibitor组)和二者相应的阴性对照(negative control, NC组)均构建于上海GenePharma公司;mimic、inhibitor、NC的转染方法均根据制造商的说明执行操作,通过 Lipofectamine 2000(美国Invitrogen公司)进行转染。反转录-定量聚合酶链反应(RT-qPCR)用于确定转染效率。
5.RT-qPCR 检测:根据制造商的说明,TRIzol 试剂(美国Invitrogen公司)用于从25例正常对照组和25例激素性股骨头坏死组骨髓组织中分别提取总RNA。从对照组hBMSCs细胞和地塞米松组hBMSCs细胞中分别提取细胞总RNA。通过PrimeScript RT-PCR试剂盒提取总 RNA 用于 cDNA 的反转录。随后,通过SYBR Green PCR试剂盒在ABI 7500实时PCR系统上进行RT-PCR。mRNA相对表达量采用2-ΔΔCt法计算,以GAPDH或U6为内参。引物方向如下:HOTAIR上游引物为 5′-TGATAGGATACATCTTGGACATGGA-3′,下游引物为5′-AACCTAATGAAACAAGTCCTGACATACA-3′;miR-17-5p上游引物为5′-CGCGAATTCTTGAGGTGAGGCTCAGGAGG-3′,下游引物为5′-ACGGGATCCTTGGCTACAGGCAAAGGGTT-3′;U6上游引物为 5′-CTCGCTTCGGCAGCAGCACATATA-3′,下游引物为 5′-AAATATGGAAACGCTTCACGA-3′; Smad7上游引物为 5′-TCGAAGTTCATTCCGTTAGCGCGAGC-GAATCCT-3′,下游引物为5′-TCCAGTACGGTACCGCCTGCCGCCTCAA-3′;RUNX2上游引物为5′-TCGCACGTCAAGTCACAGGCCGGAATATCGT-3′,下游引物为5′-CAGCTTAAGCCACATGGGGACCTAG-CTCTGA-3′; PPAR-γ上游引物为 5′-GTCGCGGATCATGTGAGGACCGTTCCAGCTTA-3′,下游引物为5′-GAGDCTTGATCCCTTCGTGAGCGCAGTCGC-3′。PCR扩增后,实时荧光定量PCR仪自动分析结果,计算公式如下:△Ct= Ct目的基因-Ct内参,记为ΔCt对照,用各组的ΔCt分别减去ΔCt对照平均,求得ΔΔCt值,再计算各组2-ΔΔCt值,即为各组中基因的相对表达量。
6.Western blot法检测:BCA测定hBMSCs中总蛋白的浓度。将等量的蛋白质(30μg)进行 10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳并转移到PVDF膜上。用5%脱脂牛奶封闭后,将膜与 Smad7(1∶500)和GAPDH(1∶1000)的一抗在4℃下孵育过夜。随后将膜与HRP 标记的二抗(1∶5000)在37℃下孵育1h。用ECL系统显示蛋白条带,用ImageJ -lab 3.0分析条带强度。
7.双荧光素酶报告基因检测:通过StarBase预测HOTAIR与miR-17-5p的潜在结合位点,上海吉玛公司合成相关的引物[HOTAIR突变型(HOTAIR-MUT)和HOTAIR野生型(HOTAIR-WT)]基因制药。将hBMSCs接种在96孔板中直到生长到约85%的浓度,并使用lipofectamine 2000联合转染mimic和HOTAIR-MUT或OTAIR-WT,或用lipofectamine 2000联合转染NC和HOTAIR-MUT或OTAIR-WT。分别设置为mimic组和NC组、HOTAIR-MUT组、HOTAIR-WT组。转染48h后,用双荧光素酶报告基因检测试剂盒(上海碧云天生物技术有限公司)检测相对荧光强度。
通过StarBase预测 Smad7与miR-17-5p的潜在结合位点,上海吉玛公司合成相关的引物[Smad7-3′UTR突变型(Smad7-3′UTR-MUT)和Smad7-3′UTR野生型(Smad7-3′UTR-WT)]基因制药。将hBMSCs接种在96孔板中直到生长到约85%的浓度,并使用lipofectamine 2000联合转染mimic和Smad7-3′UTR-WT(mimic+Smad7-3′UTR-WT组),或联合转染mimic和Smad7-3′UTR-MUT(mimic+Smad7-3′UTR-MUT组),或者联合转染NC和Smad7-3′UTR-WT(NC+Smad7-3′UTR-WT组)。转染48h后,用双荧光素酶报告基因检测试剂盒(上海碧云天生物技术有限公司)检测相对荧光强度。
8.细胞成骨诱导和成脂诱导实验分组:hBMSCs分为hBMSCs组、hBMSCs+成骨诱导液组、hBMSCs+成骨诱导液+空载组、hBMSCs+成骨诱导液+过表达HOTAIR慢病毒组、hBMSCs+成脂诱导液组、hBMSCs+成脂诱导液+空载组和hBMSCs+成脂诱导液+过表达HOTAIR慢病毒组。利用成骨诱导液和成骨诱导培养基100ml(含10% FBS,2%双抗,0.01μmol/L DEX,10mmol/L β-甘油磷酸钠,50mg/L抗坏血酸)诱导成骨分化。将100μl 1×105个/毫升的P3代细胞的单细胞悬液滴加至细胞爬片进行孵育,2h后向培养皿内加入DMEM完全培养基2ml孵育,24h后首次换液,并将培养液换为成骨诱导培养液,2~3天进行换液,培养至14天,取细胞上清进行碱性磷酸酶活性测定和茜素红染色。细胞成脂诱导:①BMSCs接种到35mm细胞培养皿,并在含有10%FBS的DMEM培养基中进行培养;②待细胞贴壁并长到90%时,换成成脂诱导培养基进行培养(成脂诱导培养基:DMEM,10μg/ml胰岛素,1μmol/L DEX,0.5mmol/L IBMX,0.1mmol/L吲哚美辛);③3天换液1次,诱导分化14天。按照“RT-qPCR检测”项中的方法检测每组hBMSCs细胞中RUNX2和PPAR-γ的表达。
9.茜素红染色:细胞接种于6孔板内,诱导培养至28天时进行茜素红染色。具体染色步骤:取出6孔板,弃尽原培养液,无菌PBS漂洗2次;4%多聚甲醛固定15min;弃固定液,双蒸水漂洗3次;每孔加入0.2%茜素红染液2ml,染色30min;弃去染料,双蒸水漂洗5次;充分漂洗后,每孔加入适量双蒸水防止孔内干燥,显微镜下观察拍照。
10.碱性磷酸酶ALP活性测定:吸取诱导分化14天各组中细胞的培养液,1000~1500r/min,离心10min,取上清液备用;酚标准应用液配制:1.1mg/ml酚标准贮备液∶蒸馏水=1∶54,现配现用;轻轻振荡孔板,520nm波长测定各孔吸光度(A)。
11.油红O染色:将各组诱导分化14天的细胞弃去上层培养液,用PBS清洗3次;每孔加入1ml 10%中性甲醛固定30min,PBS洗涤3次;加入0.5%油红工作液,避光染色1h;异丙醇漂洗,洗去多余染料,加PBS拍照观察。

结 果
1.DEX处理的hBMSCs中HOTAIR/miR-17-5p/Smad7的表达:激素性股骨头坏死组中HOTAIR和 Smad7的表达较对照组上调(P均<0.05),而miR-17-5p下调(P<0.05,图1中A~C)。地塞米松组hBMSCs的增殖率较对照组降低,而HOTAIR和 Smad7的mRNA表达上调,miR-17-5p表达水平降低(P均<0.05,图1中D~G)。

图1 激素性股骨头坏死的骨髓组织和地塞米松处理的hBMSCs后HOTAIR/miR-17-5p/Smad7通路分子的表达以及细胞增殖率A~C.RT-qPCR检测激素性股骨头坏死组(n=25)和正常对照组(n=25)患者骨髓样本中HOTAIR、miR-17-5p、Smad7的相对表达;D.CCK-8法测定hBMSCs增殖率;E、F.RT-qPCR检测10-8mol/L DEX处理的hBMSCs中HOTAIR、miR-17-5p和 Smad7的相对表达。*P<0.05
2.miR-17-5p是HOTAIR的靶点:StarBase预测发现,HOTAIR对miR-17-5p具有直接调控潜力(图2A)。与HOTAIR-WT联合NC组比较,HOTAIR-WT联合mimic组的荧光素酶活性降低(P<0.05,图2B),而HOTAIR-MUT组中NC组与mimic组比较,差异无统计学意义(P>0.05,图2B)。此外,激素性股骨头坏死组中HOTAIR与miR-17-5p表达呈负相关(P<0.05,图2C)。

图2 miR-17-5p是HOTAIR的靶点A.HOTAIR和miR-17-5p的假定结合位点;B.双荧光素酶基因报告检测HOTAIR和miR-17-5p之间的结合;C.SONFH患者HOTAIR与miR-17-5p表达的相关性。与NC组比较,*P<0.01
3.Smad7是miR-17-5p的靶基因:StarBase预测表明,miR-17-5p对Smad7具有直接调控潜力(图3A)。与NC+Smad7-3′UTR-WT组比较,hBMSCs的mimic+Smad7-3′UTR-WT组的荧光素酶活性显著降低,而mimic+Smad7-3′UTR-MUT组差异无统计学意义(图3B)。此外,mimic可以抑制Smad7的表达,inhibitor上调了Smad7的表达(P<0.05,图3C)。激素性股骨头坏死组织中Smad7与miR-17-5p表达呈负相关(P<0.05,图3D)。

图3 Smad7是miR-17-5p的靶基因A.Smad7和miR-17-5p的假定结合位点;B.双荧光素酶基因报告检测 Smad7和miR-17-5p之间的结合;C.Western blot法检测Smad7的表达;D.激素性股骨头坏死患者Smad7和miR-17-5p表达的相关性。*P<0.001
4.HOTAIR过表达对hBMSCs成骨分化的影响:与hBMSCs组比较,成骨诱导后ALP活性水平增加(P<0.05);而转染过表达HOTAIR慢病毒显著降低ALP活性水平(P<0.05);与hBMSCs组比较,hBMSCs的成脂诱导组、成脂诱导+空载组和成脂诱导+过表达HOTAIR组中ALP活性明显降低(P<0.05),详见图4A。而过表达HOTAIR抑制RUNX2的表达(P<0.05),详见图4B。
hBMSCs经过成骨培养基诱导之后,视野内茜素红染色增加,细胞显著成骨(P<0.05);转染过表达HOTAIR慢病毒显著抑制成骨分化;成脂诱导组、成脂诱导+空载组和成脂诱导+过表达HOTAIR组基本无成骨形成,详见图4C。
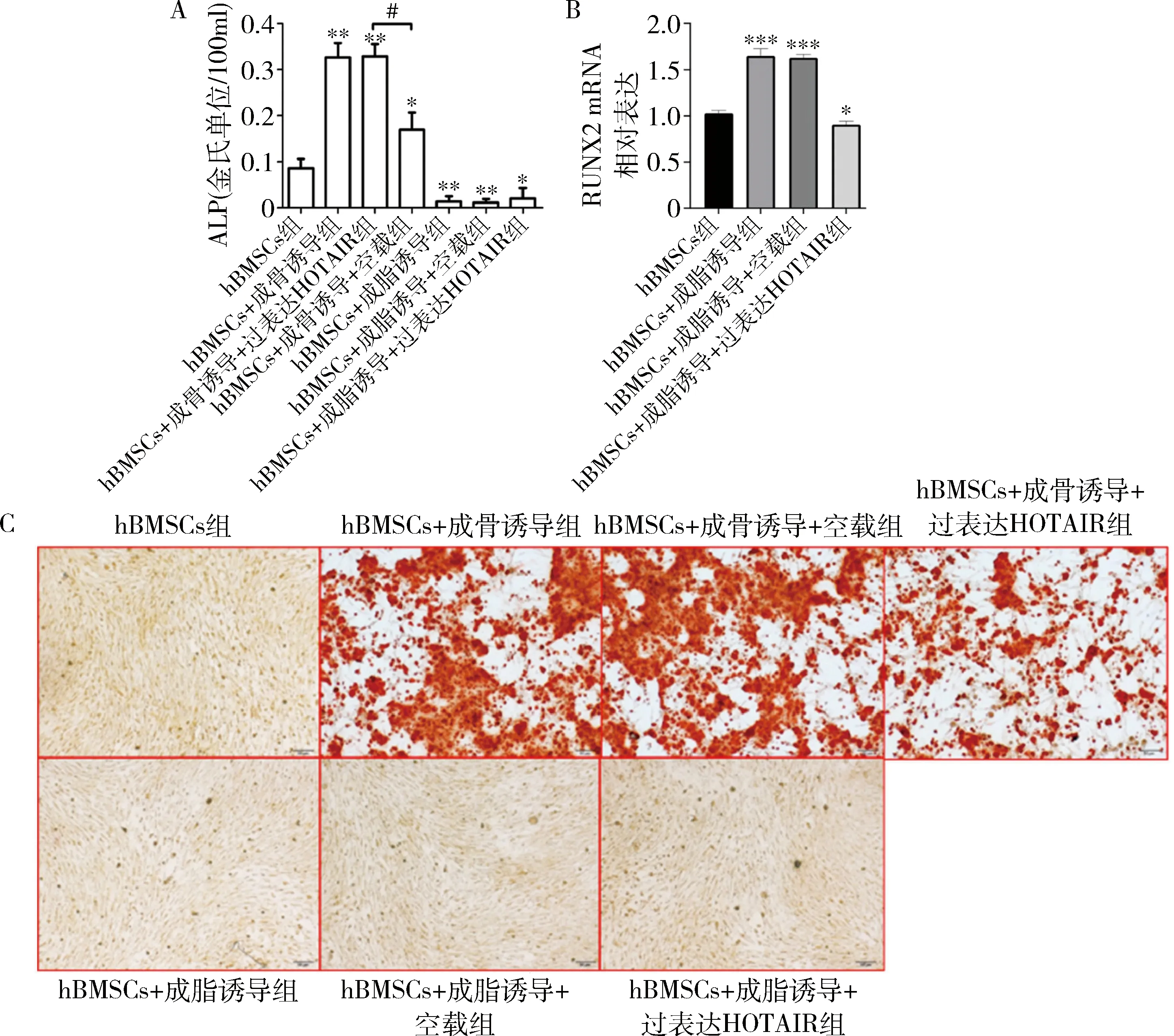
图4 HOTAIR过表达对hBMSCs成骨分化的影响A.ALP活性检测结果;B.RTqPCR检测RUNX2的mRNA相对水平;C.茜素红染色(×200)。与hBMSCs组比较,*P<0.05,**P<0.01,***P<0.001;#P<0.01
5.HOTAIR过表达对hBMSCs成脂分化的影响:hBMSCs经成脂培养基诱导之后,油红O染色增加(P<0.05);转染过表达HOTAIR慢病毒显著促进成脂分化,油红O染色增加(P<0.05)。而成骨诱导组、成骨诱导+空载组和成骨诱导+过表达HOTAIR组基本无成脂形成(P>0.05),详见图5。
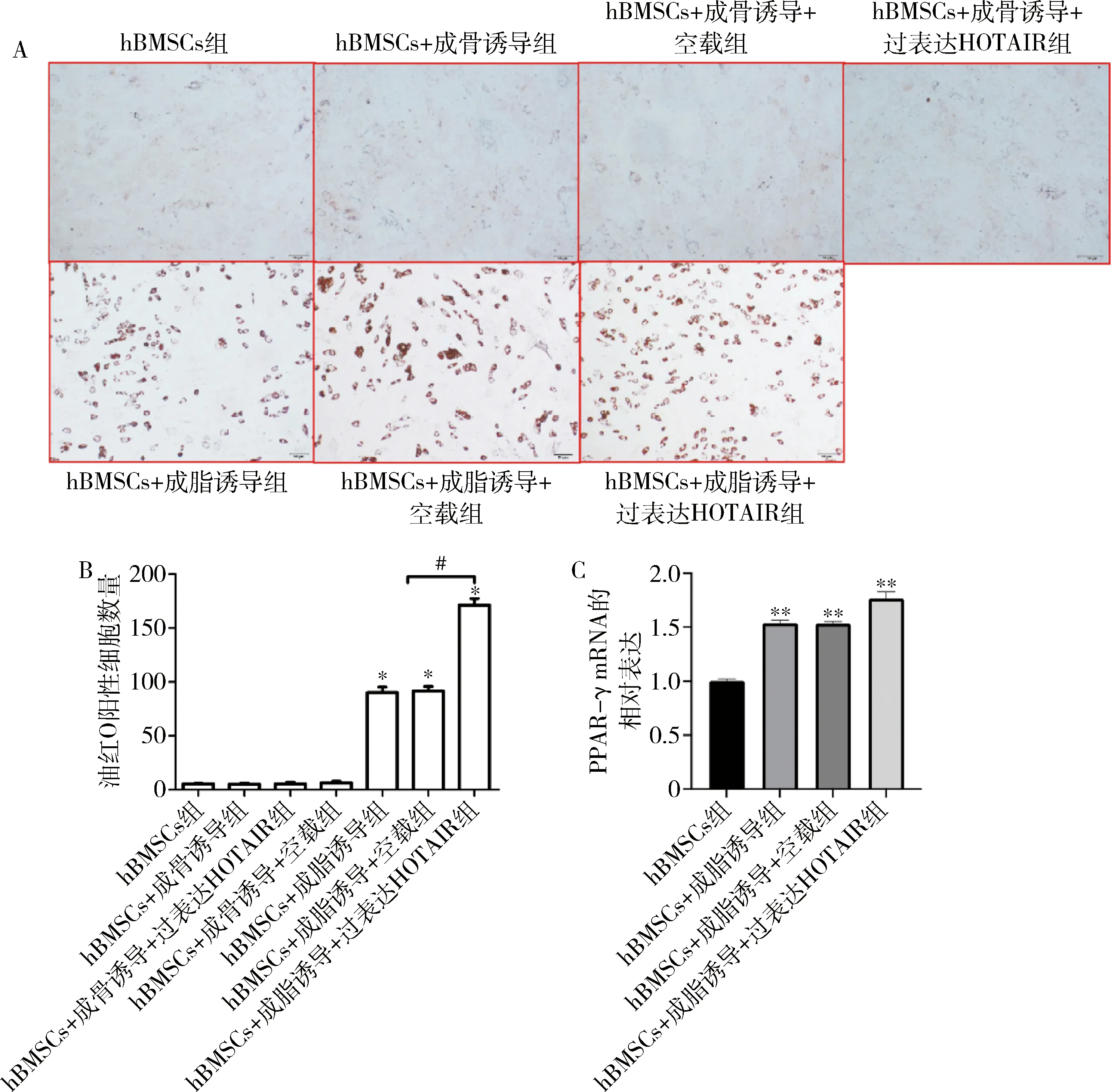
图5 HOTAIR过表达对hBMSCs成脂分化的影响A.油红O染色(×200);B.油红O阳性细胞数量;C.RTqPCR检测RRAR-γ的相对表达水平。与hBMSCs组比较,*P<0.01,**P<0.001;#P<0.01
6.HOTAIR过表达对miR-17-5p和 Smad7表达的影响:过表达HOTAIR后的成骨细胞和成脂细胞中miR-17-5p水平显著降低(P<0.05),而 Smad7的水平显著升高(P<0.05),详见图6。
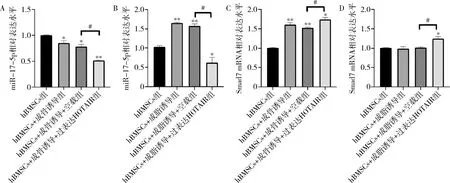
图6 过表达HOTAIR对分化的hBMSCs中 Smad7和miR-17-5p的影响成骨诱导(A)和成脂诱导(B)中hBMSCs的miR-17-5p相对表达。通过RT-qPCR检测成骨分化(C)和成脂分化(D)诱导的hBMSCs中 Smad7mRNA的相对表达。与hBMSCs比较,*P<0.01,**P<0.001;#P<0.01
讨 论
BMSCs与股骨头坏死(osteonecrosis of the femoral head,ONFH)发展密切相关,而且lncRNAs和miRNAs在ONFH发展中也具有调控作用[7,8]。HOTAIR已被证实在癌症中高表达,且参与细胞增殖、分化和凋亡[9]。本研究中HOTAIR在激素性股骨头坏死组的组织中表达量增加,而miR-17-5p表达下调。体外DEX也诱导了HOTAIR和 Smad7的表达,促进了hBMSCs增殖。此外,过表达HOTAIR会抑制hBMSCs中miR-17-5p表达,并促进 Smad7表达。研究还发现,HOTAIR在非创伤性ONFH样本中上调,且抑制HOTAIR的表达可以促进成骨分化和成骨细胞增殖,表明HOTAIR参与抑制hBMSCs的成骨分化[10,11]。
研究表明,miR-17-5p通过靶向 Smad7促进hMSC-BM细胞的增殖和分化[12]。本研究首先用StarBase预测了HOTAIR和miR-17-5p、miR-17-5p和 Smad7的3′UTR均具有结合位点,并通过荧光素酶基因报告实验证实HOTAIR和miR-17-5p、miR-17-5p和 Smad7的直接作用;另外,HOTAIR与miR-17-5p以及 Smad7与miR-17-5p均呈负相关。表明在BMSCs中,HOTAIR/miR-17-5p/Smad7三者可以通过直接作用从而对细胞的分化发挥重要作用。
RUNX2是一种特异性转录因子,参与肿瘤转移和成骨分化[13]。已证明 HOTAIR过表达会抑制RUNX2的mRNA表达[14]。在本研究中,笔者获得了类似的结论,HOTAIR的过表达显著抑制成骨诱导细胞中RUNX2的mRNA。总之,这些结果表明高表达HOTAIR后 hBMSCs中miR-17-5p被抑制,并抑制了hBMSCs的成骨分化。
研究已证实HOTAIR参与BMSCs的成脂分化作用,例如Kalwa等[15]研究表明,HOTAIR可促进MSCs的成脂分化。另有研究证实,HOTAIR在激素性股骨头坏死模型小鼠中高表达,这与笔者在激素性股骨头坏死患者体内的观察结果一致[14]。该研究还发现,成脂分化后HOTAIR的表达上调,但是成骨分化后下调。而且HOTAIR过表达抑制成骨分化和RUNX2、OCN、ALP的表达,而且增加了成脂分化[14]。而本研究中利用油红O染色检测观察到HOTAIR过表达明显促进了油红O染色效果,并增加了成脂标志物RRAR-γ的表达。
综上所述,HOTAIR表达在激素性股骨头坏死的组织中上调,而miR-17-5p 表达下调, Smad7表达上调。而且在成脂分化和成骨分化的hBMSCs中HOTAIR过表达可通过直接抑制miR-17-5p上调 Smad7。而且HOTAIR过表达可抑制成骨分化促进成脂分化。本研究可能为激素性股骨头坏死的治疗和诊断提供新的见解。
