间充质干细胞介导白细胞介素因子调节免疫反应的机制研究
2023-03-27陆柏江袁明俊
秦 菊 江 滨 陆柏江 袁明俊 周 影
间充质干细胞(mesenchymal stem cells,MSCs)是具有多向分化潜能且具有较强免疫调节活性的成体干细胞,可以分化为骨细胞、软骨细胞和脂肪细胞等多种组织细胞,存在于人体骨髓、脂肪、脐带和胎盘等多种组织和器官。目前已被广泛应用为组织工程及再生医学的原材料,或作为治疗炎性疾病的免疫调节剂。MSCs包括CD11b-、CD14-、CD34-、CD45-、HLA-DR-、CD73+、CD90+、CD105+等免疫表型,具有广谱的免疫调节能力,因而有一定的抗炎及免疫抑制作用,既是炎性反应的感受器,又是炎性反应的调节器[1]。其对于损伤组织的再生修复也展露出一定的治疗优势及广阔的应用前景。目前大多数研究认为,MSCs主要是通过可溶性细胞因子的释放和(或)细胞间接触而进行免疫调控。其与免疫调节相关的包括白细胞介素、前列腺素及吲哚胺2,3-双加氧酶等多种细胞因子,而这些免疫调节因子在MSCs介导的免疫调节中的相关作用机制尚未完全阐明,明确其关键作用机制对今后MSCs在临床疾病治疗中的推广至关重要[2]。
一、白细胞介素功能概述
白细胞介素(interleukin,IL),简称白细胞介素,是指在白细胞或免疫细胞间相互作用的细胞因子,在调控机体免疫反应的过程中发挥重要作用。IL种类繁多,功能复杂,包括IL-1家族、IL-2家族、趋化因子家族、IL-6家族、IL-10家族、IL-12家族、IL-17家族及其他类,包含IL-1、IL-2、IL-4、IL-6、IL-8、IL-10等多种白细胞介素,不同种类白细胞介素来源于不同免疫细胞,同时又靶向作用于各种免疫细胞,从而调节免疫细胞增殖、活化及分化等生物进程,进而调节炎性反应和机体免疫性疾病,是细胞内最为重要的炎性反应介质[3]。与MSCs调节免疫相关的白细胞介素分子主要功能详见表1[4]。
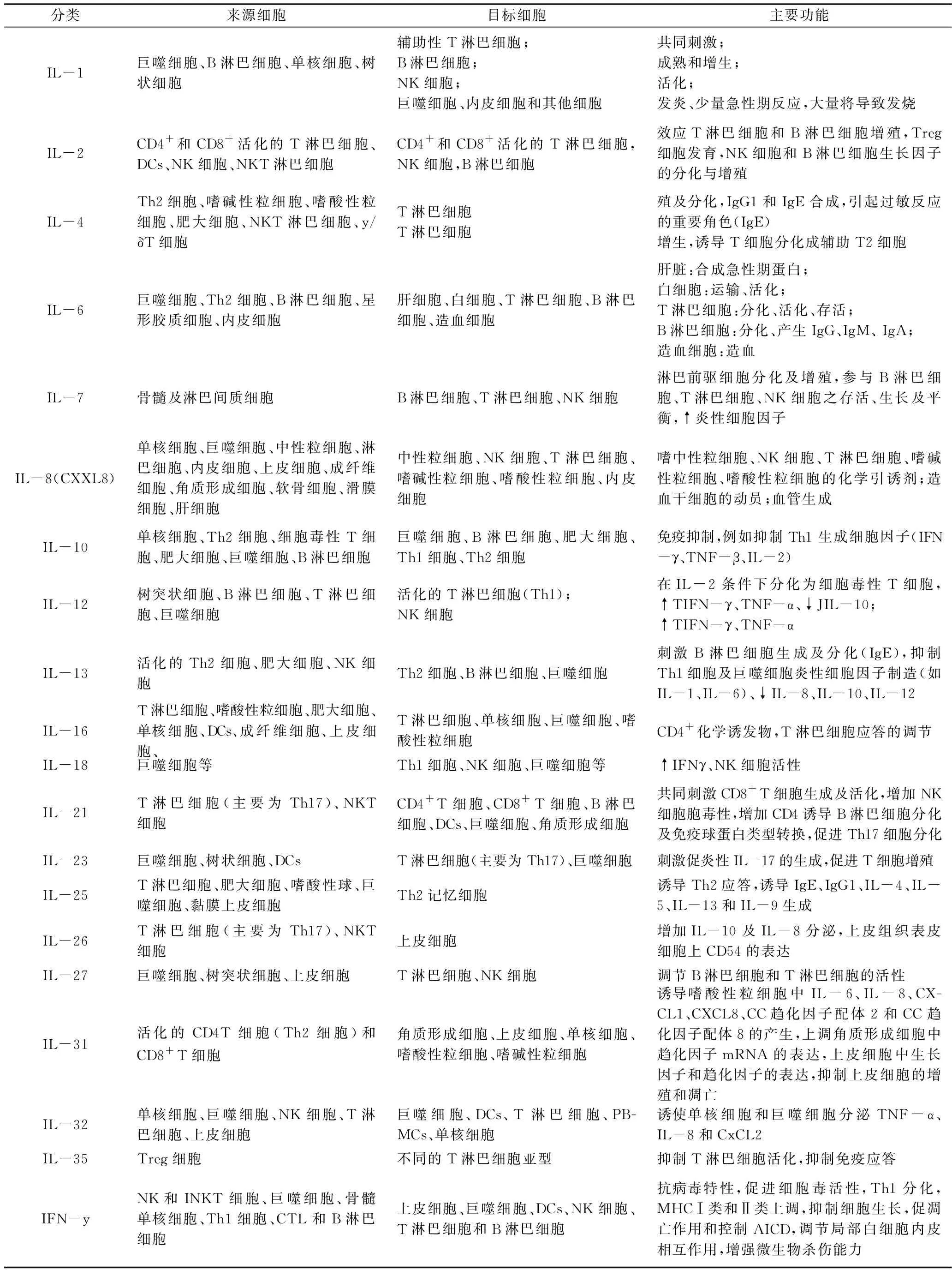
表1 各类白细胞介素因子来源及功能
二、MSCs介导白细胞介素调节免疫细胞的研究概况
1. 对T淋巴细胞的调节作用:T淋巴细胞在细胞免疫中起着核心作用,目前大多数研究认为MSCs调节免疫主要依赖T淋巴细胞[5]。
(1)调控Th17/ Treg平衡:Th17细胞是原始T淋巴细胞(Th0)在IL-6、TGF-β等可溶性细胞因子的刺激下诱导分化形成的辅助性T细胞。Treg细胞是外周成熟T淋巴细胞在持续性抗原刺激及IL-10、TGF-β等细胞因子的作用下诱导产生的调节性T细胞。Th17/Treg比值的变化与机体的炎性反应状态密切相关。研究发现,MSCs可通过分泌免疫抑制性细胞因子(如IL-6、IL-8、IL-10、TGF-β和HGF)来抑制促炎性Th17细胞的发育并刺激Treg细胞分化,如MSCs通过降低IL-6的水平,抑制Th0分化形成为Th17;同时,MSCs分泌IL-10又通过下调单核细胞表面主要组织相容性复合体Ⅱ类抗原(MHCⅡ类)的表达,减弱其抗原递呈作用,促进原始T淋巴细胞向Treg方向分化,抑制炎性细胞的激活、迁移和黏附[6]。Th17细胞增殖受到抑制:一方面,由Th17细胞分泌的IL-17、IL-21等炎性细胞因子减少。另一方面,IL-17的减少又从一定程度上负反馈抑制T淋巴细胞增殖及活化,减轻炎性反应。IL-17是一种多效性细胞因子,不仅可直接诱导巨噬细胞产生IL-6、IL-8等促炎性细胞因子,同时又能通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径或经核因子κB(nuclear factor-kappa B,NF-κB)信号通路刺激内皮细胞、上皮细胞和成纤维细胞分泌粒细胞-巨噬细胞刺激因子,进一步促进中性粒细胞在炎症部位的募集,触发T淋巴细胞增殖及活化,上调部分促炎性细胞因子最终诱发机体炎性反应[7]。Treg细胞增多:一方面通过表达FoxP3蛋白(控制Treg细胞发育和功能的关键转录因子之一)和分泌IL-10、TGF-β等抗炎性细胞因子直接发挥抗炎作用;同时又能抑制T淋巴细胞的异常活化和减少部分炎性细胞因子(如IL-1β、TNF-α和IFN-γ)的分泌,协同调控免疫炎性反应[8]。另有研究指出,MSCs分泌产生的IL-10不仅可直接促进Th0细胞向Treg方向分化,又能诱导成熟的Th17细胞向Treg转化,同时还能刺激Treg上的程序性死亡配体1(PD-L1,T淋巴细胞表面的一种共刺激分子,主要表达于活化的T淋巴细胞表面)高表达,而增强MSCs的免疫抑制能力,其机制与Foxp3蛋白通路相关[9]。其他相关研究示MSCs调节Th17/Treg平衡的机制可能与STAT3/STAT5信号通路相关,STAT5磷酸化会抑制Th17细胞的分化,减少IL-17的产生,同时促进Treg细胞的分化和FoxP3蛋白的表达[10]。也有研究认为MSCs调节Th17/Treg平衡与FAS/ FASL通路、IL-6-JAK-STAT3轴及转录因子RORγt和RORα表达水平相关[11]。
(2)调控Th1/ Th2平衡:Th1/Th2平衡对于维持机体正常的免疫功能至关重要。Th1/Th2平衡偏向Th1,Th1细胞分泌IL-2、IFN-γ、TNF-α等炎性细胞因子,激活NF-κB炎症通路,同时促进IL-1β及其他炎性细胞因子的产生,导致炎症发生;Th1/Th2平衡偏向Th2,Th2主要分泌IL-4、IL-10等抗炎性细胞因子,通过抑制Th1的分化及IFN-γ、TNF-β等炎性细胞因子生成,而发挥抑制炎症的作用[12]。Chen等[13]研究发现,骨髓来源MSCs和外周血单核细胞共培养,能促进辅助性T细胞Th1向Th2方向转换,并显著减少促炎性细胞因子IL-1β和TNF-α水平。有研究认为,不同的白细胞介素因子对MSCs的免疫调节作用也有差异。Xu等[14]研究发现,IL-27可通过JAK/STAT1途径提高MSC的PD-L1的表达水平,不仅可调节MSC的增殖、黏附和迁移等功能,同时也增强了MSC对Th1和Th2细胞的调控作用。此外,IL-33也可诱导T淋巴细胞由Th1向Th2方向转换,有利于炎症的缓解[15]。也有研究认为,MSCs分泌的IDO在抑制淋巴细胞活性和增强调节性T细胞的功能方面发挥主要作用。
2.对巨噬细胞的调节作用:巨噬细胞是广泛分布的先天性免疫细胞,是固有免疫的重要组成部分,在不同的微环境刺激下,巨噬细胞可通过极化分型而发挥不同的生物学作用。研究发现,MSCs分泌的IL-6可直接改善系统性红斑狼疮小鼠中CD206+巨噬细胞的比例及其生物活性[16]。相关研究证明,MSCs可显著抑制NLRP3炎症体介导的IL-1β及TNF-α的分泌,同时在环氧合酶2(cyclooxygenase2,COX-2)和肿瘤坏死因子α刺激基因-6(tumor necrosis factor alpha stimu-lated gene-6,TSG-6)信号通路的协同作用下诱导M2型巨噬细胞的产生,抑制M1型巨噬细胞的活化,从而减轻炎性反应[17]。此外,MSCs分泌的PGE2、IDO等细胞因子也可协同促进M1巨噬细胞向M2的转化。M1型巨噬细胞受到抑制,IL-1β、IL-6、IL-12、IL-23、TNF-α、IFN-γ等炎症相关细胞因子表达减少,进而Th1、Th17等促炎性免疫细胞活化减少,炎性反应减轻[18];M2型增多,则通过M2型分泌的IL-10、精氨酸酶-1(Arg-1)及血管内皮生长因子(vascular endothelial growth factor, VEGF)等细胞因子增加,不仅可抑制机体炎性反应,同时也可促进损伤组织修复等生物进程。因此,有研究提出,MSCs能促进M2巨噬细胞活化和基质金属蛋白酶-13(matrix metalloproteinase 13, MMP13)的表达,具有阻止组织纤维化进展的作用,有望成为今后抗纤维化治疗的靶点[19]。此外,有研究发现,MSCs可通过激活S1P/SK1/S1PR1、miR-let7/HMGA2/NF-κB等途径促进巨噬细胞M2极化[20,21]。或者通过MSC表面表达上调的CD200与M1巨噬细胞受体CD200R之间相互作用而致巨噬细胞重新编程,最终促进M2型巨噬细胞活化[22]。
3.对树突状细胞的调节作用:树突状细胞(dendritic cell,DC)是机体内最主要的抗原递呈细胞,是先天性免疫和适应性免疫之间的桥梁,成熟DC通过膜表面的抗原肽MHCⅠ类和抗原肽MHCⅡ类分子复合物将抗原递呈给相应的T淋巴细胞,诱导T淋巴细胞增殖活化,启动T淋巴细胞介导的适应性免疫[23]。DC分为未成熟型和成熟型:未成熟型具有较强的吞噬和吞饮作用,而抗原递呈能力弱;成熟型抗原递呈能力强,吞噬能力较弱。研究证实,MSCs可通过分泌IL-6、单核细胞集落刺激因子而进一步抑制和破坏DC表面Toll样受体2(toll-like receptors 2,TLR2)的活化,抑制NF-κB信号转导通路来抑制DC的分化、内吞作用,影响单核前体细胞向DC分化,抑制DC成熟,使DC处于耐受状态,同时又可调节DC刺激淋巴细胞的增殖,使其从分泌促炎性细胞因子转为分泌抗炎性细胞因子[24]。另一方面,IL-6能够减弱DC识别和摄取抗原的能力,抑制DC参与活化的表面标志物的表达,减弱DC处理抗原及向T淋巴细胞递呈抗原的能力,减少T淋巴细胞的增殖[25]。此外,IL-10也通过JAK-STAT途径的下游信号转导参与了DC的分化和成熟[26]。相关研究进一步发现,MSCs通过其分泌的PGE2、IL-10、半乳糖凝集素-1 (galectin-1,Gal-1)和Gal-3等细胞因子,进而下调单核细胞衍生分化为DC过程中CD1a、CD40、CD80、CD86和HLA-DR的表达,同时阻止DC成熟过程中CD40、CD86和CD83的表达,最终抑制DC内吞作用和分泌IL-12能力,阻止其活化[27]。其中,PGE2主要是促进生成 IL-10,通过下调MHCⅡ类分子,阻碍单核细胞向DC的分化。另有研究认为MSC可通过Notch/Jagged1信号通路使DC诱导更多Treg细胞的扩增。
4.对自然杀伤细胞的调节作用:自然杀伤细胞(natural killer cell,NK)是体内重要的免疫细胞之一,能在不依赖 T、B淋巴细胞的情况下发挥细胞毒性作用,参与机体免疫反应。研究发现,MSCs可通过分泌IL-1、IDO、PGE2、可溶性的HLA-G5和TGF-β等细胞因子,对抗IL-2和IL-15诱导自然杀伤细胞的增殖效应,阻止细胞毒活性和杀伤性细胞因子的产生。且MSCs对NK细胞的增殖、活化及细胞毒性等不同生物进程均有不同程度的影响。MSC不仅可以抑制未激活的NK细胞的增殖,尚能抑制激活的NK细胞增殖,同时还可抑制NK细胞的细胞毒性以及受体CD69、CD94D、NKp G2和NKp30等的表达[28]。其可能机制为MSCs通过分泌细胞因子激活JAK/STAT信号通路,上调细胞因子信号转导抑制因子3的目的基因,从而抑制自然杀伤细胞的增殖,最终发挥免疫抑制作用。
三、展 望
MSC取材容易、用途广泛等优势使得MSCs在目前的众多研究中占有独特地位,是细胞疗法可靠的种子细胞之一。目前越来越多的研究认为MSC的免疫调节作用是其发挥治疗作用的主要功能特性,而MSCs调节免疫的作用机制复杂多样,目前仍不十分明确,需进一步的研究和验证。与此同时,虽然MSCs分泌的白细胞介素因子对于炎性反应的调控作用已被目前大量研究所证实,但MSCs调控白细胞介素因子的途径复杂多样,包括直接分泌白细胞介素因子调节免疫反应和(或)通过分泌其他的细胞因子调控免疫细胞的增殖、分化及分泌等功能而间接调节免疫反应。细胞因子种类繁多,作用靶点广,对于不同的免疫细胞又可表现出不同的功能特性。且目前研究证实,MSC的免疫调节作用受细胞来源及所在微环境的影响可发生一定程度的变化。因此,明确MSC介导白细胞介素调控免疫反应的作用机制,以及不同种类白细胞介素因子对MSC功能的影响,对于今后MSC在临床治疗中的应用至关重要。此外,白细胞介素因子种类繁多,作用复杂,对于免疫细胞的调控方式具有多样性,因此,MSC对于各种不同白细胞介素因子的研究仍有待于进一步探索和细化。
