滇水金凤花斑形成相关基因IuMYB114 和IuMYB36 的克隆及表达分析
2023-03-25陶宇蝶孟丹晨黄美娟魏春梅赵秋燕周敏瞿素萍黄海泉
陶宇蝶孟丹晨黄美娟魏春梅赵秋燕周敏瞿素萍黄海泉
(1.西南林业大学园林园艺学院/国家林业和草原局西南风景园林工程技术研究中心/云南省功能性花卉资源及产业化技术工程研究中心/西南林业大学园林园艺花卉研发中心,云南 昆明 650224;2.云南省农业科学院花卉研究所,云南 昆明 650205)
花色是被子植物花器官的重要表型性状之一,在提高植物抗逆性、吸引传粉者、维持繁衍进化基石等方面发挥着重要作用[1,2]。 花斑一般指在花瓣或花萼上位置、大小和形态基本固定的斑块,是被子植物一个独特的表型特征,是人工选择创新、植物进化和自然选择的综合结果,能极大地丰富植物的观赏价值,是现代花卉业的重要研究领域[3]。 因此,揭示花斑形成的分子机理对花色改良具有重要意义[4,5]。
植物花斑的形成是由于花色素基因在花瓣或其他成花部位上差异表达,且调控基因可以调节花色素合成催化酶基因在不同区域的表达水平,进而导致花斑的形成[6]。MYB基因作为植物中最庞大的一个基因家族,在花斑及色素形成、生长发育等过程中发挥着重要作用。 已在多种植物中发现调节花色素苷合成及与色斑形成相关的MYB 转录因子,且以R2R3 类型为主,也有单一R重复结构的MYB 转录因子[7]。 如AtMYB75、At-MYB90、AtMYB113参与花青素的生物合成[8];在蝴蝶兰中,PeMYB2调控唇瓣的全红着色,PeMYBI1调控唇瓣的红色斑点,PeMYBI2调控唇瓣纹理的形成[9];R2R3-MYB 转录因子LhMYB6、Lh-MYB12和LhMYB12-Lat分别在百合的凸起式斑点[10]、飞溅式斑点[11]和非斑区表达[12];cjMYB1基因可能在红色山茶品种的花色苷合成途径中起关键作用[13];FtMYB23提高了苦荞原花青素的合成与积累[14];在月季红花突变体中,RhMYB基因正调控花青素的合成[15]。 刘盛雨[16]研究发现,MYB114转录因子可能在血橙果实成熟过程中介导蓝光对多甲氧基黄酮和花青素的合成调控;Yao 等[17]提出PyMYB114与已报道的Py-MYB10有着色增强的效应,并在草莓果实和烟草叶片中得到验证;赵英[18]提出SmMYB36的同源基因首次出现在洛矶山耧斗菜中, 过表达SmMYB36的转基因材料可以提高丹参酮类物质而抑制酚酸类物质。 但关于MYB36基因调控花斑形成的相关研究尚未见报道。
滇水金凤(Impatiens uliginosa)为中国特有的凤仙花科凤仙花属一年或多年生草本植物,花色艳丽,以红色为主,花形独特,旗瓣圆形,花期长,具有较高的园林应用价值[19]。 目前关于滇水金凤的研究主要集中于种子萌发特性、花发育调控基因克隆、花色调控基因及金属元素测定等方面[20-23],尚未见关于其花斑的研究报道。 本研究从斑色系滇水金凤花瓣中克隆得到IuMYB114和IuMYB36基因,并分析了其序列结构、系统发育和表达模式,为研究滇水金凤花斑形成的分子调控机理以及凤仙花花色改良等提供一定的基础数据和理论依据。
1 材料与方法
1.1 试验材料
供试斑色系滇水金凤于2020 年10 月取自昆明市寻甸县清水海,于滇水金凤盛花期采集样品(图1),迅速放于液氮中,并带回实验室保存于-80℃冰箱中备用。
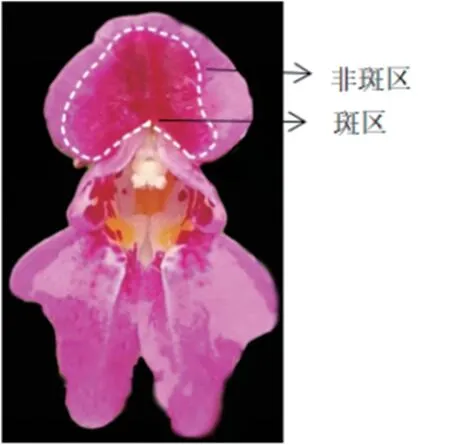
图1 斑色系滇水金凤花器官
1.2 总RNA 的提取与IuMYB114 和IuMYB36 基因的克隆
以滇水金凤整个花器官为试验材料,采用RNA 提取试剂盒(OMEGA)提取总RNA;RNA 逆转录采用逆转录试剂盒(北京全式金生物技术股份有限公司),-20℃保存备用。 根据转录组数据设计扩增全长的特异性引物(表1)。 以RNA 逆转录合成的cDNA 第一链作为模板进行Iu-MYB114和IuMYB36基因全长cDNA 扩增。 回收产物并进行克隆,送上海生工生物工程有限公司测序。
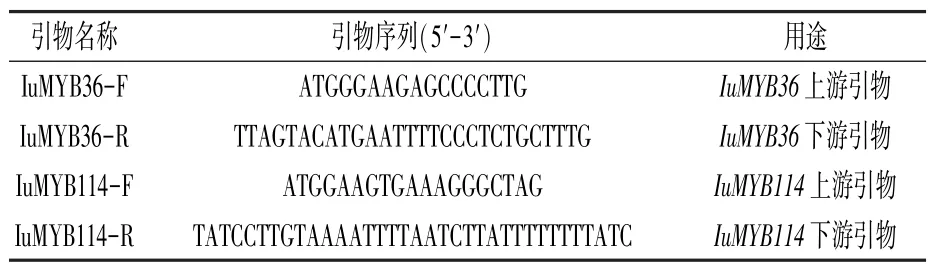
表1 滇水金凤MYB 基因cDNA 序列扩增引物
1.3 滇水金凤花斑IuMYB114 和IuMYB36 序列分析
采用ExPasy-ProtParam 在线软件进行基因编码蛋白质的基本理化性质分析;运用TMHMM 2.0 对蛋白进行跨膜结构域的预测分析;利用NCBI 的CDD 工具预测目的基因结构域;运用SMART 对蛋白结构域进行分析,蛋白质的二级结构预测采用SOPMA 在线软件进行,蛋白质的三级结构预测采用SWISS-MODE 在线软件进行;运用NCBI 中的Protein BLAST 工具寻找同源序列,借助NCBI BLAST、DNAMAN 和MEGA 11 进行序列分析和系统进化树构建。
1.4 IuMYB114 和IuMYB36 基因的表达模式
按照前述方法分别提取滇水金凤旗瓣斑区和非斑区2 个部位(图1)的RNA,反转录合成cDNA,设计qRT-PCR 引物(表2),以滇水金凤Actin1作为内参基因,进行qRT-PCR 试验。 每个样本设置3 个生物学重复。 将非斑区的表达水平设为对照,与斑区的进行比较。
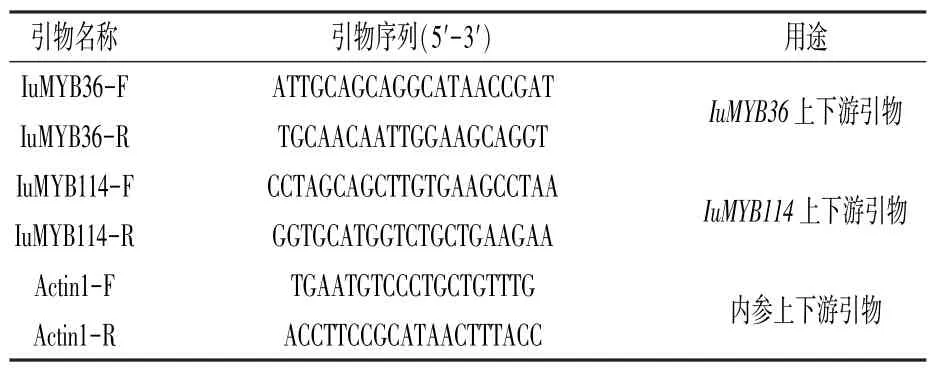
表2 滇水金凤MYB 基因qRT-PCR 扩增相关引物序列
2 结果与分析
2.1 滇水金凤IuMYB114 和IuMYB36 基因的克隆
通过PCR 扩增,获得IuMYB114与IuMYB36基因的cDNA 全长,分别为315 bp 和876 bp(图2),分别编码104 个和151 个氨基酸。 对这两个MYB基因的内含子和外显子进行分析发现两者均不具有内含子。
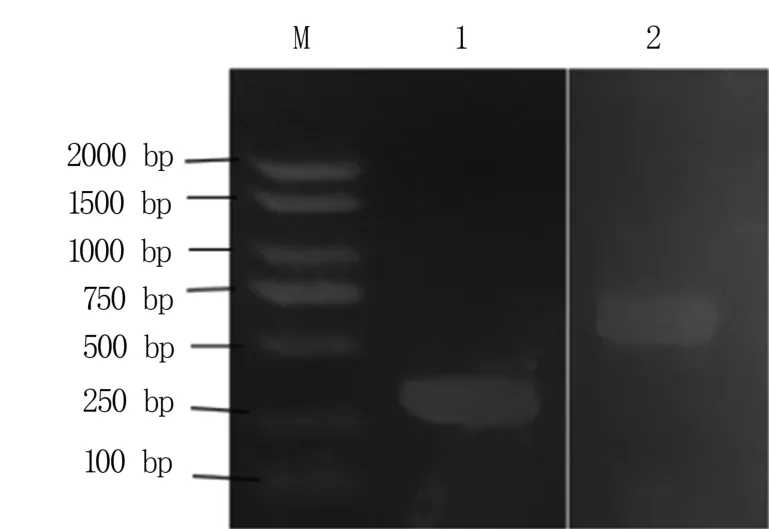
图2 IuMYB114 和IuMYB36 基因的PCR 扩增
2.2 IuMYB114 和IuMYB36 基因的序列结构分析
IuMYB114、IuMYB36 蛋白均为亲水性不稳定蛋白,均不具有跨膜结构域,均属于MYB 超家族蛋白成员(图3、表3)。 预测目的基因结构域发现IuMYB114具有MYB 转录因子典型的SANT 结 构域,IuMYB36不具有保守结构域(图4)。
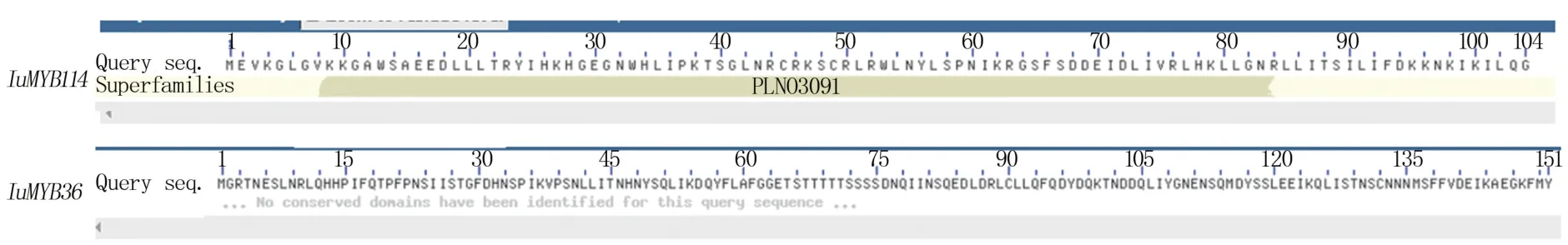
图3 IuMYB114 (上)和IuMYB36 (下)基因的保守结构域
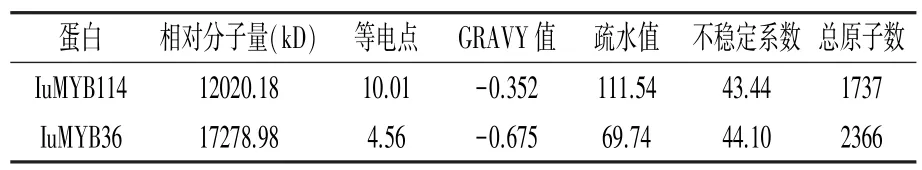
表3 IuMYB114 和IuMYB36 基因编码蛋白的理化性质
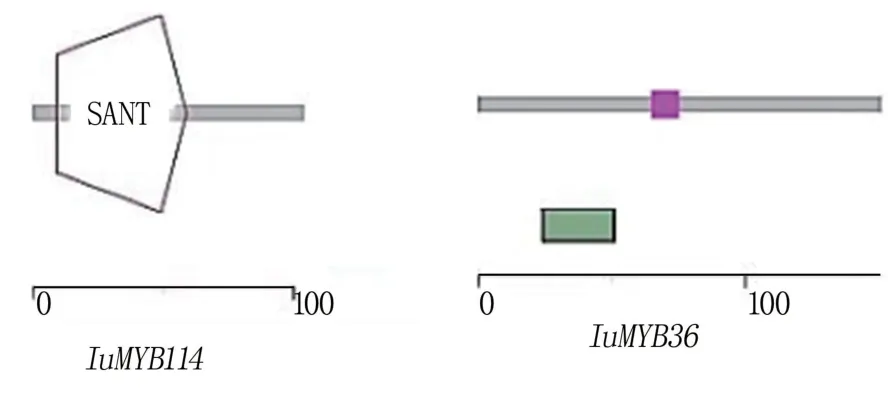
图4 IuMYB114 和IuMYB36 结构域
2.3 IuMYB114 和IuMYB36 基因编码蛋白的二、三级结构预测
IuMYB114 和IuMYB36 蛋白的二级结构均以无规则卷曲为主,说明其结构不稳定。 蛋白质三级结构预测结果(图5)显示,IuMYB114 是以转录因子WER 为模型,属于R2R3 型亚类成员,覆盖率为53.19%,序列相似性为47%;IuMYB36 是以涂层蛋白为模型,覆盖率为27.08%,序列相似性为33%。
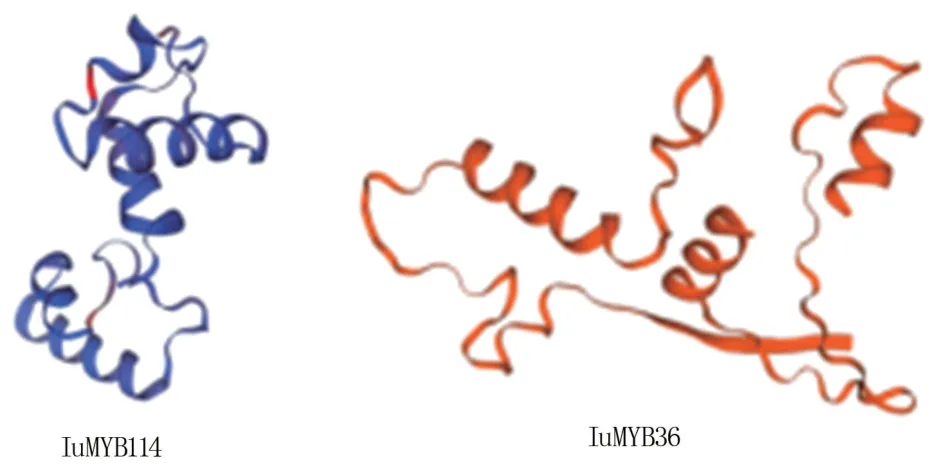
图5 IuMYB114 和IuMYB36 蛋白三级结构预测
2.4 IuMYB114 和IuMYB36 的氨基酸序列同源性分析及系统进化分析
分别将IuMYB114 和IuMYB36 的氨基酸序列与其它植物的氨基酸序列进行对比,结果(图6)显示,IuMYB114 与芝麻(XP_011100166.1)、欧洲李(XP_034208044.1)等物种的MYB 同源性较高,同源性均达64%左右;IuMYB36 与常绿越橘(KAH7854734.1)、黄芩(AKA59789.1)和蓝果树(KAA8518714.1)等的同源性较高,同源性均在50%左右。 通过构建系统进化树,发现IuMYB114和IuMYB36 均分别与各自的同源序列聚在一起,各处在两个分支,与IuMYB114 亲缘关系最近的是旱金莲,而与IuMYB36 亲缘关系最近的是除虫菊(图7)。

图6 IuMYB114(A)和IuMYB36(B)的同源氨基酸序列比对
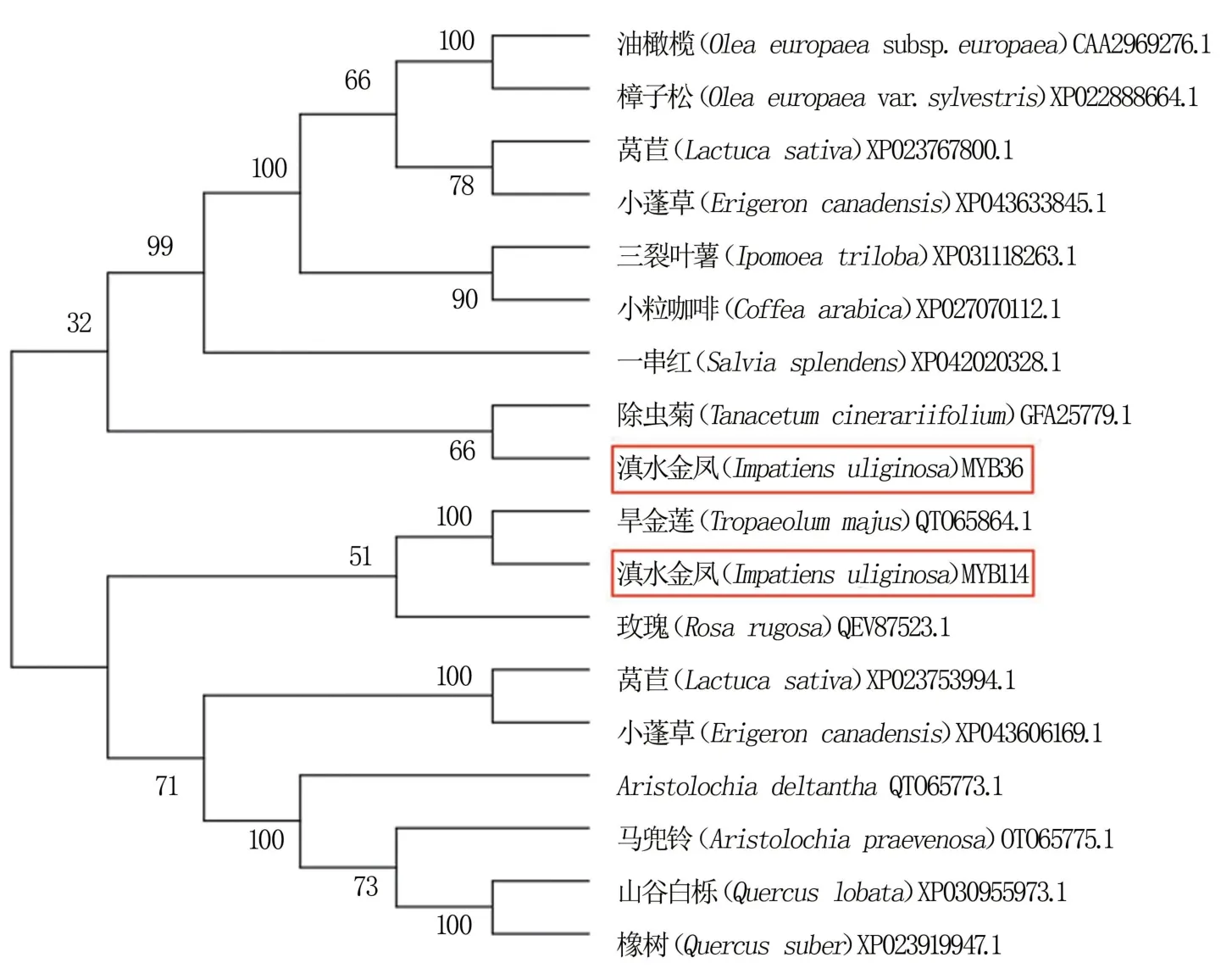
图7 基于IuMYB114 和IuMYB36 氨基酸序列构建的系统发育树
2.5 IuMYB114 和IuMYB36 基因在滇水金凤旗瓣中的表达模式分析
通过对两个基因在滇水金凤旗瓣不同部位的表达分析(图8)发现,IuMYB114与IuMYB36在斑区和非斑区均有表达,但斑区表达量显著高于非斑区,分别为非斑区的12.83 倍和9.88 倍,与转录组分析结果相符。 推测IuMYB114 和IuMYB36 可能在盛花期存在一定的正调控作用从而使花斑显现;另外,两个基因的表达模式和表达量相似,推测两者在斑区具有一定的协同作用。
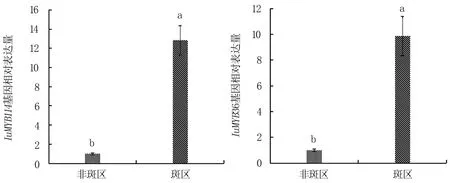
图8 IuMYB114 和IuMYB36 基因在滇水金凤旗瓣2 个部位的表达分析
3 讨论与结论
MYB 转录因子集特异性和多样性于一体,在花色素中发挥着重要作用,是花斑形成的关键基因。 最早从玉米中克隆出第一个调节花色素合成的单一型MYB基因——C1基因[24],随后从巨峰葡萄中克隆出VlMYBA基因,能诱导葡萄果实上红紫色斑点的产生[25]。 近几年,关于MYB 转录因子组织表达特异性导致花斑出现的机理逐渐成为研究热点,但未见其在滇水金凤花斑形成中作用的相关研究报道。
本研究成功从滇水金凤花器官中克隆得到2个cDNA 全长分别为315 bp 和876 bp、分别编码104 个和151 个氨基酸的MYB基因,命名为Iu-MYB114和IuMYB36。 经生物信息学分析,Iu-MYB114和IuMYB36均没有内含子,这与从蓖麻茎秆中克隆的RcMYB114[26]、从丹参中克隆的SmMYB36[27]分析结果一致,且二者均属于亲水不稳定蛋白,二级结构均以不稳定的无规则卷曲为主;IuMYB114 三级结构以转录因子WER 为模型,属于R2R3 型亚类,且具有典型的MYB 转录因子SANT 结构域,这与在甘蓝型油菜中克隆的RFBnMYB114的分析结果一致[28];IuMYB36不具有保守结构域,与丹参SmMYB36基因[27]的分析结果一致,推测其属于新的R2R3-MYB 转录因子亚组[29]。 同源性分析发现,滇水金凤的Iu-MYB114 与芝麻(Sesamum indicum) 和 欧洲李(Prunus dulcis)等的MYB 同源性均达64%左右,IuMYB36 与常绿越橘(Vaccinium darrowii)、黄芩(Scutellaria playfairii)等的MYB 同源性均达50%左右;系统进化分析发现IuMYB114 和IuMYB36各处在两个分支。
植物花斑的出现主要依赖花青素在时间和空间上的受限沉积,由于MYB基因是调节花青素合成和积累的关键因子,研究MYB基因对花斑形成的作用具有重要意义。 研究表明,在牡丹中R2R3-MYB 转录因子PsMYB12 协同WD40 和bHLH 转录因子,共同调控牡丹花瓣底部花斑的形成[30];文心兰中得到的OgMYB1基因通过控制OgCHI和OgDFR两个结构基因的表达进而调控花斑的形成[31];外源αMYB基因对中国水仙花色素苷代谢途径产生了影响,且诱导了结构基因的表达,使其花瓣发生了颜色的变化[32];PcMYB114是导致梨果皮红色突变的关键基因[33];AT-MYB114作为激活剂参与了拟南芥中原花青素、类黄酮或花青素的生物合成[34];PyMYB114与PybHLH3、PyERF3之间相互作用形成调控复合体,促进梨果实花青素的积累[35];MdMYB114是苹果花青素生物合成和运输的积极调节因子[36]。结合以往研究,推测IuMYB114可能与滇水金凤的花色苷生物合成有关。 另外,有研究表明,CsMYB36可以调节黄瓜的黄绿色果皮着色[37];SlMYB36-1基因过表达后对番茄根系内皮层凯氏带形成具有影响[38];MYB36控制拟南芥侧根原基边界,从而调控根从增殖到分化的转变[39,40]。本研究发现IuMYB114和IuMYB36在滇水金凤旗瓣斑区和非斑区均有表达,但在斑区的表达量显著高于非斑区,这与MYB114L在‘凤丹’牡丹花色变化过程中的表达分析结果[41]一致。 推测Iu-MYB114可能在滇水金凤盛花期的斑区中起一定的正调控作用,而IuMYB36可能在斑区颜色形成中发挥着一种新功能,从而对花斑的形成具有一定调控作用;因二者表达模式和表达量相似,推测它们具有一定的协同作用,但具体功能尚有待进一步试验验证。
本研究结果可为后续进行IuMYB114和Iu-MYB36基因的功能研究、探究其对滇水金凤花斑形成的调控机制以及凤仙花花色改良等提供一定的理论依据。
