质量源于设计在注射液工艺研究中的应用
2023-03-25路婷婷池芳泽杨保姣高培培刘清梁
*路婷婷 池芳泽 杨保姣 高培培 刘清梁
(华润双鹤药业股份有限公司 北京 100111)
国际上,药品质量管理模式已经从生产与检验相结合的模式发展成为设计(研发)模式,ICH成员国率先采用质量源于设计(QbD)方法进行药品研发和注册申请,从源头设计开始抓最终质量,强调过程控制和风险评估,注重建立控制策略和持续改进。这些理念和方法对于全面提升我国药品质量,真正实现药品的有效、安全和稳定,有着十分重要的借鉴和引导作用。本文即基于QbD理念,进行注射液产品的工艺开发[1-2]。
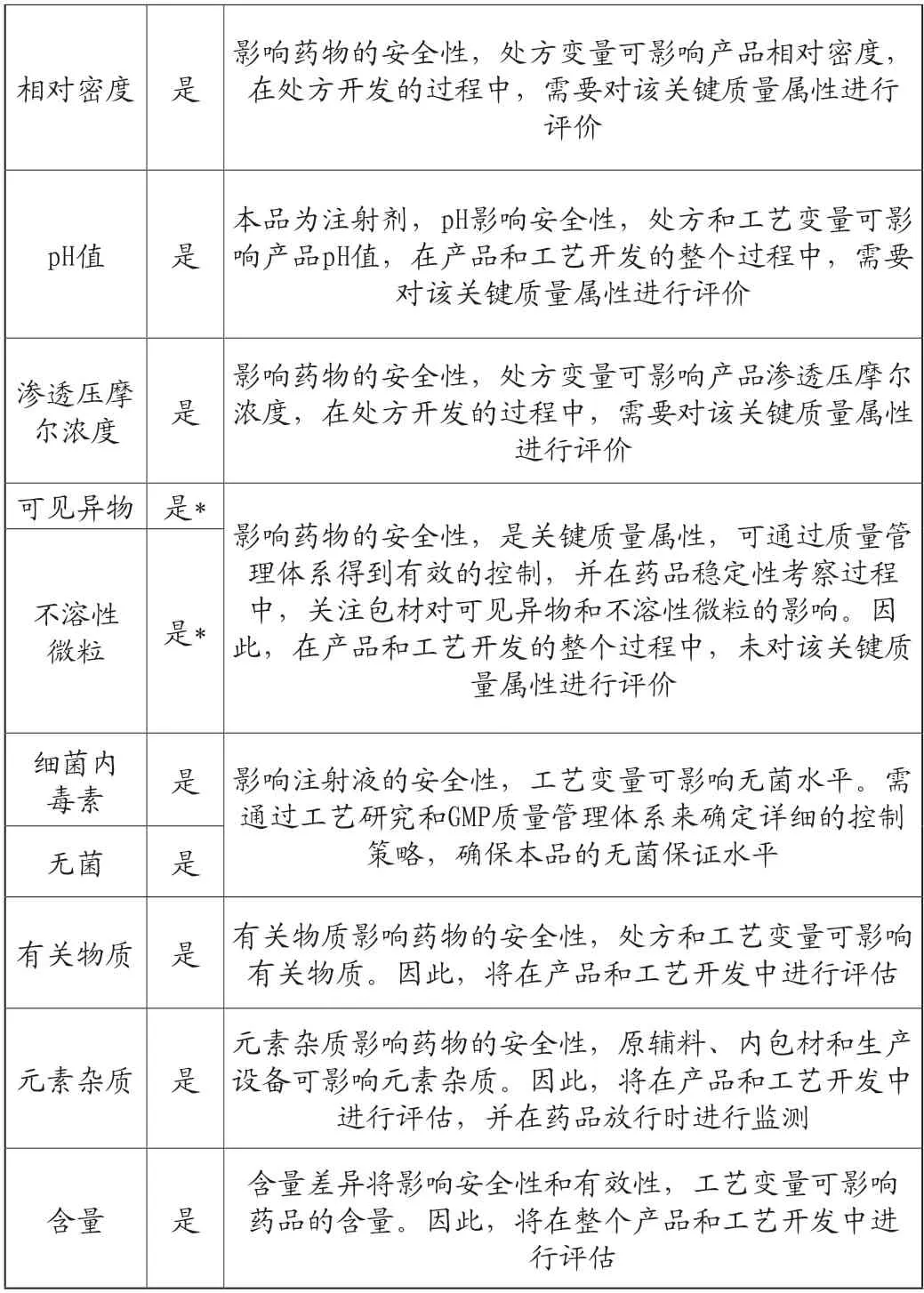
1.确定项标产品关键质量属性(CQAs)
在研发过程中应用质量源于设计(QbD)理念来进行生产工艺的开发,以确保产品安全、有效和质量可控。确定药品的关键质量属性(CQAs)和拟控制策略,见表1[3-5]。

表1 目标产品的关键质量属性(CQAs)

续表
2.生产工艺开发过程
小容量注射剂,采用该剂型常规生产工艺,生产过程主要包括:称量、配制、过滤、灌封、灭菌、灯检、包装、入库。我们重点对配制、过滤、灌封和灭菌等关键步骤的参数进行研究[6-9]。
3.工艺流程图
工艺流程图以一种稳定性和溶解性较好的小分子化合物注射液为例,以说明常规的注射液制备流程。
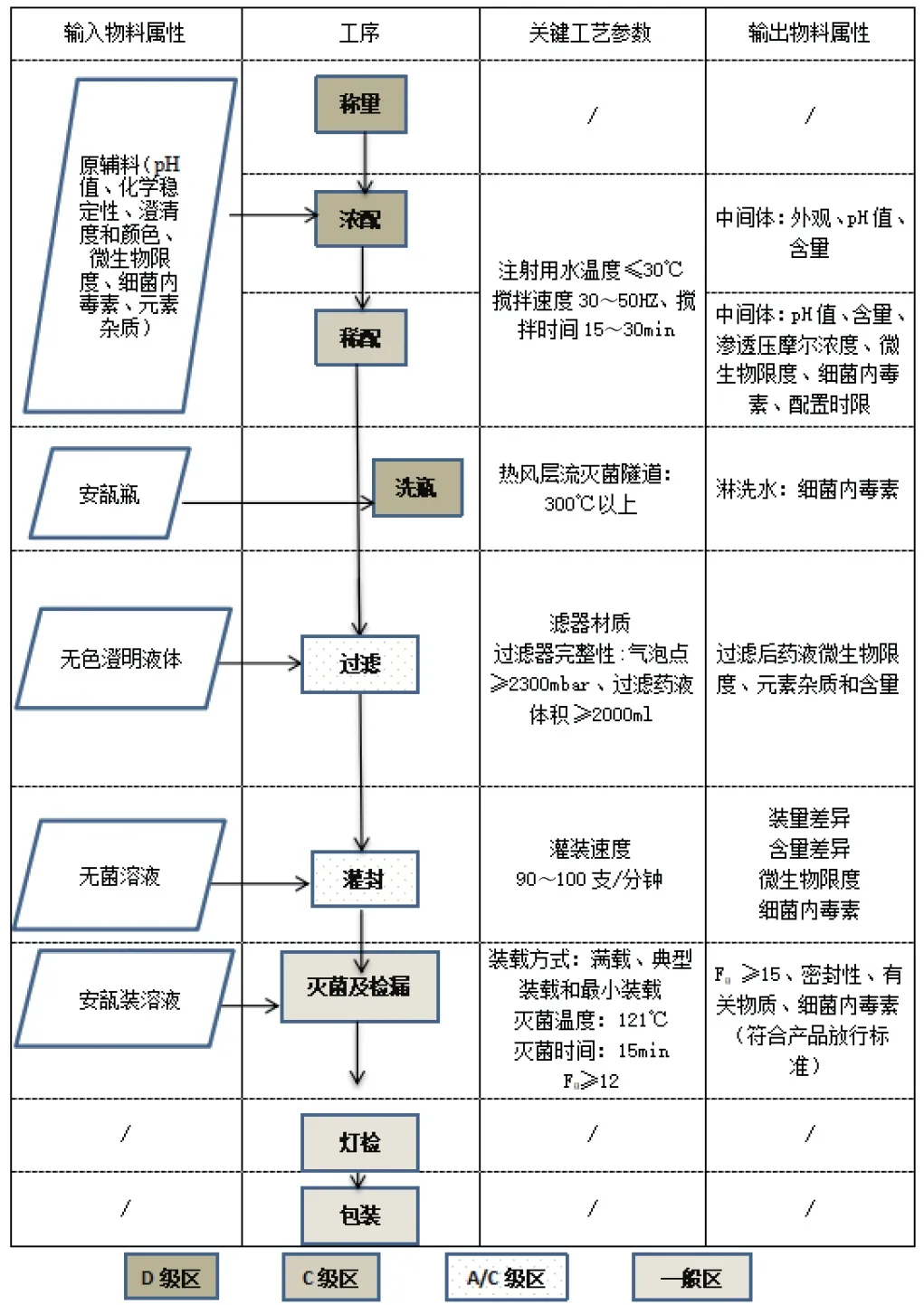
图1 注射液工艺流程
4.生产工艺对产品关键质量属性的影响评估
首先对整个药品生产工艺进行风险评估,以确定可影响成品药品关键质量属性的高风险工艺步骤。对每一工艺步骤进行风险评估以确定潜在的高风险工艺变量。这些变量可能影响已确定的中间产品的关键质量属性,并最终影响药品的关键质量属性[10-11]。生产工艺的初始风险评估、依据及拟控制策略见表2。
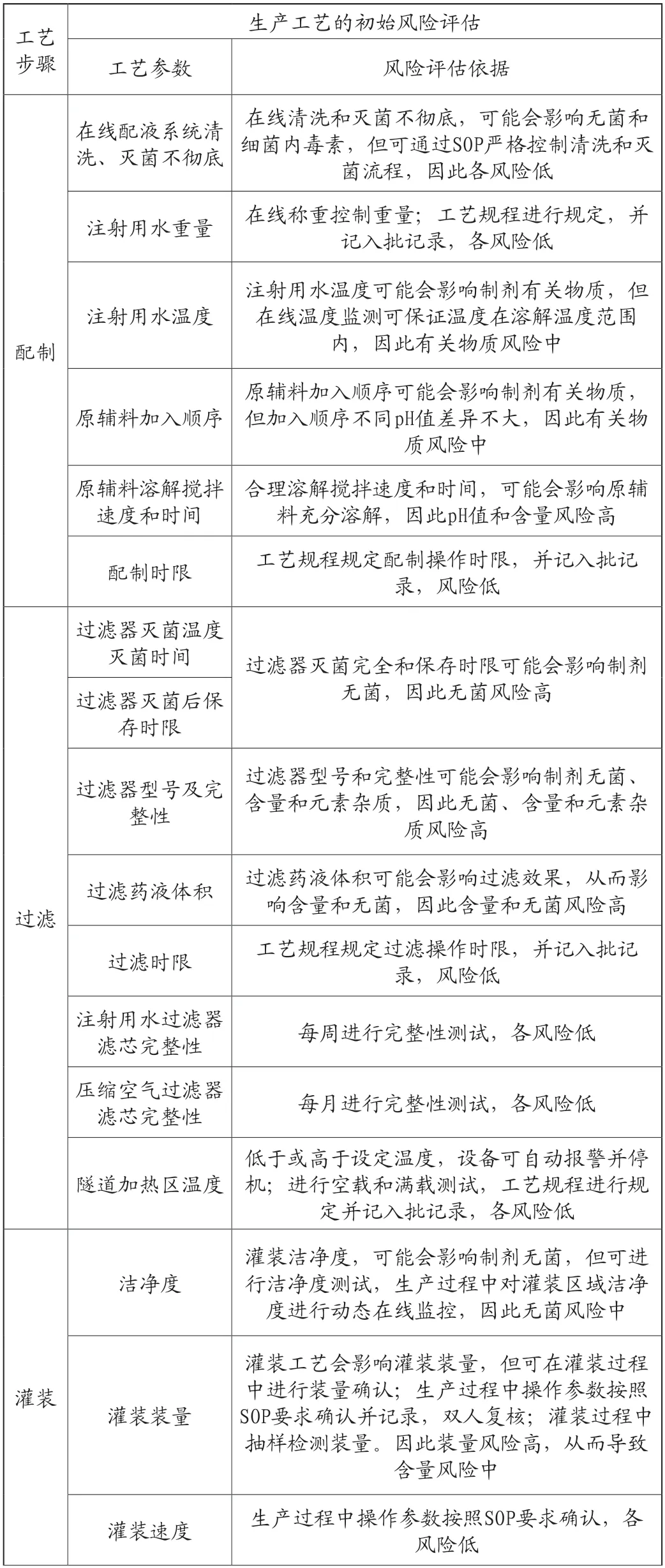
表2 生产工艺的初始风险评估

续表
通过风险评估,确认配制、过滤、灌封和灭菌为关键工艺步骤,后续开展相应研究。
5.确定的关键工艺参数
生产工艺中配制、过滤系统、灌封和灭菌工艺的关键工艺参数见表3。
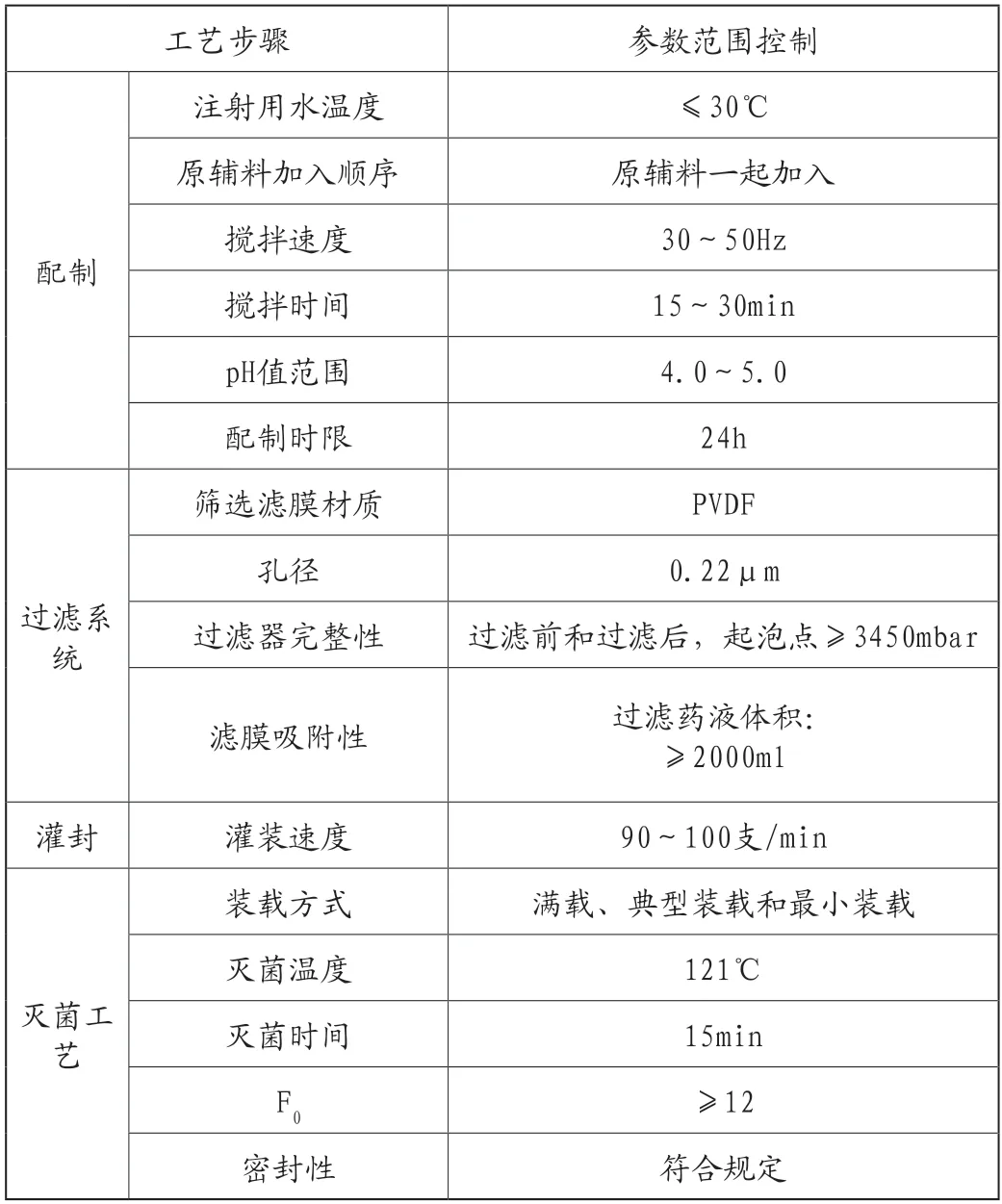
表3 工艺研究
6.药物性质对注射液工艺的影响
根据药物不同的性质,注射液工艺参数需要进行调整,如,不同药物过滤体积会不同;药液黏度不同装量不同则灌装速度也不同;稳定性不同的药物灭菌方式、灭菌温度和时间不同;复杂注射液工艺相较复杂,如为了改善原料的溶解性增加表面活性剂,增加乳化等制备工艺。因此,注射液制备工艺需要根据药物性质,给药目的等制定合理的工艺参数。
7.讨论
在注射液处方工艺中应用QbD理念,确定产品的关键质量属性,基于风险评估,采用过程控制策略,如控制输入物料关键质量属性(CMAs)和控制关键工艺参数(CPP)保障产品质量,进一步说明产品是设计出来的,不是检验出来的。
