三叶青地上部分水溶性多糖的抗肿瘤作用研究*
2023-03-22龚来觐李鹤
龚来觐,李鹤
江西农业工程职业学院 江西宜春 331200
三叶青 Tetrastigma hemsleyanum 为葡萄科崖爬藤属蔓生植物,主要以块根入药。三叶青又名金线吊葫芦、蛇附子、石抱子等,主产地为浙江、福建、江西等南方地区,其性凉,味微甘、辛,具有清热解毒、消炎止痛、祛风化痰等功效[1-2]。据报道,三叶青具有抗炎、抗病毒、抗氧化、抗肿瘤及免疫调节等药理活性,三叶清块根可以抑制肿瘤细胞的增殖并诱导各种癌细胞的凋亡[3]。广泛用于白血病和肺癌、肝癌、胃癌的治疗。现代研究发现,乙醇提取的三叶清黄酮抗肿瘤和抗氧化作用[4]。然而,三叶清水煎剂在传统民间医学中被广泛使用,三叶清水提物中的活性成分,包括多糖,仍然缺乏研究。此外,大多数研究集中于三叶青的块根,从三叶青叶子中提取的多糖研究报告较少。为了开发药用资源,本研究旨在从三叶清叶子中提取纯化多糖,对其化学性质进行表征。并用H22荷瘤小鼠研究其抗肿瘤作用,对小鼠血清中的细胞因子进行了评价,并对其调节机制进行了研究。
实验材料与方法
1 试剂与材料
肿瘤坏死因子α(TNF)a、白细胞介素-6(IL-6)、白细胞介素-10、白细胞介素-12、环磷酸腺苷(cAMP)、干扰素 -γ(IFN-γ)、白细胞介素 -1β(IL-1β)和前列腺素E2(PGE2)的酶联免疫吸附试验(ELISA)试剂盒购自上海新凡生物科技公司(中国上海);BCA蛋白检测试剂盒购自Beyotime biotechnology(中国上海);脂多糖(LPS)购自美棉生物科技(中国江苏盐城);本研究中使用的其他试剂为分析级试剂,本研究中使用的水是从默克Milli-Q水净化系统获得的去离子水。
三叶青的地上由江西大茅山中药生物科技有限公司提供,经江西农业工程职业学院龚福保教授鉴定。
2 动物
健康雄性昆明小鼠(22±2 g)、ICR 雄性小鼠(25±2 g)和 BALB/c雄性小鼠(22±2 g)购自江西中医药大学实验动物中心。小鼠被安置在温度为21~23°C、相对湿度为30%~70%、光照/暗照周期为12h的有机玻璃笼中,可以自由获取食物和水。
3 三叶青地上部分多糖的制备与分析
3.1 多糖的提取与纯化 取三叶青地上部分粉末250g,1000mL去离子水80℃提取三次,每次30min,合并,过滤,在4000r/min下离心20min,减压浓缩,干燥得水溶性部分(WSP)。在浓缩液中加入三倍体积的95%乙醇,4℃放置12h。离心,将沉淀重新溶解在水中,并重复沉淀程序,冻干沉淀得到粗多糖。sevag法脱蛋,脱蛋白样品上DEAE-Sepharose fastflow柱(2.6cm×30cm),用流速 1.0 mL/min 的 0.2mol/L 、0.5mol/L、1.0mol/L NaCl溶液逐步梯度洗脱。0.2moL/LNaCl溶液洗脱部分过Superdex-200(2.0cm×80cm)色谱柱,去离子水洗脱,获得纯化的多糖为三叶青多糖[5-7]。
3.2 均匀性和分子量测定[8-9]高效凝胶渗透法测多糖的均质性和分子量,以分子量为5kDa、25kDa、50kDa、80kDa、150kDa的右旋糖酐标准物用作标准分子标记物;Waters1525(Waters Ultrahydrogel500 柱),蒸发光散射检测器;流动相:20mmoL/L醋酸铵溶液等度洗脱,样品用流动相溶解制备成1mg/mL的溶液,注射体积20μL。
3.3 化学性质及单糖组成分析 气相色谱-质谱(GCMS)测定多糖的单糖组成,在密封试管中,100℃TFA水解多糖6h,添加甲醇将水解产物蒸发至干燥,以去除TFA。依次添加去离子水和四氢硼酸钠(NaBH4)还原单糖3h。还原产物用醋酸酐中和并蒸发至干燥,然后用3mL吡啶和3mL醋酸酐在100℃下乙酰化1h。冷却至室温后,旋转蒸发器去除多余的醋酸酐。乙酰化衍生物通过岛津GC-MSQP2010进行分析,色谱柱 HP-5毛细管柱(30.0 m×0.25 mm,0.25μm)。柱烘箱温度以2℃/min的速率从120℃上升到200℃,并以10℃/min的速率进一步上升到250℃。使用氦气作为载气,速率 1.0 mL /min。MS操作参数如下:电离能70eV;离子源温度230℃;在扫描模式下收集数据。用保留时间和质谱对化合物进行了鉴定。样品中的糖醛酸还原为中性,随后通过GC-MS进行测定[10-11]。
4 血清细胞因子水平的测定
小鼠给药2h后从眼眶采集血样,血清在4℃下以4000 r/min的速度离心分离10min,然后储存在-80℃,直到测量细胞因子。根据制造商的方案,使用ELISA试剂盒测定可溶性细胞因子的浓度。
5 抗肿瘤活性
取活的癌细胞(0.2 mL,1×107细胞 /mL)皮下移植到小鼠右侧腹股沟。接种后,将荷瘤小鼠随机分为五组,每组10只,分别为:生理盐水对照组、环磷酰胺(CTX)50 mg/kg组和以 50、100 和 200 mg/kg浓度给药的三个三叶青多糖组。每天口服一次生理盐水和三叶青多糖,连续10d。每隔一天腹腔注射一次CTX。在接种后4、7和10天内测量肿瘤体积。在最后一次给药后12h,称量小鼠体重并通过颈椎脱位处死。按照第4所述方法,从眼眶腔采集血样,以检测小鼠血清细胞因子。立即收集肿瘤、脾脏和胸腺并称重[12-13]。通过以下等式计算肿瘤抑制率、脾脏指数和胸腺指数:
抑制率(%)=1-(试验组平均肿瘤重量/对照组平均肿瘤重量)×100
脾 脏 指 数(mg/g)=脾 脏 重 量 /小 鼠 重 量×1000mg/g
胸腺指数(mg/g)=胸腺重量/小鼠重量×1000(mg)/1(g)
6 脾淋巴细胞增殖试验
小鼠脾细胞在RPM中的96孔板(1×106个细胞/孔)中培养,并与三叶青多糖在0~400μg/mL下孵育48h。随后,向每个孔中添加40μLMTS,并将细胞再孵育2h,记录490nm处的吸光度[14]。
7 THP-1和RAW264.7细胞分泌细胞因子的测定
THP-1和RAW264.7细胞,THP-1细胞用杜尔贝科改良的鹰氏培养基(DMEM)在96孔板(5×104细胞 /孔)培养 48h。然后,制备四种 0、5、10和 20μg/mL浓度的TAK-242,将LPS和三叶青多糖添加到最终浓度为100μg/mL的三叶青多糖中,并将LPS添加到100ng/mL和1μg/mL中。培养24h后,收集培养上清液。将RAW264.7细胞接种到另一个96孔板(1×105细胞/孔)中,重复与THP-1培养相同的程序。使用商业ELISA试剂盒测定细胞因子TNF-α和IP-10的定量。
8 统计分析使用SPSS19.0软件包进行统计分析。
使用单因素方差分析对数据进行分析。P<0.05的值被认为具有统计学意义。
结 果
1 多糖的分离与表征
250 g三叶青叶子中获得了27.8gWSP。sevag法脱蛋白后,DEAE-Sepharose阴离子交换色谱进行分离纯化。如图1A所示,在用0.2 mol/LNaCl溶液洗脱的部分中观察到一个相对较强的峰,该峰被收集用于进一步纯化,而用 0.5 mol/L NaCl溶液洗脱的部分呈现一个相对较弱的峰,并被丢弃。随后在Superdex-200柱上对收集的洗脱液进行色谱分析,并获得一个单峰,如图1B所示。收集该组分并命名为三叶青多糖以供进一步分析。
用HPGPC测定三叶青多糖的均一性。如图1 C所示,三叶青多糖呈对称窄峰,保留时间为8.325min。右旋糖酐的校准曲线为 lg Mw = 9.9006-0.6184t(R2= 0.9936),(其中 Mw 为分子量,t为保留时间)。根据校准曲线,三叶青多糖的平均分子量约为66.4 kDa,三叶青多糖的总糖和糖醛酸含量分别为84.8%和47.28%。
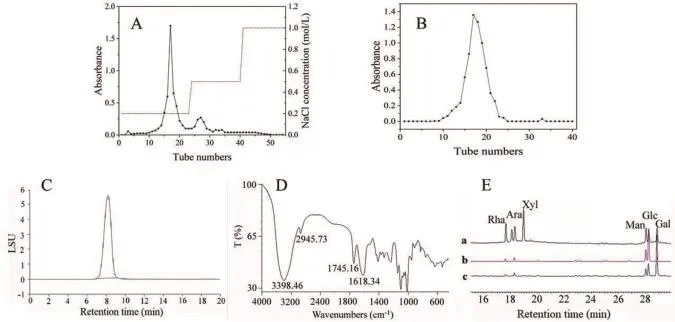
图1 多糖的分离和表征
三叶青多糖的FT-IR光谱如图1D所示。在3398.46 cm-1处观察到两种多糖的特征吸收和2945.73cm-1,分别对应于碳水化合物的O-H拉伸和芳香结构和甲基的C-H拉伸。1618.34cm-1处的强吸收表明三叶青多糖中存在羧基。峰值为1745.16 cm-1表明存在糖醛酸。[15]
用BCA蛋白检测试剂盒测定三叶青多糖蛋白含量为4.48%。此外,经水解和衍生后,用GC-MS测定三叶青多糖的单糖组成,如图1E的色谱图b所示。
GC-MS结果表明,还原产物(三叶青多糖R)由Glc、Man、Ara、Gal和 Rha。如图1E 的色谱图 c所示。
2 三叶青多糖的抗肿瘤活性
如图2所示,以H22移植瘤小鼠为研究对象,灌胃给予三叶青多糖,评估其抗肿瘤活性。最后一次给药后,对照组、CTX组、50mg/kg 三叶青多 糖 组、100mg/kg 三 叶 青 多 糖 组 和 200mg/kg 三叶青多糖组小鼠的体重分别为(36.70g±2.44g)、(34.52g±1.54g)、(33.96g±2.76g)、(34.30g±2.36g)和(34.43g±1.97g)。接种CTX和三叶青多糖后4、7和10天内,用CTX和三叶青多糖治疗的小鼠的肿瘤体积小于对照组。在不同的三叶青多糖治疗组中,观察到给予大剂量三叶青多糖的小鼠,在所有组中,CTX治疗对肿瘤体积的抑制作用最为显著。结果表明,三叶青多糖对H22荷瘤小鼠的肿瘤大小和重量均有抑制作用。200mg/kg剂量组对H22肿瘤的抑制率为46.8%,与对照组相比有非常显著性差异(P<0.01)。根据实验结果,SYQP通过与对照组表现出显著差异来抑制肿瘤生长,并且随着SYQP给药剂量的增加,抑制率增加。CTX对肿瘤生长的抑制率为66.9%,比SYQP更有效。
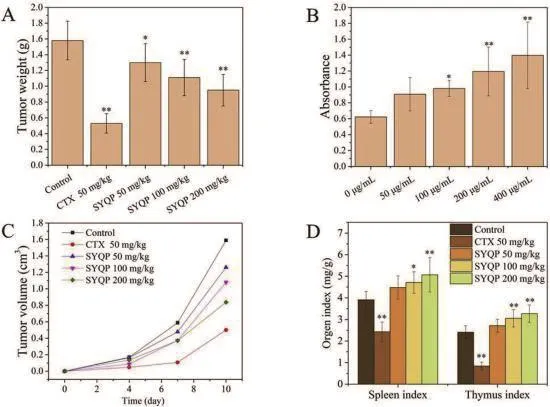
图2 三叶青多糖对肿瘤生长、器官指数和脾细胞增殖的影响。
3 抗脾淋巴细胞增殖
胸腺和脾脏是动物重要的免疫器官,在免疫细胞的产生和免疫反应中起着至关重要的作用。[16]探讨三叶青多糖对免疫功能的影响对系统在体、脾脏指数和胸腺指数进行了研究。结果表明,与对照组相比,CTX组胸腺指数和脾脏指数均显著降低(P<0.01),表明CTX抑制了机体的免疫能力,导致免疫功能减弱。与对照组相比,脾脏和胸腺指数均有改善,且在剂量为200 mg/kg时,与对照组相比有显著性差异(P<0.01)。这些数据表明,三叶青多糖对H22荷瘤小鼠的免疫器官具有有益作用。
在动物实验结果的基础上,进一步研究了三叶青多糖对脾细胞增殖的影响。分离小鼠脾细胞,用三叶青多糖培养。如图2 所示,0、50、100、200、400μg /mL的三叶青多糖处理显著刺激脾细胞增殖呈剂量依赖性。类似地,这种治疗可以促进有丝分裂原刺激的脾细胞增殖,当应用200μg/mL和400μg/mL的高浓度三叶青多糖时,获得了显著差异。因此,本研究获得的结果表明,三叶青多糖可能同时增强细胞免疫和体液免疫。[17]
多糖精确的抗肿瘤机制相当复杂,多糖发挥抗癌或抗肿瘤活性的一种作用模式可能是激活宿主免疫反应。[18]
胃内注射三叶青多糖的荷瘤小鼠和用三叶青多糖培养的脾细胞的增殖均证明了三叶青多糖在体内外上调免疫系统方面的积极作用,这可能与对肿瘤生长的抑制作用有关。进一步研究三叶清对荷瘤小鼠细胞因子水平的影响,以了解三叶清的作用机制。
4 三叶青多糖对荷瘤小鼠血清细胞因子水平的影响
探讨三叶青多糖对血清细胞因子水平的抗肿瘤作用,收集血清样本,用ELISA方法测定细胞因子。如表1所示,当对照组肿瘤重于1g时,在禁食12h后取出小鼠眼睛并采集血清样本。尽管正常组与对照组之间几乎没有显著差异,但INF-γ,与对照组相比,服用100和200 mg/kg 三叶青多糖的荷瘤小鼠血清中TNF-α和IL-6水平显著升高(P<0.05)。
表1 三叶青多糖对荷H22肝癌小鼠血清细胞因子的影响(±s)

表1 三叶青多糖对荷H22肝癌小鼠血清细胞因子的影响(±s)
结果表示为平均值±标准差(n=10),与正常组比较有显著性差异,*P<0.05;与正常组比较有非常显著性差异,**P<0.01;与对照组比较有显著性差异,△P<0.05;与对照组比较有非常显著性差异,△△P<0.01。
Group Dose(mg/kg) TNF-α(ng/L) IL-6(pg/mL) IFN-γ(ng/L) IL-1β(ng/L)Normal - 377.07±23.10 21.79±4.19 34.88±7.44 15.68±2.01 Control - 332.40±27.59** 16.81±4.81 36.29±8.73 14.66±1.56三叶青多糖 50 355.07±37.21 21.32±4.82 48.75±12.38 12.97±1.56三叶青多糖 100 371.07±24.83△ 23.65±5.59△ 53.64±11.89*△ 14.83±2.56三叶青多糖 200 395.07±20.49△△ 26.11±6.32△△ 71.98±17.99**△△ 17.52±5.23
此外,三叶青多糖处理浓度为10、100和1000μg/mL对H22肝癌细胞系的体外生长无明显影响。结果表明,三叶青多糖的抗肿瘤活性不是通过直接杀死肿瘤细胞来实现的,但与其免疫调节活性有关[19]。服用三叶清多糖可激活免疫功能,包括巨噬细胞、T或B淋巴细胞和自然杀伤细胞,并促进细胞因子的产生,以促进免疫系统的调节[20],表明,三叶青多糖中存在高含量的GalA,因此,GalA除了其他成分外,可能在抗肿瘤和调节免疫调节活性方面发挥重要作用。GalA的生物活性和药理学有待进一步研究。
5 三叶青多糖与toll样受体4(TLR4)的结合激活免疫调节因子
如图3所示,研究发现,100μg/mL的三叶青多糖和1μg/mL和100 ng/mL的LPS都能刺激THP-1分 泌 TNF-α 和 IP-10,TAK-242阻 断 TLR4后,TNF-α和IP-10被显著抑制。在RAW264.7中也观察到同样的现象。表示三叶青多糖可以通过MyD88依赖和三重依赖途径刺激TLR4,这可能与LPS的机制相同。
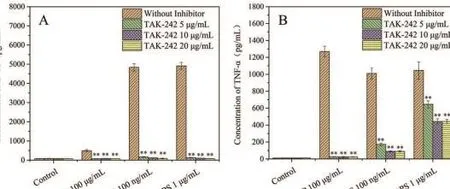
图3 三叶青多糖对TAK-242抑制剂处理的THP-1细胞因子分泌的影响
讨 论
本研究比较了三叶青地上部分的水溶性多糖,发现在200 mg/kg 三叶青多糖小鼠模型中,对H22肿瘤的抑制率为48.6%。脾脏指数、胸腺指数和脾细胞增殖与三叶青多糖的应用成正比,表明多糖激活了免疫功能。添加TLR4抑制剂TAK 242后,三叶青多糖和LPS刺激产生的细胞因子(包括IP-10和TNF-α)减少,表明三叶青多糖和LPS都通过TLR4刺激细胞因子的产生。进一步的研究表明,服用三叶青多糖可以刺激细胞因子的产生,降低LPS引起的血清细胞因子水平,这表明三叶青多糖可能与TLR4竞争,与TLR4相互作用,调节细胞因子的产生。因此,结果表明,三叶青多糖的抗肿瘤活性不是通过肿瘤细胞的凋亡来实现的,而是通过其多糖的免疫调节活性来实现的。本研究将为开发三叶青多糖作为肿瘤药物提供基础。
