去铁胺对糖尿病大鼠肝细胞铁死亡通路的影响
2023-03-22杨文曲韩冲芳贺建东李浩甲山西医科大学第三医院山西白求恩医院山西医学科学院同济山西医院麻醉科太原03003山西医科大学麻醉学院麻醉教研室通讯作者mailhanchongfang003foxmailcom
杨文曲,韩冲芳,贺建东,王 慧,李浩甲(山西医科大学第三医院,山西白求恩医院,山西医学科学院,同济山西医院麻醉科,太原 03003;山西医科大学麻醉学院麻醉教研室;通讯作者,E-mail:hanchongfang003@foxmail.com)
糖尿病患者往往伴随多器官功能的下降,肝细胞受损及功能下降导致的胰岛素抵抗是造成血糖升高的主要原因之一[1]。有研究发现,核受体共同激活因子4(NCOA4)表达增加可能是导致糖尿病肝脏受损的关键[2],而NCOA4可以特异性连接铁蛋白和自噬小体,促进铁蛋白自噬的发生,导致细胞内游离铁离子增多,激活铁死亡通路[3]。去铁胺是一种铁螯合剂,通过结合游离Fe3+抑制了铁死亡通路,改善胰岛素抵抗[4],但具体机制尚未明确。本文旨在评价去铁胺对糖尿病大鼠肝脏铁死亡通路的影响,探讨去铁胺减轻糖尿病大鼠肝脏损伤的可能机制。
1 材料与方法
1.1 实验动物与造模
取体质量240~290 g的健康成年雄性SD大鼠36只,山西医科大学实验动物中心提供。采用随机数字表法将其分为3组(n=12):正常组(Con组)、糖尿病组(DM组)、去铁胺处理组(DFO组)。Con组大鼠在禁食8 h后经腹腔注射10 ml/kg枸橼酸钠缓冲液,普通饲料喂养,饮水饲料供应充足,保持垫料干燥;DM病组大鼠在禁食8 h后,参照文献[5]采用头低位腹腔注射55 mg/kg STZ(美国Sigma公司,浓度10 mg/ml)建立糖尿病模型,三组大鼠于造模后第1,3,10,17,24,31天监测日间随机血糖、体质量和24 h饮水量;DFO组采用与DM组相同的方法制备糖尿病模型,于造模后第24天开始每日腹腔注射去铁胺(诺华制药有限公司,0.2 mg/g,浓度50 mg/ml)持续1周。造模失败的大鼠由重新购买并造模成功的大鼠补足。
1.2 血液生化仪测定血浆ALT浓度
于造模后第31天,采用断尾法采血2.5 ml,收集于抗凝采血管中,4 ℃离心机12 000 r/min离心10 min,取约1 ml血浆,使用全自动动物血液生化仪测血浆ALT浓度。
1.3 HE染色观察肝细胞的病理学变化
采血后采用脊椎脱臼法处死大鼠,取肝脏左外侧叶,生理盐水冲洗后置于-80 ℃冰箱冷冻5 min。将肝脏左外侧叶切成10 mm×7 mm的标本,经过固定、脱水、透明、石蜡包埋、切片,制成4 μm厚标本切片。采用苏木素染液染色5 min,伊红染液染色1 min后封片,光镜下观察肝细胞结构。
1.4 普鲁士蓝染色观察含铁小粒数量
取1.3中标本切片,经脱腊、蒸馏水冲洗后,采用普鲁士蓝染料染色30 min,核固红染色液10 min,经脱水透明后树胶封片,光镜下观察肝细胞内含铁小粒数量。
1.5 Western blot检测LC3Ⅱ、FTH、NCOA4的表达
每只大鼠的肝脏各取50 mg组织,加入RIPA裂解液10 μl/mg和PMSF蛋白酶抑制剂0.1 μl/mg,提取总蛋白。每份样品取50 μg,选择12%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),进行湿法转膜。37 ℃脱脂牛奶封闭2 h,分别加入铁蛋白重链单克隆抗体(FTH,1 ∶1 000);核受体共同激活因子4单克隆抗体(NCOA4,1 ∶1 000);微管相关蛋白3单克隆抗体(LC3Ⅱ,1 ∶1 000)和内参GAPDH(1 ∶1 000)孵育过夜。洗膜后加入HRP二抗山羊抗兔(1 ∶1 000)孵育2 h,自动曝光仪曝光显影。采用ImageJ软件测定条带灰度值,以目的条带灰度值与GAPDH灰度值的比值反映表达。
1.6 统计学方法

2 结果
2.1 糖尿病模型造模结果
与Con组比较,DM组和DFO组在造模后第3,10,17,24,31天血糖和饮水量明显升高(P<0.05),DM组和DFO组体质量在第17,24,31天明显降低(P<0.05,见表1、表2);与DM组比较,DFO组造模后各日饮水量和体质量均无统计学差异(P>0.05),造模后第1,3,10,17,24天血糖无统计学差异,造模后第31天血糖明显降低(P<0.05,见表3)。

表1 各组大鼠饮水量比较Table 1 Comparison of 24-hour water intake in rats between groups (ml/24
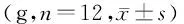
表2 各组大鼠体质量变化比较Table 2 Comparison of body weight of rats between
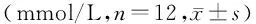
表3 各组大鼠血糖值比较Table 3 Comparison of blood sugar level in rats between
2.2 血浆ALT浓度的测定结果
造模后第31天,与Con组比较,DM组和DFO组大鼠血清ALT含量增加[(20.7±2.3)U/Lvs(45.7±4.2)U/L,(30.2±4.1)U/L,P<0.05];与DM组比较,DFO组大鼠血清ALT含量降低(P<0.05)。
2.3 肝脏HE染色结果
Con组肝细胞形态正常,细胞排列整齐,肝小叶结构清晰,胞质含粉红色嗜酸性颗粒;DM组肝细胞肿胀,细胞核染色加深;DFO组肝细胞结构较完整,胞质染色较均匀(见图1)。
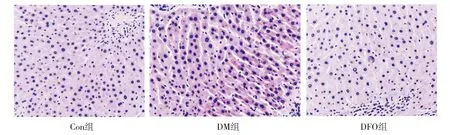
图1 各组大鼠肝脏HE染色细胞形态结构的比较 (×200)Figure 1 Comparison of morphological structure of hepatocytes by HE staining between groups (×200)
2.4 肝脏普鲁士蓝染色结果
Con组肝细胞内有少量含铁小粒;DM组肝细胞内有较多含铁小粒;DFO组肝细胞内出现少量空泡和少量含铁小粒(见图2)。

箭头所指为含铁小粒图2 各组大鼠肝脏普鲁士染色含铁小粒数量的比较 (×400)Figure 2 Comparison of the number of iron particles in hepatocytes by perls staining between groups (×400)
2.5 肝细胞中LC3Ⅱ、FTH、NCOA4的表达
与Con组比较,DM组和DFO组肝细胞LC3Ⅱ、FTH、NCOA4表达增多(P<0.05);与DM组比较,DFO组大鼠肝细胞FTH、LC3Ⅱ、NCOA4含量降低(P<0.05,见图3)。

与Con组比较,*P<0.05;与DM组比较,#P<0.05图3 三组大鼠肝细胞LC3Ⅱ、FTH、NCoA4蛋白表达量比较Figure 3 The expression levels of LC3Ⅱ,FTH, and NCOA4 proteins in hepatocytes in each group
3 讨论
铁死亡是铁代谢异常导致的细胞内过氧化损伤引发的调节性细胞死亡[6]。铁蛋白自噬对铁死亡有促进作用,可通过损伤胰岛β细胞功能,引发胰岛素分泌障碍[7,8]。肝细胞结构和功能异常所致胰岛素抵抗是糖尿病进展的主要机制之一[1]。研究表明,去铁胺作为一种铁螯合剂,可改善糖尿病胰岛素抵抗并减轻肝细胞损伤[9,10]。本实验参照既往预实验及文献[5],选择单次腹腔注射STZ 55 mg/kg成功制备糖尿病大鼠模型。糖尿病组和去铁胺组大鼠在造模后第3,10,17,24,31天血糖和饮水量显著升高,造模后第17,24,31天体质量显著降低,表明糖尿病组和去铁胺组糖尿病大鼠模型制备成功。
铁蛋白自噬可降解铁蛋白、释放游离铁离子,从而通过芬顿反应加速细胞内氧化应激,促进铁死亡的发生[11]。NCOA4是决定铁蛋白自噬水平的关键蛋白[12]。在本实验中,糖尿病组大鼠NCOA4、FTH、LC3II表达增加,ALT浓度升高,肝细胞结构受损且含铁小粒数量增加,提示糖尿病损伤肝细胞与肝细胞内铁蛋白自噬增加有关。与之相似,糖尿病对缺血再灌注心肌细胞的损伤机制也与心肌细胞内铁蛋白自噬增加有关,并可通过抑制铁蛋白自噬、抑制铁死亡改善心肌损伤[13]。由此推测,抑制铁蛋白自噬与铁死亡有益于糖尿病状态下的肝细胞保护。
去铁胺作为一种铁螯合剂,临床上主要用于治疗地中海贫血,输血引起的铁负荷过重,可以结合Fe3+,抑制芬顿反应和脂质过氧化,从而抑制铁死亡的发生[14,15]。在本研究中,与糖尿病组相比,去铁胺组大鼠在注射去铁胺1周后血糖水平降低,肝细胞NCOA4、FTH、LC3II表达降低,肝细胞结构较完整且含铁小粒数量减少,提示去铁胺可通过抑制铁蛋白自噬减轻糖尿病所致肝细胞损伤,并改善血糖水平。因此,靶向抑制铁蛋白自噬介导的肝细胞铁死亡可能是针对糖尿病状态下肝细胞损伤与糖代谢异常的潜在治疗策略。
综上所述,去铁胺减轻糖尿病大鼠肝细胞损伤可能通过抑制铁死亡通路中的肝细胞内NCOA4的表达有关。
