miR-338-5p过表达对胃癌细胞进展及耐药基因表达的影响
2023-03-22邢智伟常丽娟史雅瑄高雅楠刘彩霞内蒙古医科大学附属医院肿瘤内科呼和浩特00050内蒙古医科大学内科教研室通讯作者maillcxzhg97463com
邢智伟,常丽娟,史雅瑄,高雅楠,刘彩霞(内蒙古医科大学附属医院肿瘤内科,呼和浩特 00050;内蒙古医科大学内科教研室;通讯作者,E-mail:lcxzhg974@63.com)
胃癌发病率在恶性肿瘤里位居第5位,死亡率位居第3位,对人类健康构成了严重威胁[1]。胃癌早期的症状并不典型,仅表现出轻微的上腹部不适。当症状变得更加明显时,通常已经发展到病变晚期,并伴随癌细胞的远处转移。胃癌的高死亡率和不良预后与其侵袭性强、转移率高、增殖快、复发率高密切相关,侵袭和转移被认为是胃癌的恶性标志[2]。此外,胃癌细胞的耐药性也是胃癌患者治疗失败的最重要原因之一[3]。
microRNAs(miRNAs)作为高度保守的非编码RNA,靶向特定的mRNA,参与调节细胞增殖、死亡和信号通路等多种基本细胞过程。其中,miR-338可作为肿瘤发生发展过程中的抑制因子,诱导细胞凋亡与周期阻滞,抑制癌细胞增殖[4]。miR-338-5p作为凋亡相关酶中的内含子miRNA,可抑制肝细胞生长因子受体和皮生长因子受体来抑制食管鳞癌转移[5]、抑制胰腺癌细胞上皮间质转化[6]等。同时,miR-338可通过调控第10染色体同源丢失性磷酸酶张力蛋白基因人第10号染色体缺失的磷酸酶(phosphatase and tensin homology deleted on chromosome ten,PTEN)和蛋白激酶B(protein kinase B,AKT)组成的PTEN/AKT信号通路在肿瘤进展过程中发挥发挥肿瘤抑制作用[7]。抑制PTEN/AKT信号通路,可以抑制胃癌细胞侵袭转移及耐药作用[8]。然而,miR-338-5p参与胃癌细胞侵袭转移还未见报道,是否通过PTEN/AKT信号通路调控胃癌细胞的耐药性也尚待研究。探讨miR-338-5p能否通过PTEN/AKT信号通路影响胃癌细胞的侵袭和耐药,对加强对胃癌细胞转移、耐药的见解,提供靶点替代疗法具有重要意义。因此,本研究通过探讨miR-338-5p对胃癌细胞侵袭及耐药的调控作用,为后续寻找胃癌新的治疗方法提供理论基础。
1 材料与方法
1.1 材料
人胃癌细胞MKN-45来源于中国典型培养物保藏中心(武汉大学);RPMI-1640培养基(Roswell Park Memorial Institute)(北京TBD生物技术发展中心);胎牛血清(武汉普诺赛生命科技有限公司);PBS,0.25%胰蛋白酶,结晶紫(南京森贝伽生物科技有限公司);减血清培养基,Opti-MEM(美国sigma公司);Lipofectamine®RNAiMAX(美国life公司);SYBR FAST qPCR Master Mix(美国KAPA Biosystems公司);基质凝胶,Tween-20,RIPA(强)组织细胞快速裂解液,BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);化学发光试剂(美国Millipore公司);细胞计数试剂-8(Cell Counting Kit-8,CCK-8),PTEN蛋白一抗,AKT蛋白一抗,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)蛋白一抗,山羊抗兔二抗(武汉贝茵莱生物科技有限公司);Trizol,磷酸化蛋白激酶B(phosphoprotein kinases B,p-AKT)(英国abcam公司)。
1.2 方法
1.2.1 人胃癌MKN-45细胞复苏与培养 将冻存的人胃癌MKN-45细胞在37 ℃条件下融化后,吸至离心管中,加入含有105 U/L青霉素、100 mg/L链霉素和10%灭活胎牛血清的RPMI-1640培养液中,37 ℃ 5% CO2培养箱中培养,待MKN-45细胞融合度达到90%后,进行传代(比例为1 ∶2~1 ∶3)培养,取对数生长期的细胞进行后续实验。
1.2.2 miR-338-5p mimics及inhibitor的设计与合成 以miR-338-5p(GI:764016550)为对象(序列信息:AACAAUAUCCUGGUGCUGAGUG),通过基因合成的方法获取目的基因序列,进行载体线性化、回收,与目的基因连接、转化、阳性克隆鉴定,测序,最终成功构建并合成miR-338-5p的mimics、inhibitor及相应NC。
1.2.3 分组干预 在完成1.2.1的细胞复苏和培养后,将MKN-45细胞分为control组、mimics组、mimics-NC组、inhibitor组和inhibitor-NC组,正常培养的MKN-45细胞作为control组,其余组分别转染miR-338-5p mimics质粒、miR-338-5p mimics NC质粒,miR-338-5p inhibitor质粒和miR-338-5p inhibitor NC质粒。转染样品稀释于250 μl Opti-MEM后静置和室温孵育备用,后续加入至含有MKN-45细胞的新鲜培养基的培养板孔中转染4 h后换新鲜培养基培养24 h。
1.2.4 CCK-8检测各组细胞增殖情况 收集干预后的细胞,于37℃、5% CO2的条件下培养至贴壁,分别在培养24,48,72 h后加入10 μl CCK-8溶液,并继续培养4 h。随后使用酶联免疫检测仪测量其在450 nm处的OD值,用OD值大小代表各组细胞增殖活力变化。
1.2.5 Transwell小室检测各组细胞迁移及侵袭检测 分组干预后的细胞换成无血清培养基培养24 h,接种到准备好的24孔板(与Transwell小室用PBS浸泡湿润过)被铺设matrigel胶后放置30 min。其后使用无血清培养液洗涤细胞并用1% FBS的培养基重悬细胞进行计数并稀释至1×105/ml,再接种到Transwell小室培养24 h。培养后使用4%甲醛溶液室温固定20 min并使用0.5%结晶紫溶液染色30 min,置于200倍显微镜下观察并对视野中的细胞进行计数。
1.2.6 qRT-PCR检测各组miR-338-5p及耐药蛋白基因表达 使用Trizol裂解各组干预后的细胞后提取其总RNA进行反转录并按照SYBR GREEN PCR Kit说明书进行qRT-PCR法检测。PCR扩增体系为95 ℃预变性3 min,95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,循环40次。引物序列见表1。miRNA-338-5p以U6为内参,其余基因以GAPDH为内参,按照计算公式2-ΔΔCt=目标基因相对表达量进行数据处理分析。
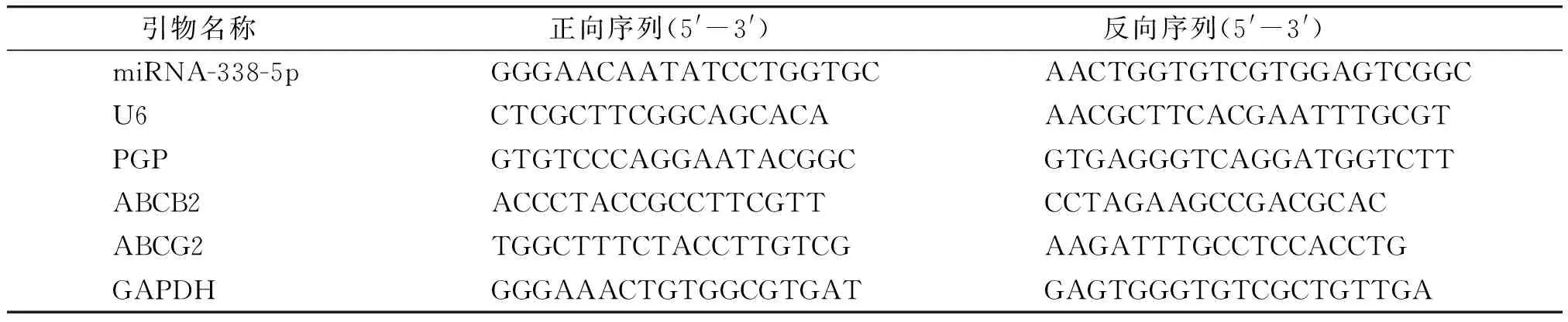
表1 引物序列信息Table 1 Primer sequence information
1.2.7 Western blot检测PTEN/AKT信号通路蛋白的表达 每组细胞收集约1×106个,加入含有蛋白酶和磷酸酶抑制剂的裂解液于4 ℃充分裂解,于95 ℃进行加热离心后取上清于100 ℃水浴中煮样5 min,冷却后加入10%的SDS-PAGE分离目标蛋白并转移至PVDF膜。接下来使用5%脱脂牛奶进行封闭,加入稀释比例为1 ∶1 000的PTEN一抗、AKT一抗、p-AKT一抗孵育1 h后,加入稀释比例为1 ∶10 000的羊抗兔二抗孵育1 h,于暗室使用发光液混匀并使用自动化学发光分析仪检测。TANON GIS软件读取相关条带灰度值。

2 结果
2.1 转染miR-338-5p mimics/inhibitor对人胃癌MKN-45细胞中miR-338-5p表达水平的影响
与control组相比,mimics-NC组和inhibitor-NC组miR-338-5p表达量无显著差异。与control组和mimics-NC组相比,mimics组的miR-338-5p表达量显著提高(P<0.05),与control组和inhibitor-NC组相比,inhibitor组的miR-338-5p表达量显著下调(P<0.05,见图1),说明转染后的各组人胃癌MKN-45细胞都符合后续的实验要求。

与control组相比,△P<0.05;与mimics-NC组相比,*P<0.05;与inhibitor-NC组相比,#P<0.05图1 不同转染后miR-338-5p在胃癌细胞中的表达Figure 1 Expression of miR-338-5p in gastric cancer cells after different transfection
2.2 miR-338-5p抑制细胞增殖、迁移与侵袭
与control组和mimics-NC组相比,细胞培养24,48,72 h,mimics组细胞增殖活力显著下降(P<0.05);与control组和inhibitor-NC组相比,inhibitor组细胞增殖活力明显上升(P<0.05,见表2),表明其细胞增殖没有受到抑制。与control组和mimics-NC组相比,mimics组细胞迁移和侵袭能力明显被抑制(P<0.05);与control组和inhibitor-NC组相比,inhibitor组细胞迁移和侵袭能力明显被增强(P<0.05,见图2)。

表2 miR-338-5p对MKN-45细胞增殖活力的影响Table 2 Effects of miR-338-5p on the proliferative activity of MKN-45 cells

与control组相比,△P<0.05;与mimics-NC组相比,*P<0.05;与inhibitor-NC组相比,#P<0.05图2 miR-338-5p表达对迁移和细胞侵袭能力的影响Figure 2 Effect of miR-338-5p expression on cell migration and invasion
2.3 miR-338-5p对耐药基因PGP、ABCB2和ABCG2 mRNA表达的影响
耐药基因mRNA表达的检测数据显示,与control组和mimics-NC组相比,mimcs组PGP、ABCB2和ABCG2的mRNA表达水平都显著下降(P<0.05);与control组和inhibitor-NC组相比,inhibitor组PGP、ABCB2和ABCG2的mRNA表达都显著上升(P<0.05,见图3)。
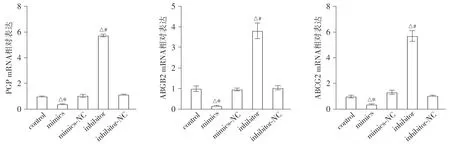
与control组相比,△P<0.05;与mimics-NC组相比,*P<0.05;与inhibitor-NC组相比,#P<0.05图3 miR-338-5p表达对细胞PGP、ABCB2和ABCG2 mRNA表达的影响Figure 3 Effect of miR-338-5p expression on the mRNA expression of PGP, ABCB2 and ABCG2 in cells
2.4 miR-338-5p对PTEN/AKT信号通路蛋白表达的影响
与control组和mimics-NC组相比,mimics组PTEN蛋白表达量显著上调(P<0.05),p-AKT蛋白表达量显著下调(P<0.05),AKT蛋白表达量无显著性变化(P>0.05);与control组和inhibitor-NC组相比,inhibitor组PTEN蛋白则显著上调(P<0.05),p-AKT蛋白则显著下调(P<0.05),AKT蛋白表达量无显著性差异(P>0.05,见图4)。

与control组相比,△P<0.05;与mimics-NC组相比,*P<0.05;与inhibitor-NC组相比,#P<0.05图4 miR-338-5p表达对细胞中PTEN,p-AKT和AKT蛋白表达的影响Figure 4 Effect of miR-338-5p expression on the protein expression of PTEN, p-AKT and AKT in cells
3 讨论
胃癌对中国人的健康造成巨大的负担,化学疗法是治疗胃癌的主要方法之一,但其耐药性限制了化学疗法的有效性,导致治疗失败,而遗传和表观遗传改变是胃癌发生和化疗耐药的关键因素[9]。最近研究发现,miRNAs的表达异常与肿瘤发病机制密切相关[10],但仍缺乏对涉及miRNA的胃癌分子机制的深入研究。临床研究中,胃癌患者癌组织和血清中的miR-338-5p低表达,且与临床病理特征、肿瘤体积增长、淋巴结转移等呈正相关[4]。同时,miR-338-5p可以靶向B淋巴瘤Mo-MLV插入区1同源物,介导抗肿瘤和基因调节作用,抑制胃癌细胞的生长[11]。本研究中miR-338-5p模拟物表达时,胃癌细胞的增殖被抑制;而miR-338-5p表达缺失时,胃癌细胞增殖能力增强,表明miR-338-5p上调能够有效抑制胃癌细胞的增殖。因此,miR-338-5p在肿瘤细胞中差异表达时,能通过胞内信号调节肿瘤细胞的恶性行为[12]。
癌细胞的侵袭和转移程度能反应癌症的严重程度[13]。癌细胞侵袭发生时,癌细胞会离开原发病灶组织,占领邻近的组织并对其破坏,在该组织中继续繁殖生长[14]。并且癌细胞转移发生时,癌细胞会从原发病灶扩散到继发部位形成继发瘤[15]。许广松等[16]研究发现,桦木酸通过迁移和侵袭发挥对胃癌MGC-803细胞增殖的抑制作用,进而抑制胃癌生长和扩散。本研究中,miR-338-5p表达上调后,胃癌细胞的迁移和侵袭能力被抑制,miR-338-5p的表达下调时,胃癌细胞迁移和侵袭能力增强,因此miR-338-5p对胃癌细胞迁移和侵袭能力有显著的抑制作用。
PGP、ABCB2和ABCG2是癌细胞的耐药性相关的基因,在体内的表达下降时,癌细胞的耐药性也会相对减弱[17,18]。在miR-338-5p表达上调时,PGP、ABCB2和ABCG2 mRNA表达显著下调,而miR-338-5p表达受到抑制时则显著上升,表明miR-338-5p的表达上调能够抑制胃癌细胞的耐药性,增强药物治疗的效果。
PTEN/AKT通路与肿瘤发生和发展密不可分。PTEN能够调节相关因子表达抑制肿瘤血管的生成,从而削弱肿瘤细胞的侵袭[19],其C2结构域能单独抑制瘤细胞迁移[20]。同时,p-AKT能够抑制肿瘤细胞的凋亡,通过催化相关蛋白质磷酸化促进其生长增殖,抑制凋亡[21]。PTEN作为PI3K/AKT通路中的主要抑制剂,当PTEN缺失从而激活PI3K/AKT后,会促使癌症恶化和增强其耐药性[22,23]。在异种移植肿瘤小鼠模型中,橙皮素可以调控AKT信号通路并上调PTEN表达,增强对胃癌的抗肿瘤作用,促进顺铂诱导的胃癌体内外凋亡[24]。本研究中miR-338-5p表达上调时,PTEN蛋白表达量显著上调,p-AKT蛋白表达量下调;而miR-338-5p表达缺失使PTEN蛋白下调,p-AKT蛋白上调。该结果表明,miR-338-5p的表达能够促进PTEN蛋白表达,抑制AKT蛋白激活,从而调控PTEN/AKT通路影响胃癌的发展。
综上所述,miR-338-5p能通过影响PTEN/AKT通路,抑制耐药基因表达和胃癌细胞的侵袭迁移,从而抑制胃癌细胞的增殖,提示miR-338-5p有成为治疗胃癌的生物靶标的潜力,能够通过上调其基因表达来降低耐药性,让药物治疗达到更好的效果,这为胃癌的治疗提供了广阔的应用前景。然而该研究仅能提供基础数据支持,其在体内肿瘤中的作用还需进一步研究。
