心脉安的UHPLC-Q-Exactive-Orbitrap-MS定性分析和UHPLC-QTRAP-MS/MS含量测定
2023-03-21李楚源王德勤郭海彪孙晓波徐科一
张 薇,李楚源,王德勤,郭海彪,孙晓波,徐科一*,殷 玮
心脉安的UHPLC-Q-Exactive-Orbitrap-MS定性分析和UHPLC-QTRAP-MS/MS含量测定
张 薇1, 2,李楚源1,王德勤1,郭海彪1,孙晓波2*,徐科一1*,殷 玮3
1. 广州白云山和记黄埔中药有限公司,广东 广州 510515 2. 中国医学科学院药用植物研究所,北京 100193 3. 广州医药研究总院有限公司,广东 广州 510240
应用UHPLC-Q-Exactive-Orbitrap-MS技术分析心脉安中的化学成分,同时建立一种快速同时测定心脉安中15种成分含量的UHPLC-QTRAP-MS/MS方法。采用ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),0.1%甲酸水溶液(A)-乙腈(B)为流动相系统进行梯度洗脱,采用加热电喷雾离子源(HESI),正、负离子模式下采集数据,分析推定心脉安化学成分。并采用Waters ACQUITY UPLC CSH C18色谱柱(100 mm×2.1 mm,1.7 µm),流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱,电喷雾离子源(ESI),采用多反应监测模式(MRM)正负离子同时对心脉安中15个成分进行定量分析。根据精确相对分子质量数据和多级质谱碎片离子,结合对照品比对或文献报道,共从心脉安中分析推定109个主要化学成分,包括31个三萜类(主要是三萜皂苷类)、25个黄酮类、15个苯丙素类、13个甾体、9个单萜类、7个醌类、9个其他类化合物。在优化的液相-质谱条件下,人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、丹参素、丹酚酸B、丹参酮I、隐丹参酮、丹参酮IIA、毛蕊异黄酮葡萄糖苷、黄芪甲苷、芍药苷、芍药内酯苷、麦冬皂苷D、鲁斯可皂苷元在测定浓度范围内线性关系良好(≥0.995 8),平均加样回收率(=6)为91.8%~106.5%,RSD为1.9%~4.5%,精密度、稳定性、重复性试验的RSD均小于4.6%。该研究基本阐明了心脉安的化学物质基础,建立的UHPLC-QTRAP-MS/MS含量测定方法,重复性和专属性好,稳定可控,可用于心脉安的质量控制。
心脉安;UHPLC-Q-Exactive-Orbitrap-MS;UHPLC-QTRAP-MS/MS;三萜类;人参皂苷Re;人参皂苷Rg1;丹参酮I;黄芪甲苷;芍药苷
心脉安片由人参、黄芪、丹参、赤芍、麦冬、冰片6味药组成,具有益气、养阴、活血定悸之功效,用于心悸气阴两虚兼心血瘀阻证(轻中度冠心病室性早搏)。现代药理学研究表明心脉安片能使动作电位时程与有效不应期的比值APD90/ERP<l,从而发挥其抗心律失常作用[1]。心脉安片有明显对抗乌头碱、氯仿、氯化钡及结扎冠脉等所致心律失常的作用[2]。多项临床试验证明心脉安片明显减少冠心病室性早搏患者室性早搏的次数,对气阴两虚兼心血瘀阻型冠心病所致室性早搏疗效确切,具有较好安全性[3-5]。但其化学物质基础研究薄弱,目前执行的国家药品标准YBZ12852004-2009Z仅对丹参酮ⅡA和丹酚酸B进行含量测定,难以反映复方的整体特点,不利于心脉安片的全面质量控制和进一步深入研究。
UHPLC-Q-Exactive-Orbitrap-MS是一种快速、灵敏度高、分离能力高、准确的数据采集技术,被广泛应用于中药复杂化学成分的结构鉴定。刘坤等[6]采用UHPLC-Q-Exactive-Orbitrap-MS技术鉴定树舌灵芝的化学成分。UHPLC-QTRAP-MS/MS具有高选择性、高通量和高灵敏度的特点,可分离复杂中药化学成分,检测通量多,耗时短。Xu等[7]采用UHPLC-QTRAP-MS/MS技术同时测定枸杞7种单糖的含量。
本研究基于UHPLC-Q-Exactive-Orbitrap-MS技术,建立心脉安中主要化学成分的分析方法,结合精确相对分子质量数据、碎片离子和对照品比对等手段进行结构推定。并采用UHPLC-QTRAP- MS/MS技术,选取覆盖组方5个单味药的特征性成分以及活性成分(人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、丹参素、丹酚酸B、丹参酮I、隐丹参酮、丹参酮IIA、毛蕊异黄酮葡萄糖苷、黄芪甲苷、芍药苷、芍药内酯苷、麦冬皂苷D、鲁斯可皂苷元)为指标成分,建立心脉安多指标成分含量测定方法,为心脉安质量标准的提升奠定一定的基础。
1 仪器与试剂
1.1 仪器
Thermo Scientific™ Q Exactive™组合型四极杆- Orbitrap质谱仪,美国Thermo Scientific公司;超高效液相色谱三重四极杆质谱联用(UHPLC-QTRAP-MS/MS)系统,包括LC-30AD UHPLC超高效液相色谱仪(含二元梯度泵-自动进样器-柱温箱),日本岛津公司;Sciex QTRAP 5500三重四极杆质谱,美国Sciex公司;Milli-Q Reference超纯水仪,美国Millipore公司;Secura 125-1CN型电子天平,德国Sartorius公司;SIGMA 3-18KS型冷冻离心机,美国Sigma公司;HYCD-205型医用冷藏冷冻箱,海尔集团公司。
1.2 试药
色谱级乙腈及色谱级甲醇,美国Sigma-Aldrich公司;色谱级甲酸,上海阿拉丁生化科技有限公司;超纯水来自超纯水机自制。
对照品人参皂苷Rg1(批号110703-202034,质量分数94.0%)、人参皂苷Rb2(批号111715-201203,质量分数93.8%)、人参皂苷Rd(批号111818- 202104,质量分数97.3%)、丹酚酸B(批号111562- 201917,质量分数96.6%)、丹参酮I(批号110867-201607,质量分数96.5%)、隐丹参酮(批号110852-201807,质量分数99.0%)、丹参酮IIA(批号110766-202022,质量分数98.9%)、毛蕊异黄酮葡萄糖苷(批号111920-201907,质量分数96.8%)、黄芪甲苷(批号110781-2021118,质量分数96.8%)、芍药苷(110736-202145,质量分数94.6%)、鲁斯可皂苷元(批号111909-201906,质量分数98.0%)均购于中国食品药品检定研究院;人参皂苷Rc(批号8799,质量分数98.0%)、丹参素(批号7830,质量分数98.0%)、芍药内酯苷(批号8409,质量分数90.5%)、麦冬皂苷D(批号9815,质量分数98.0%)均购于上海诗丹德标准技术服务有限公司;人参皂苷Re(批号RSF-R02001906001,质量分数98.0%)、人参皂苷Rb1(批号RSF-R01201907001,质量分数98.0%)均购于成都瑞芬思生物科技有限公司。
3批心脉安干膏粉(批号21041401、21041402、21041403),均由广州白云山和记黄埔中药有限公司现代中药研究院提供。
人参为五加科植物人参C. A. Mey.的干燥根和根茎;丹参为唇形科植物丹参Bge.的于燥根和根茎;黄芪为豆科植物蒙古黄芪(Fisch.) Ege. var.(Ege.) Hsiao的干燥根;赤芍为毛茛科植物芍药Pall.的干燥根;麦冬为百合科植物麦冬(L. f) Ker-Gawl.的干燥块根。人参(批号2011001)产地吉林,购于北京同仁堂健康药业有限公司;丹参(批号2012001)产地山东,购于广东天生药业有限公司;黄芪(批号2010001)产地甘肃,购于北京同仁堂健康药业(福州)有限公司;麦冬(批号2011001)产地四川,购于广东汇群药业有限公司;赤芍(批号2011001)产地内蒙古,购于广东汇群药业有限公司。
2 方法与结果
2.1 心脉安的UHPLC-Q Exactive-Orbitrap-MS定性分析
2.1.1 UHPLC分析条件 色谱柱为ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 µm);自动进样器温度:8.0 ℃,柱温35 ℃,体积流量0.4 mL/min;流动相为0.1%甲酸水溶液(A)-乙腈溶液(B),洗脱梯度:0~0.5 min,5% B;0.5~11.0 min,5%~95% B;11.0~12.0 min,95% B;12.0~12.1 min,95%~5% B;12.1~15.0 min,5% B;进样量3 μL。
2.1.2 质谱条件 Thermo Scientific™ Q Exactive™组合型四极杆-Orbitrap质谱仪;离子源:加热电喷雾离子源(HESI);扫描方式:数据依赖性扫描(DDA)模式进行正、负离子全扫描;扫描范围:/100~1200。源参数:喷雾电压:3 000.00 V(+),−3 000.00 V(−);离子传输管温度:325.00 ℃;鞘气体积流量:45.00 units;辅助气体积流量:11.00 units(+),11.25 units(−);加热温度:350.00 ℃;S-Lens 电压:50.00 V。
2.1.3 对照品溶液的制备 精密称取人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rb2、人参皂苷Rc、人参皂苷Rd、丹参素、丹酚酸B、丹参酮I、隐丹参酮、丹参酮IIA、毛蕊异黄酮葡萄糖苷、黄芪甲苷、芍药苷、芍药内酯苷、麦冬皂苷D、鲁斯可皂苷元对照品适量于样品瓶中,加入相应体积的甲醇溶解,制备成1.00 mg/mL的对照品储备溶液。
2.1.4 供试品溶液的制备 精密称取人参、丹参、黄芪、赤芍、麦冬药材粉末,以及心脉安干膏粉各200 mg,置于10 mL离心管中,精密加入75%甲醇4 mL,超声处理30 min,放冷,10 000 r/min下离心10 min,取上清液通过0.22 μm微孔滤膜,取滤液,即得供试品溶液。
2.1.5 UHPLC-Q-Exactive-Orbitrap-MS成分推定 本研究利用UHPLC-Q-Exactive-Orbitrap-MS对心脉安的化学成分进行定性分析。通过高分辨质谱及二级质谱的碎片离子推测化合物的结构式,再结合文献进一步比对或与对照品比对,共推定出109个化合物,并对化合物的药材来源进行了归属。正离子下推定化合物22种,负离子下推定化合物87种,包括31个三萜类(主要是三萜皂苷类)、25个黄酮类、15个苯丙素类、13个甾体、9个单萜类、7个醌类和9个其他类化合物,三萜类和黄酮类化合物是心脉安中的主要成分。其中,17个成分可通过与对照品比较保留时间、一级质谱和多级质谱信息得到确证。其他化合物均利用质谱裂解规律,同时参考文献中质谱碎片信息及裂解规律进行推定。结果见图1和表1。
C21(保留时间为7.71 min)的正离子图谱显示其加和分子离子峰为[M+HCOO]−/845.493 7,确定分子式为C42H72O14,/637.430 5为脱去1分子葡萄糖形成,475.379 9为脱去2分子葡萄糖形成,根据调研文献中人参皂苷类成分结构推测,该化合物为人参皂苷Rf[8]。
C38(保留时间为5.74 min)的负离子图谱显示其分子离子峰为[M-H]−/493.114 7,确定分子式为C26H22O10,313.072 1 [M-C9H8O4]−,295.061 6 [M-C9H10O5]−,185.023 8 [M-C9H10O5-C6H6O2]−等主要的碎片离子。根据调研文献中苯丙素类成分结构推测,该化合物为丹酚酸A[12]。
C58(保留时间为6.09 min)的正离子图谱显示其分子离子峰为[M+H]+/269.080 5,确定分子式为C16H12O4,/251.070 1为脱去1分子水形成,/223.074 9为脱去1分子水和甲氧基。根据文献中黄酮类成分结构推测,该化合物为芒柄花素[16-17]。
C74(保留时间为3.86 min)的负离子图谱显示其分子离子峰为[M-H]−/169.013 5,确定分子式为C7H6O5,/125.023 3为断裂1分子[COO],根据调研文献中没食子酸类成分结构推测,该化合物为没食子酸[20-22]。
C91(保留时间为7.19 min)的负离子图谱显示其加和分子离子峰为[M+HCOO]−/387.108 9,确定分子式为C19H18O6,/341.109 2为[M-H]−母离子峰,/179.034 2为苯基相连的六元环断裂羰基后形成的碎片,/135.044 1为苯并五元环碎片。根据调研文献中麦冬黄烷酮类成分结构推测,该化合物为甲基麦冬黄烷酮A[23,25-26]。
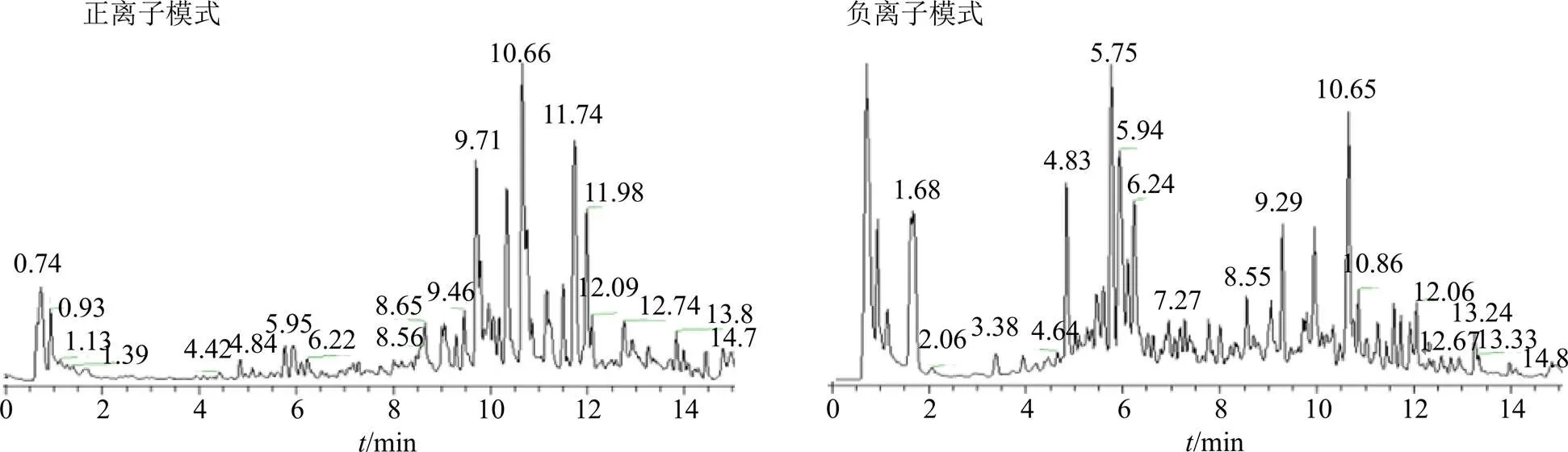
图1 心脉安UHPLC-Q-Exactive-Orbitrap-MS的TIC图
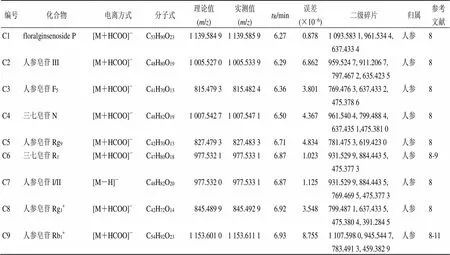
表1 心脉安正、负离子模式下的化合物推定及化合物归属
续表1

编号化合物电离方式分子式理论值(m/z)实测值(m/z)tR/min误差(×10−6)二级碎片归属参考文献 C10malonyl-ginsenoside Rb1[M-H]−C57H94O261 193.595 41 193.601 36.994.9431 149.610 1, 1 107.596 8, 1 089.589 7, 945.546 9人参8 C11三七皂苷R2[M-H]−C41H70O13769.473 8769.476 37.083.249637.433 2, 475.379 8, 391.287 9人参8, 9 C12人参皂苷Rc/Rb2*[M+HCOO]−C53H90O221 123.590 01 123.592 57.112.2251 077.588 5, 915.539 0, 783.492 9人参8, 10 C13malonyl-ginsenoside Rc/Rb2[M-H]−C56H92O251 163.584 91 163.590 27.164.5551 119.598 9, 1 077.599 0, 927.528 7, 783.490 7人参8 C14人参皂苷Rg2[M+HCOO]−C42H72O13829.494 9829.497 17.202.652783.492 2, 637.435 9, 475.379 9,391.285 7人参8, 10- 11 C15人参皂苷Ro [M-H]−C48H76O19955.490 3955.493 77.273.558793.440 7, 469.385 4, 455.353 5人参8, 10- 11 C16人参皂苷Rh1/F1[M+HCOO]−C36H62O9683.437 0683.439 67.303.804637.435 1, 554.238 8, 475.380 7人参8-10 C17人参皂苷Re/Rd*[M+HCOO]−C48H82O18991.549 7991.550 87.511.109945.545 2, 783.491 4, 621.438 8, 459.385 0人参8 C18malonyl-ginsenoside Re[M-H]−C51H84O211 031.542 71 031.543 27.530.485987.556 0, 945.545 1, 927.534 2,621.444 0人参8 C19pseudoginsenoside Rs1[M-H]−C50H84O19987.552 8987.556 07.553.240945.545 5, 927.534 5, 783.490 2,621.436 5人参8 C20chikusetsusaponin IVa[M-H]−C42H66O14793.437 4793.439 87.623.025569.386 2, 455.354 0, 329.657 5人参8 C21人参皂苷Rf[M+HCOO]−C42H72O14845.489 9845.493 77.714.494799.487 0, 637.430 5, 475.379 9. 391.288 0人参8 C22三七皂苷Fe[M+HCOO]−C47H80O17961.537 2961.540 87.953.744915.535 1, 753.483 5, 621.437 9, 375.291 3人参8 C23人参皂苷F2[M+HCOO]−C42H72O13829.494 9829.492 48.51−3.014783.488 4, 695.973 4, 621.440 9人参8, 10- 11 C24人参皂苷Rg3[M+HCOO]−C42H72O13829.494 9829.497 38.942.893783.492 1,713.286 6, 621.439 8, 375.291 1人参8, 10- 11 C25人参皂苷Rs3[M+HCOO]−C44H74O14871.505 5871.508 58.973.442825.502 7, 783.491 9, 765.481 6, 621.437 9人参8 C26人参皂苷F4[M-H]−C42H70O12765.478 9765.480 810.112.482603.425 5, 490.150 0, 383.149 5人参8, 10 C27香草醛[M-H]−C8H8O3151.039 5151.039 21.611.986133.028 6, 123.044 1, 95.048 9, 81.033 4丹参 C28咖啡酸[M-H]−C9H8O4179.034 4179.034 31.71−0.559151.039 1, 135.044 1, 117.033 3, 107.049 0丹参12 C29咖啡酰酒石酸[M-H]−C13H12O9311.040 3311.040 42.540.322179.034 3, 149.008 2, 135.044 1丹参13 C30原儿茶酸[M-H]−C7H6O4153.018 8153.018 44.25−2.614135.007 7, 118.552 1, 109.028 3, 92.000 1丹参12 C31阿魏酸[M-H]−C10H10O4193.050 1193.050 14.460.000178.026 4, 149.059 9, 134.036 3, 121.064 6, 丹参14 C32yunnaneic acid D[M-H]−C27H24O12539.119 0539.120 35.012.411493.231 9, 341.066 3, 297.076 7, 179.034 2丹参15
续表1

编号化合物电离方式分子式理论值(m/z)实测值(m/z)tR/min误差(×10−6)二级碎片归属参考文献 C33紫草酸[M-H]−C27H22O12537.103 3537.104 85.152.793493.114 5, 295.061 4, 185.023 7, 109.028 3丹参12 C34丹酚酸D[M-H]−C20H18O10417.082 2417.081 25.18−2.398373.093 2, 197.045 0, 175.039 3, 135.043 9丹参12 C35异迷迭香酸苷[M-H]−C24H26O13521.129 5521.130 55.251.919359.077 0, 323.077 6, 179.034 2, 161.023 5 丹参15 C36丹酚酸B*[M-H]−C36H30O16717.145 6717.146 95.641.813537.104 6, 519.093 8, 493.116 0, 321.040 7丹参12 C37迷迭香酸[M-H]−C18H16O8359.076 7359.077 95.713.342197.045 0, 179.034 2, 161.023 6, 135.044 1丹参12 C38丹酚酸A[M-H]−C26H22O10493.113 5493.114 75.742.434313.072 1, 295.061 6, 185.023 8, 109.028 3丹参12 C39丹参素*[M-H]−C9H10O5197.045 0197.045 45.922.030179.034 2, 151.038 8, 135.044 1, 123.044 0丹参12 C40原儿茶醛[M-H]−C7H6O3137.023 9137.023 35.96−4.37993.033 3, 85.649 7, 66.475 9丹参12 C413′-O-甲基丹酚酸B[M-H]−C37H32O16731.161 2731.163 16.312.599551.118 5, 533.109 5, 353.067 3, 335.056 6丹参12 C42甲基丹酚酸I/H[M-H]−C28H24O12551.118 9551.120 16.332.177519.093 4, 507.129 7, 353.067 1, 321.040 8丹参15 C43丹酚酸F[M-H]−C17H14O6313.071 2313.072 26.363.194269.082 4, 225.091 0, 197.096 5丹参12 C44丹酚酸C[M-H]−C26H20O10491.097 8491.099 06.502.444311.056 7, 293.046 1, 135.044 1丹参12 C45新隐丹参酮[M+H]+C19H22O4315.159 6315.158 69.93−3.173297.148 1, 279.137 7, 251.142 4, 197.095 8丹参12 C46丹参酮I*[M+H]+C18H12O3277.086 5277.085 610.22−3.248259.075 2, 249.090 8, 221.096 4, 193.100 9丹参12 C47隐丹参酮*[M+H]+C19H20O3297.149 1297.147 810.30−4.375279.137 0, 251.142 9, 209.095 9丹参12 C48二氢丹参酮I[M+H]+C18H14O3279.102 1279.101 310.33−2.866261.090 6, 233.095 8, 205.101 1, 169.064 5丹参12 C49丹参酮ⅡB[M+H]+C19H18O4311.128 3311.127 410.42−2.893293.117 5, 267.137 5, 252.114 0丹参12 C50丹参酮ⅡA*[M+H]+C19H18O3295.133 4295.132 410.71−3.388277.121 6, 249.126 7, 225.127 2丹参12 C51丹参新酮[M+H]+C19H22O2283.169 8283.169 012.02−2.825265.158 9, 240.114 1, 223.111 7, 195.116 5丹参12 C52毛蕊异黄酮葡萄糖苷[M+H]+ C22H22O10447.129 1447.128 55.12−1.342285.075 5, 270.052 2, 253.048 8, 137.023 3黄芪16-17 C53calycosin-7-O-glc-6"-O-malonate[M+H]+ C25H24O13533.129 5533.129 05.59−0.938285.075 4, 270.051 8, 253.049 1, 137.022 8黄芪16 C54pratensein 7-O-glucoside[M+H]+C22H22O11463.124 0463.123 25.63−1.727421.668 3, 301.070 4, 286.046 7, 241.049 2黄芪16 C55calycosin-7-O-Glc-6"-O-acetate[M+H]+ C24H24O11489.139 7489.139 25.95−1.022457.786 0, 285.075 5, 270.052 0, 253.048 7黄芪16 C56芒柄花苷[M+H]+ C22H22O9431.134 2431.132 56.04−3.943325.002 0, 269.080 7, 254.056 9, 213.091 0黄芪16-17 C57pratensein-7-O-glucoside-6"-O-malonate[M+H]+ C25H24O14549.124 4549.123 56.08−1.639463.120 7, 301.070 3, 286.047 0, 184.073 2黄芪16 C58芒柄花素[M+H]+ C16H12O4269.081 4269.080 56.09−3.345251.070 1, 223.074 9, 205.064 0, 154.025 4黄芪16-17
续表1
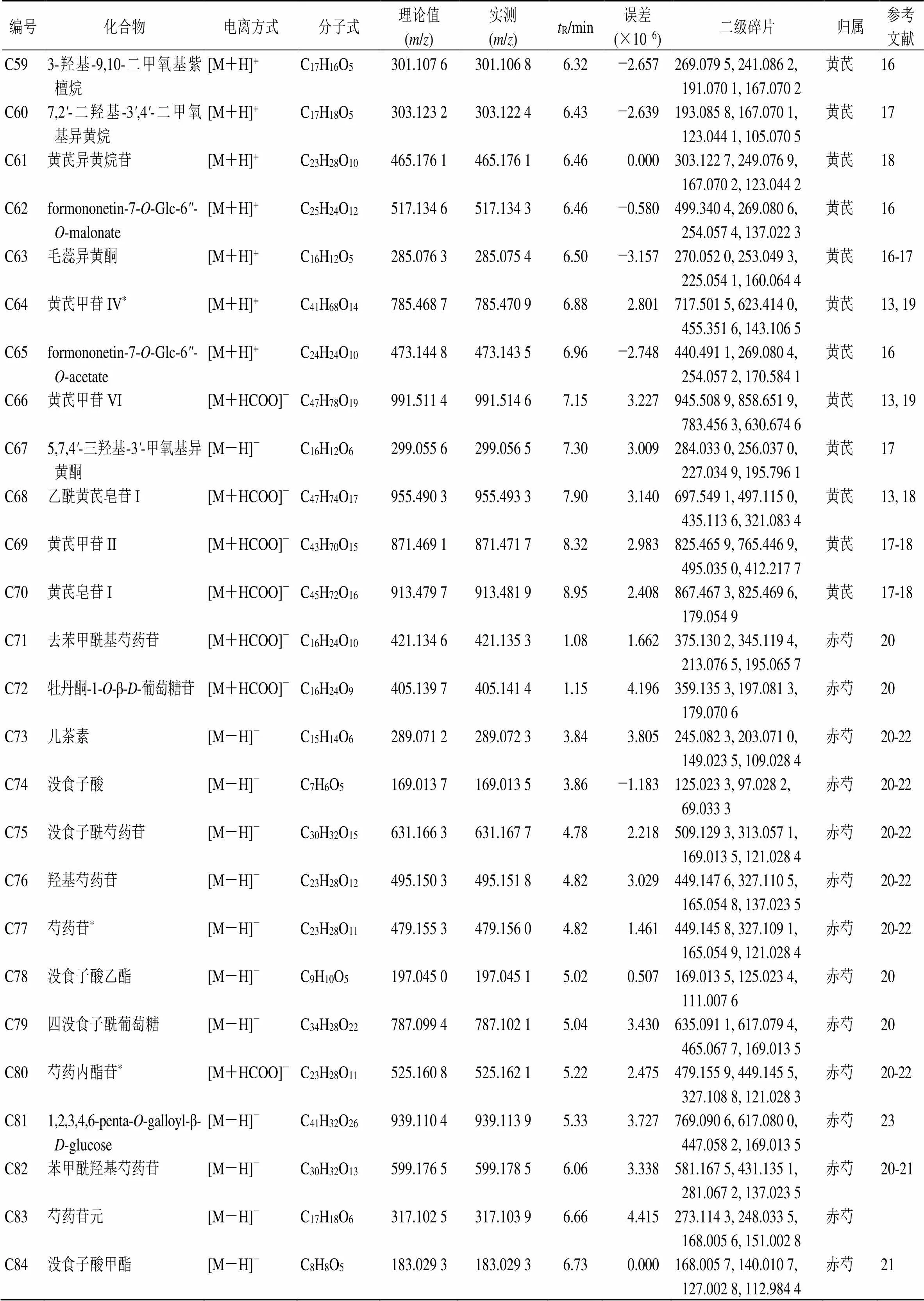
编号化合物电离方式分子式理论值(m/z)实测(m/z)tR/min误差(×10−6)二级碎片归属参考文献 C593-羟基-9,10-二甲氧基紫檀烷[M+H]+ C17H16O5301.107 6301.106 86.32−2.657269.079 5, 241.086 2, 191.070 1, 167.070 2黄芪16 C607,2'-二羟基-3',4'-二甲氧基异黄烷[M+H]+C17H18O5303.123 2303.122 46.43−2.639193.085 8, 167.070 1, 123.044 1, 105.070 5黄芪17 C61黄芪异黄烷苷[M+H]+ C23H28O10465.176 1465.176 16.460.000303.122 7, 249.076 9, 167.070 2, 123.044 2黄芪18 C62formononetin-7-O-Glc-6"-O-malonate[M+H]+C25H24O12517.134 6517.134 36.46−0.580499.340 4, 269.080 6, 254.057 4, 137.022 3黄芪16 C63毛蕊异黄酮[M+H]+ C16H12O5285.076 3285.075 46.50−3.157270.052 0, 253.049 3, 225.054 1, 160.064 4黄芪16-17 C64黄芪甲苷IV*[M+H]+C41H68O14785.468 7785.470 96.882.801717.501 5, 623.414 0, 455.351 6, 143.106 5黄芪13, 19 C65formononetin-7-O-Glc-6"-O-acetate[M+H]+C24H24O10473.144 8473.143 56.96−2.748440.491 1, 269.080 4, 254.057 2, 170.584 1黄芪16 C66黄芪甲苷VI[M+HCOO]−C47H78O19991.511 4991.514 67.153.227945.508 9, 858.651 9, 783.456 3, 630.674 6黄芪13, 19 C675,7,4'-三羟基-3'-甲氧基异黄酮[M-H]−C16H12O6299.055 6299.056 57.303.009284.033 0, 256.037 0, 227.034 9, 195.796 1黄芪17 C68乙酰黄芪皂苷I[M+HCOO]−C47H74O17955.490 3955.493 37.903.140697.549 1, 497.115 0, 435.113 6, 321.083 4黄芪13, 18 C69黄芪甲苷II[M+HCOO]−C43H70O15871.469 1871.471 78.322.983825.465 9, 765.446 9, 495.035 0, 412.217 7黄芪17-18 C70黄芪皂苷I[M+HCOO]−C45H72O16913.479 7913.481 98.952.408867.467 3, 825.469 6, 179.054 9黄芪17-18 C71去苯甲酰基芍药苷[M+HCOO]−C16H24O10421.134 6421.135 31.081.662375.130 2, 345.119 4, 213.076 5, 195.065 7赤芍20 C72牡丹酮-1-O-β-D-葡萄糖苷[M+HCOO]−C16H24O9405.139 7405.141 41.154.196359.135 3, 197.081 3, 179.070 6赤芍20 C73儿茶素[M-H]−C15H14O6289.071 2289.072 33.843.805245.082 3, 203.071 0, 149.023 5, 109.028 4赤芍20-22 C74没食子酸[M-H]−C7H6O5169.013 7169.013 53.86−1.183125.023 3, 97.028 2, 69.033 3赤芍20-22 C75没食子酰芍药苷[M-H]−C30H32O15631.166 3631.167 74.782.218509.129 3, 313.057 1, 169.013 5, 121.028 4赤芍20-22 C76羟基芍药苷[M-H]−C23H28O12495.150 3495.151 84.823.029449.147 6, 327.110 5, 165.054 8, 137.023 5赤芍20-22 C77芍药苷*[M-H]−C23H28O11479.155 3479.156 04.821.461449.145 8, 327.109 1, 165.054 9, 121.028 4赤芍20-22 C78没食子酸乙酯[M-H]−C9H10O5197.045 0197.045 15.020.507169.013 5, 125.023 4, 111.007 6赤芍20 C79四没食子酰葡萄糖[M-H]−C34H28O22787.099 4787.102 15.043.430635.091 1, 617.079 4, 465.067 7, 169.013 5赤芍20 C80芍药内酯苷*[M+HCOO]−C23H28O11525.160 8525.162 15.222.475479.155 9, 449.145 5, 327.108 8, 121.028 3赤芍20-22 C811,2,3,4,6-penta-O-galloyl-β- D-glucose[M-H]−C41H32O26939.110 4939.113 95.333.727769.090 6, 617.080 0, 447.058 2, 169.013 5赤芍23 C82苯甲酰羟基芍药苷[M-H]−C30H32O13599.176 5599.178 56.063.338581.167 5, 431.135 1, 281.067 2, 137.023 5赤芍20-21 C83芍药苷元[M-H]−C17H18O6317.102 5317.103 96.664.415273.114 3, 248.033 5, 168.005 6, 151.002 8赤芍 C84没食子酸甲酯[M-H]−C8H8O5183.029 3183.029 36.730.000168.005 7, 140.010 7, 127.002 8, 112.984 4赤芍21
续表1

编号化合物电离方式分子式理论值(m/z)实测(m/z)tR/min误差(×10−6)二级碎片归属参考文献 C85没食子酸丁酯[M-H]−C11H14O5225.076 3225.076 96.752.666207.102 2, 181.122 7, 168.005 2赤芍 C86苯甲酰芍药苷[M-H]−C30H32O12583.181 6583.180 06.90−2.744553.172 3, 431.135 5, 165.054 8, 121.028 4赤芍20-22 C87ophiofurospiside F[M+HCOO]−C45H74O20979.475 0979.466 85.29−8.372933.472 5, 787.415 0, 607.349 4, 445.297 7麦冬23-24 C88ophiofurospiside L[M+HCOO]−C50H82O231 095.522 31 095.524 55.362.0081 077.513 5, 861.351 9, 627.303 2, 467.213 7麦冬24 C89ophiofurospiside I[M-H]−C51H84O241 079.527 41 079.531 05.563.335917.477 0, 771.420 3, 591.356 2麦冬23-24 C90ophiofurospiside K[M-H]−C51H84O231 063.532 51 063.535 65.992.915901.483 4, 755.431 4, 593.371 0麦冬23-24 C91甲基麦冬黄烷酮A[M+HCOO]−C19H18O6387.108 0387.108 97.192.325341.109 2, 320.475 3, 179.034 2, 135.044 1,麦冬23, 25- 26 C92麦冬皂苷R[M+HCOO]−C39H62O15815.406 5815.409 27.583.311769.403 4, 623.344 0, 443.281 4麦冬25 C93麦冬黄烷酮F[M-H]−C20H22O7373.128 7373.129 67.952.412358.105 6, 254.042 7, 183.065 6, 168.041 9麦冬23 C9414-hydroxy sprengerinin C[M+HCOO]−C44H70O17915.459 0915.462 08.003.277869.455 8, 737.413 3, 591.353 1麦冬23 C95鲁斯可皂苷元*[M+H]+ C27H42O4431.316 1431.314 98.36−2.782413.304 0, 395.293 3, 346.646 9, 269.189 4麦冬 C96甲基麦冬黄酮B[M+HCOO]−C19H18O5371.113 1371.114 08.772.425356.090 6, 341.067 1, 297.076 0, 161.023 4麦冬23 C97麦冬黄烷酮A[M-H]−C18H16O6327.086 9327.087 88.792.752312.064 6, 236.032 8, 191.034 3, 123.043 8麦冬25-26 C98麦冬黄烷酮E[M-H]−C19H20O7359.113 1359.114 08.822.506344.090 5, 169.049 8, 154.026 1麦冬25-26 C99deacetyl ophiopojaponin A[M+HCOO]−C46H72O18957.469 5957.470 69.051.149911.466 2, 869.455 6, 851.444 5, 737.413 8麦冬23 C100麦冬皂苷D*[M+HCOO]−C44H70O16899.464 0899.466 89.213.113853.460 4, 835.443 5, 721.417 9, 575.358 6麦冬24 C101麦冬黄烷酮B[M-H]−C18H18O5313.107 6313.108 69.633.194224.033 0, 192.042 1, 164.046 7, 135.007 4麦冬 C102甲基麦冬黄酮A[M-H]−C19H16O6339.086 9339.087 89.842.654311.093 0, 217.049 9, 179.034 3麦冬23, 25 C103麦冬皂苷P/Q[M+HCOO]−C46H72O17941.474 6941.477 79.953.293895.471 7, 853.460 8, 721.417 8麦冬24 C104麦冬皂苷B[M+HCOO]−C39H62O12767.421 8767.422 910.021.433721.418 3, 575.363 3, 424.027 9麦冬24 C105麦冬皂苷C[M+HCOO]−C44H70O18931.453 9931.448 410.02−5.905853.460 7, 721.423 0, 648.563 8麦冬24 C106甲基麦冬黄烷酮B[M-H]−C19H20O5327.124 2327.123 210.353.057238.047 8, 206.058 1, 178.062 9, 165.054 8麦冬23, 25- 26 C107麦冬黄烷酮D[M-H]−C20H18O7369.097 4369.098 310.462.438342.107 0, 219.029 5, 191.034 2, 164.010 1麦冬 C108麦冬皂苷A[M+HCOO]−C41H64O13809.432 3809.434 010.812.100763.428 6, 721.418 3, 685.397 3, 575.354 3麦冬23 C109麦冬黄烷酮C[M-H]−C19H16O7355.081 8355.082 811.222.816327.088 3, 307.062 7, 193.013 6, 164.047 4麦冬
*经过对照品验证的化学成分
*Chemical composition verified by reference
2.2 UHPLC-QTRAP-MS/MS含量测定
2.2.1 UHPLC分析条件 色谱柱为Waters ACQUITY UPLC CSH C18(100 mm×2.1 mm,1.7 µm);柱温35 ℃,体积流量 0.3 mL/min;流动相为0.1%甲酸水溶液(A)-乙腈溶液(B),洗脱梯度:0~0.3 min,50% B;0.3~1.2 min,50%~95% B;1.2~3.0 min,95% B;3.0~3.1 min,95%~50% B;3.1~4.0 min,50% B;进样量3 μL。
2.2.2 质谱条件 电喷雾离子源(ESI),数据采集模式为多反应监测(MRM)模式正负离子同时检测。喷雾电压:5500 V(+),−4500 V(−);雾化温度500.0 ℃;气帘气:137.9 kPa;喷雾气:206.84 kPa;辅助加热气:206.84 kPa;去簇电压:60.0 V;入场电压:10.0 V;出场电压:25.0 V。各定量成分的参数设定见表2。17种化合物的MRM色谱图见图2。
2.2.3 供试品溶液的制备 取心脉安干膏粉约50.0 mg,精密称定,置于10 mL离心管中,加入75%甲醇5.0 mL,超声处理30 min,放冷,10 000 r/min下离心10 min,取上清液通过0.22 μm微孔滤膜,取滤液,为使不同化合物稀释后能够在定量限之内,用50%甲醇分别稀释10、100、1000、10 000倍,即为供试品溶液。

表2 15种化合物的多反应监测模式信息
2.2.4 对照品溶液的制备
(1)对照品储备液的制备:精密称取人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、丹参素、丹酚酸B、丹参酮I、隐丹参酮、丹参酮IIA、毛蕊异黄酮葡萄糖苷、黄芪甲苷、芍药苷、芍药内酯苷、麦冬皂苷D、鲁斯可皂苷元对照品适量于样品瓶中,加入相应体积的甲醇溶解,制备成1.00 mg/mL的对照品储备溶液。
(2)混合对照品溶液的制备:精密吸取15种对照品溶液,混合稀释,配制成含人参皂苷Re(10.0 μg/mL)、人参皂苷Rg1(10.0 μg/mL)、人参皂苷Rb1(10.0 μg/mL)、人参皂苷Rb2(10.0 μg/mL)、人参皂苷Rc(10.0 μg/mL)、人参皂苷Rd(10.0 μg/mL)、丹参素(10.0 μg/mL)、丹酚酸B(10.0 μg/mL)、丹参酮I(1.00 μg/mL)、隐丹参酮(0.200 μg/mL)、丹参酮IIA(0.400 μg/mL)、毛蕊异黄酮葡萄糖苷(0.200 μg/mL)、黄芪甲苷(2.00 μg/mL)、芍药苷(1.00 μg/mL)、芍药内酯苷(1.00 μg/mL)、麦冬皂苷D(0.400 μg/mL)、鲁斯可皂苷元(0.080 μg/mL)的混合溶液,用50%甲醇依次稀释得一系列混合对照品溶液。
2.2.5 方法学考察
(1)专属性考察:分别取心脉安供试品溶液、混合对照品溶液以及空白溶液各3 μL,按“2.2.1”和“2.2.2”项下条件进行检测,色谱图见图2。实验结果表明,各化合物所选峰之间无干扰,方法专属性良好。

1-人参皂苷Re 2-人参皂苷Rg1 3-人参皂苷Rb1 4-人参皂苷Rd 5-丹参素 6-丹酚酸B 7-丹参酮I 8-隐丹参酮 9-丹参酮IIA 10-毛蕊异黄酮葡萄糖苷 11-黄芪甲苷 12-芍药苷 13-芍药内酯苷 14-麦冬皂苷D 15-鲁斯可皂苷元
(2)线性范围及定量限考察:精密量取“2.2.4”项下的混合对照品溶液,用50%甲醇进行逐级稀释,得到混合对照品溶液浓度的1/20、1/25、1/50、1/100、1/200、1/500、1/1000、1/2000倍的系列混合对照品溶液,稀释得系列混合对照品溶液,按“2.2.1”和“2.2.2”项下的UHPLC-QTRAP-MS/MS条件检测,以各对照品质量浓度为横坐标(),峰面积为纵坐标(),对定量成分进行线性回归。结果表明15个定量成分在线性范围内线性良好(表3),符合分析测试要求。
(3)重复性考察:按“2.2.3”项下方法平行制备6份心脉安供试品溶液,按“2.2.1”和“2.2.2”项下的UHPLC-QTRAP-MS/MS条件检测,随行当日标准曲线。记录峰面积响应值,根据标准曲线计算15种被测成分的含量的RSD值为1.5%~4.4%。结果表明,各定量成分的重复性良好。
(4)精密度考察:取高、中、低质量浓度的混合对照品溶液,分别按“2.2.1”和“2.2.2”项下分析测试条件连续进样6次,记录峰面积响应值。计算15种被测成分峰面积的RSD值,考察日内精密度。连续操作3 d,计算定量成分的峰面积及其RSD值,作为方法日间精密度。结果15种化合物的日内、日间精密度RSD均小于4.6%。

表3 回归方程、线性范围考察结果
(5)加样回收率考察:取25 mg已知含量的心脉安干膏粉(S1)6份,精密称定,加入与样品中各成分含量相近的混合对照品溶液,按“2.2.3”项下方法处理得到待测供试品溶液,供试品溶液按照“2.2.1”和“2.2.2”项下定量测试条件进样分析,利用当日随行的标准曲线计算各定量成分的含量,15个定量成分的平均回收率分别为103.4%、106.5%、105.1%、94.8%、 95.3%、102.5%、103.1%、103.8%、97.6%、93.5%、94.9%、92.6%、91.8%、94.7%、94.4%,RSD值分别为3.5%、4.3%、3.2%、3.4%、3.7%、2.7%、2.5%、1.9%、3.6%、2.7%、4.5%、3.7%、3.8%、4.1%、2.8%。结果15个化合物的加样回收率为91.8%~107.8%,RSD值小于4.5%,表明该方法准确度满足测试要求。
(6)稳定性考察:按照“2.2.3”项下方法制备供试品溶液,在4 ℃放置0、4、8、24 h 后,按“2.2.1”和“2.2.2”项下方法对15种成分进行测定,记录峰面积响应值,计算RSD值为1.5%~4.6%。
2.2.6 样品定量测定 取待测样品,按照“2.2.3”项下方法制备供试品溶液,按“2.2.1”和“2.2.2”项下方法测定并计算各待测组分的量,结果见表4。
3 讨论
3.1 心脉安的UHPLC-Q-Exactive-Orbitrap-MS定性分析
本研究首次采用UHPLC-Q-Exactive- Orbitrap-MS技术对心脉安中化学成分进行分析,同时采用正、负离子2种扫描模式,通过结构信息互补,较为全面地推定心脉安的主要化学成分。其中,黄酮类在正、负离子扫描模式下有较好响应;三萜皂苷、苯丙素类化合物在负离子扫描模式下有较好响应;醌类化合物在正离子模式下有较强的响应,在负离子模式下则响应较弱。实现了心脉安中109个化合物的快速辨识,所推测和鉴定的化合物中涵盖了31个三萜类、25个黄酮类、15个苯丙素类、13个甾体、9个单萜类、7个醌类、9个其他类化合物,为心脉安中化学成分的定性分析提供一种高效、快速的分析方法。为心脉安后续的入血实验研究和关键成分定量控制提供了理论基础。
3.2 UHPLC-QTRAP-MS/MS含量测定
3.2.1 检测方法的选择 心脉安中皂苷类成分没有紫外吸收,采用紫外或二极管阵列检测器时只能在末端吸收波长下进行检测,由于多数成分含量较低,基线干扰大,因此选择了质谱检测器,以MRM方式进行测定,可以避免其他成分的干扰,专属性强,可准确用于心脉安样品的测定,有效地提高心脉安片的质量控制水平。
表4 心脉安中15种化学成分定量测定结果
Table 4 Content of 15 analytes in Xinmai'an
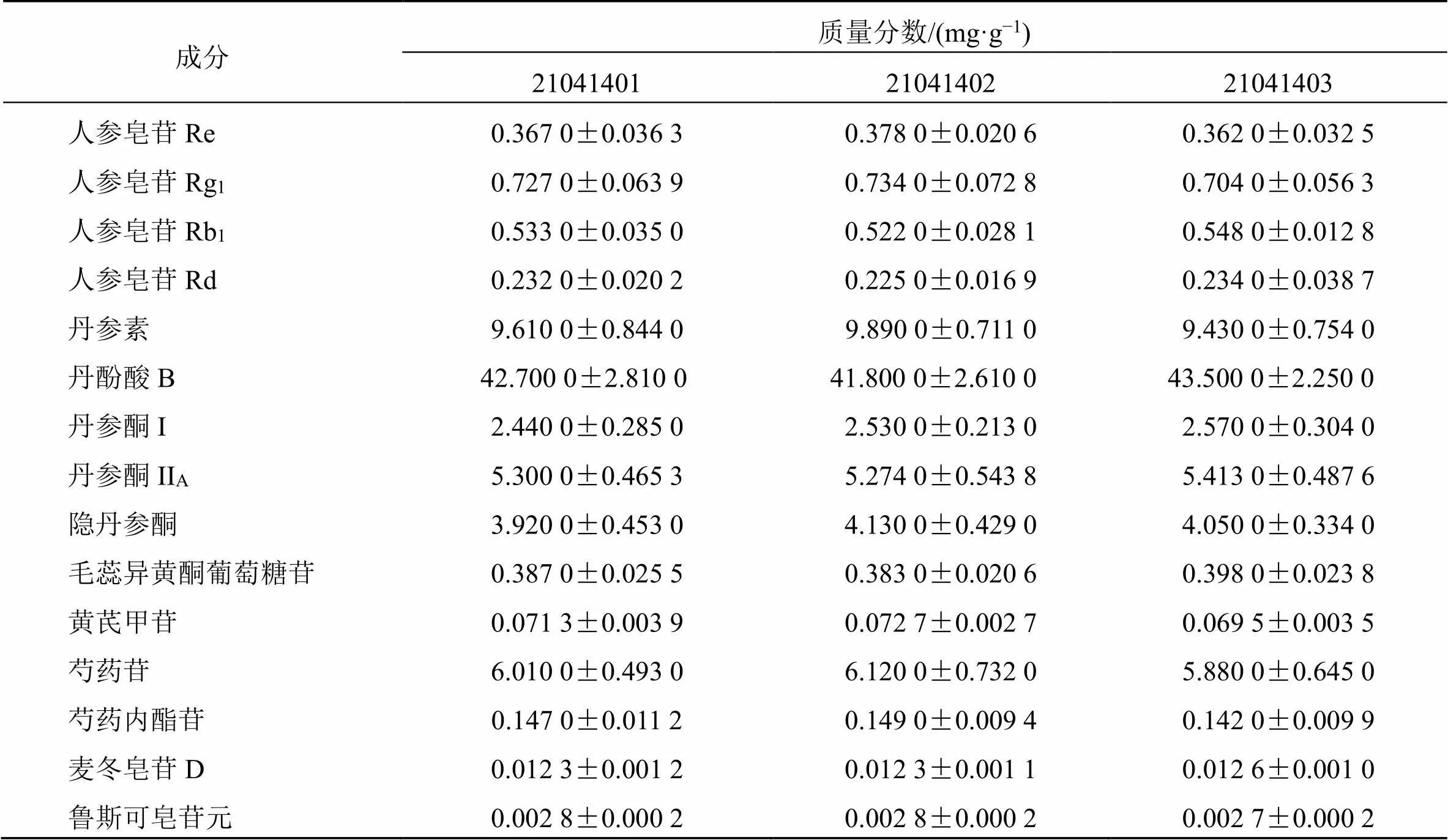
成分质量分数/(mg·g−1)210414012104140221041403人参皂苷Re0.367 0±0.036 30.378 0±0.020 60.362 0±0.032 5 人参皂苷Rg10.727 0±0.063 90.734 0±0.072 80.704 0±0.056 3 人参皂苷Rb10.533 0±0.035 00.522 0±0.028 10.548 0±0.012 8 人参皂苷Rd0.232 0±0.020 20.225 0±0.016 90.234 0±0.038 7 丹参素9.610 0±0.844 09.890 0±0.711 09.430 0±0.754 0 丹酚酸B42.700 0±2.810 041.800 0±2.610 043.500 0±2.250 0 丹参酮I2.440 0±0.285 02.530 0±0.213 02.570 0±0.304 0 丹参酮IIA5.300 0±0.465 35.274 0±0.543 85.413 0±0.487 6 隐丹参酮3.920 0±0.453 04.130 0±0.429 04.050 0±0.334 0 毛蕊异黄酮葡萄糖苷0.387 0±0.025 50.383 0±0.020 60.398 0±0.023 8 黄芪甲苷0.071 3±0.003 90.072 7±0.002 70.069 5±0.003 5 芍药苷6.010 0±0.493 06.120 0±0.732 05.880 0±0.645 0 芍药内酯苷0.147 0±0.011 20.149 0±0.009 40.142 0±0.009 9 麦冬皂苷D0.012 3±0.001 20.012 3±0.001 10.012 6±0.001 0 鲁斯可皂苷元0.002 8±0.000 20.002 8±0.000 20.002 7±0.000 2
3.2.2 色谱条件的优化 心脉安中15种成分完全色谱分离较难,分别试用了不同的流动相组合(甲醇、乙腈和水)及添加不同的电解质(甲酸及乙酸),结果表明仅有0.1%甲酸水溶液-乙腈作为流动相进行梯度洗脱,15种成分的色谱峰峰形好,响应值稳定,分析时间短,且无其他干扰。
3.2.3 指标性成分的选择 基于本研究采用UHPLC-Q-Exactive-Orbitrap-MS技术对心脉安全方进行检识分析,共检识得到109个化学成分;对文献报道心脉安中主要成分研究进展剖析发现,心脉安中含有大量具有心血管保护作用的成分,如人参皂苷Rb1、人参皂苷Rg1、黄芪甲苷、丹参酮ⅡA、丹酚酸B、芍药苷、芍药内酯苷、麦冬皂苷D等[27-34];《中国药典》2020年版规定各单味药质控指标性成分。综上,选择15个涵盖5个组方药味代表性结构类型的成分作为指标成分。
3.2.4 含量测定结果分析 本研究采用UHPLC-QTRAP-MS/MS技术建立心脉安多指标成分含量测定研究方法,同时进一步考察这些成分在3批次产品中的含量变化,样品检测结果显示批次间产品含量差异较小,表明样品质量较好且相对稳定,为建立现代化心脉安质量标准提供科学依据。
3.3 小结
本实验运用UHPLC-Q-Exactive-Orbitrap-MS技术对心脉安进行了全面系统地解析,为进一步开展心脉安全面质量控制研究、药效及安全性评价提供了物质基础支撑。建立的UHPLC-QTRAP-MS/MS含量测定方法可在4 min内同时测定心脉安中15种成分,该方法样品处理简单、分析时间短、灵敏度高、专属性好、结果准确可靠,重复性好,对于心脉安的质量控制及后续研究具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 许实波, 项辉, 李锐. 中成药结代停对豚鼠心肌细胞动作电位的影响 [J]. 中山大学学报论丛, 1994(6): 115-117.
[2] 李锐, 廖惠芳, 廖习珍, 等. 结代停药效学研究 [J]. 中药药理与临床, 1997, 13(1): 30-34.
[3] 李玉峰, 鲁卫星. 心脉安片治疗冠心病室性早搏40例临床观察 [J]. 北京中医药大学学报, 2003, 26(3): 67-69.
[4] 邱晓军, 邓国忠. 心脉安片治疗冠心病室性早搏40例疗效观察 [J]. 成都中医药大学学报, 2003, 26(1): 23-25.
[5] 邵雪松. 心脉安片治疗冠心病室性早搏临床观察 [J]. 辽宁中医药大学学报, 2013, 15(9): 183-185.
[6] 刘坤, 殷九一, 程华, 等. UHPLC-Q-Exactive-Orbitrap- MS整合网络药理学探讨树舌灵芝有效成分及其防治新型冠状病毒肺炎的可行性 [J]. 中国药理学通报, 2022, 38(2): 267-274.
[7] Xu J, Wang R, Liu J L,. Determination of monosaccharides infruit polysaccharide by an efficient UHPLC-QTRAP-MS/MS method [J]., 2021, 32(5): 785-793.
[8] Shi J J, Cai Z C, Chen S Y,. Qualitative and quantitative analysis of saponins in the flower bud of() by UFLC-Triple TOF-MS/MS and UFLC-QTRAP-MS/MS [J]., 2020, 31(3): 287-296.
[9] Huang X, Liu Y, Zhang N,. UPLC orbitrap HRMS analysis ofL. for authentication ofgenus with chemometric methods [J]., 2018, 56(1): 25-35.
[10] Li S L, Lai S F, Song J Z,. Decocting-induced chemical transformations and global quality of Du-Shen-Tang, the decoction of ginseng evaluated by UPLC-Q-TOF-MS/MS based chemical profiling approach [J]., 2010, 53(4): 946-957.
[11] Wu W, Lu Z Y, Teng Y R,. Structural characterization of ginsenosides from flower buds ofby RRLC-Q-TOF MS [J]., 2016, 54(2): 136-143.
[12] Yang S T, Wu X, Rui W,. UPLC/Q-TOF-MS analysis for identification of hydrophilic phenolics and lipophilic diterpenoids from[J]., 2015, 27(4): 711-728.
[13] 祁晓霞, 董宇, 单晨啸, 等. 基于UFLC-Q-TOF/MS分析黄芪-丹参药对化学成分研究 [J]. 南京中医药大学学报, 2017, 33(1): 93-96.
[14] 张亦琳, 潘高, 延永, 等. ESI-Q-TOF-MS直接进样法比较陕西五个不同地区丹参的化学成分差异 [J]. 广西植物, 2019, 39(4): 490-498.
[15] Xia L, Liu H L, Li P,. Rapid and sensitive analysis of multiple bioactive constituents in Compound Danshen Preparations using LC-ESI-TOF-MS [J]., 2008, 31(18): 3156-3169.
[16] Zhang J, Xu X J, Xu W,. Rapid characterization and identification of flavonoids inby ultra-high-pressure liquid chromatography coupled with linear ion trap-orbitrap mass spectrometry [J]., 2015, 53(6): 945-952.
[17] 施怀生, 毕小凤, 史宪海. UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用分析黄芪根及其茎叶中黄酮和皂苷类成分 [J]. 世界中西医结合杂志, 2018, 13(3): 357-361.
[18] 信悦, 白晶. 复方黄芪生脉饮化学成分的UPLC-Q-TOF/MS分析 [J]. 哈尔滨商业大学学报: 自然科学版, 2021, 37(1): 21-25.
[19] Liu Q F, Jiao Z, Liu Y,. Chemical profiling of San-Huang Decoction by UPLC-ESI-Q-TOF-MS [J]., 2016, 131: 20-32.
[20] 刘杰, 陈琳, 范彩荣, 等. 基于HPLC-DAD-Q-TOF- MS/MS的白芍和赤芍主要成分定性定量研究 [J]. 中国中药杂志, 2015, 40(9): 1762-1770.
[21] 周海玲, 许舜军, 周若龙, 等. 白芍、赤芍化学成分的高效液相色谱-飞行时间串联质谱分析[J]. 中药材, 2018, 41(7): 1637-1640.
[22] Liu E H, Qi L W, Peng Y B,. Rapid separation and identification of 54 major constituents in Buyang Huanwu Decoction by ultra-fast HPLC system coupled with DAD-TOF/MS [J]., 2009, 23(8): 828-842.
[23] Lyu C G, Kang C Z, Kang L P,. Structural characterization and discrimination of(Liliaceae) from different geographical origins based on metabolite profiling analysis [J]., 2020, 185: 113212.
[24] 晏仁义, 马凤霞, 余河水, 等. UPLC-Q-TOF-MSE结合相对保留时间在线快速鉴定麦冬中甾体皂苷类成分 [J]. 中国实验方剂学杂志, 2016, 22(24): 43-50.
[25] Liu C H, Jin Q, Zhou D Z,. Influence of ultrafiltration membrane on ophiopogonins and homoisoflavonoids inas measured by ultra-fast liquid chromatography coupled with ion trap time-of-flight mass spectrometry [J]., 2017, 15(2): 121-141.
[26] 王子健, 刘颖, 刘思燚, 等. UPLC-HRMSn结合高能诱导裂解快速鉴定麦冬中高异黄酮类成分 [J]. 质谱学报, 2016, 37(6): 481-491.
[27] 刘岩, 赵世萍, 董晞, 等. 甘草苷及人参皂苷对乌头碱导致心肌细胞离子通道mRNA表达变化的影响 [J]. 中国中医基础医学杂志, 2008, 14(5): 359-361.
[28] 王浩, 邹茜. 人参皂苷Rg1调节沉默信息调节因子1对抗晶状体上皮细胞衰老的影响[J]. 世界中医药, 2021, 16(7): 1095-1098.
[29] Lu C, Sun Z J, Wang L. Inhibition of L-type Ca2+current by ginsenoside Rd in rat ventricular myocytes [J]., 2015, 39(2): 169-177.
[30] 曹瑀莹, 杜丙秀, 李劭恒, 等. 人参皂苷Re对异丙肾上腺素诱导离体灌流大鼠心脏心律失常的调节作用 [J]. 中草药, 2021, 52(20): 6234-6244.
[31] 郑鹏, 王俊帅, 占大钱, 等. 丹参酮IIA通过NLRP3/ Caspase-1信号通路对心肌成纤维细胞的保护作用[J].世界中医药, 2021, 16(6): 916-919.
[32] 龚奥娣, 孙敬和. 黄芪甲苷对心肌缺血心律失常大鼠模型Ca2+浓度影响初步研究 [J]. 亚太传统医药, 2013, 9(8): 11-12.
[33] 李凤. 芍药苷预处理对大鼠缺血再灌注损伤心肌细胞凋亡及自噬的调控作用 [D]. 长春: 吉林大学, 2019.
[34] 王佳. 麦冬皂苷D诱导CYP2J3增强SERCA2a/PLB相互作用的分子机制 [D]. 广州: 广东药科大学, 2019.
Identification of chemical constituents of Xinmai'an by UHPLC-Q-Exactive-Orbitrap-MS and determination of its content by UHPLC-QTRAP-MS/MS
ZHANG Wei1, 2, LI Chu-yuan1, WANG De-qin1, GUO Hai-biao1, SUN Xiao-bo2, XU Ke-yi1, YIN Wei3
1. Hutchison Whampoa Guangzhou Bai Yunshan Chinese Medicine Co., Ltd., Guangzhou 510515, China 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China 3. Guangzhou General Pharmaceutical Research Institute Co., Ltd., Guangzhou 510240, China
The UHPLC-Q-Exactive-Orbitrap-MS was developed for the identification of chemical constituents in Xinmai'an. and an UHPLC-QTRAP-MS/MS method was also established for rapid and simultaneous determination of the content of 15 components in Xinmai'an.ACQUITY UHPLC HSS T3 chromatography column (100 mm × 2.1 mm, 1.8 μm) was used with 0.1% formic acid (A)-acetonitrile (B) as the mobile phase in gradient elution.The data were collected by heated electrospray ion source (HESI) under positive and negative mode. Besides, Waters ACQUITY UPLC CSH C18chromatography column (100 mm × 2.1 mm, 1.7 µm) was used with 0.1% formic acid water (A)-acetonitrile (B) as mobile phase for gradient elution. Multiple reaction monitoring (MRM) in positive and negative ion mode.by using electrospray ion source (ESI) was performed for quantitative analysis of 15 compounds in Xinmai'an.Based on the accurate mass measurements, mass fragmentation patterns combined with comparison of reference or literature reports, a total of 109 major compounds including 31 triterpenoids (mainly triterpene saponins), 25 flavonoids, 15 phenylpropanoids, 13 steroids, 9 monoterpenes, 7 quinones, and 9 other compounds were tentatively identified and speculated. Besides, under the optimized MS/MS condition, the linearity ranges of ginsenoside Re, ginsenoside Rg1, ginsenoside Rb1, ginsenoside Rb2, ginsenoside Rc, ginsenoside Rd, danshensu, salvianolic acid B, tanshinone I, cryptotanshinone, tanshinone IIA, calycosin glucoside, astragaloside IV, paeoniflorin, albiflorin, ophiopogonin D, and ruscogenin were with good linearity≥ 0.995 8). The average recovery rate of 15 compounds in the samples were in the range of 91.8%—106.5%, and the RSD range was from 1.9% to 4.5%. The RSD values of precision, stability and repeatability test were all less than 4.6%.The results of this study clarified the chemical substance basis of Xinmai'an, and the method of UHPLC-QTRAP-MS/MS had good repeatability, high specificity, stability and controllability, which could be used for quality control of Xinmai'an.
Xinmai'an; UHPLC-Q Exactive-Orbitrap-MS; UHPLC-QTRAP-MS/MS; triterpenoids;ginsenoside Re; ginsenoside Rg1; tanshinone I; astragaloside IV; paeoniflorin
R284.1
A
0253 - 2670(2023)06 - 1743 - 14
10.7501/j.issn.0253-2670.2023.06.006
2022-12-29
名优中成药产学研深度融合发展服务平台(20212210006)
张 薇(1992—),女,博士研究生,研究方向为中药药效物质基础及中药质量控制研究。E-mail: 751305770@qq.com
孙晓波(1958—),男,研究员,博士生导师,研究方向为心脑血管及糖尿病药理学。E-mail: sun-xiaobo@163.com
徐科一(1965—),男,本科,高级经济师,研究方向为中药大健康。E-mail: 553555422@qq.com
[责任编辑 王文倩]
