外源亚精胺对草莓NaCl胁迫的缓解效应
2023-03-21马媛媛孙军利赵宝龙鲁倩君陈丽靓
马媛媛,孙军利,赵宝龙,鲁倩君,陈丽靓,刘 迎
(特色果蔬栽培生理与种质资源利用兵团重点实验室/石河子大学农学院,新疆石河子 832003)
草莓(Fragaria×ananassaDuch.),蔷薇科草莓属,多年生温带常绿草本植物,原产地南美洲,在中国各地以及全球均有广泛的种植,具有株体小、易种植、成熟早、周期短和收益高等特点,是我国重要的经济作物之一[1]。我国是盐渍土分布广泛的国家之一,从沿海到内陆、热带到寒带以及湿润地区到沙漠地区均有大量盐渍土的分布,面积达到 9 913万hm2,占全国可利用土地面积的4.88%,成为制约我国农产品增产的主要原因之一[2]。我国在不断克服盐碱地对作物造成的损害,所以利用外源物质提高植物耐盐性成为近几年的研究热点。
多胺(polyamines,简称PAs)是广泛存在于植物体内的一类低分子含氮碱,是一种重要的植物生长调节物质,主要包括腐胺(putrescine,简称Put)、亚精胺(spermidine,简称Spd)、精胺(spermine,简称Spm),其中Spd与植物抗逆性的关系最密切[3]。Spd又称三盐酸亚精胺,是植物体内的重要代谢物,并且由于其多价阳离子的特性,导致生理功能更强,在植物受到环境胁迫时可以直接作为保护物质,还可以在胁迫信号转导中作为信号分子,有助于促进胁迫抗性机制的构建[4-5],还能够保护非生物胁迫条件下植物光合器官功能的完整性,来维持较高的光合效率[6]。前人研究已证明Spd能够缓解逆境胁迫对植物的影响,已在低温[7]、水淹[8]、干旱[9]和盐胁迫[10]等多种非生物胁迫中被证实。海霞等对盐胁迫下的燕麦外源施加0.75 mmol/L Spd,发现可通过提高燕麦幼苗的渗透调节和抗氧化能力,维持生物膜系统的稳定,有效减轻离子毒害对植株的伤害,以达到提高燕麦耐盐性,促进幼苗生长的目的[11]。杨妮等对NaCl胁迫下茶树外源施加不同浓度Spd,发现可有效缓解叶绿素降解,促进植株光合作用,提高茶树耐盐性,促进植株生长,0.5 mmol/L 浓度Spd处理效果最佳[12]。此外,Spd还在甜高粱[13]、豇豆[14]、核桃[15]、菠菜[16]等多种植物中施用,表明可以缓解多种植物的盐胁迫。
本试验以甜查理草莓品种为材料,对NaCl胁迫下的草莓外源施加不同浓度的Spd,研究其光合色素含量、光合特性、叶绿素荧光和抗氧化酶活性,明确Spd对草莓幼苗NaCl胁迫的缓解机制,为提高草莓耐盐性提供理论依据和新的技术途径,对我国盐渍化土地较重区域的草莓产业发展具有重要的意义。
1 材料与方法
1.1 试验材料
试验草莓品种为甜查理,选取6~8张叶、长势均匀健壮的植株,移栽定植到装有20 L营养液的水培盒80 cm×50 cm×30 cm中,每盒放入15株,共10盒。使用霍格兰营养液(电导率为1.2 mS/cm),每5 d更换1次,24 h通气。所有试验材料生长到 7~8张叶后进行处理。
1.2 试验设计
试验于2021年5—6月在石河子大学试验站温室进行。在同一天对草莓植株进行处理(表1),叶片正面和反面喷施均匀(记作0 d),以药液附于叶面但不下滴为标准,喷施等量蒸馏水为对照。处理后3、6、9 d取样测定光合色素含量、光合特性、叶绿素荧光和抗氧化酶活性,采集的叶片经过液氮处理,放入-80 ℃超低温冰箱,待3次叶片采集完成,同时测定。
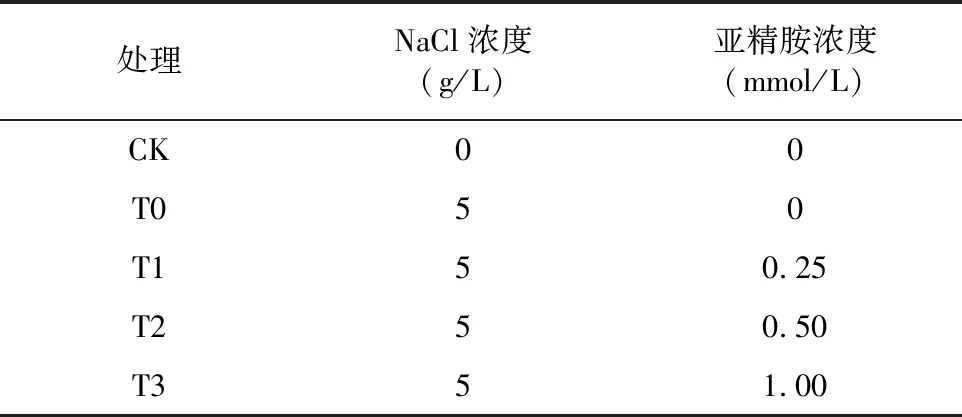
表1 草莓幼苗的不同Spd浓度组合处理
1.3 测定指标与方法
1.3.1 光合色素含量的测定 取样品0.1 g,剪碎后加入95%乙醇,黑暗处浸提26~30 h,至叶片颜色变白,叶绿素提取完全,使用紫外分光光度计分别在470、649、665 nm下测定吸光度,每个处理重复3次,计算叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量[17]。
1.3.2 光合特性相关指标 采用开放式气体交换Li-6400便携式光合仪于处理后3、6、9 d 10:00—12:00测定草莓幼苗自上至下第2~4张完全展开功能叶片的气孔导度(Gs)、净光合速率(Pn)、胞间CO2浓度(Ci)和蒸腾速率(Tr),每个处理重复3次。
1.3.3 荧光指标的测定 处理后3、6、9 d的 12:00—13:00进行叶片遮光30 min后,选取从上到下第2~4张完全展开的功能叶片,采用植物效率仪(M-PEA)测定叶片初始荧光(Fo)、最大荧光(Fm)、PSⅡ潜在光化学效率(Fv/Fo)和PSⅡ最大光化学效率(Fv/Fm),每个处理重复3次。
1.3.4 抗氧化酶相关指标 酶提取液的获得:称取0.2 g样本放入预冷研钵,加2 mL pH值=7.8的0.05 mol/L磷酸缓冲液(含EDTA),冰浴研磨,匀浆倒入离心管中,于4 ℃离心机10 500 r/min离心 20 min,上清液(酶液)倒入干净的离心管中,置于 0~4 ℃条件下保存待用。过氧化物酶(POD)活性通过愈创木酚法测定;超氧化物歧化酶(SOD)活性通过氮蓝四唑(NBT)还原法测定;过氧化氢酶(CAT)的活性根据H2O2的分解速度来测定;抗坏血酸过氧化物酶(APX)活性通过紫外分光光度法测定[18-19]。
1.4 数据统计分析
全部试验数据均重复3次以上,利用SPSS 20.0软件进行显著性分析和主成分分析,OriginPro 7.5软件作图。采用Duncan’s检验比较平均差异(α=0.05)。
2 结果与分析
2.1 外源Spd对NaCl胁迫下草莓幼苗叶片光合色素含量的影响
由图1可知,与对照相比,T0处理下草莓幼苗叶片的叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)和总叶绿素(Cal a+b)含量均呈下降的趋势,光合色素含量在处理后9 d达到最低值。外源施加不同浓度Spd,均能够提高草莓叶片的光合色素含量,T2处理效果最佳。从图1-A可以看出,处理后3、6、9 d,与T0相比,T2处理下的Chl a含量显著增加32.02%、45.98%、45.98%。从图1-B可以看出,外源施加Spd后,不同浓度处理下的 Chl b 含量均显著高于T0,T2处理后3 d与CK相比增加5.64%,与T0相比显著增加79.24%。从图1-C可以看出,外源施加Spd后,草莓幼苗的总叶绿素含量均显著高于T0,在处理后3 d,T1、T2、T3分别增加29.06%、40.67%、24.10%。从图1-D可以看出,Car在处理后3、6 d,T2处理增幅最显著,与CK相比分别增加13.93%、3.61%,与T0相比增加25.59%、51.85%。表明外源施加不同浓度Spd都可以有效缓解NaCl胁迫导致的草莓幼苗叶片光合色素含量下降,且以0.5 mmol/L的浓度为最佳。
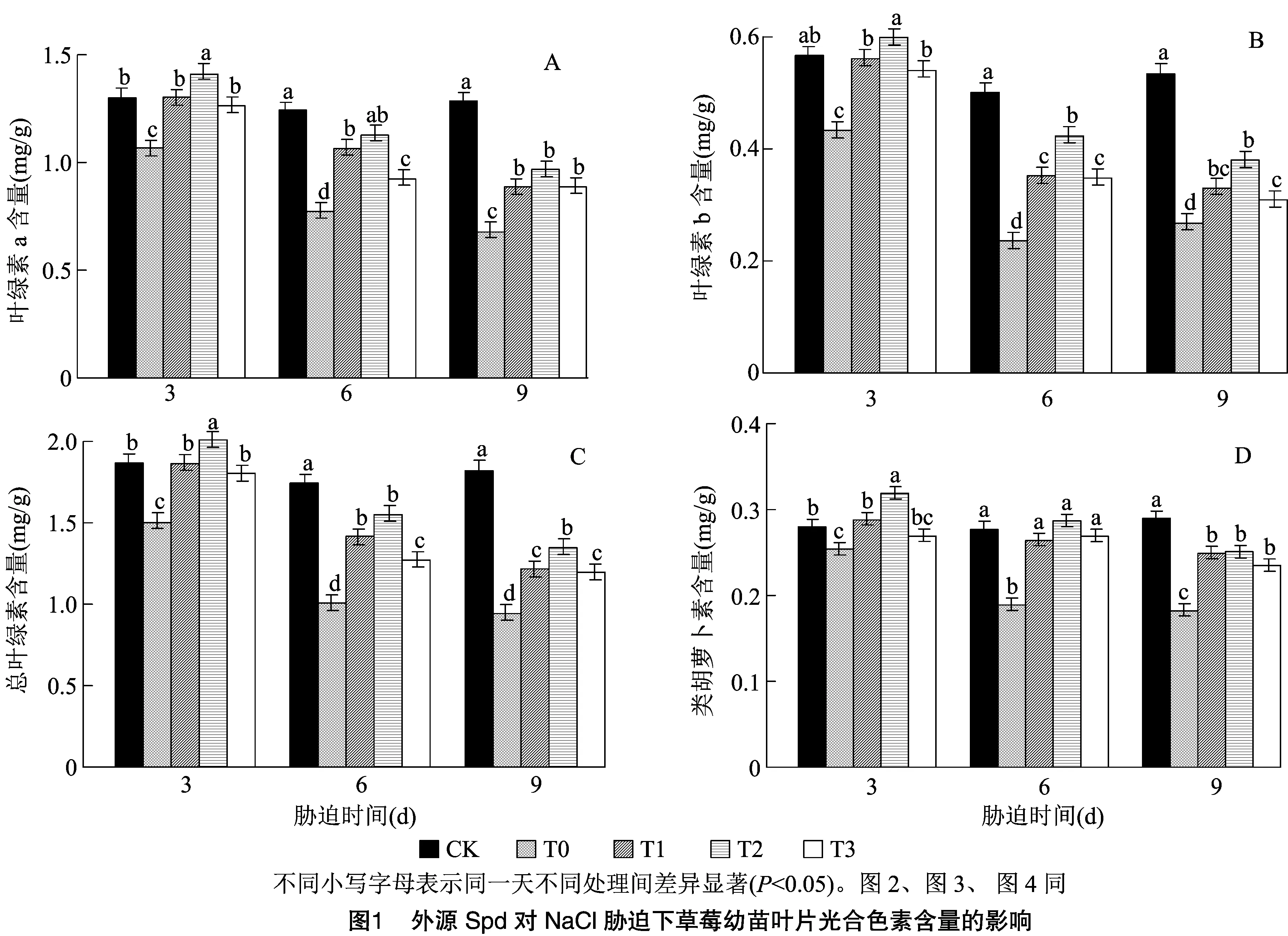
2.2 外源Spd对NaCl胁迫下草莓幼苗叶片光合参数的影响
由图2可知,T0处理下草莓幼苗叶片光合特性显著低于CK,净光合速率(net photosynthetic rate,Pn),蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)在处理后9 d达到最低值,与CK相比显著降低68.09%、72.00%、73.96%。T0处理下的胞间CO2浓度(intercellular CO2concentration,Ci),随着时间的延长,呈现出上升的趋势,处理后9 d达到峰值。由图2-A可以看出,外源施加不同浓度Spd后,草莓叶片的Pn显著高于T0处理,T1、T2、T3处理的增幅在处理后3 d分别为107.76%、143.15%、76.50%,随着处理时间的延长,呈现出下降的趋势,在处理后9 d下降到最低值。由图2-B可以看出,外源施加Spd后,显著提高T0处理下草莓叶片的Tr。处理后3 d与T0相比,T1、T2、T3处理分别增加124.97%、151.08%、118.63%。由图2-C可以看出,外源施加Spd后草莓叶片的Ci呈现出下降的趋势,处理后9 d达到最低值。由图2-D可以看出,外源施加Spd后,草莓叶片的Gs呈现出先上升再下降的趋势,在处理后6 d达到峰值,与T0相比,T1、T2、T3处理分别增长70.45%、93.18%、38.64%。由此说明,外源施加Spd可显著缓解NaCl胁迫下草莓叶片光合特性的降低,随着胁迫时间的延长,Spd处理效果逐渐减弱。
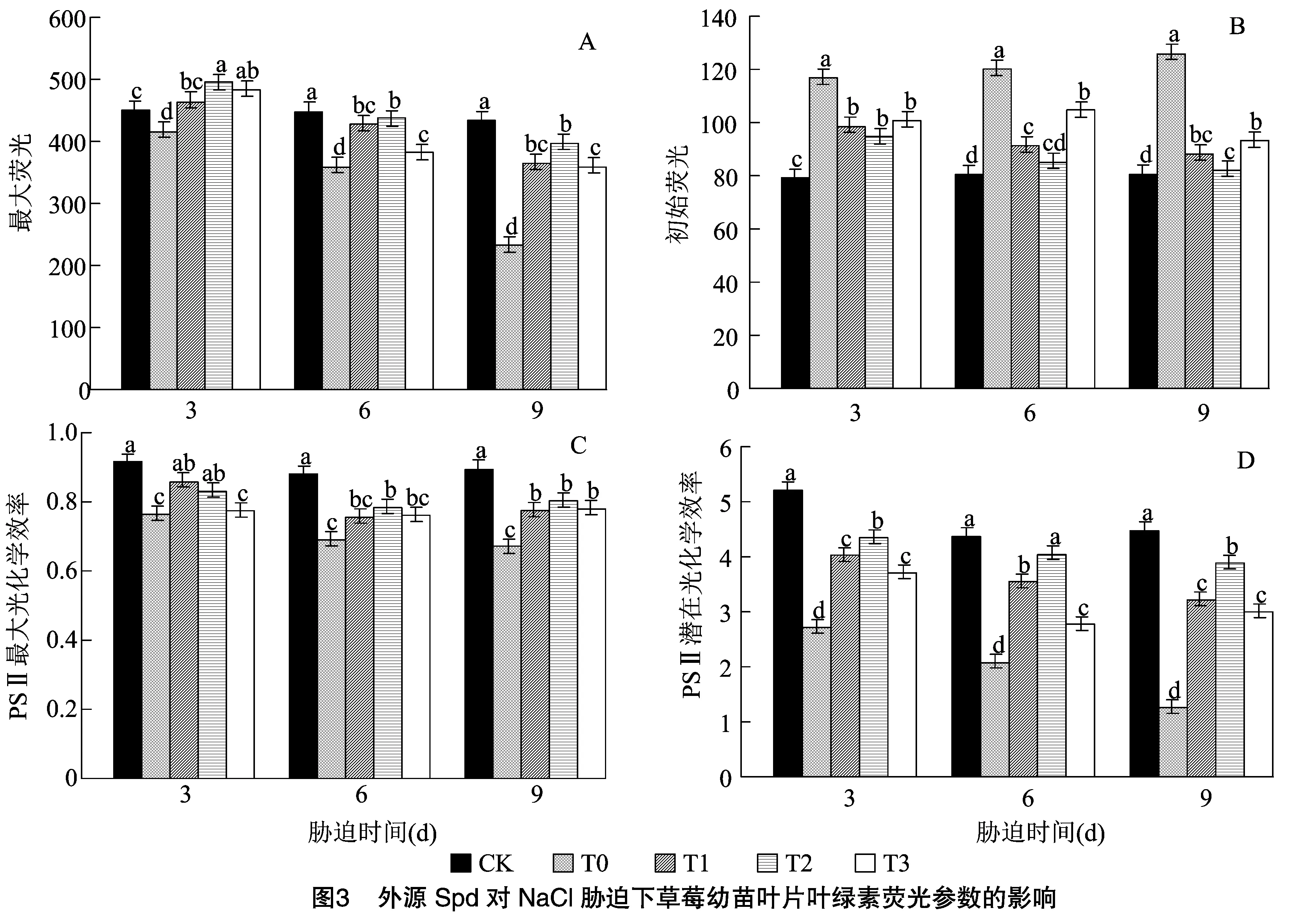
2.3 外源Spd对NaCl胁迫下草莓幼苗叶片荧光参数的影响
由图3可知,在NaCl胁迫下,草莓幼苗叶片的最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ 潜在光化学效率(Fv/Fo)均呈现出下降的趋势,处理后9 d降为最低值,初始荧光(Fo)则呈现出上升的趋势,处理后9 d上升为最大值。由图3-A可以看出,外源施加Spd后草莓叶片的Fm在处理后 3 d 高于CK和T0,随着处理时间的延长,逐渐开始下降,在6、9 d低于CK,高于T0。由图3-B可以看出,外源施加Spd后,草莓叶片的Fo与T0相比显著降低,处理后9 d降幅最大,T1、T2、T3处理分别下降29.92%、34.80%、25.87%。由图3-C可以看出,外源施加Spd后草莓叶片的Fv/Fm显著高于T0处理,T1处理在处理后3 d 缓解效果最佳,与T0相比,显著增加12.17%。处理时间延长至6、9 d时,T2缓解效果为最佳。由图3-D可以看出,外源施加Spd后显著提高了草莓叶片的Fv/Fo,处理后9 d 缓解效果最佳。由此说明,外源施加Spd可有效提高草莓幼苗叶片NaCl胁迫下的光能转化效率,缓解NaCl胁迫对草莓光系统的破坏。

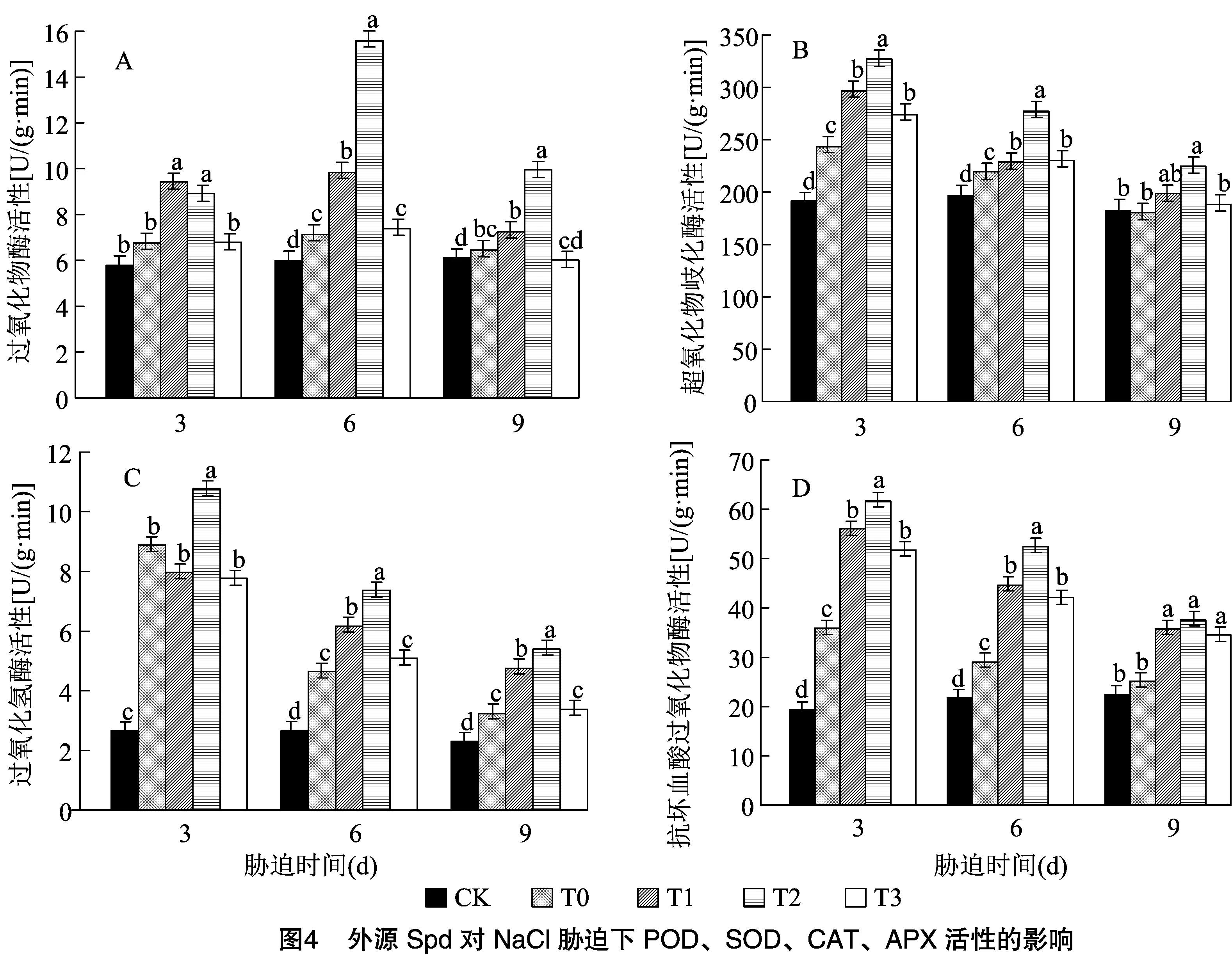
2.4 外源Spd对NaCl胁迫下草莓幼苗抗氧化酶的影响
由图4可知,草莓幼苗叶片的POD、SOD、CAT和APX活性随着外源Spd处理浓度的升高,呈现出先上升后下降的趋势。从图4-A可以看出,草莓叶片的POD活性在T0处理3、6、9 d分别增加16.58%、19.27%、5.69%,外源施加不同浓度Spd后显著高于T0,T1、T2和T3处理后6 d达到了峰值,与T0相比显著增加37.58%、118.10%和3.38%;与CK相比显著增加64.09%、160.12%和23.29%。由图4-B可以看出,外源施加不同浓度Spd后草莓叶片SOD活性显著高于T0和CK,T2处理效果为最佳,处理后3 d与CK相比显著增加70.83%。由图4-C可以看出,与T0相比,处理后3 d T2处理显著增加21.24%;T1在处理后6、9 d显著高于T0。由图4-D可以看出,外源施加Spd后,草莓叶片的APX活性显著高于T0和CK,处理后3 d差异最显著,T1、T2、T3处理与T0相比显著增加56.15%、71.87%、44.10%,与CK相比显著增加189.95%、219.14%、167.58%。草莓幼苗在NaCl胁迫下,抗氧化酶活性可以提高,外源施加Spd后,抗氧化酶活性可以在短时间内持续升高,表明Spd可以缓解叶片受到盐胁迫后的膜脂过氧化损伤。
2.5 外源Spd对草莓幼苗盐胁迫缓解能力的综合评价
利用SPSS对外源Spd缓解NaCl胁迫下草莓的14个指标进行主成分分析,结果(表2)表明,2个主成分初始特征值大于1,第1主成分贡献率为65.269%,第2主成分贡献率为29.523%,累计贡献率达到了94.792%,所以提取前2个主成分作为综合指标评价依据。根据成分矩阵(表2)计算出主成分得分系数,计算2个主成分的得分如下:
y1=0.324x1+0.324x2+0.299x3+0.327x4+0.327x5+0.284x6+0.317x7-0.294x8+0.329x9+0.320x10+0.025x11+0.053x12-0.057x13-0.037x14;
y2=-0.085x1+0.044x2-0.199x3+0.022x4-0.027x5-0.198x6+0.126x7-0.205x8+0.001x9+0.121x10+0.433x11+0.471x12+0.475x13+0.451x14。
式中:y1和y2代表主成分1和主成分2的得分,x1~x14分别代表Chl a+b含量、Car含量、Pn、Tr、Ci、Gs、Fm、Fo、Fv/Fm、Fv/Fo、POD活性、SOD活性、CAT活性、APX活性经过Z-score方法标准化处理的值。
根据综合主成分分析结果(表3),各处理综合评价由高到低排名依次为CK>T2>T1>T3>T0。
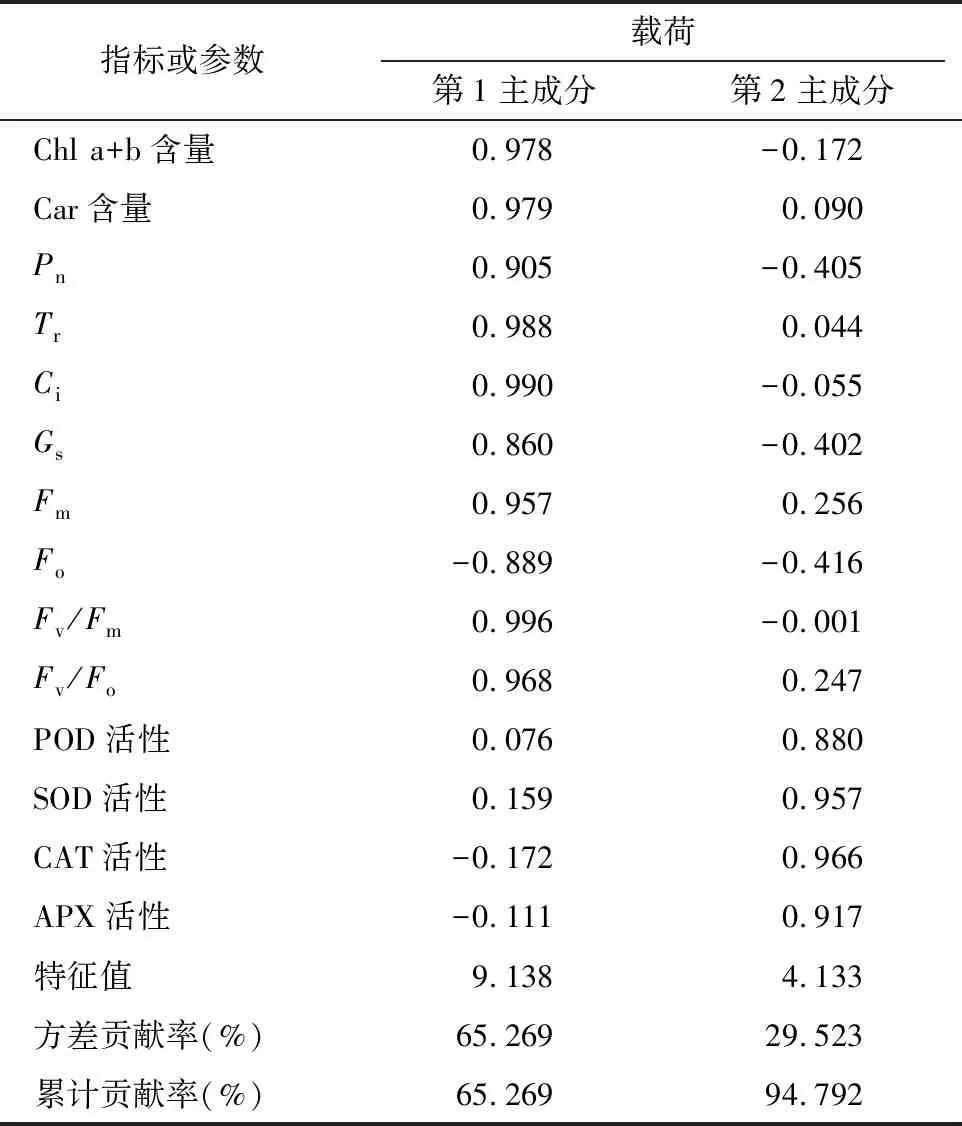
表2 主成分分析载荷矩阵
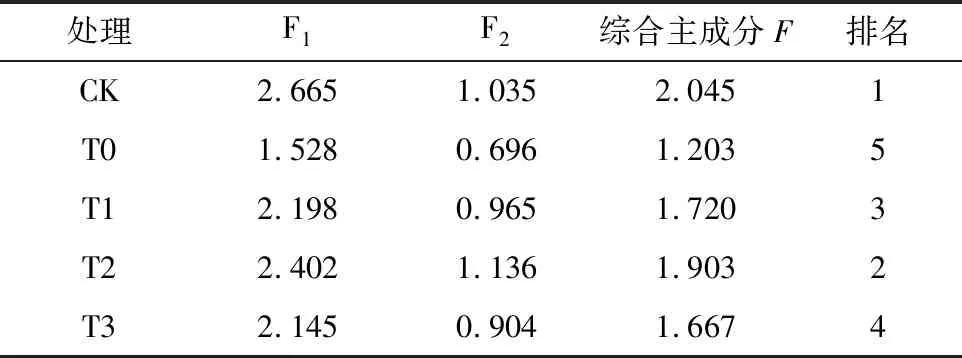
表3 综合主成分分析值及排序
3 讨论与结论
当植物受到逆境胁迫时,光合作用显著下降,叶绿素是参与光能吸收、转化和传递的重要指标[20-21]。盐胁迫会影响叶绿素的降解、类囊体膜的稳定性以及叶绿体对光能的吸收,从而影响光能在2个光系统之间的合理分配,降低光合速率[22]。本试验结果表明,与CK相比,5 g/L NaCl胁迫下草莓幼苗叶片的Chl a、Chl b、Car以及总叶绿素均显著降低。这与李文娟对盐胁迫下草莓的研究结果[23]一致。本试验对叶片表面喷施不同浓度的外源Spd后,显著提高草莓叶片的光合色素含量,说明Spd可有效降低盐胁迫下草莓叶片光合色素含量下降的速度,这与张乃元对菊花幼苗的研究结果[9]保持一致,可能是因为亚Spd常以多聚阳离子的状态存在,因此可以直接与细胞膜上带负电荷的磷酸及光合蛋白进行结合,从而稳定细胞膜的结构,达到减轻叶绿体结构被破坏的目的,使光合色素含量下降速度减慢。
盐胁迫下降低植物光合作用的原因主要分为有气孔限制和非气孔限制,非气孔限制主要包括光合酶活性降低和光合器官受到损伤[24]。Ci随着Gs的升高而降低,是由于气孔限制的影响;Ci随着Gs的升高而升高,则是由于非气孔因素的影响[25]。本研究发现,在NaCl胁迫下草莓幼苗叶片Ci在逐渐降低,说明NaCl胁迫下的叶片光合作用降低主要因为气孔限制,可能与光合酶活性降低和光合器官受到损伤有关。外源施加Spd后显著缓解草莓叶片的Pn、Tr、Ci和Gs,其中0.5 mmol/L浓度的处理效果最佳。表明Spd可以缓解NaCl胁迫下引起草莓光合作用降低的气孔限制,增强光合速率和维持光系统稳定,这与杜红阳等在盐胁迫下大豆外源施加Spd的研究结果[26]一致。Spd能缓解盐胁迫下光合作用的原因,可能是其阳离子化合物可以与阴离子结合,从而缓解盐胁迫对草莓幼苗叶片的毒害,保护叶绿体完整性,促进光合作用[27]。
叶绿素荧光参数是用来说明植物光合作用和光合生理状况的变量或常数值,被视为研究植物光合作用与环境作用的关键,叶绿素含量的多少可以直接影响到Fo,从而反映PS Ⅱ中心的活性。本研究发现,在NaCl胁迫下,Fo随着处理时间的延长,呈现出增加的趋势,并且其值越高,表明光系统中心活性降低,造成这种现象的原因可能是逆境胁迫下活性氧会积累,破坏植物的叶绿素结构,叶绿素的合成速率下降,从而降低光能的吸收和转化,影响光合作用,这与汪志伟在辣椒上的研究结果[28]基本一致。在盐胁迫下PS Ⅱ电子传递情况的Fm和光能转化效率的的Fv/Fm都显著降低,说明 PS Ⅱ 遭到破坏。外源施加不同浓度的Spd,Fm和Fv/Fm均有不同程度的提升,说明PS Ⅱ的破坏程度减轻,这可能是因为外源施加Spd后导致PS Ⅱ开放程度更大,可以解除盐胁迫导致光抑制的现象,吸收的光能不再大量以热能形式消散,而是能够更多地用于光化学电子传递,完成光合作用[29]。
POD、SOD、CAT和APX是植物酶促防御系统中重要的保护酶,他们可以催化超氧阴离子自由基,歧化为H2O2和O2,也是清除H2O2的关键酶,从而达到缓解植株受到胁迫后的损伤[30]。本研究发现在NaCl胁迫下,酶活性上升,这可能是因为逆境胁迫导致活性氧的增多从而诱发了保护酶的合成。与NaCl胁迫相比,外源施加不同浓度的Spd,均可显著提高抗氧化酶活性。其中0.5 mmol/L浓度的处理效果最显著,在整个处理期间,抗氧化酶活性都保持在较高水平,这可能是因为Spd促进了内源多胺和抗氧化酶蛋白的合成,同时多胺也可以直接结合到酶分子上,提高单位酶的活性[31],这与赵东晓等在桑树上的研究结果[32]一致。
综上所述,喷施不同浓度的Spd均可显著缓解NaCl胁迫下草莓受到的损害,可以不同程度地增加光合色素的含量,显著提高Pn、Tr、Ci、Gs、Fm、Fv/Fo、Fv/Fm以及SOD、CAT、POD、APX活性,显著降低Fo的上升速度。对不同处理进行综合评价发现,0.5 mmol/L浓度Spd缓解草莓盐胁迫的效果为最佳。
