血清COMP、ADAMTS-7对骨关节炎患者心血管疾病患病风险的预测价值
2023-03-15侯新凤王慧杰
吕 莉,侯新凤,李 楠,王慧杰
漯河市中心医院(漯河市医专第一附属医院)心内二科(河南漯河 462005)
骨关节炎(osteoarthritis,OA)是在不良环境、外伤、劳损、软骨组织退行性改变等因素共同作用下引发的一组以关节局部组织炎症反应为基础病理特征的临床常见关节病。近年来,随着临床医学对OA病理生理机制及患者远期预后研究的不断深入,国内外大量临床随访报道及实践研究数据显示,OA患者在病情不断进展的过程中,炎症信号通路激活、氧化应激因子释放、功能障碍致脂质代谢紊乱及免疫功能失调等均是诱发患者并发心血管疾病(cerebrovascular disease,CVD)的重要病理因素[1],且导致OA患者预后不良的往往并不是疾病本身,而是心血管疾病。因此,加强OA患者心血管疾病风险的预测,对促进临床早期识别高危患病人群,并予以前馈性干预是改善OA患者预后的关键。软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)为细胞外基质蛋白,血小板反应蛋白解整合素金属 肽 酶 7(a disintegrin and metalloproteinase with thrombospondin 7,ADAMTS-7)为金属蛋白酶,已有文献报道显示,二者在心血管疾病的发生、发展机制中发挥了重要的作用[2]。本文主要探讨血清COMP、ADAMTS-7对OA患者心血管疾病患病风险的预测价值。
1 资料与方法
1.1 研究对象
选择漯河市中心医院2020年1月—2022年6月间收治的OA患者120例设为OA组,另将同期入院体检的120例健康者设为健康组。纳入标准:①OA组患者符合骨关节炎诊疗指南(2018年版)中OA诊断标准(近一个月大多数时间有膝关节疼痛;有骨摩擦音;晨僵小于30分钟 ;年龄大于38岁;有骨性膨大。如果满足1~4条或1、2、5条,或者1、4、5条者可诊断为OA);②病历资料中提供的信息符合本研究需求。排除标准:①不能配合完成本研究所开展的检测项目者;②合并血液系统疾病者。本研究患者均已知情同意,研究经漯河市中心医院伦理委员会批准通过(B132560)。
1.2 研究方法
血清COMP检测:清晨空腹状态下抽取患者肘静脉血采集血液标本 5 mL,离心 4 000 r/min,10 min后予以血液分离,取上层清液采用ELISA法检测血清COMP。
血清ADAMTS-7检测:清晨空腹状态下抽取患者肘静脉血采集血液标本5 mL,离心3 000 r/min,15 min后予以血液分离,取上层清液采用ELISA法检测血清ADAMTS-7。
CVD诊断标准:参照心血管疾病诊疗常规诊疗指南,将OA组120例患者分为合并CVD组(32例)和未合并CVD组(88例)。同时,采用China-PAR模型将未合并CVD组患者分为高危组(患病风险≥10.0%)、中危组(患病风险5.0%~9.9%)、低危组(患病风险<5.0%)。
CVD病理特征:①临床分型。根据患者CVD诊断结果,将其分为冠心病组、心律失常组、心力衰竭组;②动脉粥样硬化程度。根据SYNTAX评分法[3](该评分系统共包括12个问题,内容包括优势分型、病变数、累及节段和病变特征,对每一病变进行评分后的总分值即为SYNTAX积分),将其分为轻度组(SYNTAX≤22分)、中度组(SYNTAX23~32分)、重度组(SYNTAX≥33分);③心功能。根据NYHA心功能分级[4]标准,将其分为I-II级组、III级组、IV级组;④临床预后。根据Duke运动平板评分[5][Duke运动平板评分=运动时间(min)-5×ST段下降(mm)-(4×心绞痛指数)]结果,将其分为预后良好组(Duke评分≥5分)和预后不良组(Duke评分<5分)。
1.3 统计分析
采用EpiData3.1和Excel进行数据录入,用数据统计分析软件SPSS 22.0进行统计分析。对所有收集的数据,计数资料采用卡方检验;符合正态分布的计量资料用均数和标准差(±s)进行统计描述,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
研究纳入OA患者120例,男68例(56.67%)、女52例(43.33%),平均年龄(53.24±4.12)岁,合并CVD患者32例(26.67%)、未合并CVD患者88例(73.33%)。研究纳入健康对照120例,男70例(58.33%)、女50例(41.67%),平均年龄(54.02±3.76)岁。OA组与健康组在性别构成(P=0.783)、年龄(P=0.835)方面的差异无统计学意义。
2.2 OA组和健康组血清COMP、ADAM TS-7比较
OA 组患者血清 COMP(14.35±2.13 vs. 7.13±1.02,P< 0.001)、ADAMTS-7(56.54±5.23 vs.30.13±3.15,P<0.001)均显著高于健康组,见图1。
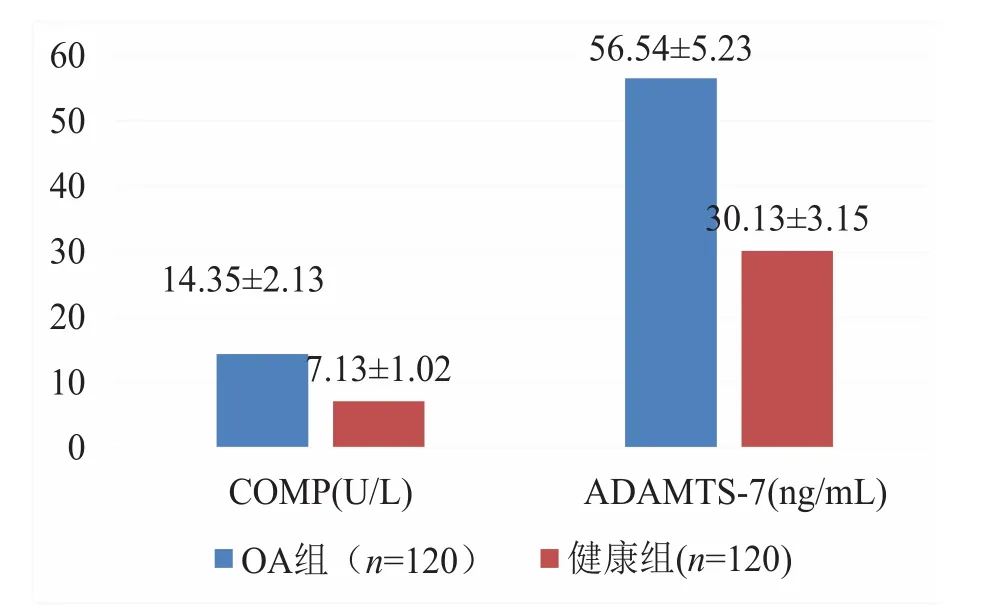
图1 OA组和健康组患者血清COMP、ADAMTS-7值Figure 1. Comparison of serum COMP and ADAMTS-7 values between OA and healthy group
2.3 合并CVD组和未合并CVD组血清COMP、ADAMTS-7比较
合并 CVD 组患者血清 COMP(18.45±2.33 vs.12.53±2.05,P=0.002)、ADAMTS-7(83.25±7.34 vs. 45.15±5.23,P<0.001)均高于未合并CVD组,见图2。在未合并CVD组患者中,CVD高危组血清COMP、ADAMTS-7值大于CVD中危组和低危组,见图3。
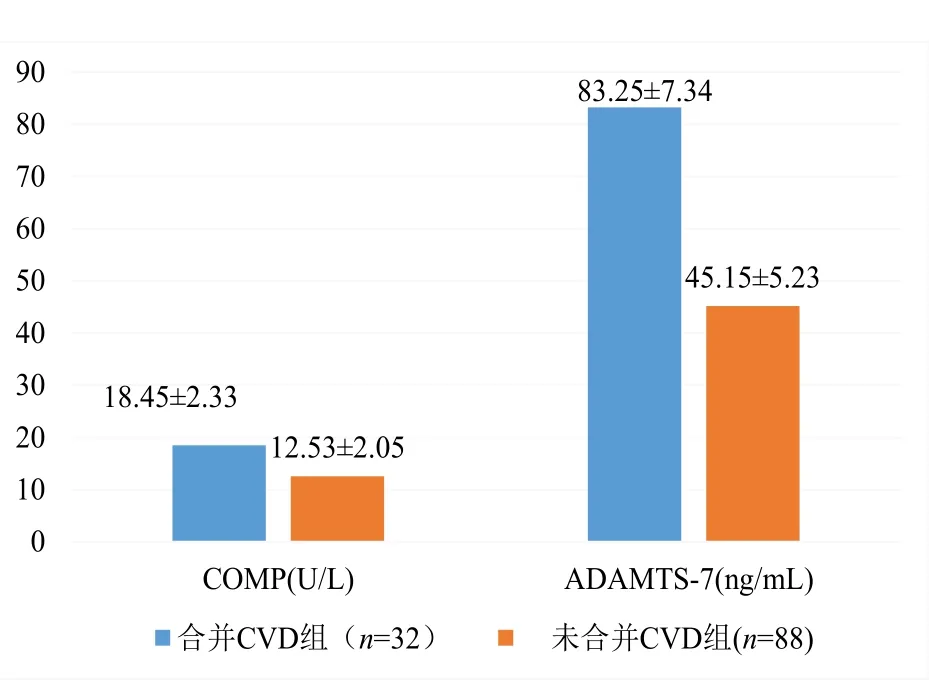
图2 合并CVD组和未合并CVD组OA患者血清COMP、ADAMTS-7值比较Figure 2. Comparison of serum COMP and ADAMTS-7 values in OA patients with and without CVD
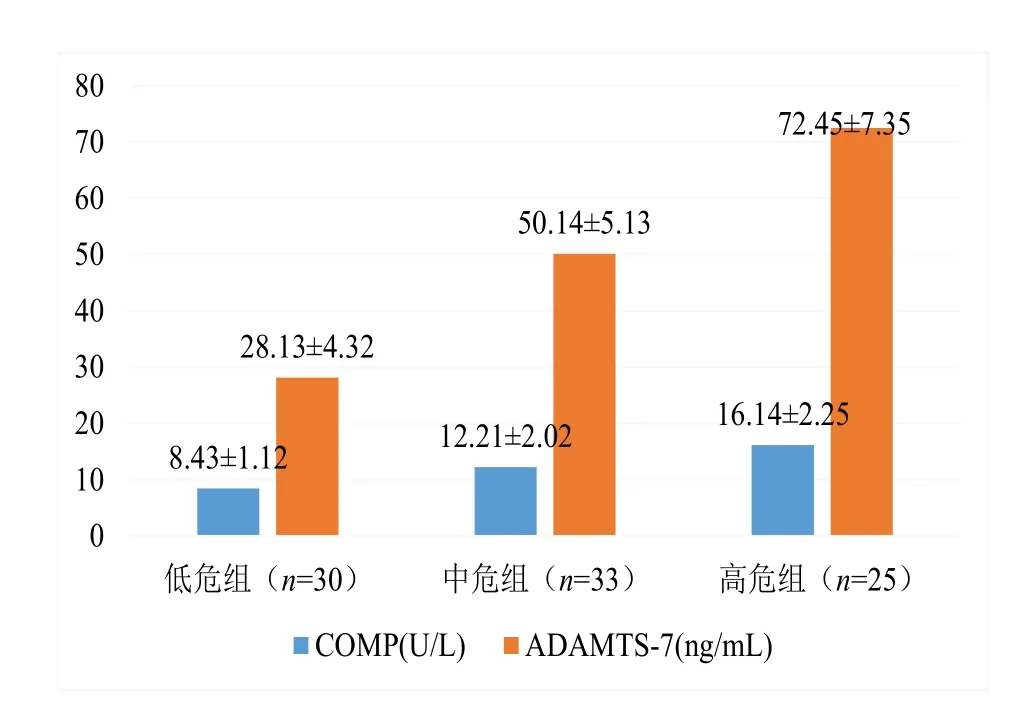
图3 未合并CVD组OA患者不同CVD患病风险亚组患者血清COMP、ADAMTS-7值比较Figure 3. Comparison of serum COMP and ADAMTS-7 values in OA patients without CVD in different CVD risk subgroups
2.4 合并CVD组血清COMP、ADAMTS-7与CVD病理特征的关系
合并CVD组患者中,冠心病组、心律失常组、心力衰竭组血清COMP(P=0.421)、ADAMTS-7(P=0.722)水平存在统计学差异。重度动脉粥样硬化患者血清COMP(P=0.007)、ADAMTS-7(P=0.009)高于轻中度患者。心功能分级上,Ⅲ-Ⅳ级组血清COMP(P=0.011)、ADAMTS-7(P=0.008)高于I-Ⅱ级组,预后不良组血清COMP、ADAMTS-7均高于预后良好组(P<0.001)见表1。
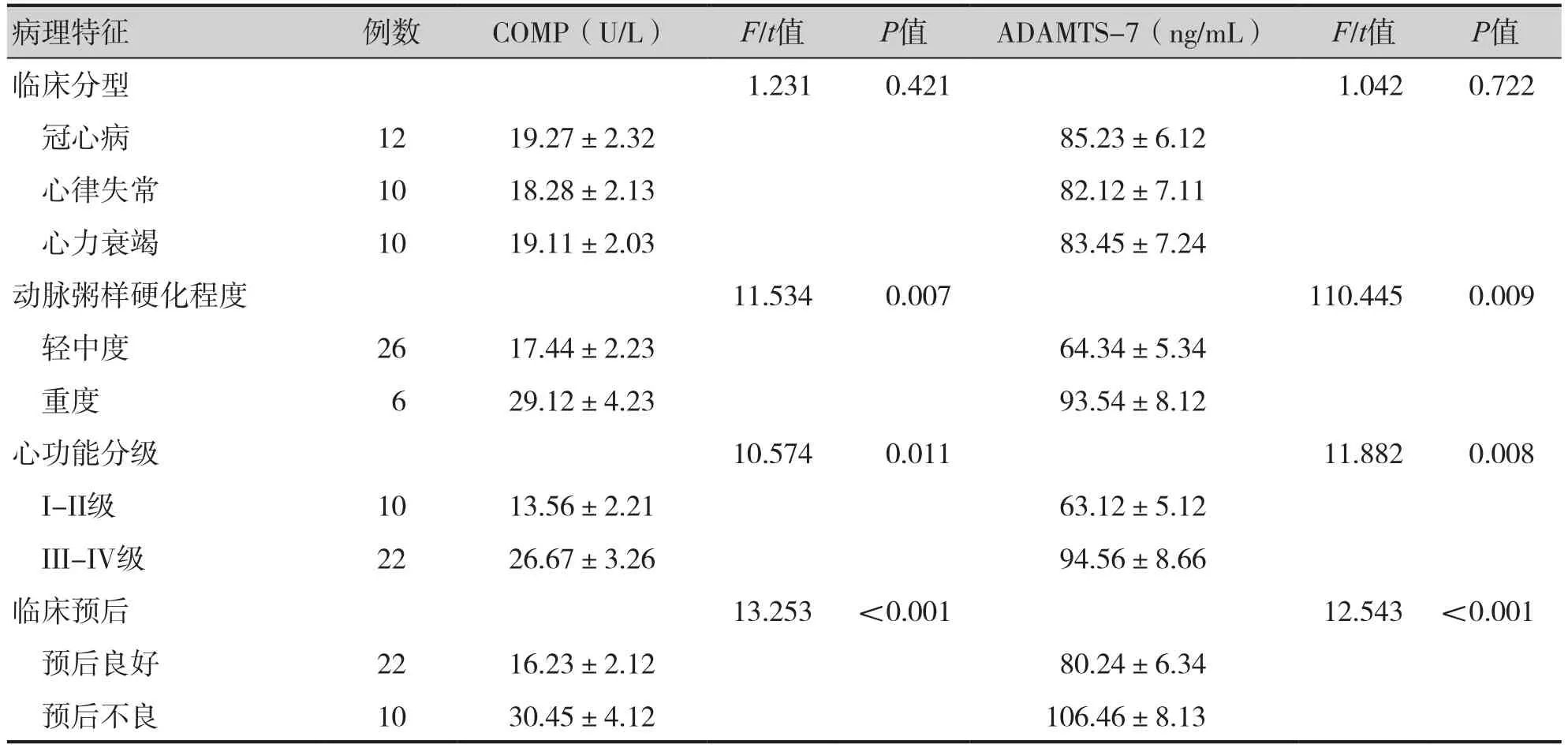
表1 合并CVD组患者血清COMP、ADAMTS-7值与CVD病理特征的关系Table 1. Relationship between serum COMP and ADAMTS-7 values and pathological features of CVD in patients with CVD
3 讨论
COMP是临床上反映关节受累程度及滑膜炎症反应程度的生物标志物,ADAMTS-7可介导炎症反应、氧化应激反应等造成软骨破坏,目前临床已证实,COMP、ADAMTS-7可通过多种理化反应途径参与OA的发生发展[6-7]。本研究中,OA组患者血清COMP、ADAMTS-7均高于健康组,提示COMP、ADAMTS-7的过表达可能在OA的发生中发挥了作用,与文献报道一致[8]。近年来,随着OA发病率的升高及患者近远期预后追踪报道的增多,有研究表明,OA患者并发CVD的风险较非OA人群高出23%,且在OA患者死亡病例中,因并发CVD致死者占32%[9]。2022年NICE指南指出,OA可显著增加心血管事件,临床上在予以OA常规治疗的同时应重视患者心血管疾病的预测及早期诊断、干预[10]。本研究主要探讨血清COMP、ADAMTS-7对OA患者CVD患病风险的预测价值,以期促进临床通过对COMP、ADAMTS-7表达水平的监测及调控加强OA患者并发CVD的防治。
本研究结果显示,合并CVD组OA患者血清COMP、ADAMTS-7值均高于未合并CVD组,且在合并CVD组患者中,动脉粥样硬化重度组血清COMP、ADAMTS-7高于轻中度组;在心功能分级上,Ⅲ-Ⅳ级组血清COMP、ADAMTS-7高于I-Ⅱ级组。即OA患者血清COMP、ADAMTS-7与CVD的合并发生、病情进展及预后可能相关。COMP主要反映OA患者机体炎症反应程度,而炎症反应是造成脂质代谢紊乱、凝血功能障碍、血流动力学障碍、血管内皮功能损伤及动脉粥样硬化等CVD发生发展病理过程的病理因子之一[11-12]。因此,COMP过表达提示OA患者机体炎症反应加剧,CVD发生、发展风险升高。同时,COMP作为人体血管壁组成成分中的重要部分,相关研究表明,当人体基质水解酶被激活后,COMP可在其酶反应下发生降解,对血管平滑肌细胞的迁移、转化产生诱导作用,进而促进血管内膜的增生以及中膜的钙化,最终导致动脉粥样硬化,并成为CVD发生发展的病理基础[13-14]。ADAMTS-7作为ADAMTS家族的重要成员,能通过对基质微环境中具有血管保护作用及血管稳态维护作用的基质成分进行降解,进而促进动脉粥样硬化的形成及加重,增加CVD患病风险[15];同时,ADAMTS-7可通过其底物COMP的精细调控而加重心血管重塑和血管内皮损伤,进而诱发或加重以血管平滑肌细胞增生、基质沉积为主要病理特征的管壁增厚、管腔狭窄性CVD[16-17]。随着OA患者血清COMP、ADAMTS-7值的升高,患者CVD的病情随之进展。
而OA患者在CVD并发风险预测中,并发CVD高危组血清COMP、ADAMTS-7大于中、低危组。即,CVD并发风险程度与血清COMP、ADAMTS-7表达密切相关。同时,已有的研究报道显示,COMP在OA患者发生CVD风险的预测中,灵敏度高达81.02%[18]。而ADAMTS-7与冠状动脉粥样硬化程度密切相关,其表达水平可作为评估CVD患病风险的重要依据。
综上所述,通过对OA患者血清COMP、ADAMTS-7的检测,可能可以为预测OA患者并发CVD的风险程度提供参考依据,同时也可作为并发CVD患者病情及预后判断的重要参考指标。
