3D-TOF-MRA 与CTA 对未破裂颅内动脉瘤诊断价值的对比研究
2023-03-15薛建建刘山波
刘 芸,薛建建,刘山波
(昌乐县人民医院影像科 山东 潍坊 262400)
颅内动脉瘤是自发性蛛网膜下腔出血的常见原因,一旦破裂,具有较高的致残率和致死率[1-2]。因此,及时、准确地检出颅内动脉瘤具有极其重要的意义。研究表明[3],颅内动脉瘤的年破裂风险仅为0.25%~2.00%,另外,最大径<3 mm 的微小动脉瘤,其获益最大的处理方式是不治疗而进行定期影像学随访。数字减影血管造影(digital subtraction angiography,DSA)具有较高的时间和空间分辨率,目前是公认的诊断颅内动脉瘤的“金标准”[4],但DSA 是一种有创、需注射对比剂、有电离辐射的检查,所以DSA 的应用受到一定限制[5]。对于未破裂颅内动脉瘤(unruptured intracranial aneurysms,UIAs)的筛查和定期随访,DSA 不宜作为首选。随着医学影像技术的不断发展,CT 血管造影(CT angiography,CTA)和MR血管造影(MR angiography,MRA)在颅内动脉瘤的筛查和定期随访中发挥着越来越重要的作用[6]。本研究以DSA 为标准,比较MRA 和CTA 对UIAs 的诊断价值,探讨UIAs 筛查和定期随访的首选影像学检查方法。
1 资料与方法
1.1 一般资料
回顾性收集2019 年7 月—2022 年6 月经昌乐县人民医院经DSA 确诊为UIAs 52 例患者的影像资料,所有患者均进行颅脑MRA 和CTA 检查,DSA、MRA 和CTA 检查间隔不超过1 周。52 例患者中男18 例,女34 例,年龄33 ~77 岁,平均(59.81±8.23)岁。
纳入标准:①经DSA 确诊为颅内动脉瘤者;②临床资料及影像学资料齐全者;③影像学图像质量合格;④无DSA、MRA 及CTA 相关检查禁忌证。排除标准:①动脉瘤破裂引起蛛网膜下腔出血患者;②合并脑出血、脑梗死、血管畸形等其他脑血管病患者;③伴有心肝肾等器官严重功能障碍患者;④精神异常不能配合检查或治疗患者。本研究根据《赫尔辛基宣言》的原则获得医学伦理委员会的批准,免于患者知情同意。
1.2 方法
MRA 检查:使用SIEMENS MAGNETOM VERIO 3.0T 磁共振扫描机,头部容积线圈,头先进,常规定位后行3D-TOF-MRA 序列扫描。扫描参数:TR 21 ms,TE 3.6 ms,层厚0.5 mm,矩阵512×512,FOV 200 mm×200 mm。
CTA 检查:使用SIEMENS SOMATOM Defniition Flash CT 扫描机,采用高压注射器团注碘海醇(350 mgI/mL)50 mL,注射速率为5.0 mL/s,对比剂注射完后再注入50 mL 0.9%氯化钠溶液。采用阈值自动触发扫描,检测血管选择主动脉弓,达到触发阈值(100 HU)后自动检测扫描,扫描方向自足侧向头侧。扫描参数:电压120 kV,电流350 mA,螺距0.6,扫描层厚0.6 mm,FOV 200 mm×200 mm。
DSA 检查:使用飞利浦的ALLURA XPER FD 20/20 数字减影血管造影机,对右侧股动脉进行Seldinger 法穿刺,插管置入5F 造影导管,于双侧颈内动脉、椎动脉开口处经高压注射器注入碘海醇,多角度投影,直至清晰显示病灶。
1.3 影像学评价
扫描完成后,所有患者的MRA 及CTA 原始图像传到后处理工作站,采用最大密度投影、多平面重组、容积再现等技术进行图像后处理,由2 名高年资神经影像诊断医师阅片,结合原始图像与三维图像综合判断,记录动脉瘤的位置、数目,测量动脉瘤的瘤体最大径和瘤体颈宽,在进行测量工作时,可以任意角度旋转,获得最佳测量角度,适当放大图像。在图像判读过程中若有异议,由两位医师商讨后达成一致意见。
1.4 统计学方法
采用SPSS 26.0 统计软件处理数据,符合正态分布的计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验,P<0.05 则差异有统计学意义。MRA 和CTA 对颅内动脉瘤检出的一致性采用Kappa检验,Kappa值≥0.75 表示一致性良好;Kappa值在0.4 ~<0.75 时表示一致性一般;Kappa值<0.4 则表示一致性较差。
2 结果
2.1 MRA 和CTA 对颅内动脉瘤检出率的比较
DSA 确诊的52 例患者中,共检出63 个动脉瘤,其中42 例患者有1 个动脉瘤,9 例有2 个动脉瘤,1 例有3 个动脉瘤;MRA 检出动脉瘤57 个,假阳性5 个,真阳性52 个,假阴性11 个;CTA 检出动脉瘤57 个,假阳性4 个,真阳性53 个,假阴性10 个,见图1、2。MRA、CTA 的检出率分别为82.54%、84.13%,差异无统计学意义(χ2=0.06,P>0.05),且两者对颅内动脉瘤的检出情况具有良好的一致性(Kappa=0.94)。检出动脉瘤的位置和数目见表1。
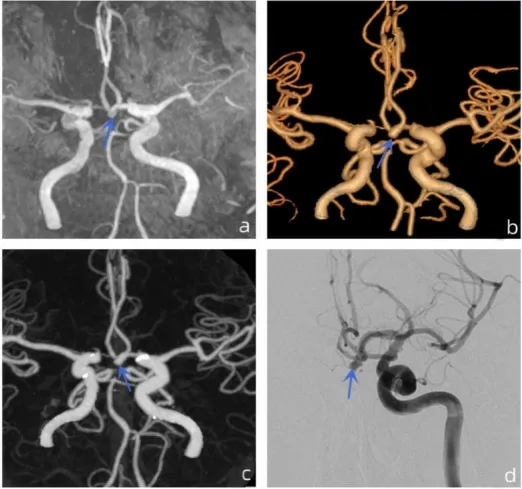
图1 前交通动脉动脉瘤
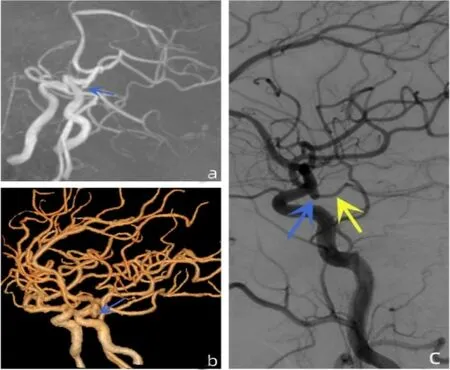
图2 左侧后交通动脉起始部动脉圆锥
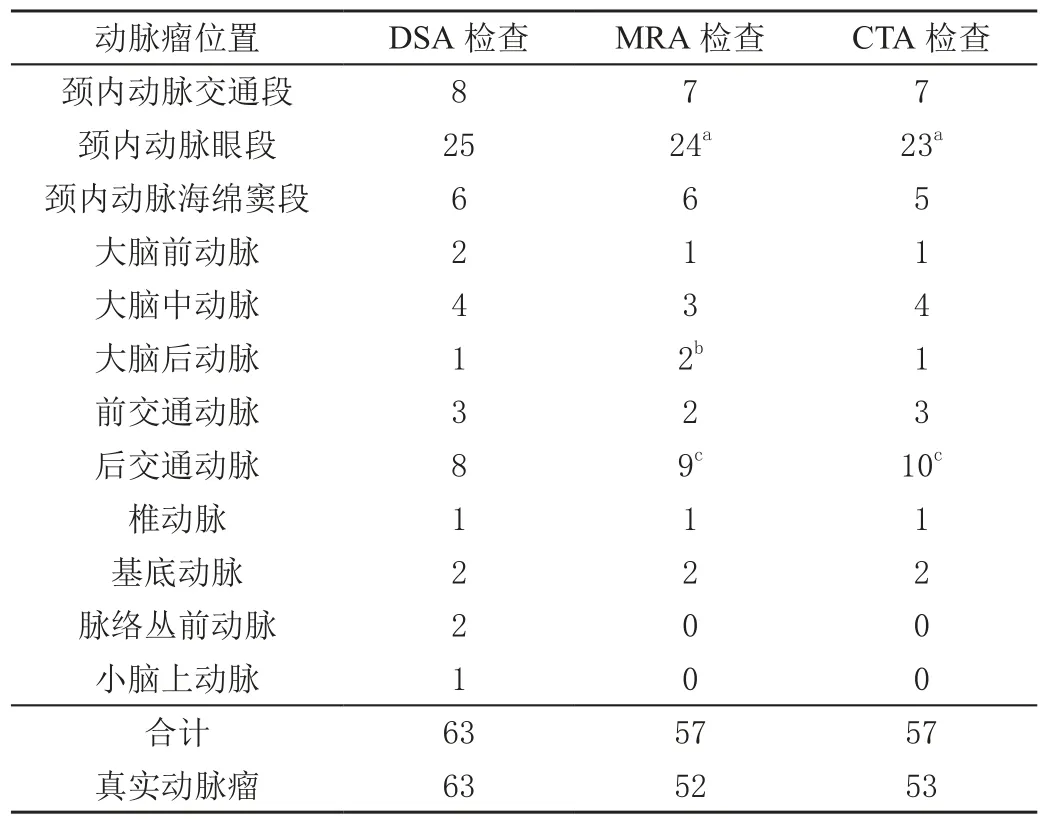
表1 DSA、MRA 和CTA 检出颅内动脉瘤的位置和数目单位:个
2.2 MRA 和CTA 对颅内动脉瘤瘤体最大径和瘤体颈宽测量结果的比较
在63 个颅内动脉瘤中,有44 个在DSA、MRA 和CTA 图像上均可清晰显示瘤体及瘤颈。DSA 与MRA、DSA 与CTA 以及MRA 与CTA 对动脉瘤瘤体最大径和瘤体颈宽测量值之间的比较,差异均无统计学意义(P>0.05)。见表2 ~表4。
表2 DSA 与MRA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)
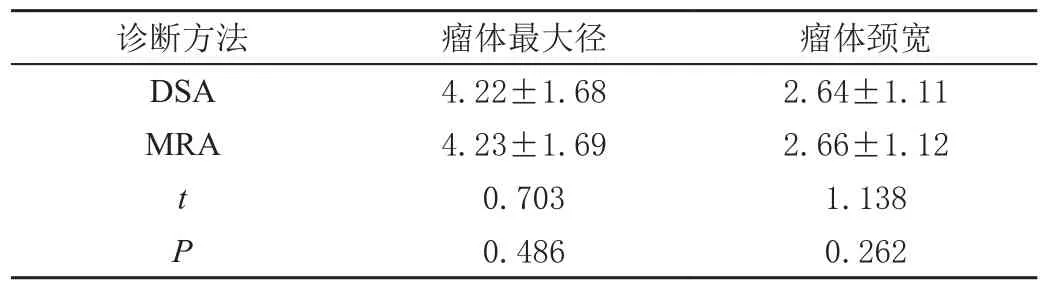
表2 DSA 与MRA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)
诊断方法 瘤体最大径 瘤体颈宽DSA 4.22±1.68 2.64±1.11 MRA 4.23±1.69 2.66±1.12 t 0.703 1.138 P 0.486 0.262
表3 DSA 与CTA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)
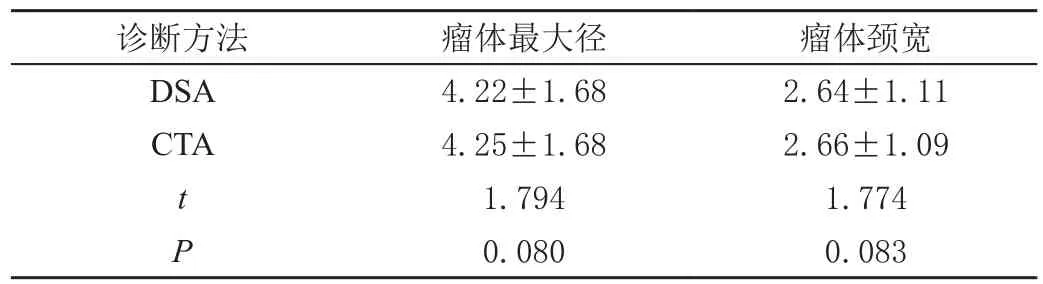
表3 DSA 与CTA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)
诊断方法 瘤体最大径 瘤体颈宽DSA 4.22±1.68 2.64±1.11 CTA 4.25±1.68 2.66±1.09 t 1.794 1.774 P 0.080 0.083
表4 MRA 与CTA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)

表4 MRA 与CTA 对瘤体最大径、瘤体颈宽测量值的比较(± s,mm)
诊断方法 瘤体最大径 瘤体颈宽MRA 4.23±1.69 2.66±1.12 CTA 4.25±1.68 2.66±1.09 t 1.386 0.503 P 0.173 0.618
3 讨论
颅内动脉瘤多位于大脑动脉环或动脉分叉处,一旦破裂会导致蛛网膜下腔出血,若不及时诊断治疗,会有再出血的风险[7]。因此,早期诊断并尽早对破裂风险高的颅内动脉瘤进行治疗是保障患者生命安全的关键。MRA 和CTA 是无创影像检查,能多方位成像,后处理功能强大,在临床诊疗中受到广泛关注和认可[8]。
本研究回顾性分析经DSA 确诊为UIAs 52 例患者的影像资料,共检出动脉瘤63 个,以DSA 结果为标准,MRA、CTA 的检出率分别为82.54%、84.13%,两者的差异无统计学意义(P>0.05),与文献报道一致[9]。MRA、CTA 对UIAs 具有较高的检出率,均可作为UIAs的筛查方式。MRA 主要通过血流与血管壁及周围组织的对比显示血管,其中3D-TOF-MRA 在进行脑血管扫描时,通过饱和效应、流入增强效应等得到薄层图像,空间分辨率相对高,且对血管细微结构的显示效果好[10]。CTA是通过对患者快速注射对比剂后采用多层螺旋CT 连续扫描获得原始图像,然后通过图像后处理软件重建获得脑血管、颅骨结构的三维立体图像,能够清晰显示动脉瘤的位置、大小、形态、瘤颈及其与周围组织结构的空间关系,且能够较好显示血管内的钙化、血栓形成等[11]。
MRA 和CTA 漏诊的主要原因是瘤体较小。文献报道[9,12],CTA 对较小动脉瘤(<3 mm)的灵敏度较低,为81.8%;对于直径<3 mm 的动脉瘤,MRA 诊断的灵敏度仅为74.1%。本研究中,MRA 假阴性的11 个动脉瘤,有10 个最大径<3 mm;CTA 假阴性的10 个动脉瘤,有9 个最大径<3 mm。MRA 假阴性的另1 个动脉瘤,位于前交通动脉,原因可能是局部管腔较细导致血流信号较弱;CTA 假阴性的另1 个动脉瘤,位于颈内动脉海绵窦段,原因主要是颈内动脉海绵窦段靠近颅底骨性结构,且该患者此部位的钙化斑块较多。MRA 和CTA 同时诊断假阳性的4 个动脉瘤,3 个位于后交通动脉,1 个位于颈内动脉眼段,DSA 证实均为动脉圆锥。MRA 诊断假阳性的另1 个动脉瘤,位于大脑后动脉,血管迂曲且存在多发狭窄,导致血流不规则,信号不稳定而误诊。
动脉瘤大小通常被认为与其破裂风险存在相关性[13]。本研究中,DSA 与MRA、DSA 与CTA 及MRA 与CTA对颅内动脉瘤瘤体最大径和瘤体颈宽测量值比较,差异均无统计学意义(P>0.05),与文献报道一致[4-7],表明MRA、CTA 均可获得较为精准的瘤体大小和颈宽,可指导临床选择合适的治疗方式。
随着无创影像学检查方法的普及,越来越多的UIAs被发现,但其自然破裂的风险较低。UIAs 手术干预的风险明显高于其自然破裂风险[14]。研究表明[9,12],对于破裂风险较低的UIAs,推荐不采取预防性手术干预而进行定期影像学随访。UIAs 定期随访大部分选择MRA、CTA[15]。但X 线辐射暴露限制了CTA 在长期随访中的应用,而3D-TOF-MRA 无电离辐射、无需注射对比剂,故在UIAs 患者长期随访中更为合适。
综上所述,3D-TOF-MRA 和CTA 在UIAs 的诊断中均具有较高的价值,但3D-TOF-MRA 是一种无电离辐射、无需注射对比剂的无创检查,且方便重复检查,图像后处理比CTA 简单、便捷。故UIAs 的筛查和定期随访首选3D-TOF-MRA。
