耐腐蚀镁合金的成分设计方法研究进展
2023-03-15王俊升田光元
张 弛,王俊升,2,李 鑫, 田光元,王 硕,苏 辉
(1.北京理工大学材料学院,北京 100081;2.北京理工大学前沿交叉科学研究院,北京 100081)
镁合金是工程应用中最轻的结构材料,由于其具有低密度、高比强度、高阻尼能力和易回收等优异的物理和化学性能,已经在航空航天、汽车、电子工业等领域得到了广泛应用,被认为是“21世纪绿色工程材料”[1–4]。据统计,飞机上使用的镁合金每减重1 kg,可节省1150美元的燃油消耗[5]。目前,美国的B–52H轰炸机,在起落架机轮、操纵系统等结构上使用镁合金材料超过900 kg[6];波音727飞机中包含大约1200个镁合金零件[3]。但是,镁的标准电化学势较低 (– 2.37 V),在航空航天等领域的极端工作环境下具有较差的耐蚀性能,极大地限制其大规模应用[7]。
镁合金耐腐蚀性差主要是因为合金内分布不均的第二相或杂质颗粒 (Fe,Ni,Cu和Co等)容易引发电偶腐蚀,以及合金表面的保护膜稳定性差[8]。目前,学者们提出了许多提高镁合金耐腐蚀性能的技术和方法,如表面改性技术,塑性加工变形技术等[7,9]。近年来,元素合金化逐渐成为一种提高镁合金耐腐蚀性能的有效方法[10],其主要通过调节合金内第二相的数量、种类和晶粒尺寸大小,以及控制杂质元素的含量来降低微电偶腐蚀发生的可能性,从而提高镁合金的耐腐蚀性能。本文主要从电化学方面回顾合金元素对镁合金腐蚀行为的影响,并总结近年来关于镁合金腐蚀动力学方面的第一性原理模型,期望为新型耐腐蚀镁合金成分设计提供指导。
1 镁合金的腐蚀机制
通常,镁及其合金的耐腐蚀性较差,主要有两个方面的原因[7–8,10–19]。
(1) 镁表面形成的薄膜保护性较差。在干燥环境中,镁的表面会形成一种薄的氧化物膜 (MgO)[12]。在潮湿水环境中,镁表面膜由内部致密的MgO纳米晶和顶部疏松多孔的Mg(OH)2层组成[13]。在酸性条件下,镁表面形成的保护膜易溶于水[14]。在强碱环境下,Mg(OH)2微溶于水,可以起到一定的保护作用。但当溶液中出现离子时,如Cl–、以及等会对镁合金的腐蚀性能产生较大的影响[15]。离子浓度越高,腐蚀速率越快,尤其是离子半径小的活性阴离子,如Cl–,它能够优先地、有选择地吸附在表面膜上,将表面的 Mg(OH)2保护性膜层转变为易溶的 MgCl2,破坏膜层结构,促进镁腐蚀的发生[16]。不仅如此,当表面膜被破坏后,Cl–还能继续与镁基体的表面原子作用形成化学键,降低表面镁原子的稳定性,使表面镁原子快速溶解[17]。近年来,Cao等[18]发现碱性环境下能够穿过疏松多孔的Mg(OH)2层,并与内层的MgO发生反应,破坏膜结构,导致高速腐蚀的发生。在标准人造海水中,Cao等[19]发现可以在镁表面膜吸附,并取代部分Cl–。由于对镁的腐蚀作用要比Cl–弱,纯镁在人造海水中的腐蚀速率比在质量分数为3.5 %的NaCl溶液中降低约一半,此现象为部分阴离子和阳离子在人造海水中对镁腐蚀抑制作用提供了可靠依据。
根据Pilling–Bedworth原理,即在氧化过程中,镁合金表面形成的膜体积VMO比生成这些膜所消耗的金属体积VM大 (VMO/VM>1)时,表面膜具有保护作用。镁合金表面形成的表面膜PB比为0.81,小于1,不能完全覆盖表面[15–16]。即使某些元素 (如Ti、Al和Cr)可以形成PB >1的氧化膜,但其氧化物在水中的溶解度很高,保护膜容易被破坏,造成了镁合金与腐蚀介质接触,导致其耐蚀性能较差[13]。
(2) 镁的电化学活性强[8],在镁基体与第二相或杂质之间存在电位差,混合后容易发生微电偶腐蚀,在镁表面会发生阳极溶解并形成Mg2+,对应的阴极发生还原反应形成氢气。镁合金的腐蚀主要分为镁的阳极溶解反应和阴极析氢反应,这两个动力学过程决定了镁合金腐蚀速率的快慢。
镁合金的腐蚀是一个动力学问题,在水环境中的腐蚀机理十分复杂,到目前为止,普遍认为镁及镁合金溶液腐蚀机制是一种物理与化学过程,如图1所示。式 (1)为镁的阳极溶解,产生的电子在阴极反应 (式 (2)或(3))中被消耗,从而生成氢气,其反应式为[20–22]

图1 镁基体的腐蚀反应机理Fig.1 Illustration of the corrosion reaction mechanism on Mg substrate
在腐蚀反应过程中,镁合金的阳极反应和阴极反应动力学可由Butler –Volmer方程表示[23]
式中,iAnode和iCathode分别为镁阳极反应和阴极反应的电流密度;i0为平衡交换电流密度;n、F、R和T分别为电极反应得失的电子数、法拉第常数、理想气体常数和温度;α和β为阳极反应和阴极反应的传递系数;U和Ue为外加电极电位和平衡电极电位。
从方程式中可以发现镁阳极反应电流密度呈指数升高,阴极析氢反应电流密度呈指数下降。然而,试验上观察到镁阳极溶解速率升高的同时阴极反应速率也会增加,这种现象被称为镁合金阳极极化的异常析氢现象[24]。即在镁阳极溶解反应过程产生的一部分电子不通过恒电位仪达到对电极 (阴极),直接在镁的阳极部位用于析氢反应,不遵循法拉第定律,无法通过电化学方法计算阳极极化镁的溶解量。目前对镁阳极极化异常析氢现象的解释主要有3种理论。
(1) 单价镁 (Mg+)理论[25–26]。该理论认为单价镁离子Mg+是镁阳极溶解反应的一个中间产物,即金属镁首先被氧化成一价镁离子:
由于单价镁离子不稳定,寿命极短,很快就会被水进一步氧化成二价镁离子,即
根据这两个反应可以看出,随着镁溶解速率的增加,产生更多的单价镁离子Mg+,与水反应增加了析氢速率,从而解释了镁阳极溶解过程中的异常阳极析氢现象。但是单价镁离子Mg+是一个假设模型,如果在溶液中存在,它将具有小于微秒级的寿命及较强的活性[24]。目前,在试验方面还没有直接证据能够证明单价镁的存在。
(2)表面腐蚀产物与杂质聚集理论[27–30]。试验中观察到镁在NaCl等溶液中容易发生腐蚀,在其表面会有腐蚀产物的形成与生长以及杂质元素的富集,它们对析氢反应具有催化作用。但是在酸性条件下,表面薄膜几乎不存在,仍然能够观察到异常析氢的现象[28]。同时,杂质在表面的聚集效率较低,试验上通过对高纯度的镁腐蚀发现,随着阳极极化的进行,析氢反应速率仍然很高[29–30],出现异常析氢现象。这说明表面腐蚀产物与杂质元素富集对镁阳极极化过程中的异常析氢现象贡献有限。
(3) 催化活性增强理论[24,31]。根据式(4),描述阴极反应动力学的Butler –Volmer方程可知,当外加电位远大于平衡电位时,镁的腐蚀主要受交换电流密度的影响,试验表明,随着阳极电流或者电位的增加,表面腐蚀产物和富集的杂质元素对腐蚀的作用相对较小[27–30],即镁阳极极化过程中增加的交换电流密度作为析氢速率加快的原因。
交换电流密度反映一个特定的界面体系的动力学性质 (包括氧化还原半反应种类以及电极表面特征)。通常,在平衡的纯活化控制的界面体系中,假定其交换电流密度为常数。然而,镁表面的阳极溶解反应是一个非平衡过程,催化活性增强理论表明,在镁阳极极化过程中,表面镁原子快速溶解,阴极反应的活性持续增加,引起阴极反应动力学公式中的交换电流密度持续增大,最终产生异常析氢现象。这种异常析氢现象是在阳极溶解的区域发生的,单位时间内增加的腐蚀面积越多,交换电流密度增加越大,析氢速率加快[24]。这表明镁的阳极表面对析氢具有催化作用。然而,目前还缺乏对镁异常析氢现象更全面的认识,需要更多的试验证据来验证。
综上,镁的溶解机理是一个复杂的过程,其中不同的参数 (如阳极溶解区域、腐蚀产物形成和表面杂质元素聚集)都可能影响腐蚀过程。近年来,一些试验和模拟上的相关研究表明[32–34],异常析氢反应受阳极溶解区域的影响,但仍需深入研究镁阳极极化过程中所有影响因素对异常析氢的影响,更进一步解释镁腐蚀的作用机理。
2 镁合金的腐蚀类型
2.1 电化学腐蚀
目前常见的镁合金中,存在多种腐蚀的类型,如电偶腐蚀,点蚀,丝状腐蚀等,其腐蚀机理一般会涉及一些电化学的腐蚀过程,因此本文把与电化学有关的镁合金腐蚀行为归为一类并分别阐述。
(1)当合金元素超出镁基体的最大固溶度时,通常会与镁形成不同种类的第二相 (Mg17Al12,MgZn2,Mg3As2,Mg2Ge,Mg2Si,Mg12Ce,Mg24Y5等)[11,24]。但镁的电化学活性强,镁基体与合金元素形成的第二相之间存在电位差,常作为阳极相和阴极相产生腐蚀电流并造成镁合金腐蚀,此腐蚀现象称为微电偶腐蚀[35–38]。图2展示了镁合金体系中常见金属间化合物与镁基体间的电极电位差[8,36–38]。可以发现,除Mg2Ca等少数第二相以外,大多数第二相的腐蚀电位都比纯镁高。因此,通常条件下镁合金中的镁基体会发生阳极溶解,而第二相则会作为局部阴极促进腐蚀,每种第二相引起的阴极反应动力能力随其组成、结构和分布状态的不同而变化。值得注意的是,近年来发现Mg – RE合金中的部分第二相能够充当微阳极相 (如Mg12La),会在初始腐蚀阶段优先溶解[10]。Azzeddine等[10]提出镁合金中可能发生腐蚀的3个过程:阳极相的溶解、Mg基体的溶解和随着溶解的加剧出现的点蚀[33]。

图2 镁合金中不同金属间化合物与镁基体间的电极电位差[8,36–38]Fig.2 Volta-potential difference of different intermetallics with matrix for magnesium alloys[8, 36–38]
从腐蚀的角度来看,镁的电化学活性较强,合金元素无论固溶于镁中或形成第二相,均会导致镁合金表面的阴极和阳极的局域化,电化学分布不均匀,导致严重的电偶腐蚀。另外,影响电偶腐蚀的因素还有很多,如第二相的种类、含量、晶体取向、晶粒尺寸以及工作环境 (pH值、温度等条件)等。因此,设计新型耐腐蚀镁合金逐渐成为一种挑战。可以通过合理设计镁合金中添加合金元素的含量和种类,调控镁基体和第二相之间的电位差,以此获得耐腐蚀性能强的镁合金。如Zhao等[39]通过密度泛函数理论 (DFT)计算镁合金中不同含量Sc元素和Y元素的功函数,来反映纯镁和掺杂元素后镁合金间的电势差,从而设计制备了一种高耐蚀的Mg–Sc–Y三元包晶合金,同时也为理论指导试验设计提供了一个新思路。
(2) 镁的点蚀是一个表面膜被破坏和电化学腐蚀的过程,它是镁合金中一种常见的局部腐蚀形式,因为孔径小、腐蚀速率快和容易被表面产物覆盖等原因,在检测中很难被发现[35,40],产生的主要原因是[35,40–41]:镁合金表面形成的保护膜疏松多孔,表面存在一些非金属夹杂物以及位错等缺陷,镁合金的表面膜在氯盐等环境下容易被破坏;裸露的镁基体与第二相或钝化膜之间形成大阴极–小阳极型原电池,且阴极与阳极的面积比相对较大,镁基体很快被腐蚀成小孔。因此,点蚀的发生主要与保护膜的稳定性,外部环境和第二相有关。如在Mg – 0.41Dy和Mg – 1.43La的合金中[10],镁合金表面分别被Dy2O3和La2O3的氧化膜所覆盖,前者的形成焓低、结构较稳定,后者的氧化膜更容易被破坏,导致腐蚀的发生。而添加Li元素则能够在镁合金表面形成稳定的碳酸盐保护膜,可以有效预防点蚀的出现[42]。Li等[43]则在Mg – 0.9Zn – 1.6Y合金的基体中观察到高密度的腐蚀点[42],发现腐蚀优先出现在镁基体和第二相界面处。
(3)丝状腐蚀[35,41,44–46]是由穿过晶界表面运动的活性腐蚀电池引起的,头部是阳极,尾部是阴极,在保护膜下的金属表面上移动且具有明显的蠕虫状外观。镁的丝状腐蚀可以看作是一个电化学腐蚀的过程,并伴随着保护膜的破坏。其主要在一些薄弱部位出现,如晶界、缺陷和其他应力集中的部位,并沿着与镁基体相邻的第二相开始。Williams等[45]通过原位观察纯镁在盐水中的腐蚀行为,并提出了一种丝状腐蚀模型,认为随着腐蚀丝的延伸,腐蚀丝前端镁基体会发生阳极溶解反应,而被腐蚀的区域为阴极。此时头部的镁基体逐渐转变为腐蚀产物Mg(OH)2并沉积在表面,失去阳极活性转化为阴极,与薄膜下未发生腐蚀的镁基体组成新的微电偶,使丝状腐蚀不断扩展[44]。目前学者们通过试验在许多镁合金中观察到的丝状腐蚀的现象,如Mg – Al – Gd、Mg – Mn – Ca等[41]。Bahmani等[8,47]发现在Mg – Mn – Ca合金中,Mg2Ca可以作为阳极相替代镁基体的溶解,延缓丝状腐蚀的发生;当Mg2Ca相完全溶解后,镁基体无法得到保护,腐蚀会逐渐在镁合金表面扩展。
2.2 应力腐蚀
镁合金应力腐蚀[9,16,48]是一个电化学腐蚀和机械破坏的过程。是指外加应力作用下,镁合金因局部塑性变形而导致表面膜发生破裂,裸露出镁合金表面与溶液接触发生快速溶解,形成局部腐蚀并引发应力集中,促进了裂纹的萌生和扩展。材料应力腐蚀的基本条件[16]: (1)是材料在冶炼或构件装备过程中存在残余应力; (2)需要有对应力腐蚀敏感的介质,即构成应力腐蚀需要材料和介质相互结合,如镁合金在含有Cl–等活性阴离子介质和内应力共同作用下,容易发生应力腐蚀开裂,以及含Al的镁合金具有强烈的应力腐蚀敏感性。Luo等[49]发现Mg – 6Gd – 2Y – 0.2Zr合金很容易在由小晶粒组成的区域腐蚀。本文提出小晶粒的晶界多,在外加拉应力下会造成更多的区域产生拉伸应力,引发应力腐蚀。
目前,学者们对镁合金应力腐蚀机制进行了大量研究,认为除了外界环境因素外,应力腐蚀开裂主要由晶界上析出的应力敏感的第二相 (如Mg17Al12) 以及裂纹尖端易出现的微电偶腐蚀增大镁合金应力腐蚀的敏感性[16]。
其中裂纹尖端处出现的微电偶腐蚀机制主要分为阳极溶解机制和氢致脆化机制[9]。前者是外加应力作用下,表面被破坏,裸露的镁基体发生阳极溶解,促使裂纹沿第二相基体扩展,直至断裂失效;后者则是认为镁合金在阴极析氢并在材料的缺陷处富集,导致裂纹发生脆化,在外加应力条件下容易发生开裂。
综上所述,镁合金腐蚀的类型都有一个共同的特点,在镁合金的保护膜被破坏后,腐蚀的发生主要是由镁基体相与第二相之间存在的电位差引起的不同局部电流密度造成的,所以控制镁合金中合金元素的含量以及掌握它对镁合金第二相的形成和分布等因素的影响是至关重要的。
3 元素对镁合金腐蚀行为的影响
元素对镁合金的耐腐蚀性能有很大的影响,镁合金中存在不同种类的元素,对镁合金耐腐蚀作用的差异化较大。因此,合理的添加元素对提高镁合金的耐腐蚀性能至关重要。镁合金中元素对耐腐蚀性能的影响主要与其在镁中的溶解度有关。不同溶解度的元素,在镁合金中会形成不同种类的第二相 (金属间化合物、颗粒、杂质等),它们对镁合金的腐蚀速率具有不同的影响。目前,学者们探索了不同种类元素在镁中的最大溶解度及其对镁合金耐腐蚀性能的作用。根据元素在镁合金中溶解度,分别介绍其对镁合金腐蚀行为的影响。
(1)完全不溶于镁的元素。如Fe元素,不能固溶于镁,它会以金属铁的形式分布于镁的晶界上,并作为阴极与镁基体形成微电偶,降低镁的耐腐蚀性能。目前,试验上发现可以通过添加Mn元素来降低Fe元素在镁中的腐蚀作用。主要是因为Mn能够包裹镁中的Fe元素,实现“清除杂质”的功能。这个能力主要与Fe/Mn在材料中的比例有关[50],须在0.032的范围内[51],而较大的Fe/Mn比会急剧增加合金的腐蚀速率[52]。
(2) 在镁中形成固溶体的元素。 当添加的合金元素低于它们在镁中的最大溶解度时,可以与镁形成固溶体,影响镁的耐腐蚀性能,如Cd、Sn、Y、Ca、Gd、Ga、In等元素[53–59]。当元素固溶于镁时,Liu等[54]发现Pb和Sn能显著降低镁的阴极反应速率,提高镁的耐腐蚀性能。Zhao等[39]通过DFT分别计算固溶Sc或Y元素的镁合金功函数,发现两者间的功函数差值较小,可以有效减缓镁合金中的电偶腐蚀作用,并在此基础上设计出新型的耐腐蚀Mg – Sc – Y合金。另外,As元素还能够固溶在镁表面富集的纯铁相中,能够有效抑制富铁相的阴极析氢反应速率,减缓镁合金的腐蚀[56–59]。
(3) 与镁形成金属间化合物的元素。当添加的元素超过在镁中的最大溶解度时,合金元素会与镁形成金属间化合物。然而,镁合金中形成的金属间化合物 (第二相)与镁基体相存在电位差,会形成腐蚀电流,导致镁合金腐蚀产生。
除了少数第二相外 (Mg2Ca相),大多数合金元素形成的第二相电极电位比纯镁高[8,24],容易作为阴极相加速镁合金腐蚀。如Y、Sn、Ce、Cu、Al、Ni、Co、Zn、Nd等元素可以在镁合金中与镁形成不同种类的第二相:Mg24Y5、Mg2Sn、Mg12Ce、Mg2Cu、Mg17Al12、Mg2Ni、MgCo2、MgZn2、Mg12Nd等[24]。这些元素形成的第二相主要作为阴极相与镁基体组成微电偶,加速镁合金的腐蚀。它们之间的区别是不同种类相的自腐蚀电位和腐蚀电流存在差异[24],会导致镁合金出现不同程度的腐蚀现象。如Mg17Al12、Mg24Y5、Mg12Ce等第二相作为比较常见阴极相,它们在不同程度上促进了镁合金的阴极析氢反应[11,60–61]。然而,Cu、Ni、Co则能够在镁合金中形成较强局部阴极相Mg2Cu、Mg2Ni和MgCo2,严重影响镁合金的耐腐蚀性能,学者们通常把它们作为有害相[11]。
同时也存在一些元素,它们与镁形成的第二相可以通过降低阴极反应速率,有效改善镁合金的耐腐蚀性能,如Mg2Ge、Mg3As2等[24,54,56,57,62]。在模拟计算方面,Luo等[62]通过DFT发现Mg2Ge相可以有效毒化纯镁中氢的吸附位点,抑制阴极析氢反应的进行。试验方面,Liu等[54]报道了质量分数0.3% 的Ge元素添加到镁合金中形成的Mg2Ge相可以有效抑制合金中的阴极反应动力学,极大地提高了镁合金的耐腐蚀能力。同时,学者们发现Mg3As2也具有抑制镁合金阴极反应的潜力[56,57]。
除此之外,Zn、As、Ca、Sm等元素会优先与除镁之外的其他元素形成第二相[11,57,63–65],以此控制镁合金耐腐蚀性能。如Ca元素可以与镁合金中的Al元素优先形成Al2Ca相,作为阳极优先溶解保护镁基体,延缓腐蚀[63];As元素在AZ91合金中能够与镁形成Mg3As2相,抑制阴极反应,也能导致Mg17Al12相含量下降且不连续,从而影响镁的耐腐蚀能力[57]。
(4)除了以上与溶解度有关的元素类型外,还存在一些元素,它们能调控表面膜稳定性。镁合金表面膜疏松,不利于腐蚀的防护。而元素添加到镁合金中形成稳定的保护膜也逐渐成为提高合金耐腐蚀能力的一种手段。不同合金元素在镁合金表面形成的保护膜特性有着巨大的差异,如Li、Dy、La、Zr等元素[10,42]。Li元素在含量较少时,其主要固溶在镁的基体相中;当Li含量(质量分数)大于11%时,会形成体心立方结构的镁基体相,且合金表面形成一层碳酸盐的保护膜[42],该表面膜依靠某些临界合金溶解产生表面富集的锂,然后再通过化学反应形成主要由难溶的碳酸锂组成的表面膜,阻碍镁合金的阳极溶解。前文中提到的Dy和La元素,由于Dy2O3和La2O3的氧化膜稳定性不同,耐腐蚀能力也有区别[10]。因此,镁合金表面的保护膜也是至关重要的,其腐蚀行为很大程度上取决于保护膜的特性。加强合金元素对保护膜调控方面的研究是一种提高耐腐蚀能力的有效途径。
综上所述,合金元素在镁合金中主要形成不同种类的第二相,对镁合金耐腐蚀性能的影响具有重要的作用。目前对耐蚀镁合金开发的研究严重不足,虽然大量的研究报道了不同组分镁合金的腐蚀机理,但探索设计新合金的工作仍然局限于以前的合金体系,亟待新型镁合金的系统研究。
4 计算机模拟在镁合金腐蚀中的应用
镁合金中的合金元素种类繁多,学者们主要通过添加不同种类的合金元素来调控第二相的种类、数量、组织形态等,从而降低电偶腐蚀的影响,提高镁合金耐腐蚀性能。但相关镁合金腐蚀方面的研究大多数集中在试验测试方面。而试验成本高,周期长且试验过程中会受到周围复杂环境的影响,测量结果存在误差,在一定程度上限制了耐腐蚀镁合金的发展。计算模拟的方法能够从原子层面上分析解释镁合金腐蚀与材料成分、结构之间存在的关系,为试验上提供理论指导,从而节省大量时间和生产成本。
4.1 第一性原理在耐腐蚀镁合金中的应用
DFT方法已成为用于表征镁合金腐蚀机理的一种有效工具,如表1所示[66],该方法能够很好地反映材料的原子结构和物理化学性质[66],近年来得到了快速发展。在DFT计算方面,学者们计算了固溶后镁合金表面的功函数、空位形成能、氢吸附能和表面能等参数的变化来快速筛选可以提高镁合金耐腐蚀性能力的合金元素[67],同时也建立了纯镁腐蚀的阴极析氢反应和阳极溶解反应模型,从获得的热力学和动力学数据来预测镁合金的腐蚀行为[53,62,68]。
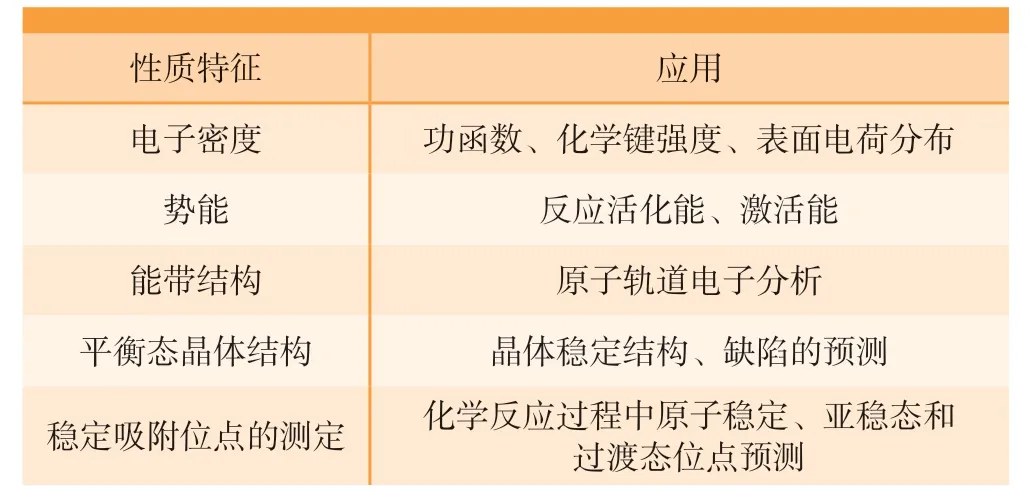
表1 典型的DFT计算模拟方法[66]Table 1 Typical outputs of DFT calculation and its application[66]
在阴极析氢方面,关于溶质原子对纯镁析氢反应速率的影响,学者们做了大量的研究。在2005年,Nørskov[69]和Greeley[70]等基于第一性原理建立了析氢反应交换电流密度和氢原子吸附能的简单动力学模型。Taylor等[71]在此基础上开发了纯镁的电偶腐蚀模型,该模型与纯镁的试验极化曲线非常吻合。Zhang等[56]研究了合金元素在合金中对氢原子吸附能的影响,发现As和Ge等元素能够抑制阴极相的析氢反应速率。Ma等[68]利用第一性原理分析了酸性条件下纯镁腐蚀的3个重要析氢反应 (Volmer反应、Tafel反应和Heyrovsky反应),发现镁腐蚀的析氢速率主要由氢原子吸附能决定。而在碱性环境下,罗哲[72]提出镁的腐蚀主要由镁表面水的分解能垒、氢原子吸附能和羟基吸附能决定。
在阳极溶解方面,学者们主要偏向于研究合金元素对镁的功函数和表面原子键结合能的影响[73–76],能够反映出表面材料的电子转移和溶解能力。Luo等[17,72]计算了局部电极电势和表面功函数筛选能够抑制镁基体阳极溶解的溶质原子,并建立了混合电位理论模型,分析了镁合金的电偶腐蚀行为。Ma等[53]利用第一性原理建立了镁基体阳极溶解反映过程中的电极电位和电流密度的关系,能够在一定程度上通过理论计算的方法实现宏观腐蚀行为的预测。除此之外,镁腐蚀行为非常复杂,其他因素也会影响腐蚀行为,如表面Cl–的吸附[17,76–77]、孪晶界[78–79]、晶向[49,79–80]等。本文主要针对镁合金腐蚀行为的第一性原理计算模型进行归纳总结。
4.1.1 第一性原理的热力学计算
合金元素是影响镁合金腐蚀行为的最重要因素之一。合金元素的加入可以显著改变镁表面的物理和化学性能,主要改变镁表面原子结构和电子分布状态,从而对镁表面的热力学稳定性产生不同的影响[81–85]。例如,合金元素的添加能够改变周围镁原子逃离表面所需的能量,在一定程度上能够反映镁表面的阳极溶解过程[85]。而表面电子的重新分布,不仅能够影响镁表面的电偶极矩,引起镁电极电位的变化[17,86],也可以影响表面H原子的吸附能,改变阴极析氢反应的速率[81]。本节通过讨论表面能、替换能、功函数、空位形成能和H的吸附能,解释固溶元素对镁表面热力学稳定性的影响,以此来揭示合金元素对镁阳极溶解和阴极析氢反应的影响。
表面能和替换能常被用来评估固溶原子在固体表面的热力学稳定性,能够反映出合金元素固溶到表面的难易程度[81,84]。较低的表面能或替换能表明原子更偏向于在表面固溶而不是偏聚[81]。金属的表面能主要受表面电子密度影响[87–88]。Skriver等[87]发现过渡态金属表面能随原子核外电子总数呈抛物线变化。学者们还提出表面能和功函数均与固体表面电子密度分布有关[87–91],发现表面能与功函数在不同晶向下成反比,较高功函数的表面具有很强的束缚电子能力和低的表面活性,可能是引起合金表面能低的原因。
功函数被认为与腐蚀电位呈正相关,通过计算功函数可以达到预测腐蚀电位的目的[72]。功函数是指电子从固体表面转移到真空处所需的最小能量,能够判定电子从表面逸出的难易程度。Zhao等[39]通过DFT分别计算固溶Sc或Y元素的镁合金功函数,发现两者间的功函数差值较小,可以有效减缓镁合金中的电偶腐蚀作用,并在此基础上设计出新型的耐腐蚀Mg – Sc – Y合金。另外,功函数较低的镁表面,束缚表面的电子能力较弱,通常电子转移能力较强,且固溶元素周围的电子密度较大,这会影响一些表面反应发生改变,如H/OH的吸附、水的分解等[81,85],影响镁表面的析氢反应。
功函数的变化不仅与表面电子转移的方向和数量有关,也主要受表面电子的重新分布控制[86]。因此,合金元素的电负性在一定程度能够影响功函数的变化[85]。例如,当合金原子的电负性高于镁时,周围相邻的镁原子将电子转移给合金原子。这会引起合金原子带负电,使镁表面产生一个负的电偶极矩,从而提高功函数[17,86]。需要注意的是,电负性较高的As和Ge元素,功函数变化不大甚至降低,主要是因为其具有较小的原子半径,在金属表面会向内部收缩,与金属表面产生一定的距离[85]。这种现象对合金元素产生一个空间阻碍效应[92],降低金属表面束缚电子的能力,导致功函数提升不明显。因此,可得功函数变化受合金元素的电负性和原子半径影响。
镁表面的阳极溶解过程主要包括电子的转移和原子脱离表面这两个过程[72]。通过计算合金元素周围镁原子的空位形成能在一定程度上能够反映原子逃离表面所需要的能量,也可以作为判定镁表面阳极溶解过程的指标[17,85]。其中空位形成能所需要的能量越大,表面镁原子越不容易逃离表面。镁表面固溶后的原子通过改变表面原子的结构排列和电子密度分布状态[85],来改变固溶原子周围近邻的镁原子脱离表面所需的能量。如图3所示,为固溶Al元素后的镁表面原子坐标,可以发现表面Al原子具有向晶体内部收缩的趋势。通过计算不同固溶原子与表面镁原子的垂直距离,发现这种空间距离的变化趋势与固溶原子的半径大小的分布趋势保持一致[85]。原子半径越小,固溶原子越趋向于向晶体内部扩展。而这种表面原子结构的重新排列,会造成表面应力分布的改变,从而影响表面不同位点的镁原子(第一近邻和第二近邻)空位形成能发生改变。Ghosh[93]也提出空位形成能受应变体积分量的影响。除此之外,作者团队通过计算差分电荷密度和晶体轨道哈密顿布居 (Crystal orbital Hamilton population,COHP)[94],发现固溶后的镁表面电子密度重新分布能够引起Mg–X键能的变化,造成表面镁原子逃离表面的能量发生变化[17]。Ke等[66]提出计算原子间键的结合能是判断金属材料溶解速率快慢的关键。研究者通常把结合能设定为常数[53],或者通过DFT计算不同原子间的键能来反映原子间相互结合能力[17,72]。Luo等[17]通过DFT计算得到了元素在纯镁表面掺杂后原子键结合能力的强弱,发现Zr和Mg之间有很强的结合能力,为了使表面的镁原子逃离表面,则需要更高的能量,提高了镁的耐腐蚀能力。

图3 固溶铝元素的镁表面原子坐标[85]Fig.3 Atomic coordinates on Al-doped Mg surface[85]
镁合金的腐蚀过程包括阳极溶解和阴极析氢反应,前者涉及电子转移和表面原子的溶解,后者主要为H原子的吸附和脱附过程。阴极析氢反应在镁合金腐蚀中同样起着至关重要的作用,它具有3种基础反应,即Volmer反应、Heyrovsky反应和Tafel反应,相关反应式如下[68,72]。
式中,H*是表面吸附的氢原子。从式中可以看出,阴极析氢反应主要分为两步进行[68]。第1种为酸性水溶液中的H+得到镁表面转移的电子,变成H原子吸附在电极表面,与Volmer反应有关;另一种为氢气的形成。两个吸附态的H原子相互靠近生成氢分子,或者溶液中的H+得到电子并与吸附态H原子结合形成氢分子,然后氢分子脱附形成氢气,即Heyrovsky或Tafel反应。因此,阴极析氢反应主要由Heyrovsky反应和Tafel反应控制[68]。
无论是Heyrovsky反应或Tafel反应,氢原子在表面的吸附是析氢反应中必然存在的状态[72]。近年来,大多数DFT计算模型通常计算材料表面氢的吸附自由能作为金属腐蚀速率的参考标准[56,69,70]。当氢原子吸附能过大时,在表面吸附困难,需要克服较高的能量势垒,导致阴极反应速率下降;当H原子吸附能为负值,H原子容易吸附在电极表面,但会导致H原子脱附困难。根据Nørskov[69]和Greeley[70]等的火山图可以发现,阴极析氢反应的交换电流密度与氢原子的吸附自由能密切相关。当H原子吸附自由能接近于零时,交换电流密度最大,阴极析氢反应速率最快。因此,可以通过合金元素控制镁合金表面氢原子吸附能的大小,增加或减缓阴极位点的析氢反应速率,从而达到控制镁合金腐蚀速率的目的[72]。在纯镁的 (0001)表面,H原子在HCP或FCC位点吸附能相对较低。通过固溶不同的合金元素,发现H原子容易吸附在Y元素周围的第一近邻的FCC位点,而对于Al元素,H原子更容易在其第二近邻的FCC位点吸附[85]。这些合金元素主要是通过控制局部区域的电子分布来控制氢原子的吸附位点,其中氢原子更容易在电子束缚能力较弱的区域吸附。Zhang等[56]通过计算氢原子吸附能筛选出了68种合金元素,发现As和Ge等元素对镁合金中的富铁相具有良好的抑制阴极反应的效果。
在碱性环境中,析氢反应的速率主要是受水解的能垒、羟基的吸附能和氢原子吸附能绝对值的影响。Williams等[82]通过DFT计算了水分子、H和OH在纯镁上的稳定吸附位点。Limmer等[83]更进一步分析了掺杂元素对镁腐蚀的影响,并计算了H和OH的吸附能、水分解的反应能、表面能和功函数,发现Al、As、Cd、Ga、Ge、In、Si、Sn、Sb和Zn可以降低阴极的析氢反应速率。Yuwono等[81]提出了Ge和Sb掺杂在镁表面上可以降低阴极反应中的某些步骤来提高耐腐蚀性。但以上研究仅为合金元素在镁表面的掺杂,关于合金元素对第二相的影响仍不明确。
近年来,学者们建立了Mg – Ge合金中Mg2Ge相的电偶腐蚀模型[36,62,72],计算了水分子、H和OH在Mg2Ge相的最稳定的吸附位点,对比吸附能量发现OH在Mg2Ge相表面的吸附能为负值,而H的吸附能为正值,使吸附位点被OH占据,而H原子吸附的空余位点较少,抑制了析氢反应。Sumer等[55]也对Mg17Al12相进行了类似的研究,取得了良好的成果。目前,在计算第二相对镁合金腐蚀能力影响方面的工作研究不多,此模型的建立能够快速筛选出镁合金中析氢反应速率较慢的合金相,为新型镁合金的设计提供了一种新思路。然而,关于析氢反应中涉及的物理化学过程仍需进一步的分析,如第二相表面吸附水分子的亚稳态、稳定吸附位点以及水解吸附产物,表面电荷的转移等问题。
因此,在镁合金腐蚀领域,第一性原理计算在筛选合金元素方面具有很强的优势,可以通过计算表面能、功函数、空位形成能和氢吸附能等热力学参数来判定合金元素对镁腐蚀的影响,从而节省试验成本,为设计新型耐腐蚀镁合金提供帮助。
4.1.2 第一性原理的动力学计算
由于腐蚀行为非常复杂,许多因素会影响腐蚀行为[17,53,56,78–85],大部分学者通过计算功函数或表面能等定性分析来反映合金的耐腐蚀能力[17,56,85]。Ma等[53]考虑了晶体取向、空位缺陷和离子吸附的影响,建立了金属阳极溶解行为的动力学模型。该模型通过第一性原理计算功函数和表面能密度,成功确定了电极电势与交换电流密度之间的关系。此方法的提出可以在一定程度上通过第一性原理计算来预测宏观腐蚀行为,方程式为[53]
式中,n为电极反应过程中转移的电荷数;α为传递系数;ρ是表面能密度;F、K、T、h、R分别为法拉第常数、波尔兹曼常数、绝对温度、普朗克常数和气体常数;ΔG0是反应活化能;φ是功函数;Esurf、Evac、Ead分别为表面能、空位形成能、吸附能。
从式(11)可以看出,纯镁的阳极溶解主要影响因素是反应活化能、功函数以及表面能等因素。其中反应活化能与材料的本身特性有关,代表着镁原子化学键断裂脱离表面进入溶液或真空中所需能量的大小,反应活化能越大,反应越难进行;而表面能量密度则代表着阳极溶解反应化学能垒的大小,其值越小交换电流密度越低;另外,功函数的提高能够加强材料的电极电位,表面电子束缚能力增强,平衡绝对电位越高,交换电流密度越大;功函数大小应与镁基体相差不大,才能降低腐蚀电位差。
在阴极析氢方面, Ma等[68]通过第一性原理建立了氢的吸附自由能和溶液中pH的变化与交换电流密度关系的模型。针对3种不同的反应机制,同时考虑了氢吸附能和溶液pH值的共同作用,通过此动力学模型筛选发现,Al、Zn、Cu和Ga等元素添加到镁基体后,可以降低表面吸附氢原子的自由能,加速镁基体的阴极析氢反应速率。
综上所述,第一性原理计算在解释镁合金微观腐蚀机理方面具有重要的意义。近年来,已经发展出许多镁合金腐蚀方面的计算模型,主要分为阳极溶解模型和析氢反应模型。这些模型可以有效地分析合金元素对镁合金耐腐蚀性能的影响,对筛选耐蚀合金元素和设计新型耐腐蚀镁合金提供帮助。但是目前的理论主要集中在研究合金元素对镁基体表面腐蚀的动力学影响方面,但是合金化会改变镁表面的电子转移、电子密度分布和应变状态,因此可能会造成局部范围内H和OH吸附能的阶梯型变化,这些细节的变化方面仍是不明确的。另外,在第二相、表面保护膜等方面的研究较少,仍需要进一步的拓展研究;并且以上模型局限于理论模型的研究,在理论指导试验方面还有待加强。
4.2 分子动力学模拟在镁合金腐蚀中的应用
在潮湿环境中,镁合金表面上的水滴可作为加速腐蚀的介质。如果镁合金表面具有疏水性,则合金表面将保持“清洁”,腐蚀可能会在一定程度上延缓。从理论上讲,MgO本身是一种亲水性材料,添加合金元素能够在一定程度上调控镁合金表面的氧化膜成分[10,42],从而达到疏水性的目的,腐蚀可能会减缓。目前,能用于观察固体界面上水分子微观结构和动力学的分析和成像技术,如同步辐射、红外光谱、中子散射等[95–98],需要在超高真空条件下进行,操作难度大成本较高。另一方面,分子动力学模拟是研究分子微观结构的有力工具,已广泛用于研究水在各种条件下的润湿行为[99–102]。可以成功地预测原子水平上的详细信息,即原子分子位置、水分子的OH取向以及氢键结构的分布等。
在以往的研究中发现固体表面的润湿性受到许多外部环境因素的影响,包括温度[101,103]、涂层[104–105]和盐浓度[100]等。如图4(a)和 (b)所示,NaCl溶液浓度能够调节MgO表面第一水化层内水分子OH键的转向和氢键密度的分布[100]。这会导致第一水化层和第二水化层之间的氢键密度发生变化,造成层间内的相互作用力减弱或增强,改变MgO表面的润湿性。近年来,研究者发现晶格常数[106–107]、表面电荷[108–109]和表面粗糙度[110]的本征特性可以从根本上影响表面润湿性。这种本征特性可以通过调节表面第一水化层水分子的结构来控制水在固体表面的润湿行为。Zhu等[107]研究了不带电荷的FCC晶体结构的表面润湿行为随晶格常数的变化。研究发现,在亲水性表面,水分子与固体表面之间的相互作用力将促使表面第一水化层的形成有序结构,强烈影响其在亲水表面上的润湿性能。然而,在疏水表面,水与固体表面的相互作用力较小,第一水化层中的水分子呈现无序结构,固体表面的润湿性变化不明显。在离子模型中,MgO表面存在静电荷,水分子与表面之间的静电力会导致表面呈现亲水性。然而,当Mg与O原子之间的长度低于电偶极子的临界长度时,静电力可以忽略不计,MgO表面呈现疏水性 (图4(c)[99])。
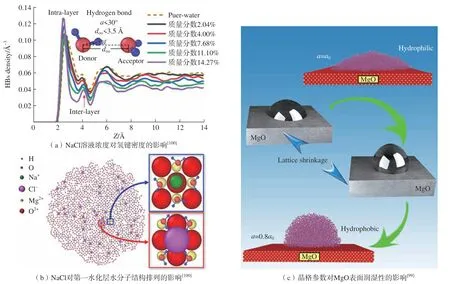
图4 MgO表面润湿性随NaCl溶液浓度和晶格常数的变化机理Fig.4 Mechanism of MgO surface wettability with NaCl solution concentration and lattice constant
因此,可以通过合金化来调控镁合金表面氧化膜的成分,对合金施加应力应变,或者进行表面微观结构设计等手段,使镁表面由亲水性逐渐转变为疏水性,以此在一定程度上延缓腐蚀。需要注意的是,经典的分子动力学模拟是基于牛顿力学,能够研究腐蚀介质在基体表面的物理动力学过程,但缺乏对表面电化学特性预测的能力。
5 X-CT技术在镁合金腐蚀方面的应用
在试验方面,研究人员认为表征镁合金的腐蚀形貌是研究腐蚀机理的一个重要途径[24,111]。目前常用的研究镁合金腐蚀过程的技术手段主要包括扫描电子显微镜(SEM)、透射电子显微镜、电子背散射衍射等[111–114]。这些技术主要基于在二维方向上观察镁合金的腐蚀过程。然而,镁合金微观结构与腐蚀之间的相互作用可能会存在更为复杂的腐蚀形貌[42]。腐蚀坑可能会在镁基体的深处形成,二维表征技术存在一定局限性。因此,利用3D成像技术系统地研究镁合金的腐蚀过程具有重要意义。
X射线计算机断层扫描技术 (X-CT)是一种无损表征技术,用于在微米尺度上对镁腐蚀过程进行三维观察[115],已用于表征镁合金腐蚀过程[116–118]。如图5所示[119],对镁合金的腐蚀进行准原位实时观测,主要原理是通过探测器收集不同角度位置 (通常是180°或360°范围内)的二维投影图[120],然后利用数学重构算法对投影图进行重构获得层状切片。

图5 镁合金准原位腐蚀试验的Zeiss 520 X-CT内部结构示意图[119]Fig.5 Internal features of Zeiss 520 X-CT equipment for in-situ corrosion experiments on Mg alloys[119]
目前,部分研究者已经使用CT成像技术研究了金属相关的腐蚀现象[116–122]。如Burnett等[121]通过这种方法研究了浸入NaCl溶液中奥氏体不锈钢点蚀的生长和扩散过程。Almuaili等[122]使用X射线CT技术观察304不锈钢在应力和电化学极化协同作用下腐蚀坑的形成过程以及腐蚀坑的生长扩散机制。Ročňáková等[116]研究了纯镁中孪晶密度与腐蚀速率之间的关系。Wang等[118]研究了流体流动过程对MgZnCa合金腐蚀类型和腐蚀速率的影响。Davenport等[117]利用X-CT扫描技术三维重构了Mg – Nd – Y(WE43)合金腐蚀的演变过程,发现镁合金腐蚀最初以凹坑的形式出现并形成均匀的腐蚀面,以及Y分布的均匀化可以降低腐蚀速率,有效减缓了腐蚀的进行,在理解腐蚀的作用机理方面起到了重大作用。
然而,在三维观察多成分镁合金的腐蚀过程中,讨论腐蚀形貌和第二相之间的关系的研究工作较少。在近期的工作中,如图6所示[119],利用X-CT技术在三维方向上观察AZ91合金和Mg – Gd – Dy – Zr合金腐蚀形貌随时间的变化。通过阈值分割技术提取出不同合金的第二相和腐蚀坑,量化分析第二相和腐蚀坑的当量直径、平均间距、数密度随时间的变化,以此探究第二相与镁合金腐蚀之间的关系。综上所述,三维重构技术为深入探索和理解镁合金腐蚀的微观组织形貌提供了一种有效途径,并且在未来的腐蚀形貌图像采集技术中,X-CT成像技术将成为一种不可或缺的工具。

图6 X-CT技术在镁合金腐蚀过程中的应用[119]Fig.6 Application of X-CT in the corrosion process of Mg alloys[119]
6 结论
镁合金作为最轻的金属结构材料,已经在许多领域得到广泛应用,但较差的耐腐蚀性能一直是阻碍其发展的“卡脖子”问题。本文综述了镁合金的腐蚀机制和腐蚀类型,并总结了不同合金元素对镁合金腐蚀的影响,分别介绍了第一性原理、分子动力学以及X-CT技术在镁腐蚀方面的应用。
目前,耐腐蚀镁合金的相关研究仍旧不足,亟须系统性地探索新型耐腐蚀镁合金。第一性原理计算是近年来研究镁合金腐蚀机理的一种有效工具,对解释镁合金微观腐蚀机理具有重要的意义。研究者们在最近工作中提出的阳极溶解和阴极析氢反应模型,可以有效地从镁合金腐蚀热力学和动力学方面分析合金元素对镁合金耐腐蚀性能的影响,为高通量筛选潜在的镁合金耐腐蚀元素奠定了基础,大量地节省试验成本。然而,第一性原理和第二相对镁合金腐蚀的影响仍需进一步的探索,期望能够对镁合金的腐蚀有更深层次的认识并推进新型耐腐蚀镁合金的发展。另外,分子动力学可以有效描述镁合金表面水分子的OH取向以及氢键分布等结构信息,解释其在微观尺度下的润湿行为。可通过合金化来调控镁合金表面氧化膜的成分,施加应力应变,或者设计表面的微观结构等手段,使镁合金表面由亲水性逐渐转变为疏水性,以此在一定程度上延缓腐蚀。
在试验方面,目前的表征技术主要基于二维方向上观察镁合金的腐蚀过程。然而,镁合金微观结构与腐蚀之间的相互作用可能会存在更为复杂的腐蚀形貌。X-CT技术是一种无损表征技术,可以在微米尺度上对镁腐蚀过程进行三维表征,能够很好地量化分析腐蚀坑和第二相之间的关系,为深入探索和理解镁合金腐蚀过程中微观组织形貌的变化提供帮助。
