曲妥珠单抗联合新辅助化疗对人类表皮生长因子受体-2 阳性乳腺癌患者预后影响因素分析
2023-03-15王晓娜韩樱松
王晓娜,韩樱松,吴 鹏
(北京市普仁医院普外科,北京 100062)
乳腺癌是导致全球女性死亡的重要原因。人表皮生长因子受体-2(HER-2)在部分浸润性乳腺癌患者中存在HER-2蛋白过表达和基因扩增现象,与HER-2阴性乳腺癌患者比较,HER-2阳性乳腺癌患者预后更差,恶性程度高,且总生存时间(OS)短,远处转移和死亡风险更高[1]。针对HER-2的单克隆抗体曲妥珠单抗,可选择性地对HER-2蛋白细胞外区域产生作用,调节HER-2阳性肿瘤细胞释放的拓扑异构酶Ⅰ表达,抑制肿瘤细胞增殖;此外,曲妥珠单抗还可以激活固有免疫细胞以杀灭肿瘤细胞,临床上已经将其用于非小细胞肺癌、胃癌、乳腺癌等多种HER-2阳性肿瘤的治疗,持续抗HER-2治疗可有效抑制癌细胞的增殖[2]。HER-2靶向治疗显著改善了新辅助化疗(NACT)对HER-2阳性乳腺癌患者的预后,近年来已证实NACT后患者可实现病理完全缓解(pCR)[3]。本研究旨在探讨曲妥珠单抗联合NACT治疗HER-2阳性乳腺癌患者预后影响因素,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2011年1月至2017年12月北京市普仁医院接受NACT治疗的223例HER-2阳性浸润性乳腺癌患者的临床资料,根据NACT是否联合曲妥珠单抗治疗,将患者分为非治疗组(83例)和治疗组(140例)。诊断标准:参照《中国抗癌协会乳腺癌诊治指南与规范(2008版)》[4]中的相关标准。纳入标准:符合上述诊断标准者;初次治疗者;肿瘤分期为T1-3、N1-3、M0者;接受NACT治疗者;HER-2蛋白阳性表达者;临床相关资料完整者等。排除标准:合并其他恶性肿瘤者;存在远处转移者;对曲妥珠单抗过敏者等。本研究经院内医学伦理委员会批准。
1.2 治疗方法 所有患者均接受蒽环联合紫杉类NACT方案治疗:注射用盐酸多柔比星[辉瑞制药(无锡)有限公司,国药准字H20013334,规格:10 mg/支] 60 mg/m2,第1天静脉滴注;紫杉醇注射液(北京协和药厂有限公司,国药准字H20083786,规格:10 mL∶60 mg)175 mg/m2,第1天静脉滴注;注射用异环磷酰胺(哈尔滨三联药业股份有限公司,国药准字H20084196,规格:1.0 g/支)600 mg/m2,第1天静脉滴注,21 d为1个疗程,共治疗4个疗程。治疗组患者在上述治疗的基础上联合注射用曲妥珠单抗[Genentech Inc.,注册证号J20180073,规格:440 mg(20 mL)/瓶]治疗,初次负荷量为4 mg/kg体质量,之后2 mg/kg体质量, 1次/周,共治疗12周。NACT后经影像学检查,均达到完全缓解,结束后3~4周两组患者均进行手术治疗,保乳手术患者于术中和术后前哨淋巴结阳性需进行腋窝淋巴结清扫;对于肿瘤直径大于5 cm、保乳手术、切缘阳性、腋窝淋巴结阳性患者建议进行放疗;雌激素受体(ER)、孕激素受体(PR)阳性者进行内分泌治疗。
1.3 观察指标 ①统计并比较两组患者年龄、T分期、ER、PR阳性情况、手术方法、是否腋窝淋巴结清扫、是否放疗、是否导管原位癌残留(采用超声检查)、是否内分泌治疗、是否术后辅助化疗、Miller-Payne(MP)分级[5](根据NACT后患者肿瘤细胞减少的比例分为1~5级,1级表示肿瘤细胞未减少,5级表示未见浸润癌细胞)等临床特征。②对两组患者进行随访,统计患者死亡和复发情况。③使用Cox比例风险回归模型对经NACT治疗的HER-2阳性乳腺癌患者的生存情况进行单因素和多因素 分析。
1.4 统计学方法 采用SPSS 22.0统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;患者生存情况影响因素采用Cox比例风险回归模型进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床特征情况比较 治疗组导管原位癌残留、术后辅助化疗、MP分级1~2级的患者占比均显著低于非治疗组,差异均有统计学意义(均P<0.05);两组患者年龄、T分期、ER、PR阳性情况、手术方法、腋窝淋巴结清扫、放疗、内分泌治疗等情况经比较,差异均无统计学意义(均P>0.05),见表1。

表1 两组患者临床特征情况比较[ 例(%)]
2.2 两组患者随访情况比较 患者的随访时间为38~62个月,中位随访时间为57个月,末次随访时间为2022年6月。随访过程中,治疗组、非治疗组中局部复发分别为3、7例;发生远处转移分别为2、6例;非治疗组1例同时存在局部复发和远处转移;治疗组、非治疗组死亡分别为1、6例。治疗组患者肿瘤复发率、远处转移率、死亡率分别为2.14%(3/140)、1.43%(2/140)、0.71%(1/140),非治疗组患者肿瘤复发率、远处转移率、死亡率分别为9.64%(8/83)、8.43%(7/83)、7.23%(6/83),治疗组复发率、远处转移率及死亡率均显著低于非治疗组,差异均有统计学意义(χ2=4.747、4.917、5.289,均P<0.05)。
2.3 影响NACT后HER-2阳性乳腺癌患者生存情况的单因素分析 本研究中共有7例患者死亡,单因素分析结果显示,T1~2分期、放疗及MP分级1~2级是影响NACT治疗后HER-2阳性乳腺癌患者预后的相关因素,差异均有统计学意义(HR=0.846、0.531、1.127,均P<0.05),见表2。
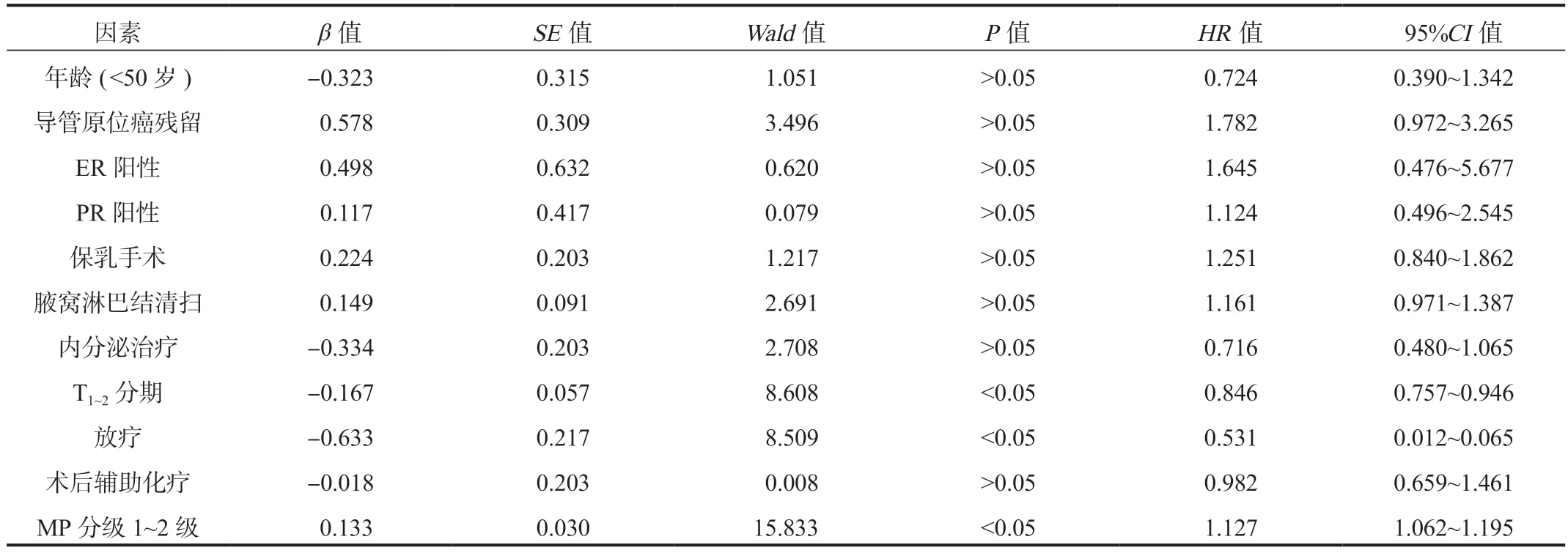
表2 影响NACT后HER-2阳性乳腺癌患者生存情况的Cox回归模型单因素分析
2.4 影响NACT后HER-2阳性乳腺癌患者生存情况的多因素分析 将单因素分析中差异有统计学意义的因素(T1~2分期、是否接受放疗及MP分级)纳入Cox比例风险回归模型进行多因素分析,结果显示,T1~2分期、放疗及MP分级1~2级是影响NACT治疗后HER-2阳性乳腺癌患者死亡的独立危险因素,差异均有统计学意义(HR=0.716、0.583、1.142,均P<0.05),见表3。
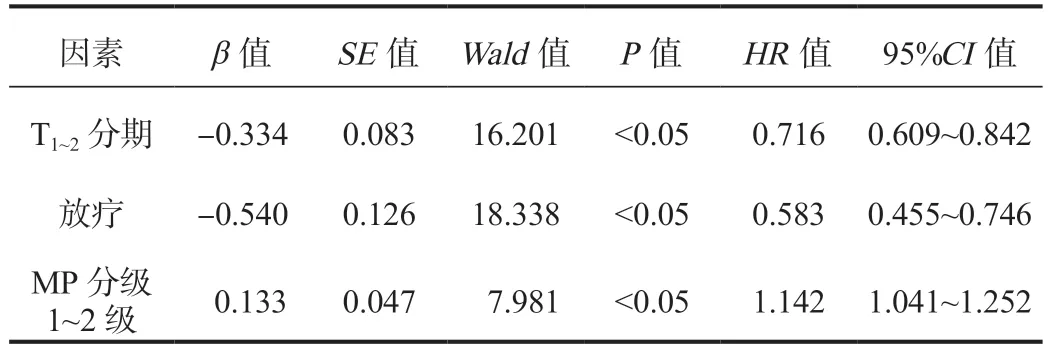
表3 影响NACT后HER-2阳性乳腺癌患者生存情况的 Cox回归模型多因素分析
3 讨论
乳腺癌属于恶性肿瘤,发生于乳腺上皮细胞组织,其治疗方法有手术、放化疗及内分泌治疗等,且化疗为主要治疗方法。HER-2高表达是乳腺癌患者病情进展的重要原因,并且是判断乳腺癌预后的独立指标,曲妥珠单抗是HER-2阳性乳腺癌的一线靶向治疗药物,通过抑制患者HER-2基因的过度表达,阻碍病情的进展。曲妥珠单抗属于抗HER-2的单克隆抗体,可附着于HER-2上,从而阻止人体表皮生长因子附着在HER-2上,抑制癌细胞的生长,同时其还可以刺激机体自身的免疫细胞去摧毁癌细胞,主要应用于HER-2过度表达的转移性乳腺癌患者的治疗,且有研究显示,采用曲妥珠单抗进行辅助化疗,可有效降低患者的复发率和死亡率[6]。
本研究中首先对是否接受曲妥珠单抗治疗的两组患者的临床特征进行比较,结果显示,治疗组导管原位癌残留、术后辅助化疗、MP分级1~2级的患者占比均显著低于非治疗组,提示曲妥珠单抗联合NACT治疗HER-2阳性患者可降低患者导管原位癌残留的风险,提高MP分级,且可减少术后辅助化疗的应用,疗效确切。在对患者进行随访的过程中,治疗组肿瘤复发率、远处转移率、死亡率均显著低于非治疗组,表明在进行新辅助化疗时联合曲妥珠单抗可使乳腺癌患者的复发率和死亡率降低。孙愚等[7]对HER-2阳性乳腺癌患者的研究中也发现,新辅助化疗联合曲妥珠单抗后患者的无病生存期和OS均长于单纯化疗组。曲妥珠单抗能够作用于HER-2受体的胞外部分,使HER-2与其他HER家族基因形成异源二聚体的过程被阻断,对丝氨酸、苏氨酸激酶等酶的活性产生抑制作用,导致原癌基因失活,从而阻止癌症的发生。
本研究中Cox回归模型分析发现,T1~2分期、放疗及MP分级1~2级是影响接受NACT后HER-2阳性乳腺癌患者生存情况的独立因素。分析原因在于,T分期越高提示患者肿瘤越大、侵袭程度越高,患者预后相对更差;T分期可以通过肿瘤大小对微小转移病灶和孤立性肿瘤结节进行判断,以腋窝淋巴结转移数目作为分期的重要元素,能够客观评价淋巴结转移对预后的影响[8]。而放疗作为乳腺癌综合治疗的重要方式,其利用放射线能够将癌细胞杀死,控制人体内癌细胞的DNA复制、分裂及增殖,减缓肿瘤的发展速度,减轻患者的病痛;对于具有放疗适应证患者进行放疗后可以降低其乳腺癌的复发风险,降低患者死亡风险[9]。MP分级是评估乳腺癌患者治疗前后肿瘤细胞减少比例的重要参数,分级越高提示细胞减少越多;MP分级5级表明患者接受NACT治疗后原肿瘤部位已无浸润性癌细胞,治疗效果达到了完全缓解,患者的复发风险较其他MP分级更低,且远期生存率更高,预后 良好。
邵婉婷等[10]在对HER-2阳性乳腺癌患者采用曲妥珠单抗联合新辅助化疗的治疗效果及其预后影响因素的研究中发现,采用靶向联合化疗方案治疗的患者,其OS和无病生存期均长于单纯化疗的患者;同时通过分析发现,原发肿瘤大小、初诊与术后淋巴结情况及MP分级均是HER-2阳性乳腺癌患者OS和无病生存期的影响因素。因此,MP分级可用来预测曲妥珠单抗联合新辅助化疗后HER-2阳性乳腺癌患者的预后情况,临床上应根据HER-2阳性乳腺癌患者的T1~2分期、是否进行放疗及MP分级对患者进行筛选,对T分期较高、未接受放疗及MP分级较低的患者及时采取术后辅助化疗等措施,以改善患者的 预后。
综上,曲妥珠单抗联合NACT治疗HER-2阳性乳腺癌患者可降低患者复发风险;T1~2分期、放疗及MP分级1~2级是NACT治疗HER-2阳性乳腺癌影响患者死亡的独立危险因素,可根据上述因素采取相应措施进行干预,提高患者的预后效果。但本研究也存在一定局限性,首先本研究为回顾性分析,易导致选择偏倚;其次,患者化疗方案并未完全均衡,为了方便统计将单独使用蒽环类或紫杉类化疗者进行了合并,这种差异可能影响最终研究结果准确性;另外本研究受患者数量限制和随访时间的影响,未进行亚组分析,今后值得更大样本量的前瞻性研究,进一步明确该结论。
