姜黄素通过SIRT1/FOXO1通路缓解玉米赤霉烯酮诱导的猪肾上皮细胞氧化损伤
2023-03-14崔红杰卢春亭潘丽琴胡会钟佩云朱洁莹张凯照黄小红
崔红杰,卢春亭,潘丽琴,胡会,钟佩云,朱洁莹,张凯照,黄小红
姜黄素通过SIRT1/FOXO1通路缓解玉米赤霉烯酮诱导的猪肾上皮细胞氧化损伤
崔红杰1, 2,卢春亭1,潘丽琴1,胡会1,钟佩云1,朱洁莹1,张凯照1, 2,黄小红1, 2
1福建农林大学动物科学学院,福州 350002;2中西兽医结合与动物保健福建省高校重点实验室/福建省兽医中药与动物保健重点实验室,福建农林大学,福州 350002
【目的】探究姜黄素(Cur)对玉米赤霉烯酮(ZEA)诱导猪肾上皮细胞(PK-15)氧化损伤的保护作用,并基于SIRT1/FOXO1信号通路阐明其作用机制,为姜黄素的兽医临床应用提供依据。【方法】试验分为5组:对照组、ZEA组(36.55 μg·mL-1ZEA)、Cur 6.25组(36.55 μg·mL-1ZEA+6.25 μmol·L-1Cur)、Cur 12.5组(36.55 μg·mL-1ZEA+12.5 μmol·L-1Cur)、Cur 25组(36.55 μg·mL-1ZEA +25 μmol·L-1Cur);通过MTT法测定ZEA的半数抑制浓度和Cur对PK-15细胞的最大安全浓度;使用倒置显微镜观察PK-15细胞的形态变化;采用试剂盒检测细胞内活性氧(ROS)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及丙二醛(MDA)的水平;qRT-PCR检测细胞SIRT1、FOXO1、CAT、Mn-SOD的mRNA水平;Western Blot检测SIRT1、FOXO1和Acetyl-FOXO1蛋白的表达量。【结果】ZEA的IC50为36.55 μg·mL-1,Cur的最大安全浓度为25 μmol·L-1;与对照组相比,ZEA极显著降低PK-15细胞活力(<0.01),极显著提高ROS和MDA水平(<0.01),极显著降低SOD、CAT活性(<0.01);与ZEA组对比,不同浓度的Cur(6.25、12.5、25 μmol·L-1)显著提高PK-15细胞的存活率(<0.05),改善细胞形态;极显著(<0.01)降低ZEA诱导的ROS和MDA水平;极显著升高细胞内SOD和CAT活性(<0.01)。qRT-PCR结果显示,与对照组相比,ZEA降低SIRT1 mRNA表达量,极显著升高FOXO1 mRNA表达量(<0.01),升高Mn-SOD mRNA表达量,极显著降低CAT mRNA表达量(<0.01)。与ZEA组对比,各Cur组不同程度的升高SIRT1和CAT的mRNA表达量,极显著的降低FOXO1的mRNA表达量(<0.01);极显著升高Mn-SOD的mRNA表达量(<0.01)。Western Blot结果表明,与对照组对比,ZEA显著降低SIRT1蛋白表达(<0.05),极显著升高Acetyl-FOXO1蛋白表达(<0.01);与ZEA组对比,各Cur组均极显著升高SIRT1蛋白表达(<0.01),极显著降低Acetyl-FOXO1蛋白表达(<0.01)。【结论】Cur可以上调SIRT1的表达,降低FOXO1的乙酰化水平,诱导抗氧化酶Mn-SOD和CAT的表达,从而清除ROS,降低MDA水平,减轻ZEA对PK-15细胞的氧化损伤作用。
姜黄素;玉米赤霉烯酮;氧化应激;沉默信息调节因子1 (SIRT1)
0 引言
【研究意义】玉米赤霉烯酮(zearalenone,ZEA)是一种非甾体霉菌毒素,由多种镰刀菌通过聚酮途径生物合成[1],被国际癌症研究机构(IARC)列为具有严重生殖毒性的第3类致癌物[2]。ZEA广泛存在于谷物和食品中,BIOMIN研究中心监测全球100个国家10年的(2008—2017)霉菌毒素报告显示,45%的玉米、小麦、大麦、大豆等饲料原料及其成品饲料被ZEA污染[3],2019年我国饲料的ZEA检出率为55%[4],足见其污染严重性。ZEA化学结构与17β-雌二醇相似[5],能够与雌激素受体(17β-雌二醇特异性受体)结合,导致生殖障碍,包括生育力低、胎儿发育异常、产仔数减少和生殖激素水平的改变[6]。ZEA还具有免疫毒性、肝毒性、肾毒性、遗传毒性等。肾脏是ZEA产生毒性作用的主要器官之一,ZEA在动物体内通过肝肠循环由肾脏排出,在仔猪日粮中添加1.1—3.2 mg·kg-1ZEA会导致肝肾应激[7];通过雌性小鼠腹腔注射ZEA,发现ZEA导致小鼠肾脏氧化应激,加速肾细胞凋亡,增加血清肌酐和尿素[8]。ZEA在肾脏的积聚可引起肾小球的分叶和萎缩,诱导小鼠的肾发生氧化应激和凋亡导致蛋白尿[9]。因此,寻找有效的保护剂来保护肾脏免受ZEA的损害是非常重要的。【前人研究进展】氧化损伤是ZEA产生毒性的主要途径之一,许多研究表明ZEA通过产生活性氧(reactive oxygen species,ROS)诱导细胞周期阻滞、DNA损伤、内质网应激、细胞自噬、线粒体损伤和细胞凋亡,导致细胞死亡[10-11]。Sirtuin 1(SIRT1)是一种依赖于NAD+的去乙酰化酶,通过去除组蛋白和各种转录调控因子上的乙酰基来调控基因表达[12]。叉头转录因子O 1(forkhead box O1,FOXO1)是叉头转录因子O类家族的成员,在调节脂质代谢和氧化应激反应的各种信号通路中起着关键作用。研究表明,FOXO1是SIRT1的主要靶蛋白,SIRT1能使FOXO1 DNA结合域内的赖氨酸残基去乙酰化,并促进FOXO1的核保留,增加其转录活性[13]。姜黄素(curcumin,Cur),学名1,7-双(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮,是一种疏水多酚化合物,广泛存在于姜科姜黄属多年生植物,如姜黄、莪术、郁金等的根茎中。姜黄素具有很强的抗氧化性能,可与维生素C或E的活性相媲美。已有文献报道姜黄素是活性氧(ROS)和活性氮(RNS)的清除剂,包括超氧阴离子、羟基自由基和二氧化氮[14]。在各种动物模型中,姜黄素也被证明可以抑制包括脂质过氧化的氧化损伤[15]。【本研究切入点】目前尚不清楚姜黄素是否可以减轻ZEA对肾脏的伤害,其保护机制也尚未阐明。【拟解决的关键问题】本研究以猪肾上皮细胞系PK-15为研究模型,通过添加ZEA和不同浓度的Cur,检测ROS、SOD、CAT、MDA等氧化应激相关指标以及抗氧化基因SIRT1、FOXO1、CAT、Mn-SOD的mRNA水平,旨在探讨姜黄素对ZEA诱导氧化损伤的保护作用,以期为姜黄素的兽医临床应用提供依据,并为防治其他真菌毒素中毒提供参考。
1 材料与方法
1.1 主要试剂和仪器
姜黄素、甲基噻唑蓝(MTT)、二甲基亚砜(DMSO)均购自Sigma(美国);ZEA购自Acmec(中国);胎牛血清、DMEM-高糖培养基、PBS、青-链霉素(P&S)均购自Hyclone(美国);活性氧(ROS)检测试剂盒购自茁彩(中国);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)测定试剂盒购自南京建成生物工程研究(中国);Eastep®Supper总RNA提取试剂盒购自Promega(美国);反转录试剂盒(RR036A)和荧光定量PCR试剂盒(RR820A)均购自TaKaRa(日本);电泳液,转膜液,预染蛋白maker(10—180 kD)、脱脂牛奶、10×TBST、RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、Anti-β-actin均购自上海碧云天公司;PVDF膜购自北京索莱宝公司;羊抗兔IgG-HRP购自武汉博士德公司;ECL化学发光显色液购自美国Advansta公司;Anti-SIRT1、Anti-FOXO1、Anti-Acetyl-FOXO1购自ABclonal公司;实时荧光定量PCR仪购自赛默飞(美国);酶标仪购自TECAN(瑞士)。
1.2 试验时间和地点
试验时间为2021年3月至2022年1月,试验地点为福建农林大学动物科学学院中西兽医结合与动物保健福建省高校重点实验室。
1.3 细胞复苏与培养
将PK-15细胞从液氮罐中取出,在37℃恒温水浴箱中迅速摇晃溶解,室温下1 000 r/min,离心10 min;弃上清液,加入适量培养液重悬细胞移至培养瓶中,放在37℃ 5% CO2培养箱中常规培养,24 h后观察贴壁情况和更换培养液。待细胞生长到培养瓶80%以上时,弃掉原培养液,用PBS清洗3次后,0.25%胰酶消化,进行正常的传代。
1.4 MTT法测定细胞活力
将生长良好的PK-15细胞消化,计数、稀释至2×105个/mL,加入96孔板中培养24 h后,弃上清,加入100 μL/孔不同浓度的Cur或ZEA,培养24 h。倒置显微镜下观察药物作用效果;每孔加入10 μL MTT溶液(MTT终浓度约为5 mg·mL-1),37℃避光培养4 h后,吸出上清液,每孔加入150 μL DMSO,吹打混匀,通过酶标仪测定结晶溶液在490 nm下的OD值,用公式计算细胞存活率、细胞抑制率。
1.5 试验分组
试验分为5组,分别为对照组(维持培养液)、ZEA组(36.55 μg·mL-1ZEA+维持培养液)、ZEA+Cur 6.25组(36.55 μg·mL-1ZEA+6.25 μmol·L-1Cur)、ZEA+Cur 12.5组(36.55 μg·mL-1ZEA+12.5 μmol·L-1Cur)、ZEA+Cur 25组(36.55 μg·mL-1ZEA +25 μmol·L-1Cur)。
1.6 活性氧检测
细胞经过相应处理24 h。按照1﹕1 000用无血清培养液稀释DCFH-DA。去除细胞培养液,加入DCFH- DA。37℃细胞培养箱内孵育20 min。用无血清培养液洗涤细胞3次,在荧光显微镜下随意选取6个视野观察及拍照,通过Image J软件分析荧光强度。
1.7 细胞内抗氧化指标检测
细胞经过相应处理24 h后,收集细胞沉淀。用PBS清洗两次,在细胞沉淀中加入一定量的PBS,混匀,于冰水混合物中手动匀浆3 min,然后取破碎好的细胞悬浮液按照SOD、CAT和MDA测定试剂盒说明书进行测定。用中国海门市碧云天的Bradford蛋白浓度测定试剂盒测定总蛋白浓度,所有样品都测定三个重复。
1.8 qRT-PCR测定抗氧化相关基因表达量
用Eastep®Supper总RNA提取试剂盒,根据说明书从-70℃冰冻的细胞中提取总RNA。通过紫外分光光度计测定RNA浓度。根据PrimeScript™ RT Master Mix(Perfect Real Time)(TaKaRa)说明书取500 ng总RNA反转成cDNA。猪SIRT1、FOXO1、CAT、Mn-SOD的引物序列如表1所示,由生工生物工程(上海)股份有限公司合成,反应体系见表2。熔解曲线阶段通过Applied Biosystems QuantStudio™ 5 Real- Time PCR System按照表3进行。

表1 Real-time PCR引物序列
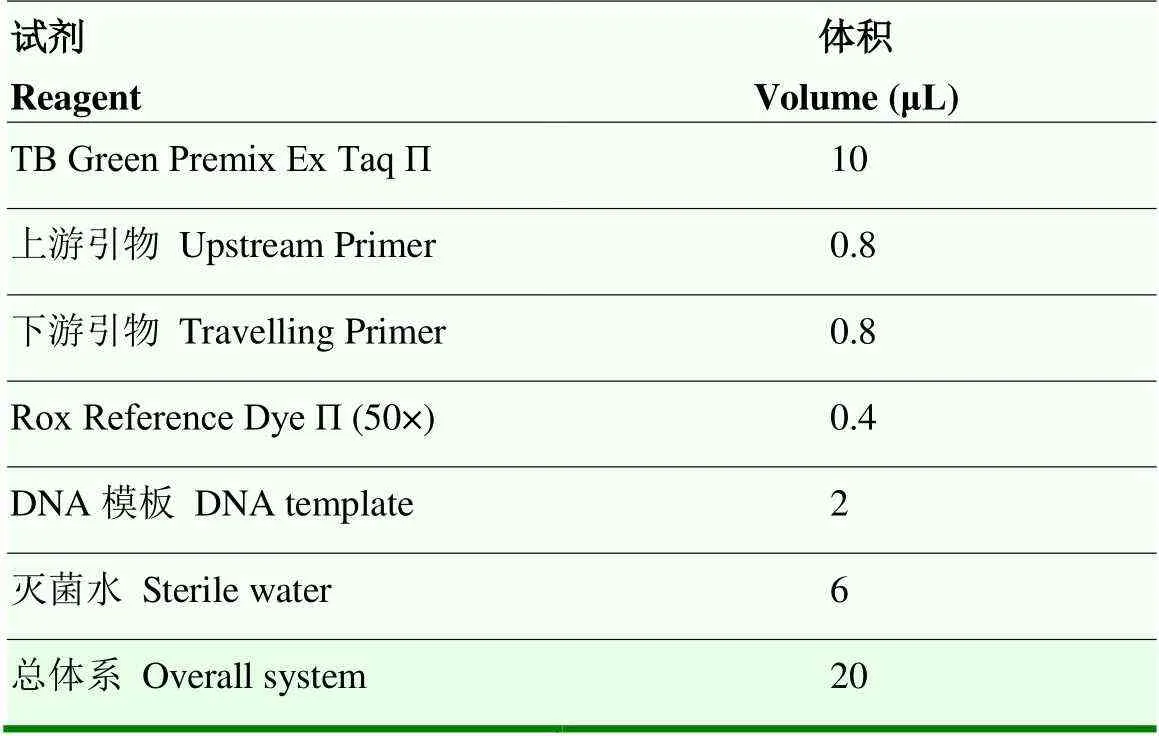
表2 Real-time PCR反应体系
1.9 Western Blot测定抗氧化相关基因蛋白表达量
细胞经过不同处理24 h,收集细胞沉淀,加PBS洗涤细胞,1 500 r/min离心10 min,弃上清,加入细胞裂解液在冰上裂解细胞30 min,再超声破碎细胞30 s,12 000 r/min 4℃离心10 min,收集蛋白上清,通过BCA法测蛋白浓度,将提取的蛋白跑电泳,转膜,5%脱脂牛奶封闭2 h,分别加入-actin、SIRT1、FOXO1和Acetyl-FOXO1抗体(1﹕500稀释)于4℃孵育过夜,TBST漂洗后加入二抗羊抗兔IgG-HRP孵育1 h,化学发光显色检测。
1.10 数据分析
实验数据的统计分析采用统计软件SPSS 25.0进行。对数据进行分析,采用单因素方差分析,再用最小显著性差异检验。数据用平均值(Mean)±标准差(SD)表示,<0.05为差异显著,<0.01为差异极显著,具有统计学意义。采用Grapher 16.5软件作图。

表3 PCR反应程序
每个样本都做三个重复,以β-actin为内参用2-ΔΔCt法计算mRNA相对水平
Three replicates were performed for each sample. And β-actin was used as an internal reference to calculate mRNA relative levels by 2-ΔΔCtmethod
2 结果
2.1 ZEA对PK-15细胞活力的影响
不同浓度的ZEA(0、10、20、30、40、50 μg·mL-1)分别与PK-15细胞共同孵育24 h,通过MTT法检测ZEA对PK-15细胞活力的影响,结果如图1所示。随着浓度的增大,ZEA对PK-15细胞活力的抑制作用越来越强,30 和40 μg·mL-1ZEA的细胞活力抑制率分别为10.91%和64.39%。通过计算ZEA的IC50为36.55 μg·mL-1,因此选用36.55 μg·mL-1作为后续试验ZEA的浓度。
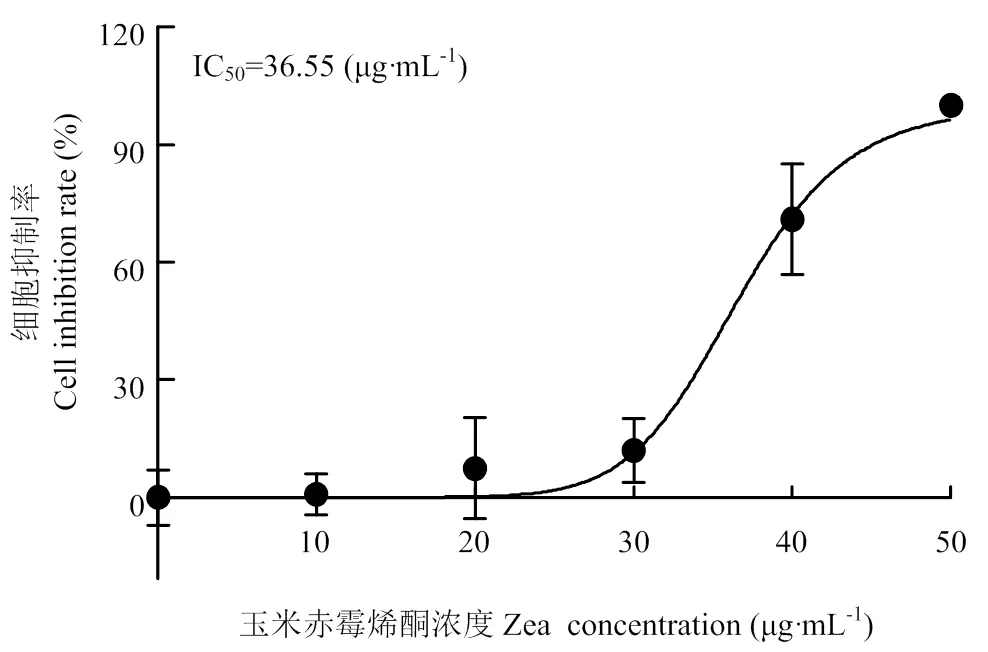
图1 ZEA对PK-15细胞活力的抑制作用
2.2 Cur对PK-15细胞活力及形态的影响
为确定适宜的Cur使用浓度,通过MTT法测定Cur对PK-15的最大安全浓度。如图2所示,Cur浓度在1.56、3.13、6.25、12.5、25、50 μmol·L-1时,细胞的存活率均在90%以上;然而在100 μmol·L-1时,细胞存活率仅为18.62%。在细胞形态学上,与对照组相比,1.56、3.13、6.25、12.5和25 μmol·L-1的Cur没有改变PK-15的细胞形态(图3),而50和100 μmol·L-1的Cur使细胞变圆,细胞间隙变大,甚至引起细胞死亡脱落(图3黑色箭头)。根据细胞活力和细胞形态观察的结果,后续试验将选择6.25、12.5、25 μmol·L-1作为Cur的使用浓度。
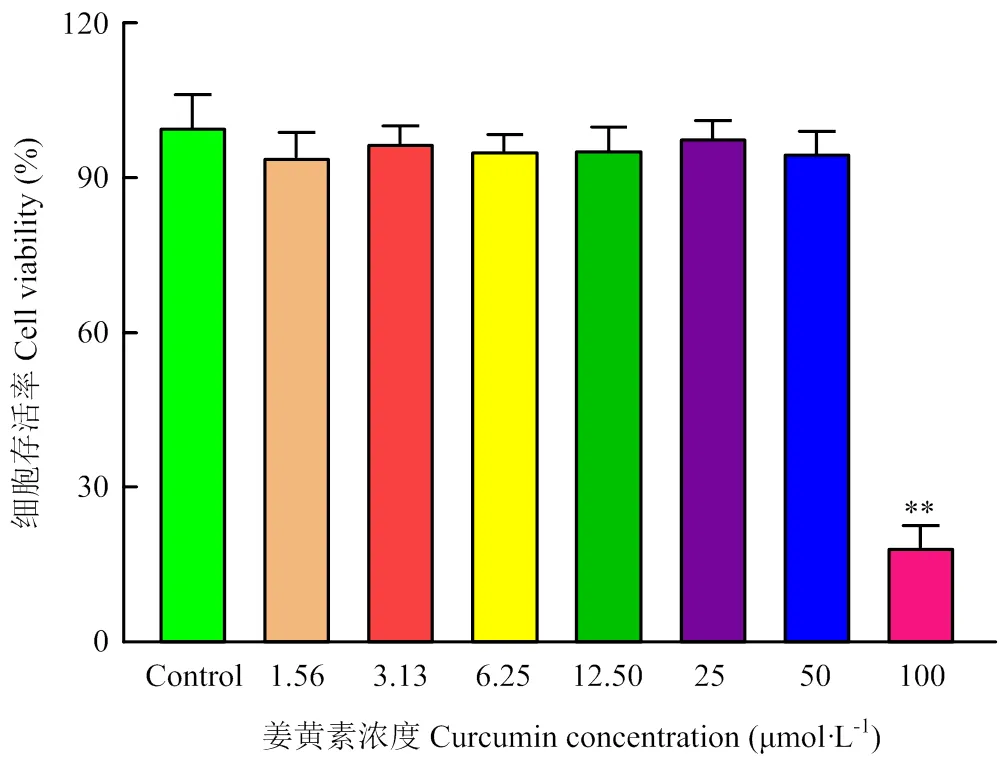
与对照组相比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
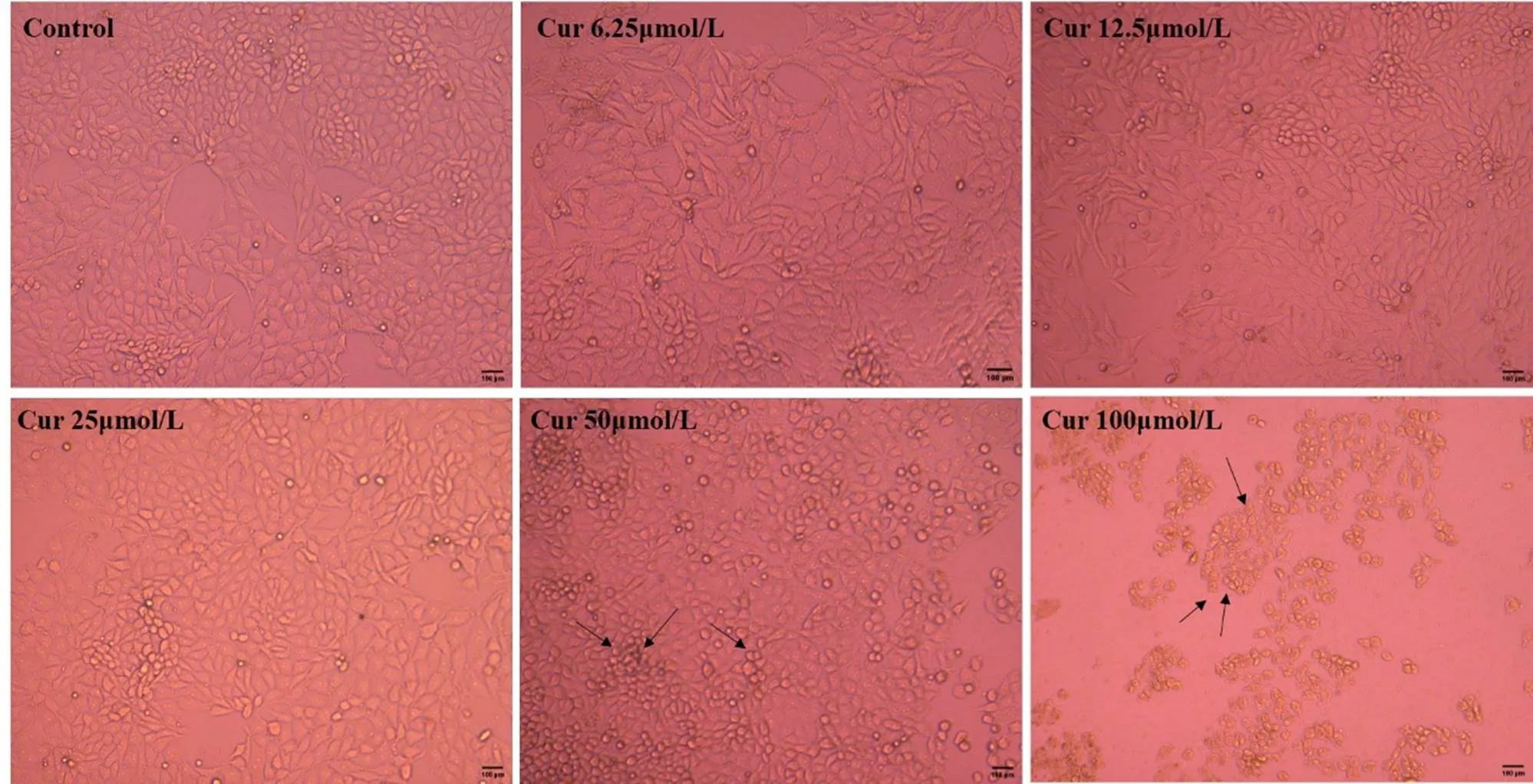
图3 不同浓度Cur对PK-15细胞形态的影响(标尺= 100 μm)
2.3 Cur减轻ZEA对PK-15的细胞毒性
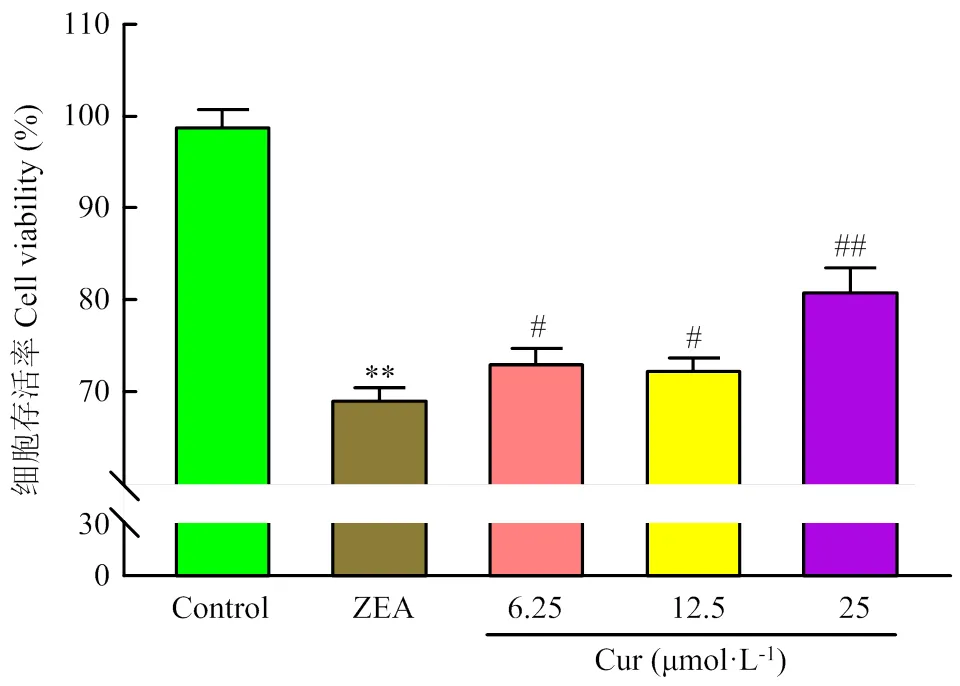
在生长良好的PK-15细胞中加入ZEA(36.55 μg·mL-1)的同时,分别添加不同浓度的Cur(6.25、12.5、25 μmol·L-1)作用24 h后,在倒置显微镜下观察细胞的形态与贴壁情况。跟对照组相比,ZEA组细胞界限模糊,细胞融合,细胞变圆有脱落现象(图4黑色箭头)。不同浓度Cur的加入,都能使细胞界限变得清晰,细胞形态变好,减少细胞变圆脱落现象(图4红色箭头)。说明Cur能改善ZEA引起的PK-15细胞形态的变化。采用MTT法检测各组的细胞存活率,结果如图5所示。与对照组对比,ZEA组的细胞存活率极显著降低(<0.01);与ZEA组相比,Cur 6.25组和Cur 12.5组细胞存活率显著升高(<0.05),Cur 25组极显著升高(<0.01)。以上结果表明,ZEA可降低PK-15细胞活力,Cur能有效降低ZEA对PK-15细胞的毒性作用。
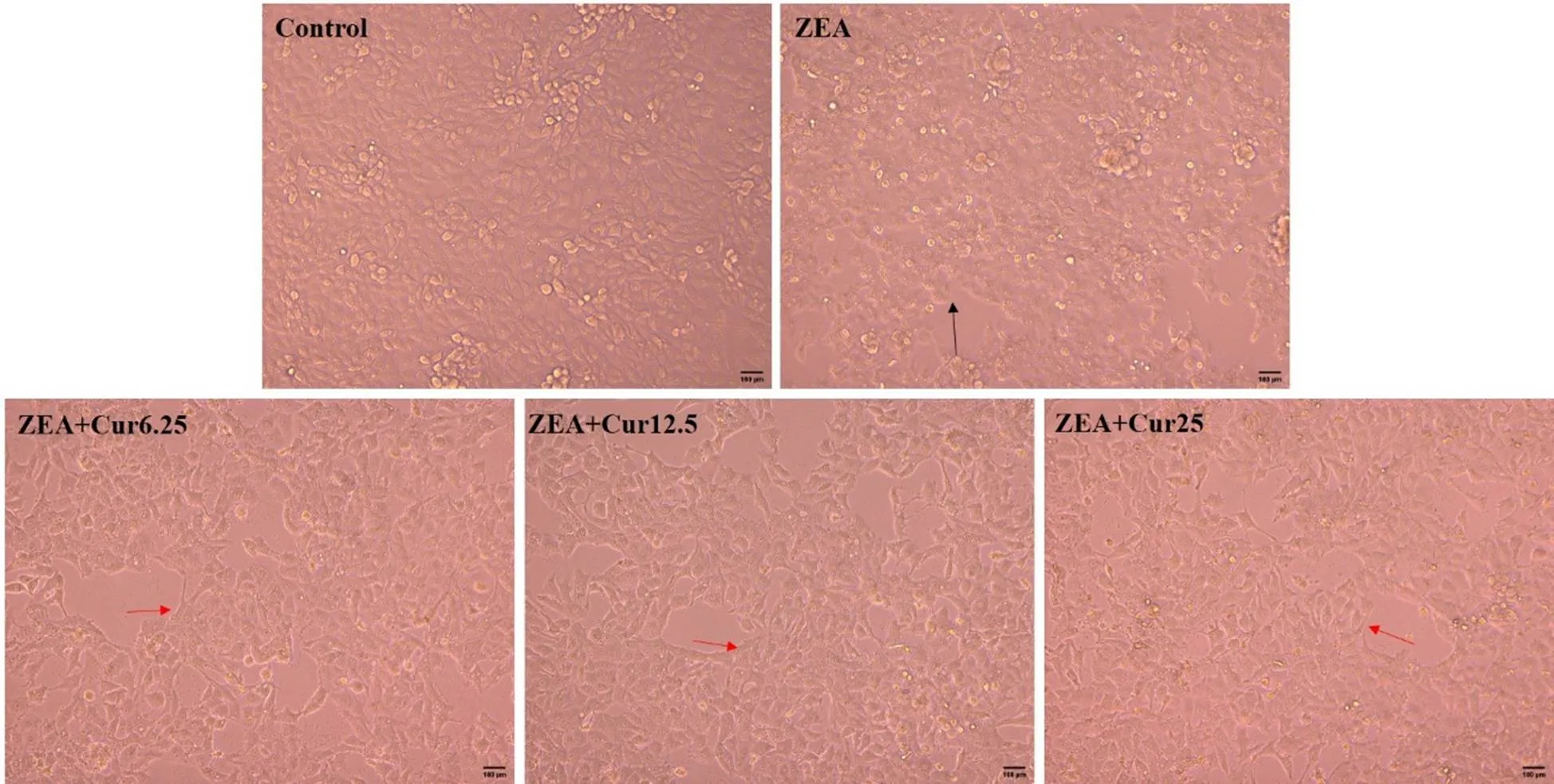
图4 不同浓度Cur对ZEA引起的PK-15细胞形态变化的影响(标尺= 100 μm)
2.4 Cur降低ZEA诱导的ROS生成
DCFH-DA荧光探针能自由穿过细胞膜,被细胞内ROS氧化为荧光DCF,荧光强度与细胞内ROS水平成正比。用DCFH-DA标记细胞,利用Image J计算和分析荧光强度。结果如图6和图7所示,ZEA组的荧光强度极显著高于对照组(<0.01),不同浓度的Cur组的荧光强度要极显著(<0.01)低于ZEA组。说明Cur能有效降低ZEA诱导的ROS产生。
2.5 Cur缓解ZEA诱导的氧化应激
将细胞进行处理24 h后,收集细胞,通过试剂盒检测细胞内SOD、CAT和MDA水平。结果如图8所示,与对照组相比,ZEA极显著降低细胞的SOD和CAT活性(<0.01);ZEA组的MDA含量极显著(<0.01)上升;而相较于ZEA组,Cur组的SOD和CAT活性均极显著(<0.01)上升,Cur组的MDA含量均极显著(<0.01)下降。以上结果说明,ZEA诱导PK-15细胞发生氧化应激,而Cur可缓解ZEA诱导的氧化应激。
与对照组相比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与ZEA相比较,#表示差异显著(P<0.05),##表示差异极显著(P<0.01)。下同
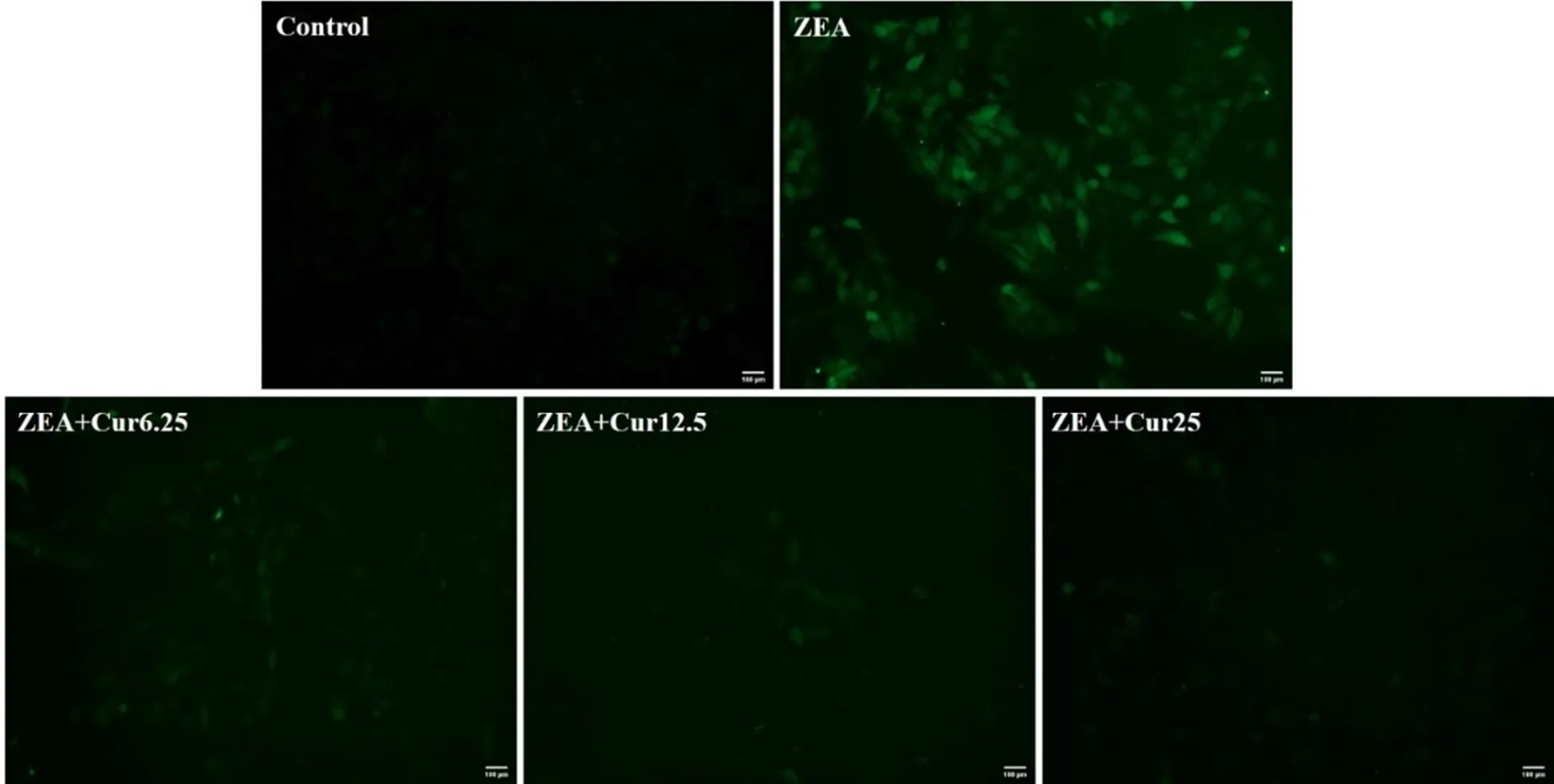
图6 Cur对ZEA诱导的PK-15细胞内ROS的影响(标尺 = 100 μm)
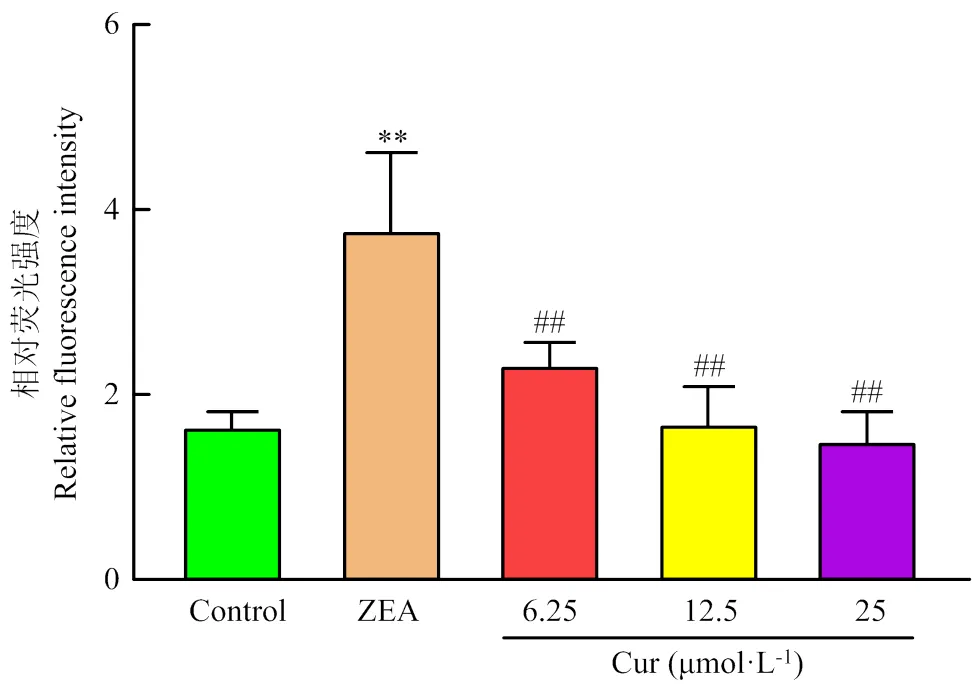
图7 活性氧相对荧光强度
2.6 Cur对ZEA引起SIRT1/FOXO1信号通路相关基因的影响
通过qRT-PCR检测细胞内SIRT1、FOXO1、CAT、Mn-SOD mRNA表达量,结果如图9所示,与对照组对比,ZEA组SIRT1 mRNA表达量降低,FOXO1 mRNA表达量极显著(<0.01)升高,Mn-SOD mRNA表达量稍有上升,CAT极显著(<0.01)降低。与ZEA组对比,Cur 6.25组显著(<0.05)升高SIRT1 mRNA表达量,Cur 12.5组和Cur 25组的SIRT1的mRNA表达量极显著(<0.01)的升高;Cur组FOXO1的mRNA表达量均极显著(<0.01)的降低;Cur组Mn-SOD的mRNA表达量极显著(<0.01)的升高;Cur 6.25组CAT的mRNA表达量显著(<0.05)升高,Cur 12.5组极显著(<0.01)升高,Cur 25组没有显著变化。
通过Western Blot检测细胞内SIRT1、FOXO1、Acetyl-FOXO1蛋白表达量,结果如图10所示,与对照组对比,ZEA组的SIRT1蛋白表达显著降低(<0.05),Acetyl-FOXO1蛋白表达极显著升高(<0.01);与ZEA组对比,Cur组SIRT1蛋白表达量均极显著升高(<0.01),Acetyl-FOXO1蛋白表达极显著降低(<0.01)。
3 讨论
ZEA是一种常见的真菌毒素,广泛存在于各种谷类作物中,并持续污染动植物食品,严重危害人类和动物健康。肾脏是机体重要的代谢器官,参与药物和毒素的代谢,比其他器官更容易受到毒素的侵害。之前的研究表明ZEA的毒性与氧化应激密切相关,具有抗氧化特性的化合物可有效地减轻这种真菌毒素的毒性作用[16-17]。因此,本研究旨在探讨抗氧化剂姜黄素对ZEA造成的PK-15细胞损伤的保护作用。
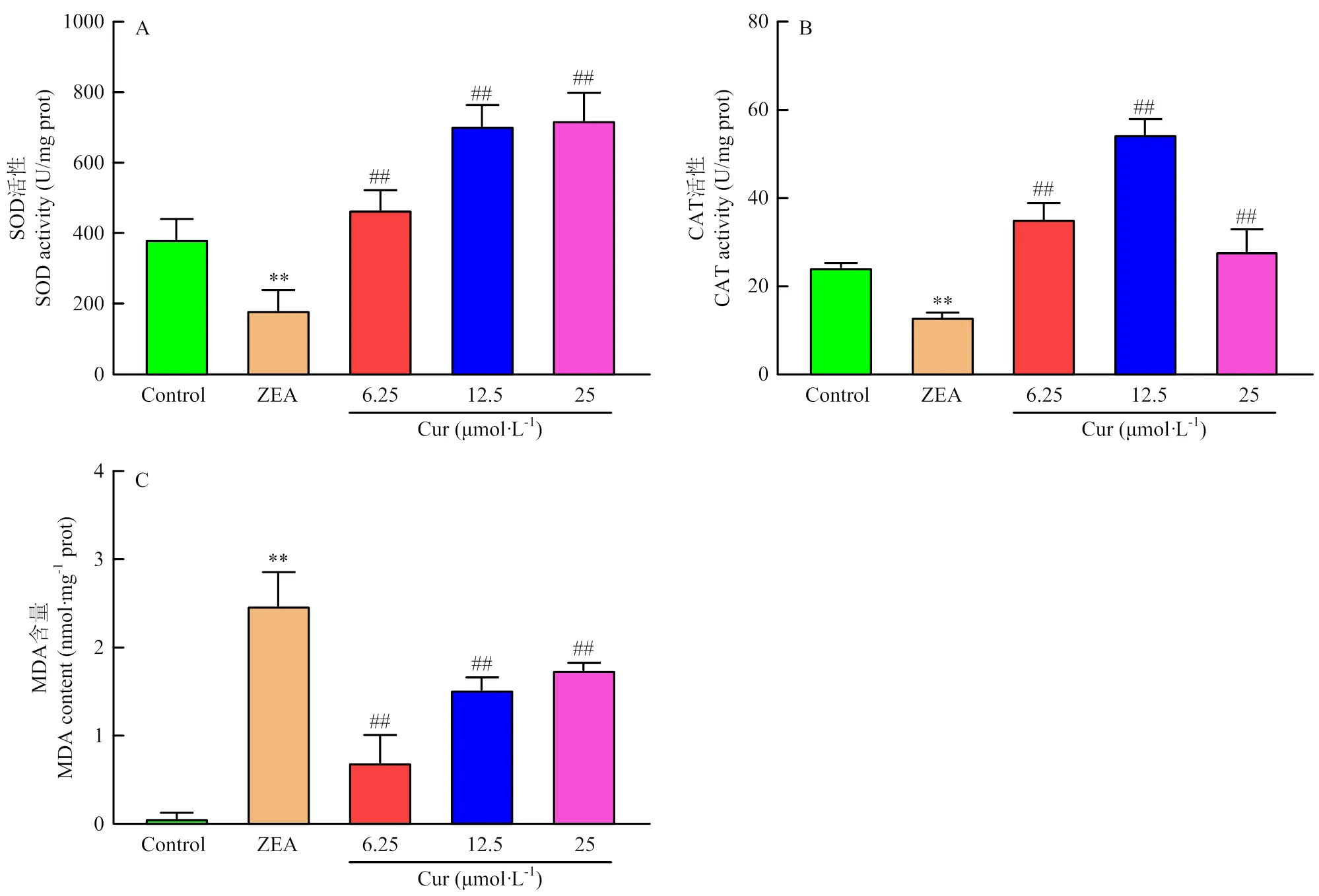
A:SOD活性 B:CAT活性 C: MDA含量
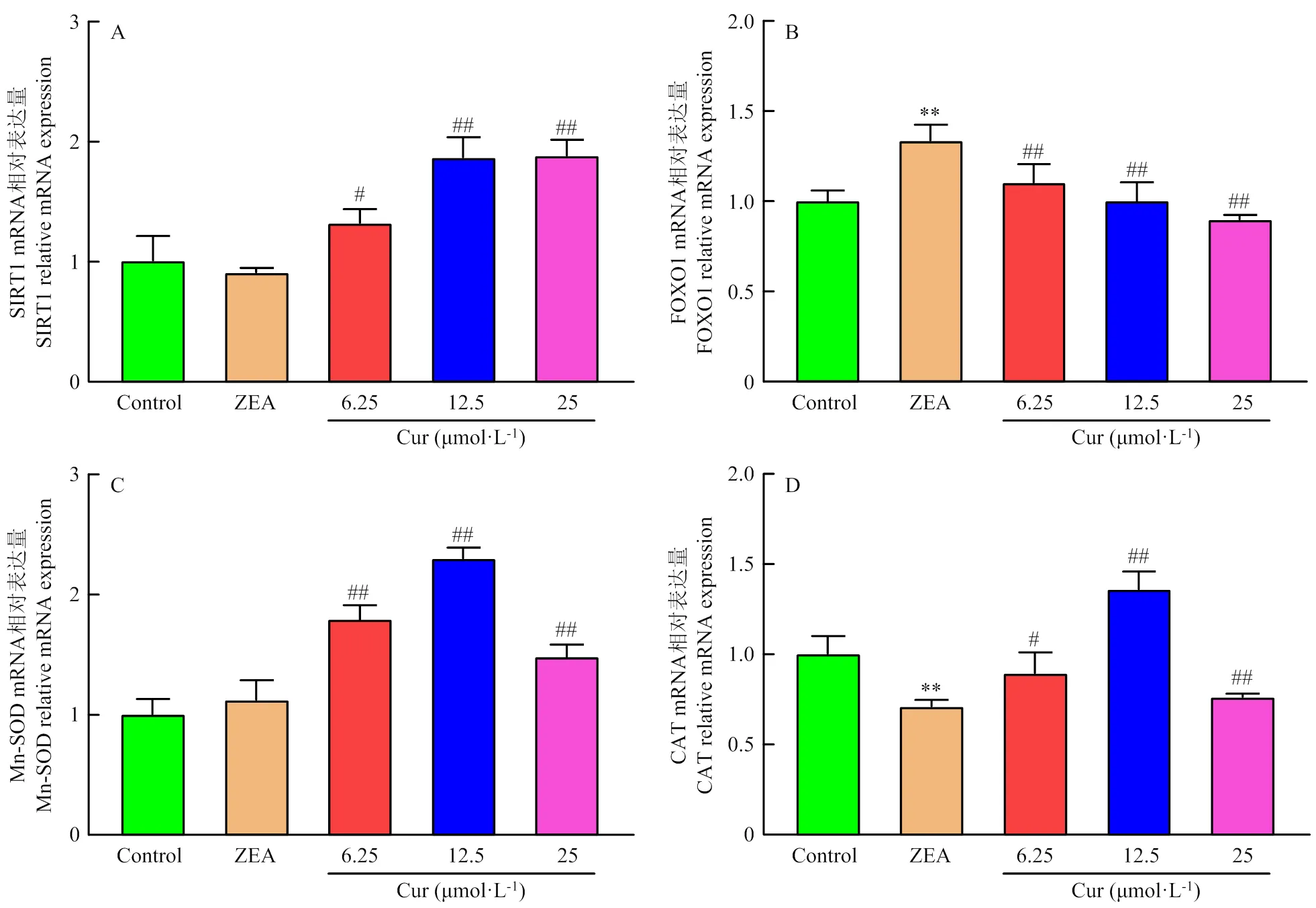
A:SIRT1 mRNA表达;B:FOXO1 mRNA表达;C:Mn-SOD mRNA表达;D:CAT mRNA表达
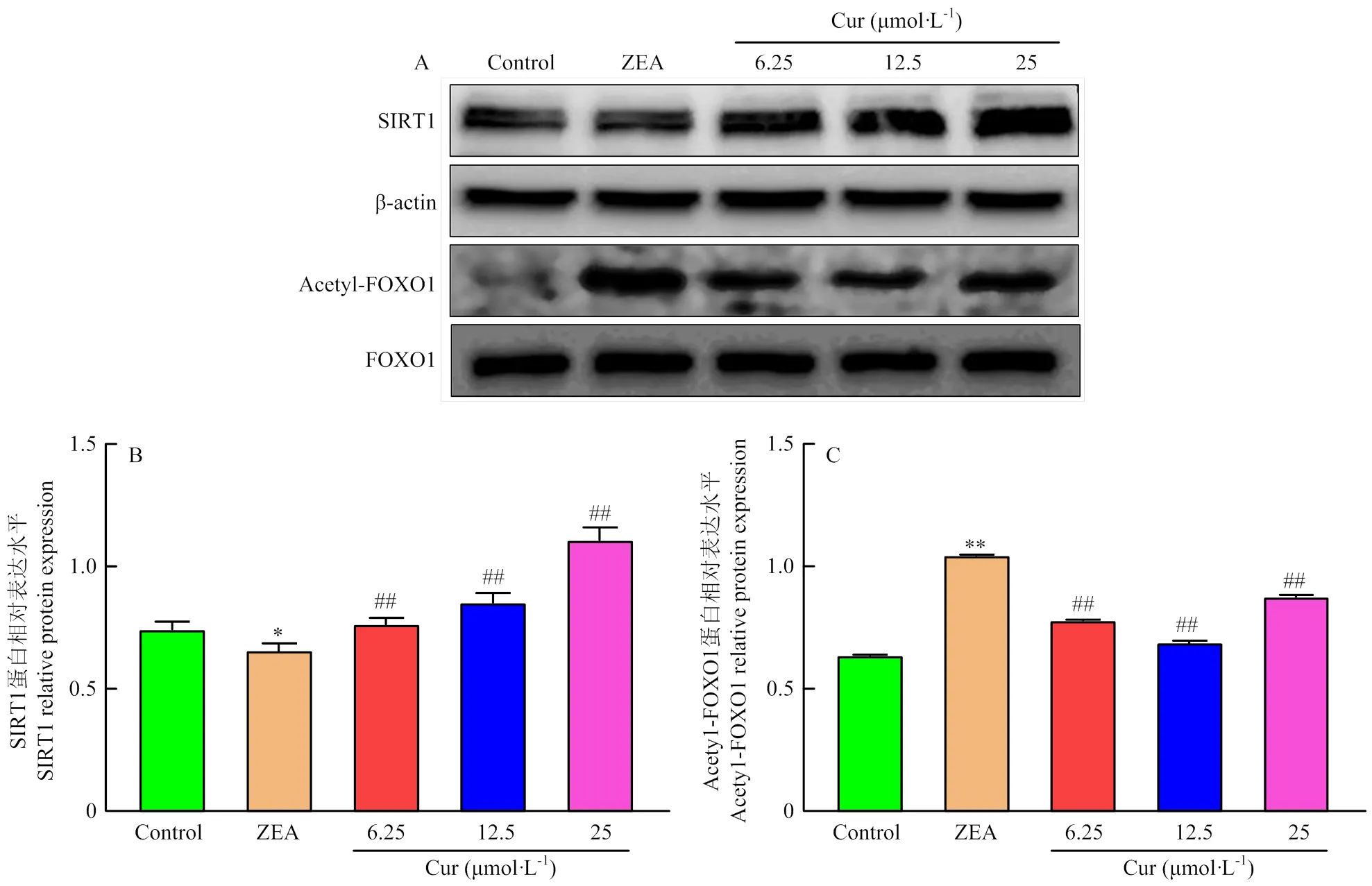
A:SIRT1,Acetyl-FOXO1和FOXO1的蛋白条带;B:SIRT1蛋白表达水平;C:Acetyl-FOXO1蛋白表达水平
3.1 ZEA对细胞的毒性作用
多项研究表明,在不同的细胞类型,不同的剂量的ZEA毒性作用机制不同。低浓度的ZEA及其衍生物能刺激细胞生长,在10-10—10-8mol·L-1浓度之间时,ZEA表现出明显的促进细胞增殖的活性[18]。ZEA能刺激T47D细胞生长,10-8mol·L-1组的细胞活力是对照组的2倍[19]。ZEA衍生物也能促进细胞生长,α-玉米赤霉醇(α-ZAL)是ZEA的衍生物之一,能有效刺激BMS细胞增殖,诱导成骨细胞分化,抑制破骨细胞形成[20]。α-玉米赤霉烯醇(α-ZEL),另一种ZEA衍生物,即使与对颗粒细胞生长有抑制作用的富马菌素B1(FB1)一起使用,依然对颗粒细胞的增殖有很强的刺激作用[21]。高浓度的ZEA则抑制细胞活力,导致细胞死亡。ZEA(15—60 mol·L-1)处理24 h后,睾丸支持细胞活力明显下降[22]。ZEA(3—300 mol·L-1)呈剂量依赖性降低HEK293细胞活力,其IC50值为80 μmol·L-1[23]。本试验中ZEA剂量依赖性的降低PK-15细胞活力,IC50为36.55 μg·mL-1,再次证明高浓度ZEA对细胞具有毒性作用。
3.2 ZEA的细胞毒性作用与氧化应激的关系
过往研究表明ZEA的细胞毒性与氧化应激密切相关。活性氧(ROS)的过量产生或抗氧化酶活性的缺乏会打破细胞内氧化还原的平衡导致氧化应激。ROS是高活性分子,其中氧自由基可破坏细胞结构,增加生物膜的脂质过氧化。本研究中ZEA作用于PK-15细胞,显著增加了细胞内ROS水平(图6和7)。SOD和CAT是细胞内重要的两种抗氧化酶,SOD将超氧化物分解为氧和H2O2,CAT将H2O2转化为水[24]。本试验中ZEA处理使SOD和CAT的活性分别下降了3倍和2倍(图8-A和B)。MDA作为脂质过氧化的最终产物,可引起细胞严重的膜结构损伤,改变细胞膜的通透性,导致细胞凋亡、坏死。因此,MDA含量的测定可以间接反映脂质过氧化程度[25]。本研究发现ZEA处理24 h后,PK-15细胞内的MDA水平升高了40倍(图8-C)。由以上可知,ZEA通过增加活性氧水平和脂质过氧化程度,降低过氧化物酶SOD和CAT的活性,对PK-15细胞产生毒性作用。
3.3 姜黄素可缓解ZEA诱导细胞产生的氧化应激作用
Cur是一种天然抗氧化剂,许多研究表明Cur能提升机体的抗氧化水平,有效清除机体内的活性氧(ROS)和活性氮(RNS)[26-29],提高抗氧化酶的活性,降低细胞毒性产物MDA的含量,从而发挥抗氧化作用[30]。本研究中Cur显著降低了ZEA诱导的ROS和MDA水平,提高了抗氧化酶SOD、CAT的活性,从而减轻了ZEA导致的PK-15细胞活力下降和细胞形态的改变。之前研究报道Cur可通过多条信号通路抑制氧化应激,如KEAP1-NRF2-ARE信号通路、NF-κB信号通路等[27]。Sirtuin家族于2000年首次在哺乳动物中发现,研究发现其可调控原核及真核生物的重要代谢途径,参与细胞衰老、增殖、凋亡、DNA修复、细胞代谢和氧化应激等多种生物学过程[31]。SIRT1作为Sirtuin家族重要的一员,是一种去乙酰化酶,可使FOXO1发生去乙酰化[13]。而去乙酰化的FOXO1会促进其下游靶基因Mn-SOD、CAT等的转录表达,但是长时间的去乙酰化会导致FOXO1 mRNA表达水平下降[32]。本试验发现Cur上调了SIRT1、Mn-SOD和CAT mRNA的表达和SIRT1的蛋白表达,下调了FOXO1 mRNA表达和Acetyl-FOXO1的蛋白表达,说明Cur激活了SIRT1/FOXO1信号通路。
综上所述,本研究结果表明Cur可通过激活SIRT1/FOXO1信号通路,上调SIRT1的表达,促使FOXO1去乙酰化,上调抗氧化酶Mn-SOD和CAT的活性,从而清除ZEA诱导生成的ROS,降低了细胞脂质过氧化水平,减轻了ZEA对PK-15细胞的毒性作用。
4 结论
Cur可有效缓解ZEA对PK-15细胞的氧化损伤作用,其保护机制是通过激活SIRT 1/FOXO 1抗氧化应激通路上调SIRT1的表达,引起FOXO1去乙酰化,上调其下游抗氧化酶Mn-SOD和CAT的表达,清除ROS,降低MDA水平,从而减轻ZEA对PK-15细胞的毒性作用。
[1] ZINEDINE A, SORIANO J M, MOLTÓ J C, MAÑES J. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of Zearalenone: An oestrogenic mycotoxin. Food and Chemical Toxicology, 2007, 45(1): 1-18. doi:10.1016/j.fct.2006.07.030.
[2] ALSHANNAQ A, YU J H. Occurrence, toxicity, and analysis of major mycotoxins in food. International Journal of Environmental Research and Public Health, 2017, 14(6): 632. doi:10.3390/ ijerph14060632.
[3] GRUBER-DORNINGER C, JENKINS T, SCHATZMAYR G. Global mycotoxin occurrence in feed: A ten-year survey. Toxins, 2019, 11(7): 375. doi:10.3390/toxins11070375.
[4] 王国强, 刘耀东, 段胜和. 2019年上半年饲料及饲料原料霉菌毒素污染及调查报告. 养猪, 2019(6): 17-20. doi:10.13257/j.cnki.21- 1104/s.2019.06.008.
WANG G Q, LIU Y D, DUAN S H. Mycotoxin contamination and investigation of feed and feed materials in the first half of 2019. Swine Production, 2019(6): 17-20. doi:10.13257/j.cnki.21-1104/s.2019.06. 008. (in Chinese)
[5] ROPEJKO K, TWARUŻEK M. Zearalenone and its metabolites- general overview, occurrence, and toxicity. Toxins, 2021, 13(1): 35. doi:10.3390/toxins13010035.
[6] KNUTSEN H K, ALEXANDER J, BARREGÅRD L, BIGNAMI M, BRÜSCHWEILER B, CECCATELLI S, COTTRILL B, DINOVI M, EDLER L, GRASL-KRAUPP B, et al. Risks for animal health related to the presence of Zearalenone and its modified forms in feed. EFSA Journal, 2017, 15(7): e04851. doi:10.2903/j.efsa.2017.4851.
[7] 姜淑贞, 孙华, 黄丽波, 杨在宾, 王淑静, 刘法孝, F.Chi. 不同水平玉米赤霉烯酮对断奶仔猪血清代谢产物和肝肾组织病理学影响. 中国农业科学, 2014, 47(18): 3708-3715. doi:10.3864/j.issn.0578- 1752.2014.18.019.
JIANG S Z, SUN H, HUANG L B, YANG Z B, WANG S J, LIU F X, F.CHI. Effects of Zearalenone contaminated diets on serum metabolite and histopathology of liver and kidney in weaned piglets. Scientia Agricultura Sinica, 2014, 47(18): 3708-3715. doi:10.3864/j.issn.0578- 1752.2014.18.019. (in Chinese)
[8] LIANG Z, REN Z H, GAO S, CHEN Y, YANG Y Y, YANG D, DENG J L, ZUO Z C, WANG Y, SHEN L H. Individual and combined effects of deoxynivalenol and Zearalenone on mouse kidney. Environmental Toxicology and Pharmacology, 2015, 40(3): 686-691. doi:10.1016/j.etap.2015.08.029.
[9] WANG N, LI P, PAN J W, WANG M Y, LONG M, ZANG J, YANG S H.velezensis A2 fermentation exerts a protective effect on renal injury induced by Zearalenone in mice. Scientific Reports, 2018, 8(1): 13646. doi:10.1038/s41598-018-32006-z.
[10] ZHENG W L, WANG B J, LI X, WANG T, ZOU H, GU J H, YUAN Y, LIU X Z, BAI J F, BIAN J C, LIU Z P. Zearalenone promotes cell proliferation or causes cell death? Toxins, 2018, 10(5): 184. doi: 10.3390/toxins10050184.
[11] ZHENG W L, WANG B J, SI M X, ZOU H, SONG R L, GU J H, YUAN Y, LIU X Z, ZHU G Q, BAI J F, BIAN J C, LIU Z P. Zearalenone altered the cytoskeletal structure via er stress- Autophagy-oxidative stress pathway in mouse TM4 sertoli cells. Scientific Reports, 2018, 8: 3320. doi:10.1038/s41598-018-21567-8.
[12] YU J J, AUWERX J. The role of sirtuins in the control of metabolic homeostasis. Annals of the New York Academy of Sciences, 2009, 1173: E10-E19. doi:10.1111/j.1749-6632.2009.04952.x.
[13] ZHANG X J, JIANG L S, LIU H M. Forkhead box protein O1: Functional diversity and post-translational modification, a new therapeutic target? Drug Design, Development and Therapy, 2021, 15: 1851-1860. doi:10.2147/DDDT.S305016.
[14] LICZBIŃSKI P, MICHAŁOWICZ J, BUKOWSKA B. Molecular mechanism of curcumin action in signaling pathways: Review of the latest research. Phytotherapy Research, 2020, 34(8): 1992-2005. doi:10.1002/ptr.6663.
[15] SIKORA-POLACZEK M, BIELAK-ZMIJEWSKA A, SIKORA E. Molecular and cellular mechanisms of curcumin action: Beneficial effect on organism. Postepy Biochemii, 2011, 57(1): 74-84.
[16] BEN SALEM I, PROLA A, BOUSSABBEH M, GUILBERT A, BACHA H, ABID-ESSEFI S, LEMAIRE C. Crocin and Quercetin protect HCT116 and HEK293 cells from Zearalenone-induced apoptosis by reducing endoplasmic reticulum stress. Cell Stress & Chaperones, 2015, 20(6): 927-938. doi:10.1007/s12192-015-0613-0.
[17] CAO L, ZHAO J, MA L, CHEN J W, XU J R, RAHMAN S U, FENG S B, LI Y, WU J J, WANG X C. Lycopene attenuates Zearalenone- induced oxidative damage of piglet Sertoli cells through the nuclear factor erythroid-2 related factor 2 signaling pathway. Ecotoxicology and Environmental Safety, 2021, 225: 112737. doi:10.1016/j. ecoenv.2021.112737.
[18] LECOMTE S, LELONG M, BOURGINE G, EFSTATHIOU T, SALIGAUT C, PAKDEL F. Assessment of the potential activity of major dietary compounds as selective estrogen receptor modulators in two distinct cell models for proliferation and differentiation. Toxicology and Applied Pharmacology, 2017, 325: 61-70. doi:10. 1016/j.taap.2017.04.005.
[19] KHOSROKHAVAR R, RAHIMIFARD N, SHOEIBI S, HAMEDANI M P, HOSSEINI M J. Effects of zearalenone and alpha-zearalenol in comparison with raloxifene on t47d cells. Toxicology Mechanisms and Methods, 2009, 19(3): 246-250. doi:10.1080/ 15376510802455347.
[20] ZONG S H, ZENG G F, FANG Y, PENG J Z, ZOU B, GAO T H, ZHAO J M. The effects of α-Zearalanol on the proliferation of bone-marrow-derived mesenchymal stem cells and their differentiation into osteoblasts. Journal of Bone and Mineral Metabolism, 2016, 34(2): 151-160. doi:10.1007/s00774-015-0659- 1.
[21] CORTINOVIS C, CALONI F, SCHREIBER N B, SPICER L J. Effects of fumonisin B1 alone and combined with deoxynivalenol or Zearalenone on porcine granulosa cell proliferation and steroid production. Theriogenology, 2014, 81(8): 1042-1049. doi:10.1016/j. theriogenology.2014.01.027.
[22] ZHENG W L, PAN S Y, WANG G G, WANG Y J, LIU Q, GU J H, YUAN Y, LIU X Z, LIU Z P, BIAN J C. Zearalenone impairs the male reproductive system functions via inducing structural and functional alterations of Sertoli cells. Environmental Toxicology and Pharmacology, 2016, 42: 146-155. doi:10.1016/j.etap.2016. 01.013.
[23] SANG Y Q, LI W Z, ZHANG G Y. The protective effect of resveratrol against cytotoxicity induced by mycotoxin, Zearalenone. Food & Function, 2016, 7(9): 3703-3715. doi:10.1039/c6fo00191b.
[24] QIN X S, CAO M J, LAI F N, YANG F, GE W, ZHANG X F, CHENG S F, SUN X F, QIN G Q, SHEN W, LI L. Oxidative stress induced by Zearalenone in porcine granulosa cells and its rescue by curcumin. PLoS ONE, 2015, 10(6): e0127551. doi:10.1371/ journal.pone.0127551.
[25] WANG J J, LI M M, ZHANG W, GU A X, DONG J W, LI J P, SHAN A S. Protective effect of N-acetylcysteine against oxidative stress induced by Zearalenone via mitochondrial apoptosis pathway in SIEC02 cells. Toxins, 2018, 10(10): 407. doi:10.3390/ toxins10100407.
[26] ZHENG S Z, FU Y M, CHEN A P. De novo synthesis of glutathione is a prerequisite for curcumin to inhibit hepatic stellate cell (HSC) activation. Free Radical Biology and Medicine, 2007, 43(3): 444-453. doi:10.1016/j.freeradbiomed.2007.04.016.
[27] SAHIN K, ORHAN C, TUZCU Z, TUZCU M, SAHIN N. Curcumin ameloriates heat stress via inhibition of oxidative stress and modulation of Nrf2/HO-1 pathway in quail. Food and Chemical Toxicology, 2012, 50(11): 4035-4041. doi:10.1016/j.fct.2012.08. 029.
[28] 张婧菲. 姜黄素对动物线粒体氧化损伤的保护作用及其抗氧化机制研究[D]. 南京: 南京农业大学, 2015.
ZHANG J F. The protective effects of curcumin on mitochondrial oxidant damages in animals and the potential antioxidant mechanism[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[29] 李光辉, 钟秀伶, Aamir Nawab, 赵一, 效梅, 刘文超, 兰瑞霞, 吴江, 安立龙. 姜黄素对罗曼蛋鸡血液和组织抗氧化性能的影响. 安徽农业科学, 2018, 46(21): 96-99. doi:10.3969/j.issn.0517-6611.2018. 21.027.
LI G H, ZHONG X L, NAWAB A, ZHAO Y, XIAO M, LIU W C, LAN R X, WU J, AN L L. Effects of curcumin on the antioxidant properties in the blood and tissues of Roman laying hens. Journal of Anhui Agricultural Sciences, 2018, 46(21): 96-99. doi:10.3969/j.issn. 0517-6611.2018.21.027. (in Chinese)
[30] 姜春晖, 孙旭东, 唐燕, 罗胜缤, 徐闯, 陈媛媛. 姜黄素通过Nrf2信号通路对H2O2诱导奶牛乳腺上皮细胞氧化应激的缓解. 中国农业科学, 2021, 54(8): 1787-1794. doi:10.3864/j.issn.0578-1752.2021. 08.017.
JIANG C H, SUN X D, TANG Y, LUO S B, XU C, CHEN Y Y. Curcumin alleviates H2O2-induced oxidative stress in bovine mammary epithelial cells via the Nrf2 signaling pathway. Scientia Agricultura Sinica, 2021, 54(8): 1787-1794. doi:10.3864/j.issn.0578-1752.2021. 08.017. (in Chinese)
[31] CARAFA V, ROTILI D, FORGIONE M, CUOMO F, SERRETIELLO E, HAILU G S, JARHO E, LAHTELA-KAKKONEN M, MAI A, ALTUCCI L. Sirtuin functions and modulation: from chemistry to the clinic. Clinical Epigenetics, 2016, 8: 61. doi:10.1186/s13148-016- 0224-3.
[32] CHEN J Y, LU Y, TIAN M Y, HUANG Q R. Molecular mechanisms of FOXO1 in adipocyte differentiation. Journal of Molecular Endocrinology, 2019, 62(3): R239-R253. doi:10.1530/JME-18-0178.
Curcumin Alleviates Zearalenone-Induced Oxidative Damage in Porcine Renal Epithelial Cells via SIRT1/FOXO1 Pathway
CUI HongJie1, 2, LU ChunTing1, PAN LiQin1, HU Hui1, ZHONG PeiYun1, ZHU JieYing1, ZHANG KaiZhao1, 2, HUANG XiaoHong1, 2
1College of Animal Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002;2University Key Laboratory for Integrated Chinese Traditional and Western Veterinary Medicine and Animal Healthcare in Fujian Province/Fujian Key Laboratory of Traditional Chinese Veterinary Medicine and Animal Health, Fujian Agriculture and Forestry University, Fuzhou 350002
【Objective】 The purpose of this study was to investigate the protective effect of curcumin (Cur) on zearalenone (ZEA)-induced oxidative damage in porcine renal epithelial cells (PK-15), and to elucidate the protective mechanism based on SIRT1/FOXO1 signaling pathway. 【Method】 The experiment was divided into 5 groups: control group, ZEA group (36.55 μg·mL-1ZEA), Cur6.25 group (36.55 μg·mL-1ZEA+6.25 μmol·L-1Cur), Cur12.5 group (36.55 μg·mL-1ZEA+12.5 μmol·L-1Cur), and Cur25 group (36.55 μg·mL-1ZEA +25 μmol·L-1Cur). MTT assay was used to determine the half inhibitory concentration of ZEA and the maximum safe concentration of Cur on PK-15 cells. The morphological changes were observed by inverted microscope. The levels of intracellular reactive oxygen species (ROS), superoxide dismutase (SOD), catalase (CAT), and malondialdehyde (MDA) were detected by the reagent kits. Real-time quantitative PCR was used to detect the mRNA levels of SIRT1, FOXO1, CAT and Mn-SOD. The expression levels of SIRT1, FOXO1 and Acetyl-FOXO1 proteins were detected by Western Blot. 【Result】 The IC50 of ZEA was 36.55 μg·mL-1, and the maximum safe concentration of Cur was 25 μmol·L-1. Compared with the control group, ZEA significantly decreased the cell viability of PK-15 cells (<0.01), significantly increased the levels of ROS and MDA (<0.01), and significantly decreased the activities of SOD and CAT (<0.01). Compared with ZEA group, the different concentrations of Cur (6.25, 12.5, 25 μmol·L-1) significantly increased the cell viability of PK-15 cells (<0.05) and improved the cell morphology. ROS and MDA levels induced by ZEA were also significantly reduced by Cur (<0.01). Moreover, SOD and CAT activities in cells were significantly increased (<0.01). qRT-PCR results showed that, compared with the control group, ZEA decreased SIRT1 mRNA expression, significantly increased FOXO1 mRNA expression (<0.01), increased Mn-SOD mRNA expression, and significantly decreased CAT mRNA expression (<0.01). Compared with ZEA group, mRNA expression levels of SIRT1 and CAT were increased in different degrees, FOXO1 mRNA expression levels were significantly decreased (<0.01), and Mn-SOD mRNA expression levels were significantly increased (<0.01) in all Cur groups. Western Blot results showed that ZEA significantly reduced SIRT1 protein expression (<0.05), and significantly increased Acetyl-FOXO1 protein expression (<0.01). Compared with ZEA group, SIRT1 protein expression was significantly increased (<0.01), while Acetyl-FOXO1 protein expression was significantly decreased (<0.01) in all Cur groups.【Conclusion】 Cur could up-regulate the expression of SIRT1, reduce the acetylation level of FOXO1, and induce the expression of antioxidant enzymes Mn-SOD and CAT, thereby eliminating ROS, reducing the level of MDA, and alleviating the oxidative damage of ZEA on PK-15 cells.
curcumin; zearalenone; oxidative stress; silencing information regulator 1 (SIRT1)

10.3864/j.issn.0578-1752.2023.05.015
2021-10-21;
2022-05-17
福建省科技厅重大专项(2021NZ029008)、福建省自然科学基金(2021J01080)、福建省中青年教师教育科研项目(JAT210066)、横向课题项目(KH190363A)
崔红杰,Tel:13696892917;E-mail:tsuisearcher@163.com。通信作者黄小红,Tel:13774550003;E-mail:984158392@qq.com
(责任编辑 林鉴非)
