血清CYR61、suPAR、8-OHdG联合检测在AECOPD并发肺动脉高压患者中的临床应用*
2023-03-14王明明刘灵芝易小明赵钢艳
王明明,刘灵芝,易小明,赵钢艳,高 辉
湖南中医药高等专科学校附属第一医院/湖南省直中医医院:1.检验科;2.呼吸内科,湖南株洲 412000
慢性阻塞性肺疾病(COPD)为慢性呼吸系统疾病,主要特征为气流阻塞,患者表现为慢性咳嗽、喘息等症状,进一步可发展为呼吸衰竭、肺性脑病、肺源性心脏病等,严重者甚至导致死亡[1-2]。慢性阻塞性肺疾病急性加重期(AECOPD)是COPD最为严重的状态,患者因呼吸道急性感染而气流受限,导致急性加重,对生活质量有严重影响[3-4]。肺动脉高压(PH)为AECOPD常见并发症,与机体慢性炎症、氧化应激反应有关,增加患者致残与致死率,故早期诊断并监测PH对改善AECOPD患者预后极为重要[5]。右心导管检查为确诊PH金标准,但该方式操作较为复杂,且对机体有创,不适用于早期诊断[6]。超声心动图为评估PH的常用筛查方式,但有一定局限性[7]。血清标志物检测方法简便快捷,且价格低廉,能重复测定并动态监测,广泛用于临床检验[8]。故寻找操作简便的有效指标对早期评估AECOPD并发PH患者病情变化与严重程度具有重要价值。富半胱氨酸蛋白61(CYR61)在肺脏不同细胞与细胞外基质中表达,可调控细胞生长、分化等多种生理功能,且在部分炎性疾病中表达上调[9]。可溶性尿激酶型纤溶酶原激活物受体(suPAR)是源于未成熟的髓系细胞中循环信号分子,能介导纤溶酶原发生反应,为新型炎症标志物[10]。8-羟基脱氧鸟苷酸(8-OHdG)为脱氧核糖核酸(DNA)氧化损伤的重要标志物,是核苷酸氧化应激损伤结果,可反映机体代谢与修复力下降[11]。有关CYR61、suPAR、8-OHdG在AECOPD并发PH中的研究较少。本研究通过检测AECOPD并发PH患者的CYR61、suPAR、8-OHdG水平,探究其在该病患者中的应用,进而为临床防治提供依据。
1 资料与方法
1.1一般资料 选取2019年1月至2022年3月本院收治的158例AECOPD患者作为研究对象,其中男87例,女71例;年龄47~76岁,平均(64.74±10.61)岁。按参考文献[12]中分组标准,根据肺动脉收缩压(PASP)检测结果将AECOPD患者分为AECOPD组(n=102,PASP<36 mm Hg)与并发PH组(n=56,PASP≥36 mm Hg);并发PH组按PASP进一步分为3个亚组:PASP 35~45 mm Hg为轻度组(19例);PASP>45~55 mm Hg为中度组(24例);PASP>55 mm Hg为重度组(13例)。纳入标准:(1)符合《慢性阻塞性肺疾病诊治指南》[13]中COPD诊断标准,且患者处于急性加重期;PH患者符合《中国肺高血压诊断和治疗指南2018》标准[14],且经超声检查确诊;(2)年龄40~80岁;(3)患者临床资料完整,且知情同意。排除标准:(1)其他心血管疾病及呼吸系统患者;(2)其他疾病导致的PH患者;(3)其他部位严重感染患者;(4)近期服用抗血小板聚集与抗凝药物患者;(5)恶性肿瘤患者;(6)精神病史患者。另选取60例体检健康者作为健康组,其中男36例,女24例;年龄45~77岁,平均(65.12±10.24)岁。AECOPD患者与体检健康者性别、年龄资料比较差异无统计学意义(P>0.05),具有可比性。本院伦理委员会已批准本研究。
1.2方法
1.2.1资料收集 收集AECOPD患者入院时的性别、年龄、吸烟史、心率、肺功能指标、血气指标及血清学指标等资料。
1.2.2PASP检测 使用彩色超声仪(迈瑞公司,Resona7型号)检查,经三尖瓣反流速度压差法测量PASP;观察血流状态,连续测量三尖瓣最大反流速度(V),根据呼吸变异度与下腔静脉切面直径估算心房压(RAP),利用简易伯努利方程计算ΔP,ΔP=4×V2,按照4V2+RAP计算出平均肺动脉压[15]。
1.2.3血清标本采集与测定 收集健康组体检当日、AECOPD患者清晨空腹肘静脉血2 mL,分别保存在无菌试管内放置室温下静置2 h,以3 000 r/min的转速离心10 min后,离心半径10 cm,取上层清液放于EP管内,标记后放置冰箱中(-80 ℃)冷冻环境中保存,采用酶联免疫吸附试验及试剂盒检测血清CYR61、suPAR、8-OHdG水平,CYR61试剂盒来自上海活乐生物科技有限公司,suPAR试剂盒来自丹麦ViroGates公司,8-OHdG试剂盒来自宁波瑞源生物科技有限公司;操作严格按试剂盒说明书进行。
1.2.4肺功能检查 使用肺功能检测仪(伟业安医疗公司/Master screen Ses型号)检测患者第1秒用力呼气容积(FEV1)及用力肺活量(FVC),并计算其FEV1/FVC。
1.2.5动脉血气分析 于AECOPD患者肱动脉或桡动脉位置进针,抽取其2 mL动脉血,试管内加肝素抗凝,记录AECOPD患者氧浓度、体温,采用血气分析仪(美国GEM公司/GEM3500型号)检测动脉血氧分压与动脉二氧化碳分压。

2 结 果
2.1各组血清CYR61、suPAR、8-OHdG水平比较 AECOPD组与并发PH组血清CYR61、suPAR、8-OHdG水平高于健康组,差异有统计学意义(P<0.05);并发PH组CYR61、suPAR、8-OHdG水平高于AECOPD组,差异有统计学意义(P<0.05)。见表1。

表1 各组血清CYR61、suPAR、8-OHdG水平比较
2.2不同程度PH患者血清CYR61、suPAR、8-OHdG水平比较 中度组、重度组血清CYR61、suPAR、8-OHdG水平高于轻度组,差异有统计学意义(P<0.05);重度组CYR61、suPAR、8-OHdG水平高于中度组,差异有统计学意义(P<0.05)。见表2。

表2 不同程度PH患者血清CYR61、suPAR、8-OHdG水平比较
2.3单因素分析AECOPD并发PH的影响因素 AECOPD组与并发PH组的性别、年龄、心率、吸烟史比较,差异无统计学意义(P>0.05),两组PASP、FEV1、FEV1/FVC、动脉血氧分压、动脉二氧化碳分压、CYR61、suPAR、8-OHdG水平比较,差异有统计学意义(P<0.05)。见表3。

表3 单因素分析AECOPD并发PH的影响因素
2.4AECOPD并发PH的多因素Logistic回归分析 以PASP、FEV1、FEV1/FVC、动脉血氧分压、动脉二氧化碳分压及血清CYR61、suPAR、8-OHdG水平为连续自变量,均为原值输入;有无并发PH为因变量,其中有=1,无=0,行Logistic回归分析,结果显示PASP、CYR61、suPAR、8-OHdG水平为AECOPD并发PH的独立影响因素(P<0.05)。见表4。

续表3 单因素分析AECOPD并发PH的影响因素

表4 AECOPD并发PH的多因素Logistic回归分析
2.5血清CYR61、suPAR、8-OHdG对AECOPD并发PH的鉴别价值分析 另以该3个指标数据建立Logistic回归预测(诊断评估)模型,并以连续数值原型输入,因变量同2.4节设计,回归预测模型结果见表5。由该回归预测模型获知Log(P/1-P)=0.025+0.044×CYR61+0.205×suPAR+0.087×8-OHdG,并进行ROC曲线分析和曲线下面积(AUC)计算。分析结果显示,血清CYR61、suPAR、8-OHdG 单独及联合应用时,对AECOPD并发PH的诊断评估价值:ROC曲线的AUC(95%CI)分别为0.726(0.496~0.931)、0.753(0.514~0.986)、0.715(0.510~0.911)、0.866(0.798~0.925)。3个指标联合应用对AECOPD并发PH的诊断评估效能更高,AUC及灵敏度、特异度、准确度均较各指标单独应用有明显提升。见表6和图1。

图1 血清CYR61、suPAR、8-OHdG及3个指标联合应用对AECOPD并发PH的诊断评估的ROC曲线分析
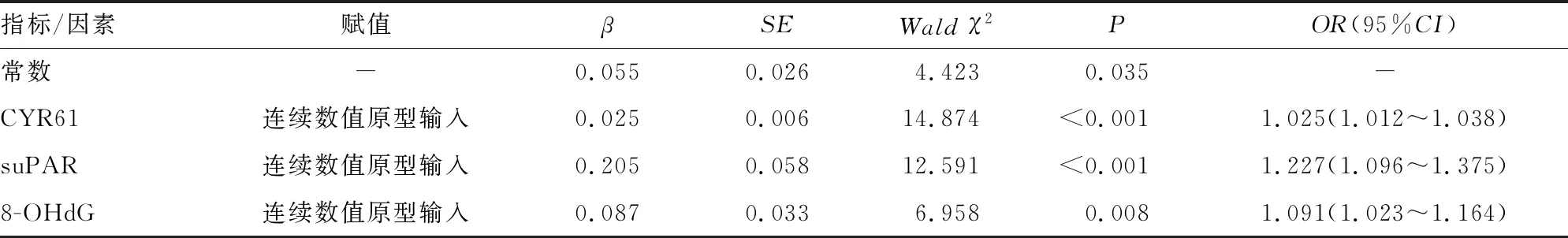
表5 血清CYR61、suPAR、8-OHdG联合应用对AECOPD并发PH的诊断评估的回归预测模型结果

表6 血清CYR61、suPAR、8-OHdG及其联合应用对AECOPD并发PH的诊断评估的ROC曲线分析

续表6 血清CYR61、suPAR、8-OHdG及其联合应用对AECOPD并发PH的诊断评估的ROC曲线分析
3 讨 论
COPD为严重危害人类健康的慢性呼吸系统疾病,随着近年来空气污染加重与吸烟人群增加,该病发病率呈上升趋势[16-17]。而该病主要病变在肺部,随着临床对COPD的认识逐渐从单纯肺疾病转为复发且具有一致性的全身疾病,故更重视COPD肺外症状与合并症。AECOPD是根据既往病史与临床症状诊断的特异性疾病,发病原因较多,主要诱因为呼吸道感染,严重者出现呼吸衰竭等急性加重症状[18]。PH为AECOPD常见并发症,发病机制复杂,是多因素导致的肺动脉压异常上升的病理生理状态,呼吸系统疾病为PH发病的主要原因之一。PH发病机制涉及多因素,主要为肺血管内皮细胞损伤后机体分泌的多种血管舒缩因子紊乱,使早期肺部血管收缩过度而血管重构[19]。AECOPD并发PH时,患者心肺功能损伤更为严重,具有明显的全身症状,急性加重频繁,且病死率更高。PH严重程度对患者预后有直接影响,PH严重程度与预后成正比[20-21]。右心导管检测为诊断PH的金标准,但该方式对机体有较大创伤性,重复性较差,无法作为常规检查方式[6]。对肺部疾病或低氧导致的PH患者,临床多采用超声心动图测量三尖瓣反流速度以评估PH,但对危重症及无法移动患者存在一定局限性。故早期诊疗AECOPD患者有无并发PH对延缓病情并延长患者生存时间具有重要价值。
CYR61在生理状态下可参与肺泡成熟与细胞外基质生成,不同病理下借助不同细胞异常表达以发挥多种调控作用。因CYR61具有特殊的结构,其受体多样性,广泛参与炎性反应、组织重塑、血管生成等病理生理过程,特别是与多种炎症有关,是新型炎症调节因子[22-23]。本研究中AECOPD组与并发PH组血清CYR61水平高于健康组,且并发PH组CYR61水平高于AECOPD组,提示CYR61可能参与COPD发病过程。作用机制可能为CYR61特殊的结构与多样性受体而参与炎性反应等,CYR61表达上调以诱发一系列炎性反应,诱导COPD发生发展。suPAR位于单核与中性粒等多细胞表面的多功能受体,可反映机体免疫活动。suPAR在肺结核等传染性疾病诊断中具有标识作用,且对评估诊断AECOPD发挥积极效果[24-25]。本研究中AECOPD组与并发PH组血清suPAR水平高于健康组,且并发PH组suPAR水平高于AECOPD组。原因为呼吸道感染引发免疫活动,机体肺部淋巴细胞处于高表达状态,且COPD患者急性加重导致血清suPAR水平上升。COPD患者易发生氧化应激,而8-OHdG不仅为氧化应激的重要标志物,也是代谢与修复力下降的重要标志。机体出现氧化应激会产生大量活性氧,活性氧经毒性作用对周围组织有损伤作用,进而使DNA氧化损伤并出现细胞凋亡[26-27]。研究显示,本研究中AECOPD组与并发PH组血清8-OHdG水平高于健康组,且并发PH组8-OHdG水平高于AECOPD组,提示AECOPD并发PH患者血清8-OHdG水平上升,其可能参与COPD发病过程。
本研究显示,并发PH组患者PASP、动脉二氧化碳分压、CYR61、suPAR、8-OHdG水平高于AECOPD组,FEV1、FEV1/FVC、动脉血氧分压低于AECOPD组,进一步行多因素Logistic回归分析显示,PASP、CYR61、suPAR、8-OHdG水平为AECOPD并发PH患者的独立影响因素。肺功能为评估诊断COPD客观指标,但大多数患者由于肺功能检查不足而无法诊断,导致不能得到有效及时治疗[28]。肺功能指标中FEV1/FVC随年龄增长而下降,年龄不足50岁患者诊断不足,高龄患者过度诊断,故肺功能指标不是影响AECOPD并发PH的独立影响因素。当AECOPD并发PH患者机体血清指标变化较大,出现动脉血氧分压降低,二氧化碳分压上升,需通气以改善患者通气障碍以纠正其呼吸衰竭,减轻缺氧程度并改善血气指标[29]。PASP是影响AECOPD并发PH的独立因素,原因与PH引发肺血管阻力增加有关[30]。ROC曲线及联合应用的回归预测模型分析显示,血清CYR61、suPAR、8-OHdG单独及联合应用时,对AECOPD并发PH的诊断评估价值:ROC曲线的AUC(95%CI)分别为0.726(0.496~0.931)、0.753(0.514~0.986)、0.715(0.510~0.911)、0.866(0.798~0.925)。其中3个指标联合应用诊断评估效能很高,AUC及灵敏度、特异度、准确度均较各指标单独应用有明显提升。该结果提示早期检测AECOPD患者血清CYR61、suPAR、8-OHdG水平可预测其是否并发PH风险,可考虑动态监测CYR61、suPAR、8-OHdG水平,当发现3个指标水平异常上升,可提前采取干预措施以降低PH发生风险。
综上所述,AECOPD并发PH患者血清CYR61、suPAR、8-OHdG水平上升,可能参与PH发生发展过程,且不同程度PH患者血清水平存在差异,3个指标联合应用对AECOPD并发PH的诊断价值更高,可作为临床辅助鉴别疾病的有效指标。本研究由于为横断面研究,未对疾病治疗后效果进行评估,也未对患者生存情况进行随访,后续应扩大样本量,进一步行多中心深入研究。
