Sweet综合征3例病例报告
2023-03-11徐小燕穆传勇
徐小燕 穆传勇
Sweet综合征又称急性发热性嗜中性皮病,是发热、外周血中性粒细胞增多、急性发作的皮肤触痛性红斑病变(丘疹、结节或斑块),主要由成熟中性粒细胞浸润的组织学表现[1]。1964年Robert Douglas Sweet首次提出这个综合征。几乎所有器官都能累及[2]。全身症状:发热最常见;关节痛[3]:单个或多个关节受累,如手、手腕、脚踝、膝盖和肩膀;肌肉疼痛;眼部病变:如结膜炎、巩膜外炎、葡萄膜炎、角膜缘结节和炎性青光眼[4]。皮肤外主要累及肾脏:出现血尿、蛋白尿、肾功能不全等;累及肠道:出现炎症性肠病等;累及肝脏:出现肝脏活检出中性粒细胞浸润等;累及心脏:出现心肌炎等[5];累及中枢神经系统:出现无菌性脑膜炎等[6];累及肺部:出现肺部感染、机化性肺炎[7]、活动性肺结核、呼吸衰竭等。临床表现多样,因此早期识别并诊断十分重要。现将苏州大学附属第一医院2018年1月至2022年1月收治的Sweet 综合征的3例患者诊治过程报道如下,并结合相关文献进行复习,以提高对此病的认识。
病例资料
例1,男性,46岁,既往体健,有烟酒嗜好,烟酒少许。2020年10月9日因“高热伴咳嗽咳痰和呼吸困难半个月”入院。入院前患者曾接受过其它医院抗感染等治疗,效果不明显。高烧持续不退数天,呼吸困难症状逐渐恶化,血压进行性下降,进入呼吸与危重症ICU进行治疗。入院实验室检查:血红蛋白 114 g/L,白细胞计数18.85×109/L,中性粒细胞18.44×109/L (淋巴细胞百分比 0.9%, 单核细胞百分比 0.7%, 中性粒细胞百分比 97.8%, 嗜酸性细胞百分比 0.0%),血小板计数 124×109/L,血沉(魏氏法) 81 mm/h ,C-反应蛋白 290.51 mg/L,降钙素原 2.07 ng/mL,肌酐49.9 μmol/L,白蛋白 27.5 g/L,乳酸脱氢酶 310.3 U/L。G/GM实验、T-SPOT实验、肥达试验等均为阴性。胸部CT示:左下肺腹主动脉旁感染可能,右肺胸膜下及左肺多发小结节。
入院后完善相关辅助检查,纤维支气管镜示:(左肺背段粘膜)慢性炎伴纤维组织增生;(ES3组织)送检:极少量炎性渗出及出血组织及个别支气管粘膜固有腺体。肺泡灌洗液高通量测序(NGS):人葡萄球菌、肺炎克雷伯杆菌。外周血NGS:近平滑念珠菌、布拉克枸橼酸杆菌。入院后多次查胸部CT,病变呈游走性,但左下肺原发病灶持续存在,两次CT定位下经皮肺穿刺活检示:送检肺组织弥漫性肺间质中性粒细胞浸润,肺泡腔内见多量纤维素性渗出及多量中性粒细胞浸润,局灶肺实质炎性坏死,局灶小肺动脉闭塞性炎症,组织学倾向大叶性肺炎灰色肝样变期(见图1)。住院期间淋巴细胞计数始终处于低位,伴血清铁蛋白明显升高,骨髓穿刺示:慢淋与淋巴瘤免疫分型组套:CD45+/SSC低,(成熟淋巴)比例 2.9%,未见异常表达。PET-CT未见全身淋巴结肿大,结合多次骨穿、血涂片结果排除血液疾病。

图1 A、B:肺穿刺活检(A、B均为HE染色,放大倍数×40):慢性炎伴肺泡上皮增生、间质纤维化,局灶见凝固性坏死。
患者最初接受抗生素(头孢类抗生素)治疗肺部感染,无改善。入院后1月内反复出现高热,先后使用比阿培南、美罗培南、利奈唑胺、莫西沙星、万古霉素、伏立康唑、卡泊芬净、复方黄胺甲噁唑、替加环素、达托霉素等抗生素抗感染,CT提示肺部病变多样性。经验性使用甲泼尼龙80mg/d治疗,发热症状有所控制,激素稍减量后病情反复,并逐渐加重,后激素加至120mg/d,仍然有间断性发热。间断发热1月后,患者面部气管插管绑带处出现红色皮损,以及右侧腹股沟深静脉置管处伤口一直未愈合,伴有白色脓苔样硬块。起初未能引起我们注意。患者发热、肺部受累等症状一直未明确诊断,1月内给予激素减量处理,缓慢减量至20mg/d,生命体征平稳,精神状态良好,维持2周左右后患者突然病情恶化,血压不稳定,左侧前臂、左侧腹股沟处可见类圆形皮损,皮损中心部位呈黑色坏死样,周围有明显红晕。右侧上臂皮损直径约4cm×4cm,中心呈黑色坏死样,周围有散在白色脓疱样改变,外周有明显红晕,皮下可触及硬结,活动度差。上述皮损均有触痛。腹部见散在瘀点。左前臂及腹股沟皮肤活检示:见大量中性粒细胞浸润,个别血管闭塞伴炎细胞浸润(图2,3)。符合Sweet综合征诊断标准[8]。
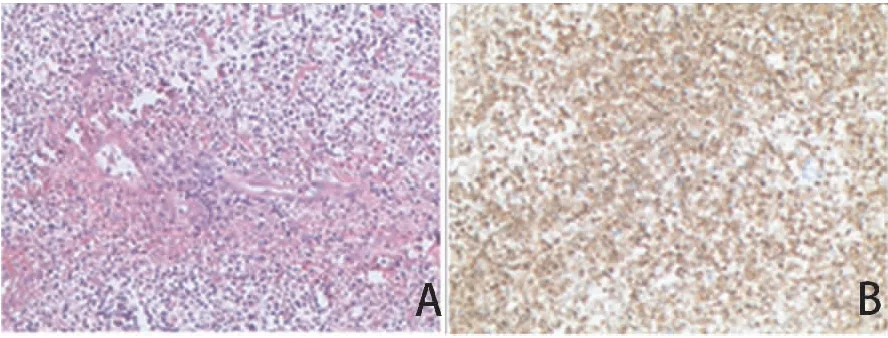
图2 A、B:左侧腹股沟皮肤活检(A为HE染色,放大倍数×100;B为免疫细胞化学染色,放大倍数×100):急性化脓性炎,部分表皮剥脱,真皮层附件区脂肪层均见大量中性粒及脓细胞及炎性坏死,局灶中-小静脉壁破坏伴出血及炎细胞浸润。
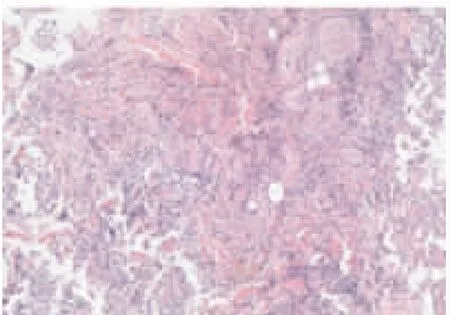
图3 左前臂活检(HE染色,放大倍数×40):真皮层见大量中性粒细胞浸润。
明确病因后尽管进行了大剂量激素冲击(500 mg/d),全身抗生素治疗,气管插管辅助通气,体外膜肺氧合(Extracorporeal Membrane Oxygenation,ECMO),连续性肾脏替代治疗(Continuous Renal Replacement Therapy,CRRT)以及最大程度的重症监护,但患者病情恶化,最终死于严重休克,多脏器功能衰竭。
例2,男性,27岁,既往体健,吸烟8年,15支/日,偶饮酒,少量。2020年9月20日因“反复发热伴左侧睾丸肿痛及双下肢皮疹20天”入院。20天前患者出现高热,热峰40℃,寒战、乏力,同时伴有左侧睾丸肿痛。双下肢皮疹伴红肿,突出皮肤表面,伴有瘙痒,逐渐连结成片,触之疼痛。至当地查血细胞分析提示:白细胞计数7.69×109/L,中性粒细胞6.6×109/L,C-反应蛋白 58.7 mg/L,当地医院予以环丙沙星联合哌拉西林他唑巴坦抗感染、止痒、对症降温等治疗,效果不佳。请皮肤科会诊后,行皮肤活检,考虑Sweet综合征,予以甲泼尼龙80mg静滴,后逐渐减量至口服强的松10mg bid。近期患者发热反复,控制不佳,遂至我院就诊。查体:双下肢皮疹基本消退,呈暗红色,残留少量皮屑,无瘙痒,左侧睾丸轻微肿大伴疼痛。胸部CT:右下肺、左上肺纯磨玻璃密度结节(pGGN);右中肺少许纤维灶;胸腺退化不全。完善睾丸B超提示:双侧睾丸、双侧附睾未见明显异常。双侧精索静脉未见明显曲张。入院后完善相关实验室检查:血红蛋白121 g/L,白细胞计数9.73×109/L,中性粒细胞6.3×109/L (中性粒细胞百分比 64.7%, 嗜酸性细胞百分比 0.0),血小板计数 306×109/L,血沉(魏氏法)11 mm/h ,C-反应蛋白 10.3 mg/L,降钙素原未见明显异常。完善相关检查后予甲泼尼龙40mg×5d,后甲泼尼龙减至20mg×3d,患者体温得到控制,双下肢皮疹面积较发病时明显缩小,皮肤颜色接近正常,遗留少许暗褐色斑块。激素逐渐减量为强的松10mg bid×2d,患者恢复后强的松减至早上10mg,晚上5mg。出院后1周随访,体温稳定,皮疹几乎消退。
例3,女性,75岁,因“全身红斑、结节伴发热2周”于2021年9月23日收住我院。糖尿病病史20余年,平素口服“格列美脲2mg bid、阿卡波糖50mg tid”控制血糖,血糖控制尚可。既往高血压病史10余年,平素口服“培哚普利叔丁胺4mg qd”控制血压,血压控制尚可。既往冠心病病史2年,口服“硫酸氢氯吡格雷75mg qd”治疗。患者2周前四肢、胸部、头皮出现散在红斑、结节状伴有疼痛,发热,热峰38℃,结膜充血同时出现四肢关节疼痛。至当地医院就诊,予以“头孢类抗生素”抗感染,口服“抗组胺类药物”治疗3天后无明显好转。皮损范围逐渐增多,红斑颜色加深,疼痛加重,遂至我院就诊。2021年9月23日行“皮肤和皮下组织的活组织检查术”,术后病理证实:符合Sweet综合征。予甲泼尼龙40mg静滴治疗辅以头孢西丁钠抗感染、护胃等治疗9天后,患者头皮、四肢、躯干处大小不一的红斑结节,边缘清楚,颜色较前转暗,背部红斑可见“假水疱样”改变,均有触痛。入院时查血细胞分析:白细胞计数8.27×109/L,中性粒细胞计数6.2×109/L,中性粒细胞百分比77.2%(其中淋巴细胞百分比 15.1%, 单核细胞百分比 7.3%, 中性粒细胞百分比 77.2%, 嗜酸性细胞百分比0.2%),C-反应蛋白 53.01 mg/L。胸腹部CT提示:左上肺叶小结节,考虑增殖灶;双肺下叶间质性改变;心包膜增厚;肝脏多发钙化灶;肝囊肿。ANA抗核抗体阳性(滴度1 ∶10,无核型),dsDNA抗体弱阳性。EB病毒抗体、呼吸道感染/肺炎抗体筛查、Torch IgM均阴性。入院后治疗上予以地塞米松7mg+5mg/d×5d,依托考昔抗炎同时辅以护胃、预防骨质疏松等治疗。出院后1周随访,体温正常,皮损范围缩小,转暗,部分脱屑,无触痛、无渗出。
讨 论
例1是一例间断发热1月余,肺部受累先于皮肤表现,以及没有合并血液疾病的快速进展并导致患者死亡的Sweet综合征。整个病程迁延两个月之久,在间断发热1月余后,患者出现散在非典型皮肤表现,面颊绑带处及右侧腹股沟深静脉置管处皮损,但未能引起我们的重视。唯一临床提示是患者病情与激素用量紧密相关。该患者第二次脱机拔管后肺部感染及胸腔积液情况逐渐好转,激素减量,生命体征基本平稳近2周,再次出现反复高热,血压心率不稳,左前臂、腹股沟、右上臂才出现典型的皮肤表现,数个成片皮下红色硬结,表面溃烂,按压时瘙痒疼痛。皮肤活检明确病因后,尽管予以甲泼尼龙冲击治疗(500mg×3天,然后减量),并予预防性护胃、维持水电解质平衡、血浆支持治疗,但患者病情未见好转。患者氧合进行性恶化,顺应性5~9 mL/cmH2O,血压和心率不稳,行ECMO替代治疗,持续CRRT,期间予去甲肾上腺素维持血压,血浆、红细胞和血小板输注支持治疗,但患者感染指标仍然很高,出现休克,最终死亡。使用糖皮质激素治疗Sweet综合征常会在减药、停药时复发。对于例1病人并不是在发病初期就表现为典型的临床表现,而且呼吸道症状及肺部表现先于皮肤症状出现,应持有警惕性[9]。对于有急性呼吸道症状同时有嗜中性粒细胞增多的患者,对大量抗生素不敏感,而对激素治疗尤其敏感的要考虑此病。该病人仍有一点值得我们深思,反复发热,病情迁延1月时,患者两处出现皮损情况,但未引起足够的重视,直到激素减量后皮疹再次爆发,才得以重视,并与病程中的其它临床表现相联系。例2、例3病人均是发热等呼吸道症状与皮肤症状几乎同时出现,结合相关检查,病理活检得以明确该病。目前有综述将糖皮质激素与碘化钾、秋水仙碱列为一线疗法,我们所收集到的3例患者均使用糖皮质激素治疗。
通过文献复习结合病例,我们可以知道,在Sweet综合征中,很少有文献报道组织学证实肺部受累,严重呼吸衰竭的肺部受累可能先于皮肤病变的出现。即使在没有皮肤损伤的情况下,早期识别肺部受累的Sweet综合征很重要。
