不同载体菌肥对刺槐光合特性及土壤养分、细菌群落的影响
2023-03-09庄家尧孙永涛
杨 皓 庄家尧 郑 康 孙永涛
(1南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2国家林业和草原局华东调查规划院,浙江 杭州 310019)
刺槐(Robinia pseudoacaciaL.)又名洋槐,是豆科刺槐属植物,多年生落叶乔木,原产于北美,17 世纪初被引入欧洲,20 世纪初出现在我国。据调查,我国已有15 个省市将刺槐列入主要造林树种名册,并开展人工林种植,至今全国种植面积已超过100 万公顷[1]。刺槐作为主要的生态防护林造林树种,在西北黄土区和北方土石山区种植尤为广泛,对林地土壤具有较明显的改良作用,可以很好地发挥生态效益[2]。刺槐本身也是很好的天然能源供给者,其根系形成的根瘤是天然的氮肥,可以极大增加土壤中的氮含量。同时,含氮量丰富的叶片分解后进入土壤也可促使土壤有机质含量增加,促进养分循环[3]。
然而,随着近年来经济社会的高速发展,大量化肥和农药的施用致使土壤退化,生态系统受到干扰,不可避免地造成了生态负荷,土壤微生物群落失衡,一些土传病菌如镰刀菌、疫霉菌滋生,危害着植物的健康[4-5]。低质低效林的出现既降低了土壤肥力对生态系统的有益调控作用,又影响生态效益、经济效益、社会效益的发挥,从而制约了农林业的高质量发展。国家对生态环境建设的日益重视大力推动了新型肥料的发展[6]。微生物菌肥兼具功能完备、成本低廉和环保的优良属性,可通过自身生命活动过程中分泌有利于植物生长的物质来增加植物肥效,提高植物的生长速度和发育水平,提升品质,改良土壤性质,对于减少化肥的施用、实现土地供肥能力平稳化和农林业的可持续发展具有深远意义[7]。
在微生物菌肥的商业化生产中,载体底物是首先需要考虑的问题。Rebah等[8]研究报道,高有机质含量、最佳氮含量、呈中性的酸碱度、高持水能力、对吸附其中的功能微生物生长无抑制作用等因素是优秀载体需具备的性质。研究发现,泥炭是很好的菌肥载体,且在菌肥生产过程中应用较多[9],但因其多位于湿地生态系统保护区且具备短期不可再生性,若长期开采,势必消耗生态资源,破坏生态平衡[10]。因此寻找其他材料替代泥炭作为菌肥载体投入生产显得尤为重要。
常见的农业废弃物有秸秆、果皮残渣、甘薯渣、酒糟、玉米渣、麦麸等[11],不仅营养元素含量丰富,而且具备菌肥载体应有的性能,故而在载体应用上展现出巨大潜能。Xu 等[12]研究多粘类芽孢杆菌生物肥料时选用甘薯淀粉生产废弃物作为载体底物,测得菌肥活菌数高达9.7×109CFU·mL-1,实际喷施于茶树叶面后,茶叶产量、水提物量、茶多酚含量均比对照显著增加16.7%、6.3%、10.4%。Zhu 等[13]用废蘑菇底物和溶磷微生物制备菌肥,活菌数达5.6×108CFU·g-1,并通过盆栽试验证实其可显著改善大豆生长性状。李月等[14]以秸秆和木本泥炭为载体与3 种腐生真菌配制成固体菌肥,并采集江西鹰潭地区红壤应用于玉米盆栽试验,发现植株地上生物量和土壤有效磷含量显著增多。苟志辉[15]研究证实,以膨润土和草炭为载体制成的复合菌肥可改善油茶生长状况,提高土壤养分含量及幼苗根际微生物数量。由此可见,研究不同载体菌肥在刺槐上的应用效果,对减少水土流失、涵养水源、维持生态系统平衡具有重大战略意义,对推动我国水土保持现代化建设进程具有重要学术价值。
本研究以不同基质(秸秆、麦麸、棉籽壳、豆饼)及其混合配方作为载体底物,设置泥炭作为对照,从不同角度分析各个载体作为菌肥载体的可行程度,并通过盆栽试验研究不同菌肥对刺槐光合特性、土壤养分及土壤微生物群落结构组成的影响,旨在评估不同载体菌肥在农林业生产实际应用中的肥效,同时筛选出在林业种植实际应用中可有效替代泥炭发挥肥效的菌肥载体,为植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)菌肥的开发利用提供理论依据。
1 材料与方法
1.1 试验材料及试验地
供试菌株:溶磷菌粘质沙雷氏菌(Serratia marcescens N1.14)X-45,南京林业大学水土保持实验室保存菌株(分离自湖南省岳阳市岳阳大道两侧的裸岩边坡岩石样品),具有溶解有机磷、无机磷,分泌生长素(indoleacetic acid)的优良特性,兼具生长迅速、竞争力强的特点[16]。
培养基:蛋白胨10 g,NaCl 10 g,酵母浸粉5 g,水1 000 mL,pH值7.0~7.2,121 ℃灭菌30 min。
盆栽试验在江苏省南京市玄武区南京林业大学新庄校区教学九楼中庭进行。试验周期为2021年7月至2021年10月。盆栽用土为基质土(购自江苏兴农科技有限公司,pH 值5.2~6.0,N∶P2O5∶K2O=10∶11∶13),所用花盆为塑料花盆(内径19 cm、外径21 cm、高19 cm),供试植物为刺槐(刺槐种子购自江苏冈仁波齐种业有限公司),补充水分采用称重法,保证每盆土壤含水量达到田间持水量的100%,其中7、8 月保证每周补给两次水分,9、10月保证每周补给一次水分。
1.2 菌肥制备、施用及试验设计
将X-45 菌株活化后置于28 ℃培养箱(上海贝茵生物科技有限公司)中培养3 d后,接种于盛有LB液体培养基的三角瓶中,放入30 ℃、200 r·min-1的摇床中培养2 d,测定菌液OD600值为0.814±0.007。菌肥制备参照朱玉[17]的方法:分别称取不同载体及其配方各100 g于高压灭菌袋中,置于灭菌锅(上海博讯医疗生物仪器股份有限公司)内,在121 ℃条件下灭菌30 min 后取出,将装有载体的灭菌袋置于无菌操作台(苏州净化设备有限公司)上冷却至室温,加入适量无菌水混合均匀后,加入80 mL 菌液,上下晃动使其混匀,封口。在每个灭菌袋上随机扎4个孔,上述所有操作均在无菌条件下完成。每个载体处理设置3 组平行试验。将制备好的菌肥置于28 ℃恒温培养箱中培养7~10 d,测得菌肥有效活菌数为≥6亿个·g-1,备用。
选取颗粒饱满的刺槐种子和菌肥以1∶1 的比例混合,空白对照组的种子用无菌水拌种,并置于阴凉避光处2 h,使细菌充分附着在种子表面。
试验共设置7 个处理(表1),每个处理设置3 个平行,播种30 d 后间苗,每盆保留3 株长势一致且长势良好的幼苗。
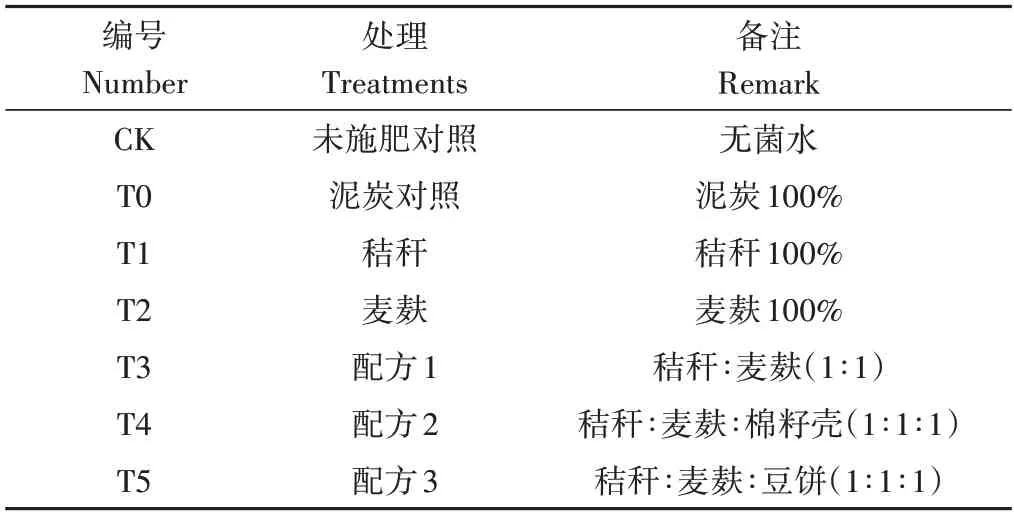
表1 试验处理Table 1 Experimental treatments
1.3 刺槐光合特性参数的测定
在盆栽种植周期内,于10 月份使用LI-6400 便携式光合仪(美国Li-Cor 公司)测定幼苗的光合参数,选用LED 红蓝光源叶室(6400-02B,美国Li-Cor 公司),设置测定时的叶室温度为30±0.6 ℃,叶室相对湿度为48.19%±4.7%,CO2浓度控制在400 μmol·mol-1,叶室内光强设置为300 μmol·m-2·s-1;随机采取植株上中下部位各3 片叶片,取样时保证各处理组间取样叶位一致,采用混合液浸提法[18]测量叶片的叶绿素含量,叶绿素a 和叶绿素b 含量的计算方法参照张俊逸等[19]的研究。
1.4 土壤理化性质测定
于2021年10月8日采集土壤样品,风干后过100目筛用于土壤理化性质的测定:pH 值采用mettler toledo pH计(上海忠赫仪器有限公司)测定(水土比为2.5∶1);有效磷采用氟化铵-盐酸浸提法测定;水解氮采用碱解扩散法测定;速效钾采用醋酸铵-原子吸收分光光度计法测定[20]。
1.5 对盆栽根际土的高通量测序
采用Illumina 测序平台MiSeq 系列测序仪对细菌16S rDNA(V5-V7 区)进行高通量测序,所用引物为799F(5'-AACMGGATTAGATACCCKG-3')_1193R(5'-ACGTCATCCCCACCTTCC-3'),委托广州基迪奥生物科技有限公司完成。具体操作如下:使用土壤基因组DNA 提取试剂盒(广州美基生物科技有限公司)提取土壤微生物总DNA,利用NanoDrop 微量分光光度计(美国赛默飞世尔科技公司)测定其纯度,用琼脂糖凝胶电泳仪(北京六一生物科技有限公司)测定其完整性。PCR扩增体系为50 μL:5×Q5 Reaction Buffer 10 μL,5×Q5 High GC Enhancer 10 μL,2.5 mmol·L-1dNTPs 1.5 μL,10 μmol·L-1上游、下游引物各1.5 μL,Q5 High-Fidelity DNA Polymerase 0.2 μL,模板X 0.05 μL(50 ng),用蒸馏水定容至50 μL。扩增程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1 min,共30 个循环;72 ℃终延伸7 min。使用AMPure XP 磁珠(美国贝克曼库尔特公司)对PCR 产物进行纯化,纯化后用Qubit3.0 定量,用TruSeqTM DNA Sample PrepKit 构建PE 文库,根据Novaseq 6000 的样品要求规范化操作后,采用PE250模式上机测序。
1.6 数据处理
试验数据均为3 次重复试验的平均值,试验数据采用SPSS Statistics 22 软件对试验数据进行处理和分析,采用Origin 2019b 软件制作图表,测序结果使用Qiime、R 语言(vegan 包和psych 包)、Mothur、STAMP 等软件进行分析。
2 结果与分析
2.1 不同载体菌肥对刺槐光合特性的影响
由表2 可知,施用菌肥处理组的净光合速率与未施肥对照组相比均有不同程度的提高。其中T3 叶片的净光合速率最高,是CK 的1.68倍,且与其余处理之间的差异均达到了显著水平。复合载体菌肥(T3、T4、T5)下的净光合速率值相较于单一载体(T1、T2)均有一定程度提升,表明施用菌肥可有效提升植物的净光合速率,且复合菌肥的应用效果更明显。
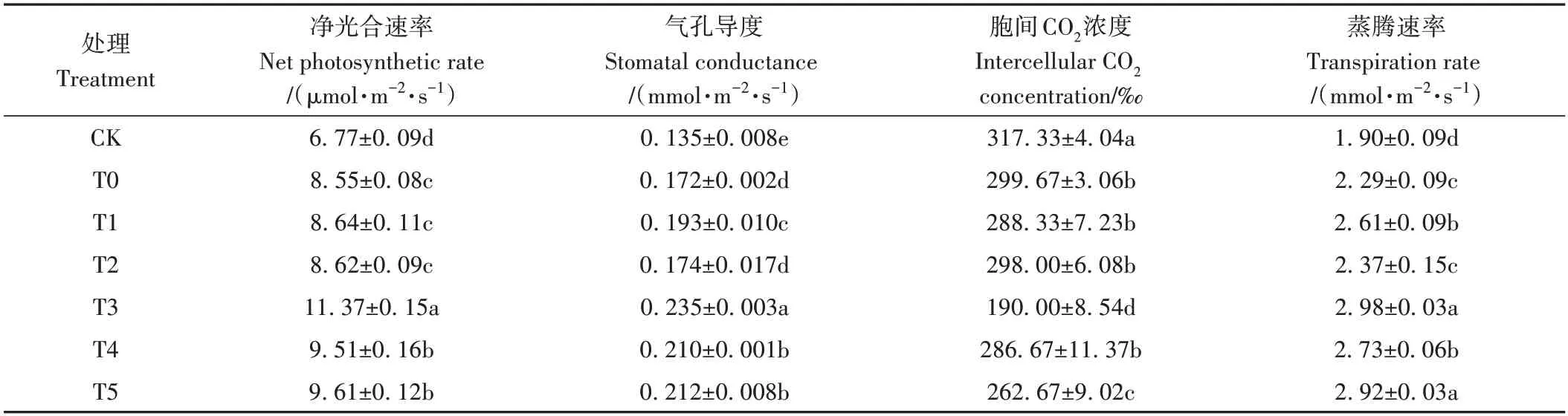
表2 刺槐叶片的光合特性参数Table 2 Photosynthetic characteristics of Robinia pseudoacacia leaves
不同载体菌肥施肥处理组刺槐叶片的气孔导度均显著高于CK(P<0.05),且增幅均超过了25%,T3 的气孔导度最高,分别是CK和T0的1.74和1.37倍,同时复合载体菌肥处理组的气孔导度显著高于单一载体组,表明复合载体菌肥的施入能一定程度提高光合作用CO2的供应,促进蒸腾作用。
不同载体菌肥施肥处理组刺槐叶片的胞间CO2浓度均显著低于CK,其中以T3 降低程度最明显,较CK降低了127.33 个千分点,T1、T2、T4 刺槐叶片的胞间CO2浓度与T0相比无显著差异,T3、T5显著低于T0,可见T3降低叶片胞间CO2浓度的效果最明显。
不同载体菌肥施肥处理组对刺槐叶片的蒸腾速率有不同程度的提高,其中以T3 提高效果最明显,分别较CK、T0增加了56.81%、30.46%,除与T5差异不显著外,与其余处理之间的差异均达到显著水平,表明T3植株体内发生的代谢作用更加旺盛,使水分达到平衡状态。
叶绿素含量是评价植物光合作用能力和积累干物质能力的依据[21]。由表3可知,不同载体菌肥处理下刺槐叶片的光合色素含量均有不同幅度的提升。除T1外,其余处理下叶绿素a含量较CK和T0均显著增加,以T3增加最明显,分别较CK和T0增加了128.53%和59.76%,但与T4、T5之间差异不显著,表明菌肥的施入能显著促进叶绿素a 含量的增加,且复合载体菌肥相比单一载体促生效果更显著。不同处理叶绿素b含量较CK 也有明显提高,增幅为74.29%~351.43%。T3、T4显著高于T0,增幅最明显的仍为T3,分别是CK 和T0 的4.51 和2.41倍,且显著高于T4。
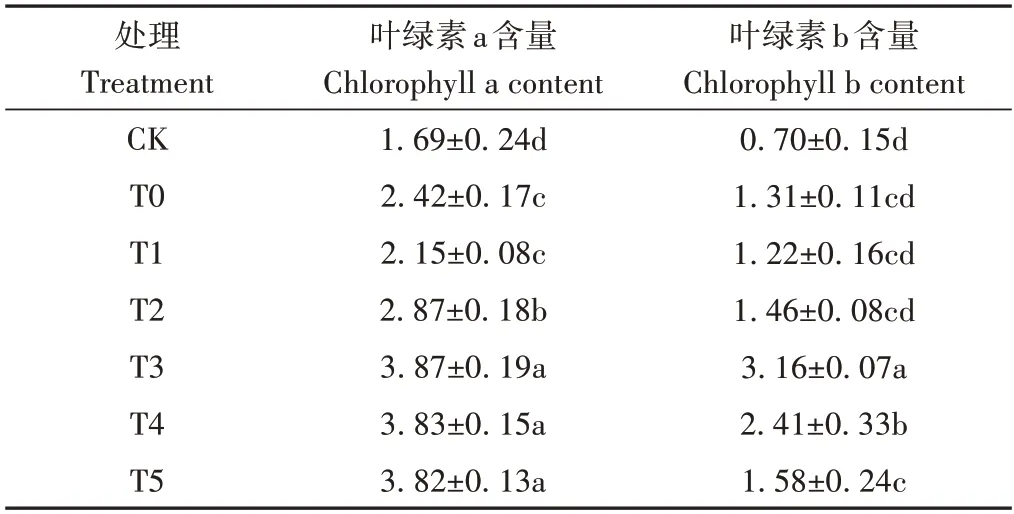
表3 刺槐叶片的光合色素含量Table 3 Photosynthetic pigment content in Robinia pseudoacacia leaves/(mg·g-1)
综上,无论是单一载体还是复合载体菌肥,对刺槐叶片叶绿素含量均有不同幅度的提高作用。总的来看,T3(秸秆∶麦麸=1∶1)处理应用效果最佳,说明该处理下刺槐的光能捕捉率和利用率较高,能充分进行光合作用。
2.2 不同载体菌肥对刺槐土壤养分的影响
由图1-A可知,与未施肥对照组相比,施肥处理组的土壤pH 值均有不同程度的下降。其中,T1 土壤pH 值与CK 相比表现出显著差异,所有施肥组与T0 之间的pH 值均无显著差异,说明施用菌肥可在一定程度上使盆栽土壤酸化,并以秸秆处理酸化程度最显著。
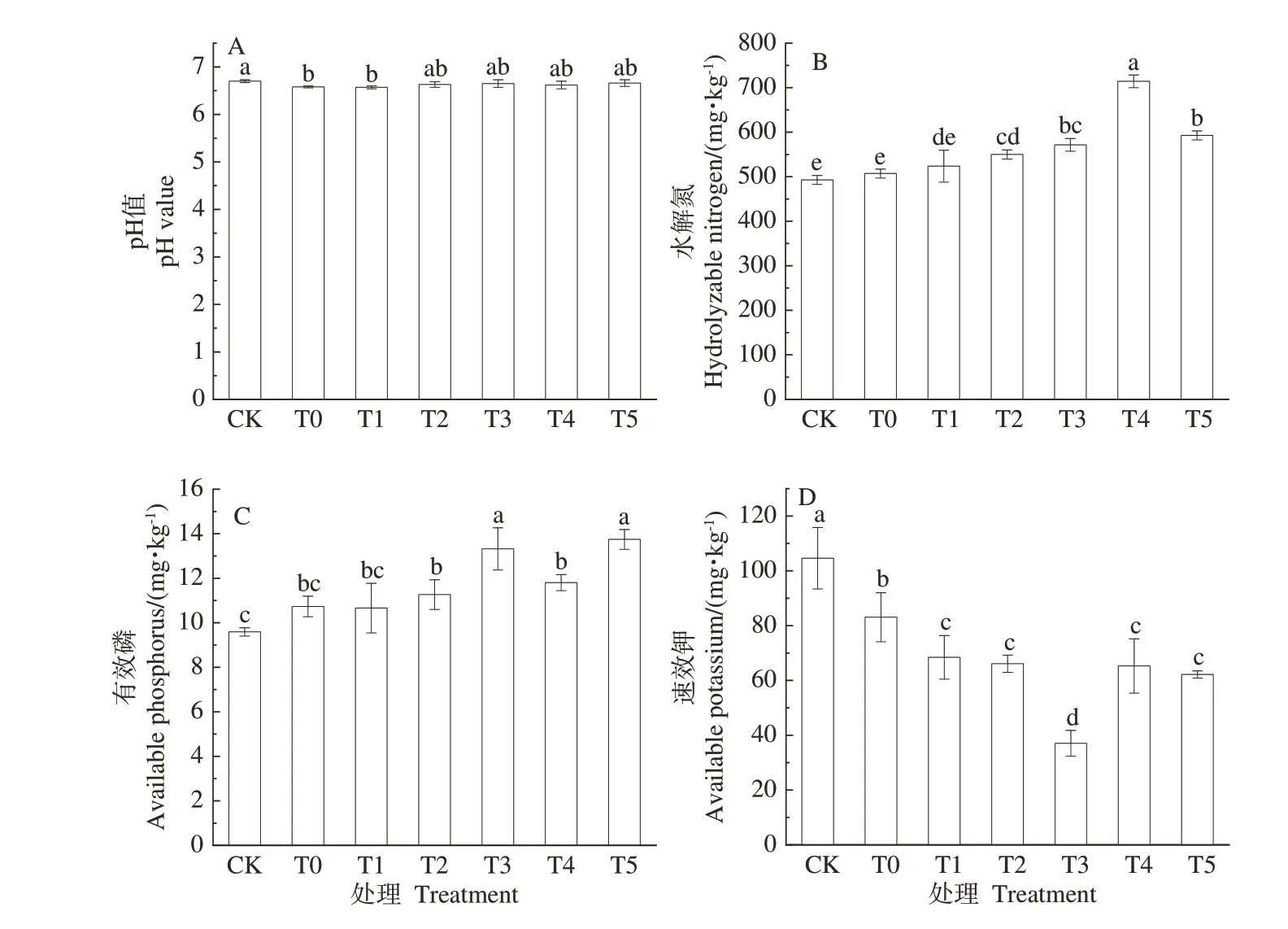
图1 菌肥对土壤pH值和养分含量的影响Fig.1 Effect of bacterial manure on soil pH value and nutrient content
由图1-B可知,随着菌肥的施加,各处理下土壤水解氮含量与对照组相比均有不同程度提升,与CK 相比增加了6.28%~44.93%,与T0 相比增加了3.29%~40.85%,除T1 外,其余施肥处理的水解氮含量均显著高于T0,其中T4 最高,为714.29 mg·kg-1,分别是CK和T0 的1.45 和1.41 倍,与此同时,T4、T5 水解氮含量整体显著高于其余处理,说明施用菌肥能有效改善土壤营养环境,提高土壤中水解氮的含量,并以复合载体菌肥应用效果更显著。
由图1-C可知,除T1外,其余施肥处理组土壤有效磷含量均显著高于CK和T0,增幅分别为11.14%~43.30%和4.94%~28.04%,其中T5含量最高,为13.75 mg·kg-1,分别是CK 和T0 的1.43 和1.28 倍,T3 次之,含量为13.32 mg·kg-1,T1 最低,仅有10.66 mg·kg-1,同时,T3、T5 组含量显著高于其他处理,说明菌肥的施用可以促进土壤有效磷的增加,而复合载体菌肥的应用效果相对更显著。
由图1-D 可知,各施肥处理组土壤速效钾含量较CK 和T0 分别降低了34.59%~64.58% 和17.64%~55.39%,其中T1、T2、T4、T5 组间无显著差异,T3 速效钾含量最低,仅为37.06 mg·kg-1,分别为CK 和T0 的35.43%和44.61%,同时显著低于其余施肥处理组,表明菌肥的施入能促进刺槐对速效钾的吸收利用,并以T3应用效果最明显。
综合所有指标,选取肥效更明显的T3、T4 处理进行后续试验。
2.3 不同载体菌肥对刺槐根际土微生物群落多样性的影响
稀释曲线达到平台期代表着测序数据能够覆盖微生物群落多样性,同时稀释曲线还能间接反映物种的丰富程度。由图2 可知,当测序数目达到20 000 时细菌曲线接近平台期,即使超出20 000 时也只能产生较少的分类操作单元(operational taxonomic unit,OTU),且每个样本的OTU 数目和测序数目成正比,会随之增多,后达到一定量而趋于平稳,说明测序量在20 000时即可涵盖绝大多数微生物,之后测序深度再增加也鲜有新物种出现,测序结果合理。
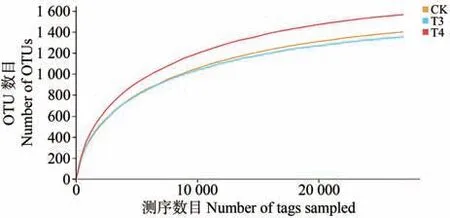
图2 各样本稀释曲线Fig.2 Dilution curves of each sample
Alpha 多样性指局域生境下或生态系统内的物种数目及物种多样性情况,主要通过Shannon、ACE、Chao1、Simpson 指数来进行分析。由表4 可知,土壤样本的覆盖度均超过了99%,可见本研究的检测结果基本反映了样本细菌群落多样性的情况,测序结果合理。Shannon指数和Simpson 指数结合可表征微生物的多样性及均匀度,Shannon指数越大,代表微生物群落丰富度越大,各物种的分配就越均匀;Simpson 指数越小,代表物种均匀度越高,多样性就越低[22]。T4 物种shannon 指数最高,且与其余两组的差异不显著(P>0.05),表明其丰富度最高;CK Simpson指数最高,且与其余两组无显著差异(P>0.05),表明其均匀度最高。Sobs指数、ACE指数和Chao1 指数通常用来表征样本中物种的丰富度,指数越大,细菌群落中所含物种的数量越多,细菌群落丰富度越大。T4 的Sobs、ACE 和Chao1 指数显著高于其余处理,说明其细菌种类较为丰富。
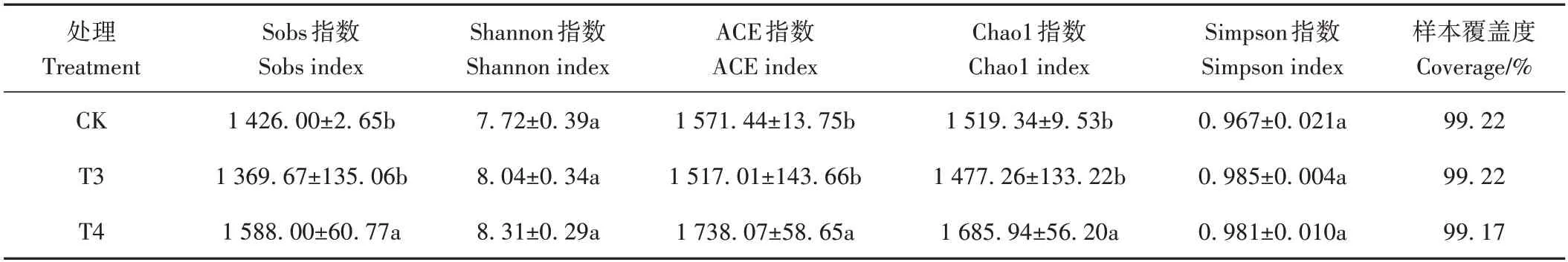
表4 根际土细菌群落多样性指数Table 4 Bacterial community diversity index of rhizosphere soil
2.4 不同载体菌肥对刺槐根际土微生物群落组成的影响
由图3 可知,施用不同载体微生物菌肥后,各处理组土壤中细菌的相对丰度都发生了变化。在相对丰度大于1%的水平上,土壤样本中的细菌门主要包括纤维杆菌门(Fibrobacteres)、疣微菌门(Verrucomicrobia)、衣原体门(Chlamydiae)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)。其中,Proteobacteria 是所有处理样本中的优势门类。除此之外,Actinobacteria、Firmicutes、Gemmatimonadetes的相对丰度也相对较高。与CK 相比,T3 和T4 中Fibrobacteres、Acidobacteria、Chloroflexi 的相对丰度分别提高了0.11、1.39、0.51 和0.33、1.46、0.40 个百分点。
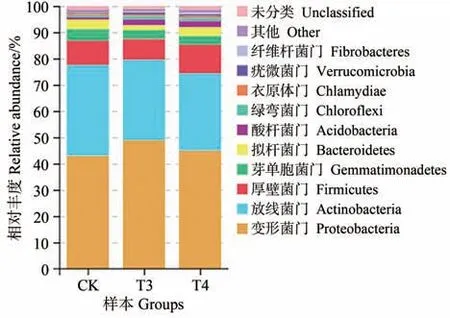
图3 不同处理样本在门水平上的相对丰度Fig.3 Relative abundance of bacteria under different treatments in phylum level
在属水平上,相对丰度大于1%的物种主要包括德沃斯氏菌属(Devosia)、生丝微菌属(Hyphomicrobium)、野野村氏菌属(Nonomuraea)、直丝菌属(Planifilum)、假乳杆菌属(Pseudolabrys)、芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)、马杜拉放线菌属(Actinomadura)、球形孢囊属(Sphaerisporangium)和中慢生根瘤菌属(Mesorhizobium)等(图4)。在所有样本中,相对丰度最高的是Sphaerisporangium(34.71%~47.25%),其次是Actinomadura(10.37%~17.38%)。与CK 相比,T3 和T4处理的Mesorhizobium相对丰度分别上升0.85 和3.37 个百分点,说明菌肥的施入很大程度上促进了Mesorhizobium相对丰度的提高,同时T3 和T4 处理的Actinomadura相对丰度也分别上升了8.56和4.32个百分点,表明菌肥的施加明显影响了盆栽土壤细菌群落属水平上的组成。
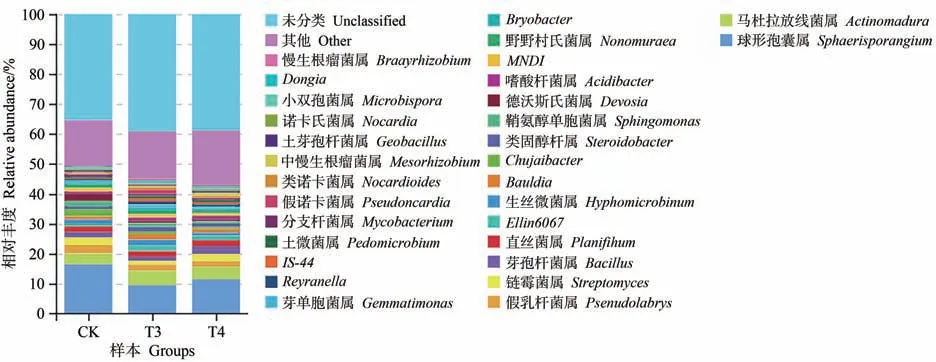
图4 不同处理样本在属水平上的相对丰度Fig.4 Relative abundance of bacteria under different treatments in genus level
2.5 土壤环境因子与微生物群落之间的关系
冗余分析(redundancy analysis,RDA)可以直观地反映样本、微生物群落、环境因子之间的关系。本研究以属水平上土壤的细菌群落为指标,以盆栽土壤水解氮含量、有效磷含量、速效钾含量、pH值为环境因子,进行RDA 分析,结果如图5 所示。第一轴的解释量为84.60%,第二轴的解释量为8.76%。水解氮、有效磷含量和施菌肥处理样本的细菌群落分布呈正相关关系(r2=0.30,P=0.30;r2=0.63,P<0.05),而pH 值和速效钾含量与施肥处理样本群落分布呈负相关关系(r2=30,P=0.31;r2=0.19,P=0.52),表明菌肥的施加能够对刺槐根际土中水解氮和有效磷含量产生增加效果。从属水平上细菌群落组成的变化来看,Actinomadura和Mesorhizobium在T3、T4 中的丰度明显上升,且这两种菌与水解氮、有效磷含量均呈正相关关系,与pH 值、速效钾含量呈负相关,表明菌肥的施入提高了这两种菌群的丰度。
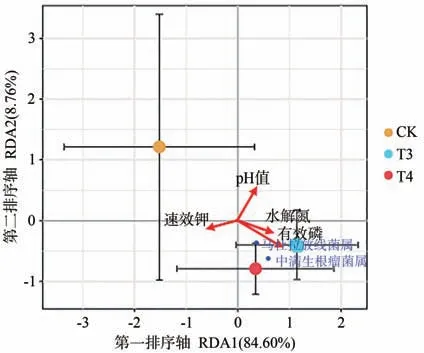
图5 冗余分析方法确定土壤环境因子对细菌群落组成的影响Fig.5 Redundancy analysis method to determine the impact of soil environmental factors on bacterial community composition
3 讨论
3.1 菌肥施用与刺槐光合作用的关系
光合作用是植物体将光能转化成有机物并释放能量的主要途径,它能维持植物体内水分的平衡及植物的生长发育,对生态系统具有十分重要的意义[23]。植物的光合作用能力代表的是植物的同化能力和形成碳水化合物的能力[24],其中净光合速率反映的是植株积累有机物的状况,是判断植株光合能力强弱的重要指标,气孔导度和蒸腾速率直观反映植被的水分利用效率、光合效率和对二氧化碳的吸收利用能力[25-26]。本研究中,在刺槐幼苗的培植试验中施用不同菌肥,对植株叶片的净光合速率、气孔导度、蒸腾速率有明显的提升作用,对胞间CO2浓度有降低作用,这与周进[27]的研究结果一致。其中T3的净先合速率、气孔导度,蒸腾速率达到峰值,表明该处理菌肥可最大程度发挥肥效,对刺槐的光合作用促进作用最明显。同时,复合载体菌肥处理下的刺槐叶片光合参数相较于单一载体处理均有一定程度提高,表明以复合载体为基质制备的菌肥促生作用更加明显,对于有效维持植物体内水分平衡和提升植物对环境的适应力的能力更强,究其原因可能是单一载体菌肥中有机质含量略低,施入到土壤中使得土壤中的有机质含量不足,植株无法充分吸收。
叶绿素位于植物叶片表层,在吸收和传递光能中发挥着重要作用,其含量直接决定了光合潜力和初级生产的大小[28-29]。叶绿素a、b 是光能转化成储存的化学能量的基本色素,因此研究植株叶片叶绿素含量对评估菌肥的应用肥效有重要参考价值[30]。前人研究发现,微生物菌肥的施用可显著增加植株叶绿素的含量。陈建生等[31]发现以20%~40%的菌肥添加量替代化肥可以使花生叶片叶绿素含量显著提升,证实菌肥可以在一定程度上替代传统化肥发挥肥效。孟建宇等[32]施用以维生素为载体的菌肥后发现其能明显促进玉米生长,植株叶片叶绿素含量较对照显著提升17.37%。本研究结果显示,随着菌肥的施用,刺槐叶片中的叶绿素a、b 含量均有不同程度的上升趋势,这与上述学者的研究结果基本一致。同时,复合载体菌肥处理下的刺槐叶片叶绿素a、b 含量相比单一载体处理明显上升,并能替代泥炭载体达到促进光合作用的目的,说明复合载体菌肥对刺槐叶片叶绿素含量的增加效果普遍优于单一载体,也印证了上文对刺槐光合特性参数的分析推断。推测原因是菌肥扩展了植物根系外延,使根系与土壤接触面扩大,促进了植物对光合作用必需的营养元素的吸收,从而提升了光合效率[33]。
3.2 菌肥施用与刺槐土壤养分的关系
土壤养分表征着土壤肥力的高低,是评价土壤质量的重要指标[34]。研究土壤养分的变化是有效评估土壤营养环境是否健康的有力参考[35]。已有研究表明,微生物肥料的施用可以提高土壤营养元素的有效性,提高土壤供肥能力和土地质量。雷娇娇等[36]将菜籽油饼和麦麸作为载体底物对长枝木霉(Trichodermaspp.)进行固态发酵制成菌肥,通过两年生闽楠幼苗种植试验发现幼苗生长指标、根际土壤有效磷、速效钾、水解氮等含量显著提升提升。Sun 等[37]通过将假单胞菌和芽孢杆菌肥料与土壤混合,并在其中种植芦苇,测得土壤速效养分含量相比对照组显著增多,同时芦苇的生长得到显著促进。本研究中,施用不同载体菌肥的土壤水解氮和有效磷含量均高于未施肥对照,速效钾含量则有所降低。这与王爱斌等[38]的研究结果基本一致,水解氮和有效磷含量的提高说明微生物菌肥中富含的固氮微生物和溶磷微生物可以发挥各自作用转化空气中的氮气和促进土壤中磷素的溶解,达到提高土壤中速效养分含量的效果[39],而速效钾含量的降低可能是因为菌肥的施用促进了植物根系对钾元素的吸收利用,进而使土壤中速效钾含量减少。从本研究结果看,T1、T2水解氮含量显著低于T4、T5,推测原因是土壤中的营养成分无法满足菌肥在分解有机质时需要合成蛋白质所需的氮素,因而造成了一定程度的脱肥[40]。T3、T5 有效磷含量显著高于其余处理,可能是因为溶磷菌株在这两种载体菌肥中的释放力和对载体中富含的养分充分吸收的能力较强,从而使有效活菌数增多,增加了土壤中有效磷的含量[41]。复合载体菌肥施用下的盆栽土壤水解氮、有效磷含量相较于单一载体改良效果更加明显,同时优于泥炭对照组,这与张建贵等[42]的研究结果一致,可能是由于复合载体中的营养成分含量普遍高于单一载体,功能微生物在其中生长更为旺盛,施入土壤后使土壤养分含量增多[43]。综上,微生物菌肥的施用普遍对土壤肥力有提高效果,且各载体都能在一定程度上代替泥炭发挥肥效,以复合载体T3、T4应用效果最为显著。
3.3 菌肥施用与刺槐根际土壤细菌群落的关系
土壤微生物群落多样性代表着土壤微生物的动态变化,直观反映了土壤供肥能力和土壤健康情况。通过对土壤微生物群落组成结构的分析判断,可以深度了解土壤微生物受土壤生境变化或外因影响所导致微观生态水平上的变化[44]。本研究结果显示,不同载体菌肥处理下的刺槐根际土壤细菌群落相对丰度有所增加,这与李金花等[45]在楸树培植上的研究结果基本一致。其中,Alpha 多样性的分析结果表明,T4 处理的微生物多样性较同水平组的其余处理更为丰富,说明T4菌肥的施用使得根际土壤微生物多样性程度大大提高,但T3 处理的ACE 和Chao1 指数较CK 相比均略有降低,究其原因可能为施用菌肥使得土壤中微生物的均匀度降低,某些细菌数量提升,致使单一细菌的占比过高,且在测序时未将真菌和放线菌的丰度计量在内[46]。
微生物群落组成代表着在特定生态环境下微生物的活跃程度及丰富程度,是反映土壤肥力水平与土壤微生物代谢功能发挥情况的指标之一[47]。本研究发现,施肥组与无菌对照组的土壤优势细菌群落一致,差异主要体现在施肥组较无菌对组照的相对丰度有一定程度的提升。由微生物群落组成可见,在门水平上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)在各个接种菌肥处理的占比较大,这与Guo 等[48]、Huang 等[49]的研究结果一致。施用菌肥处理组细菌群落在门水平上的组成和对照相比丰度提高较为明显,主要表现为根际土优势菌门Proteobacteria相对丰度的增加,从43.94%分别增加到了50.02%和46.27%,提高6.08 和2.33 个百分点,而X-45 也属于Proteobacteria,这说明菌肥的施用可促使土壤中优势菌门相对丰度的增加,进一步来看,菌肥中富含的功能微生物菌株X-45 是导致Proteobacteria 相对丰度增加的主要原因,这与前人研究结果基本一致[22]。在属水平上,施肥处理组细菌群落组成和对照相比有一定差别,主要表现在根际土中Mesorhizobium相对丰度的明显增加。但相对丰度仍处于较低水平,推测原因是盆栽种植周期较短,不足以使该类群占据主要地位。研究记载,Mesorhizobium是一种固氮根瘤菌,可以促使大气中的氮气还原成氨供植物吸收利用,实现生物固氮。王婧仪[50]探索中慢生根瘤菌MAFF303099 参与调控共生固氮的机制,发现其中的mlr5883基因具备固氮活力。Shah 等[51]将中慢生根瘤菌(Mesorhizobium ciceri)接种至柠条后发现平均单株根瘤数达到110个,同时根际致病菌P.medicaginis、F.oxysporum、F.solani有效减少,由此推测中慢生根瘤菌的接种可以改善柠条生长状况,维护土壤环境健康。本研究中Mesorhizobium相对丰度的增加直接致使土壤中固氮菌数量增多,增强了刺槐共生固氮的能力,提高了土壤中的水解氮含量,对应土壤理化性质分析结果。从环境因子的相关性分析可见,菌肥的施用可以增加根际土中速效养分含量,使得土壤中水解氮和有效磷含量增加,改善了土壤的营养环境,使得有益微生物丰度上升,对生态系统发挥着微观调控作用。
4 结论
本研究表明,施用不同载体菌肥对刺槐光合作用和土壤养分含量具有不同程度的改良效果,复合载体菌肥处理下刺槐叶片光合作用和土壤改良效果更为明显,主要表现在净光合速率、气孔导度、蒸腾速率等气体交换参数的提升和叶绿素、水解氮、有效磷含量的提升。与此同时,刺槐根际土的细菌群落组成会随菌肥的施入而发生变化,益生菌群相对丰度增多,其中T3和T4Actinomadura丰度较CK 分别增加8.56 和4.32个百分点,Mesorhizobium丰度较CK 分别增加0.85 和3.37个百分点。此外,样本细菌群落分布与水解氮、有效磷含量呈正相关关系,与pH 值、速效钾含量呈负相关关系,即土壤水解氮、有效磷含量的增加促使了益生菌群相对丰度的上升。因此,秸秆∶麦麸=1∶1、秸秆∶麦麸∶棉籽壳=1∶1∶1 这2 种载体配方可以作为菌肥载体投入生产。
