盐酸氨溴索注射液中24种元素杂质测定及包装系统相容性考察
2023-03-09钱胡月宋立平林妮妮周艳梅
钱胡月,宋立平,林妮妮,周艳梅
(北京新领先医药科技发展有限公司,北京 100094)
盐酸氨溴索是一种祛痰药,我国目前已上市的有胶囊剂、溶液剂、片剂、糖浆剂、颗粒剂、注射剂等,其中注射剂给药后因可直接接触人体组织或进入血液系统,被认为是安全风险程度较高的品种[1]。对该剂型由包装系统引入至引发安全性风险的浸出物也应进行重点关注。NMPA发布的《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》规定,注射剂玻璃包装不建议使用低硼硅玻璃和钠钙玻璃[2]。基于上述指导性文件的要求,国内盐酸氨溴索注射液一致性评价研究阶段已将包装容器调整为中硼硅玻璃安瓿。中硼硅玻璃中通常含有硅、硼、铝、钙、镁、铁、钛、钡、锌、钴等多种金属元素,而盐酸氨溴索注射液为偏酸性药物(pH值为3.5~5.5),元素杂质在酸性条件下浸出风险较高,因此灌装后及存储过程中有害元素杂质可能会迁移至药液中,甚至产生玻璃脱片,影响药品的安全性。
《人用药品注册技术要求国际协调会(ICH)Q3D元素杂质指导原则》[3]列出了34种元素杂质及其分类及不同给药途径下需要研究的元素杂质及其限度。第43版《美国药典》<232>[4]中规定的元素杂质种类和限度基本与ICH Q3D一致。《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》明确要求,在相容性研究中的相互作用研究部分应全面考虑包材成分的迁移,包括全生命周期的评估,明确给出了玻璃包装容器研究需重点关注的10种元素杂质(镉、锑、钡、砷、铅、钴、铁、锌、铬、锂)及其限度,同时强调需对药品中的硅、硼、铝3种可表征玻璃被侵蚀或产生脱片的元素杂质进行研究[5]。
电感耦合等离子体质谱法(ICP-MS)属于痕量分析方法,检测浓度可低至ng·kg-1级,具有线性范围宽、抗干扰能力强、灵敏度和准确度高、可同时测定多种元素杂质等优点,已被广泛用于痕量元素杂质含量的分析检测中[6]。近年来,ICP-MS法测定药品原料及其制剂中元素杂质含量的研究屡有报道[7-14]。根据中硼硅玻璃安瓿的成分特点及前期对盐酸氨溴索注射液的定性扫描结果,拟采用ICP-MS法对盐酸氨溴索注射液中的4种1类元素(镉、铅、砷、汞)、3种2类元素(钴、钒、镍)、3种3类元素(锂、锑、铜)及14种其他元素(硼、镁、铝、硅、钾、钙、钛、铬、锰、铁、锌、硒、钼、钡)共24种元素杂质进行研究,通过加速稳定性研究试验,考察该注射液与中硼硅玻璃安瓿瓶包装系统的相容性,旨在为产品质量控制和包装系统相容性研究提供参考。
1 实验部分
1.1 仪器
电感耦合等离子体质谱仪(Thermo iCAP RQ,赛默飞世尔科技有限公司生产);十万分之一电子天平(TB-215D型,赛多利斯科学仪器有限公司生产);微波消解仪(金牛4010型,屹尧科技有限公司生产);超纯水机(CSR-1-20(Ⅱ)型,北京爱思泰克科技开发责任有限公司生产);药品稳定性实验验箱(LHH-150SD型,重庆永生公司生产)。
1.2 样品
盐酸氨溴索注射液(规格2 mL∶15 mg,北京新领先医药科技发展有限公司生产,批号分别为1910001、1910002、1910003)。
1.3 试剂
氩气(纯度99.999%);氦气(纯度99.999%);硝酸(质量浓度为65%~68%,国药集团化学试剂有限公司生产,批号20190528);24种(镉、铅、砷、汞、钴、钒、镍、锂、锑、铜、硼、镁、铝、硅、钾、钙、钛、铬、锰、铁、锌、硒、钼、钡)单元素标准溶液(质量浓度为1 000 μg/mL,国家有色金属及电子材料分析测试中心生产,批号分别为196052-5、197018-7、198007-5、197019-4、198010-1、196009-3、198039-2、197030-3、199004-1、198106、199107、197025-2、198032-3、197023、198037-2、98036-2、198034-4、198009-4、197004-3、197011-4、199013-4、197008-8、19A002、201019);Sc、Ge、In、Bi单元素标准溶液(质量浓度为1 000 μg/mL,国家有色金属及电子材料分析测试中心生产,批号分别为196043、198003、196036-1、197031-1);超纯水(电阻率为18.2 MΩ·cm)。
2 方法与结果
2.1 元素杂质安全阈值
盐酸氨溴索注射液药品说明书中规定的最大用量为6支/d,但特殊使用说明中给出了用于早产儿及新生儿婴儿呼吸窘迫症的治疗(30 mg/kg)。为了充分保障用药安全,按照1周岁婴儿体重11.5 kg进行用量计算,确定最终的最大用量为23支/d。分析评价阈值(AET)=每日允许暴露量(PDE)÷每日最大用量,计算24种元素杂质的AET,详见表1。
2.2 试验条件
射频功率为1 550 W;载气为氩气,流量为1.0 L/min;碰撞气和辅助气均为氦气,流量分别为4.5 L/min和0.8 L/min;等离子气流量为14.0 L/min;泵速为40 r/min;测量模式为碰撞模式;数据采样模式为跳峰模式;内标溶液为在线加入;重复测定次数为3次。
2.3 溶液制备
2.3.1 供试品溶液
取3批样品分别于加速条件(温度40℃,相对湿度75%)下放置3个月、6个月,得到加速3个月和6个月样品。量取各条件下样品0.1 mL,置于10 mL量瓶中,用2%硝酸溶液稀释至刻度,摇匀即得,2%硝酸溶液为空白溶液。
2.3.2 内标溶液制备
精密量取Sc、Ge、In、Bi单元素标准溶液,用2%硝酸溶液稀释制成浓度为10 ng/mL的溶液。
2.3.3 标准曲线溶液制备
分别精密量取24种单元素标准溶液,用2%硝酸溶液稀释制成0%、5%、10%、50%、100%、500%、1 000%限度浓度的标准曲线溶液,各元素标准曲线溶液浓度见表1。

表1 元素杂质限度和标准曲线溶液浓度Tab.1 Element impurity limit and standard curve solution concentration
2.4 内标选择
选择45Sc、73Ge、115In、209Bi为内标元素,其中7Li、11B、24Mg、27Al、29Si、39K、44Ca、48Ti、52Cr、55Mn、57Fe以45Sc为内标,59Co以45Sc和73Ge质量数的均值为内标,60Ni、63Cu、66Zn、75As、77Se以73Ge为内标,95Mo、111Cd、121Sb、137Ba以115In为内标,202Hg和208Pb以209Bi为内标。
2.5 方法学验证
2.5.1 线性和范围及灵敏度
以各元素对照品浓度为横坐标,以相应响应值比率(各元素与内部元素响应值比值)为纵坐标,绘制标准曲线,计算得到各元素的线性回归方程和相关系数。取2%硝酸溶液连续进样11次,以连续测定空白响应值的3倍标准偏差除以斜率,所对应的各元素浓度作为检测限。以空白响应值的10倍标准偏差除以斜率,所对应的目标元素浓度作为定量限。由表2结果表明,24种元素相关系数均大于0.999,线性关系良好,定量限小于10%限度浓度,检测方法灵敏度良好。
2.5.2 仪器精密度及重复性
按上述标准曲线溶液制备方法制备仪器精密度溶液,重复测定6次。精密量取供试品6份,按供试品溶液制备方法制备重复性溶液。由于供试品中部分元素含量较低,在每份供试品溶液中按照各元素杂质100% AET进行加标配制。由表3结果可见,仪器精密度试验中各元素的RSD值为0.72%~2.64%,重复性试验中各元素的RSD值为1.12%~3.84%。结果表明,24种元素杂质检测方法仪器精密度和重复性均良好。
2.5.3 准确度
精密量取供试品9份,按供试品溶液制备方法,按50%、100%、150% AET加入各元素标准溶液,作为低、中、高3个浓度的加标供试品溶液,每个浓度制备3个平行样品,进行加样回收试验,结果见表3,各元素的回收率为92.6%~105.3%,RSD值为0.87%~4.10%。结果表明,24种元素杂质检测方法准确度良好。
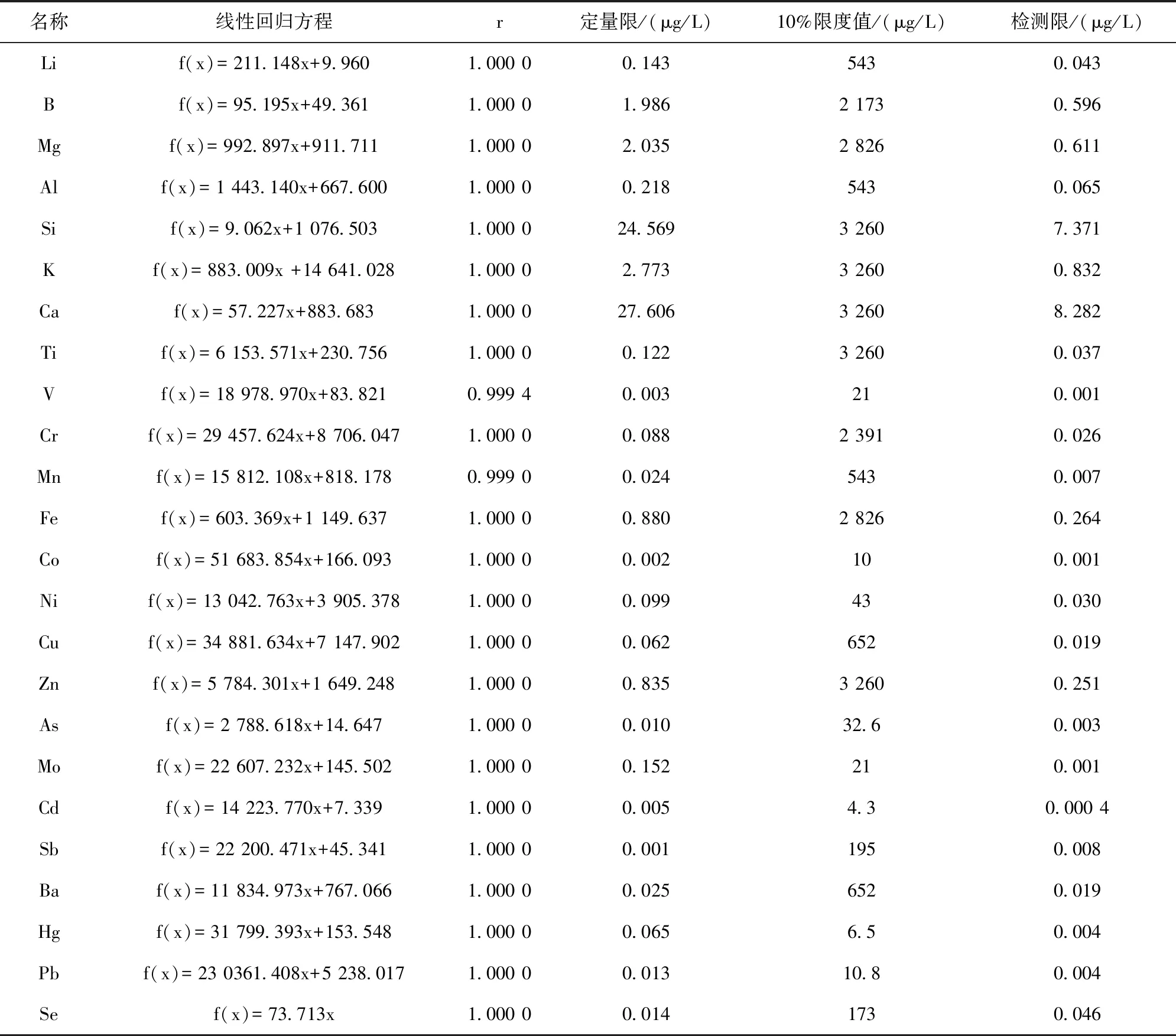
表2 24种元素的线性关系和灵敏度结果Tab.2 Linear relationship of 24 elements and sensitivity results

表3 24种元素的仪器精密度、重复性和准确度试验结果Tab.3 Test results of instrument precision, repeatability and accuracy of 24 elements
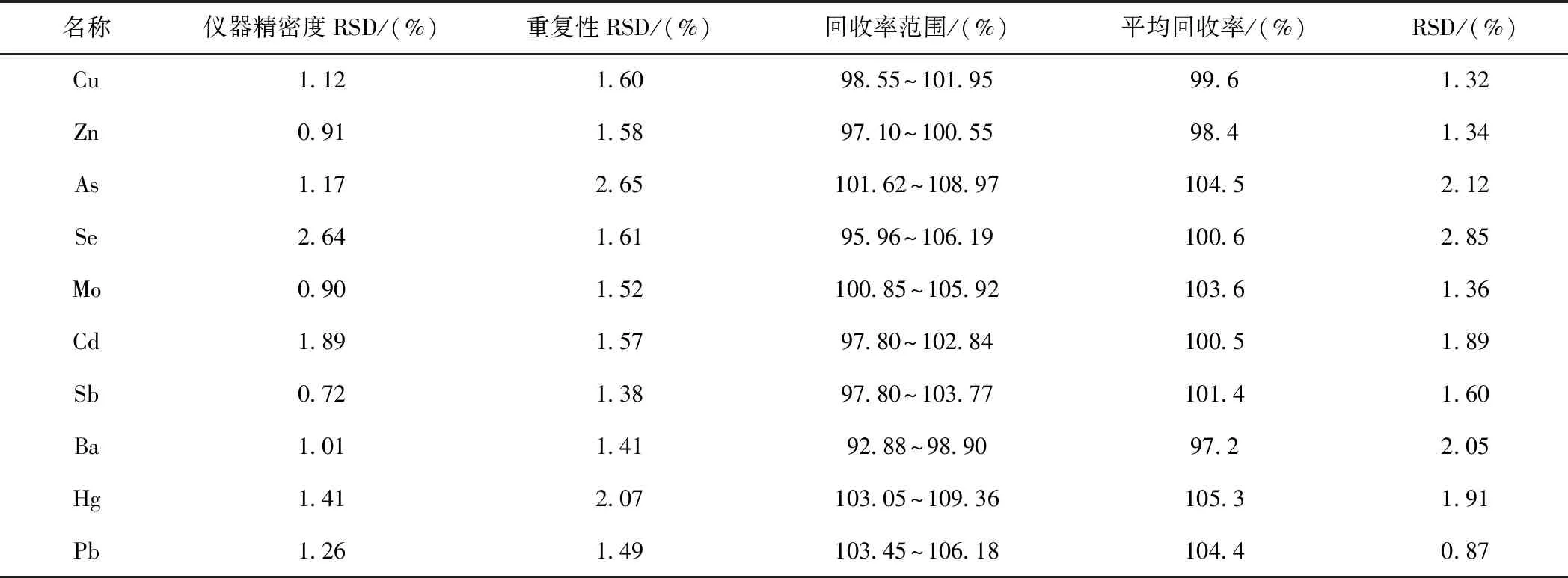
续表3
2.5.4 样品中元素杂质的含量测定
取3批0个月和在加速条件下放置3个月和6个月的样品,按溶液制备及测定方法配制并测定样品。由表4可知,各样品中24种元素杂质检出含量均符合AET限度要求,其中,仅Si、Al、B和Ba 4种元素有明显增长趋势。由表4和表5可知,放置3个月和6个月的加速样品中的Si浓度、Si/Al和Si/B浓度比值较放置0个月的样品均有较大变化。
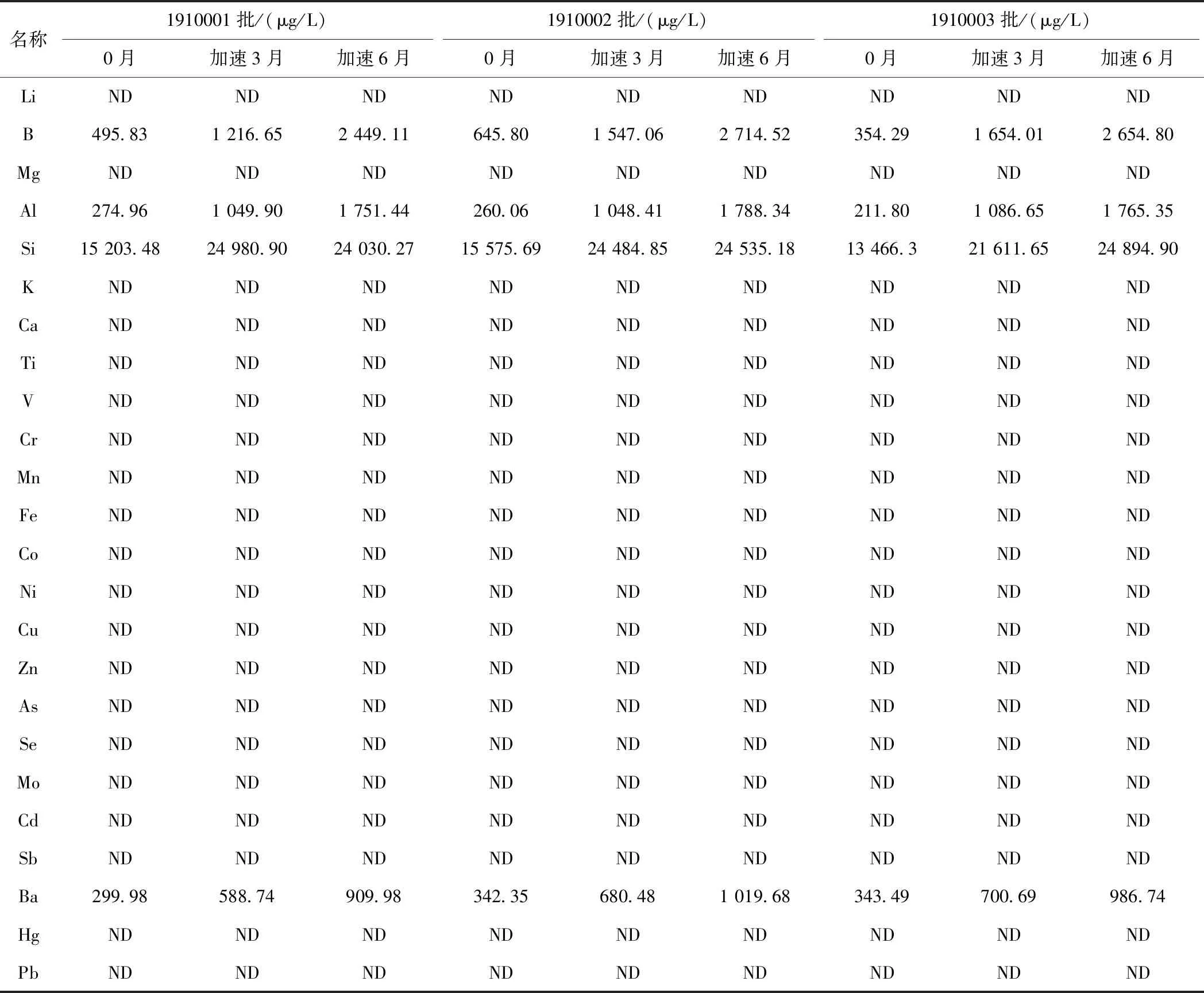
表4 盐酸氨溴索注射液0月及加速样品中24种元素杂质含量测定结果Tab.4 Determination results of 24 element impurities of ambroxol hydrochloride injection in 0 month and accelerated samples
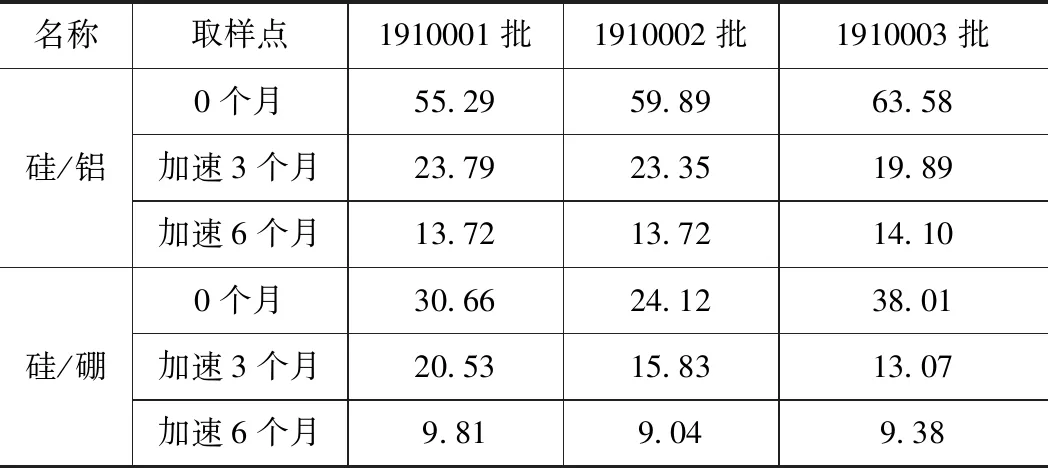
表5 盐酸氨溴索注射液加速样品硅/铝、硅/硼浓度比值测定结果Tab.5 Determination results of ambroxol hydrochloride injection accelerated silicon/aluminum, silicon/boron concentration ratio
3 讨论
建立了同时测定盐酸氨溴索注射液中24种元素杂质含量的ICP-MS法,以45Sc、73Ge、115In、209Bi为内标,可有效避免基质效应、电离效应和仪器漂移等因素对测定结果的影响。方法学考察结果显示,各元素杂质线性关系良好,重复性、仪器精密度、回收率均符合2020年版《中国药典四部》通则[15]要求。
通过对3批盐酸氨溴索注射液放置0、3、6个月的样品进行分析可知,仅Si、Al、B和Ba 4种元素有明显增长趋势,结合材质信息推测,B、Al、Si、Ba等元素杂质的来源可能为存储过程中从中硼硅玻璃安瓿迁移至药液中。B、Al、Si、Ba 4种元素杂质按照ICH Q3D中分类要求均归属为其他类,均为低毒性物质,0、3、6个月的样品检出量均小于AET,说明本品安全性良好。
放置3个月和6个月的加速样品中的Si浓度、Si/Al和Si/B浓度比值较放置0个月的样品均有较大变化。由相关文献可知,中硼硅玻璃安瓿内表面可能被侵蚀,有发生脱片的可能。NMPA发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》规定“根据加速试验和长期试验研究结果确定所采用的包装材料和容器的合理性[16]”注射剂玻璃包装材料生产工艺中的金属离子或阳离子团在和药品接触过程中均有可能浸出到药品中,影响药品质量或对患者直接产生安全隐患,因此建议生产企业选择合适的包装材料进行相容性考察,以降低药品使用风险。
综上所述,所建方法灵敏、准确、简便,可用于盐酸氨溴索注射液中24种元素杂质的含量测定;由0、3、6个月的样品研究结果表明,中硼硅玻璃安瓿与盐酸氨溴索注射液间有相互作用,存放加速6个月内元素杂质迁移量符合AET要求,说明盐酸氨溴索注射液与中硼硅玻璃安瓿包装系统相容性良好,安全性良好。由于本品市场占有率较高,从安全用药角度出发,各企业可参照《化学药品注射剂与玻璃包装材料相容性研究技术指导原则》中的内容进行模拟试验及相互作用研究,评估目前使用的包装系统在全生命周期内与药品之间相互作用的程度,用以确定药品与包装系统间的相容性和药品的安全性。
