COPD合并急性脑梗死病人NGAL、SAA变化与梗死面积及临床预后的关系
2023-03-09张红波李贯清
代 慧,张红波,瑾 瑜,李贯清
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以慢性炎症为病理表现的慢性支气管炎,其对气道及支气管可造成不可逆损伤[1]。COPD发生后,病人机体长期处于慢性炎症状态,机体内的炎性因子可激活补体系统和凝血纤溶系统,使得病人凝血功能出现异常,加重脑梗死的病情[2]。炎症反应是诱导急性脑梗死(acute cerebral infection,ACI)发生的重要病理机制之一,与病人病情进展及预后密切相关[3]。COPD与ACI共表现为机体炎症反应程度增加、神经功能受损、血管功能受损等,二者在病理机制上关系密切、相互影响[4-5]。中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)是一种由中性粒细胞分泌的糖蛋白,通过影响机体内的炎症反应影响ACI及COPD的发生发展[6]。血清淀粉样蛋白A(serum amyloid A protein,SAA)[7]是一种与炎症反应相关的载脂蛋白,与COPD和ACI有着密切联系,但关于血清NGAL、SAA水平对COPD合并ACI病人梗死面积及临床预后的相关性尚无定论。基于此,本研究以COPD合并ACI病人为研究对象,探讨COPD合并ACI病人血清NGAL、SAA水平变化与脑梗死面积及临床预后的关系,为临床预测COPD合并ACI病人的病情及预后提供参考。
1 资料与方法
1.1 临床资料 选取2020年1月—2021年4月我院收治的84例COPD合并ACI病人(合并组),其中,男45例,女39例;年龄48~75(64.61±4.35)岁。同时选取同时期在本院就诊的单纯COPD病人46例(COPD组),其中,男25例,女21例;年龄48~75(64.53±4.47)岁。另选取同时期在本院就诊的单纯ACI病人30例为ACI组,其中,男16例,女14例;年龄47~75(64.49±4.28)岁。3组性别、年龄等一般资料比较差异均无统计学意义(P>0.05)。本研究已获得医院伦理委员会批准,研究对象对本研究内容知情同意。
1.2 纳入与排除标准 纳入标准:合并组均符合COPD[8]和ACI诊断标准[9];ACI组与COPD组分别符合上述对应诊断标准。排除标准:合并其他肺部疾病;合并免疫缺陷疾病;合并其他颅内病变或有严重痴呆史;由外力导致的脑损伤;合并肢体障碍性骨病;合并其他恶性肿瘤;有严重肝肾功能障碍。
1.3 方法
1.3.1 血清NGAL、SAA水平检测 抽取所有研究对象的空腹静脉血3 mL,离心获得上清液,采用酶联免疫吸附法检测血清中NGAL水平,试剂盒购于上海美轩生物科技有限公司;采用双光径免疫浊度分析仪(美国贝克曼库尔特有限公司,型号:IMMAGE)检测血清中SAA水平。
1.3.2 脑梗死面积检测 在合并组与ACI组病人入院后采用64排螺旋CT[西门子(中国)有限公司,型号:SOMATOM Definition]进行头颅CT检查,采用机械系统动力学自动分析法测量脑梗死面积,以梗死病灶的最大直径表示梗死面积。
1.3.3 治疗情况 合并组病人在入院后均给予ACI的常规治疗,包括纠正循环障碍、控制血糖、血脂、血压以及纠正酸碱内环境失衡等,并给予COPD的常规治疗,包括糖皮质激素、吸氧、支气管扩张等。
1.3.4 随访及资料收集 随访情况:观察合并组在治疗28 d内是否发生死亡,统计已死亡者获完全数据,仍存活者获删截数据,治疗后死亡、死于非原发病者和失去随访者不计入本组资料中。总生存时间即入院当天开始至终点事件发生当天(病人因COPD合并ACI相关死亡时间)。资料收集:统计可能影响COPD合并ACI病人预后生存情况的相关因素,如性别、年龄、体质指数(body mass index,BMI)、饮酒、吸烟、入院时美国国立卫生研究院卒中量表(NIHSS)评分(≥7分为重度神经功能缺损,<7分为轻度神经功能缺损)、高血压、糖尿病、冠心病、降压药物的使用、降糖药物的使用、祛痰药的使用、血清NGAL、SAA、血小板计数(platelet count,PLT)、纤维蛋白原(fibrinogen,Fib)、呼吸频率、心率。实验室指标均为病人入院后72 h内检查所得。
1.4 统计学处理 数据处理与分析采用SPSS 27.0软件。定性资料采用χ2检验;符合正态分布的定量资料两组间比较采用t检验,多组间比较采用重复测量方差分析;采用Pearson相关性分析法分析血清NGAL、SAA水平与病人脑梗死面积的关系;采用受试者工作特征(receiver operating characteristic,ROC)曲线确定COPD合并ACI病人发生死亡的血清NGAL、SAA最佳截断值;采用Kaplan-Meier法绘制生存曲线,采用Log-rank检验进行生存分析。采用COX比例风险模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清NGAL、SAA水平比较 与COPD组相比,合并组与ACI组血清NGAL、SAA水平更高(P<0.05);与ACI组相比,合并组血清NGAL、SAA水平更高(P<0.05)。详见表1。

表1 3组血清NGAL、SAA水平比较(±s)
2.2 血清NGAL、SAA水平与脑梗死面积的关系 合并组脑梗死面积为(11.37±1.34)cm,ACI组脑梗死面积为(8.41±1.23)cm,经Pearson相关性分析显示,血清NGAL、SAA水平与脑梗死面积呈正相关(r值分别为0.512,0.536,P<0.05)。
2.3 血清NGAL、SAA最佳截断值 入院治疗28 d内,合并组有24例病人发生死亡。绘制ROC曲线判断COPD合并ACI病人发生死亡的血清NGAL、SAA水平最佳截断值,ROC曲线显示,血清NGAL、SAA的ROC曲线下面积(area under the curve,AUC)分别为0.716,0.731,灵敏度分别为71.12%,81.34%,特异度分别为60.21%,70.35%,95%置信区间(CI)分别为(1.36,3.42)、(1.41,3.97),最佳截断值分别为3.41 μg/L,12.68 mg/L,详见图1。根据最佳截断值将血清NGAL≥3.41 μg/L的病人划为高NGAL组,共49例,占比为58.33%;NGAL<3.41 μg/L的病人划为低NGAL组,共35例,占比为41.67%;并将血清SAA≥12.68 mg/L的病人划为高SAA组,共50例,占比为59.52%;SAA<12.68 mg/L的病人划为低SAA组,共34例,占比为40.48%。
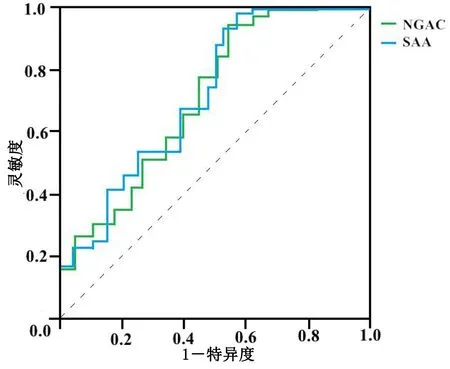
图1 血清NGAL、SAA对病人预后价值评估的ROC曲线图
2.4 影响COPD合并ACI病人预后生存情况的单因素分析 单因素分析显示,性别、年龄、BMI、饮酒、吸烟、高血压、糖尿病、冠心病、降压药物的使用、降糖药物的使用、祛痰药物的使用、PLT、Fib、呼吸频率、心率与COPD合并ACI病人预后生存时间无关(P>0.05);而入院时NIHSS评分≥7分的病人平均生存时间短于入院时NIHSS评分<7分的病人(P<0.05),血清NGAL≥3.41 μg/L的病人平均生存时间短于NGAL<3.41 μg/L的病人(P<0.05),血清SAA≥12.68 mg/L的病人平均生存时间短于SAA<12.68 mg/L的病人(P<0.05)。详见表2。
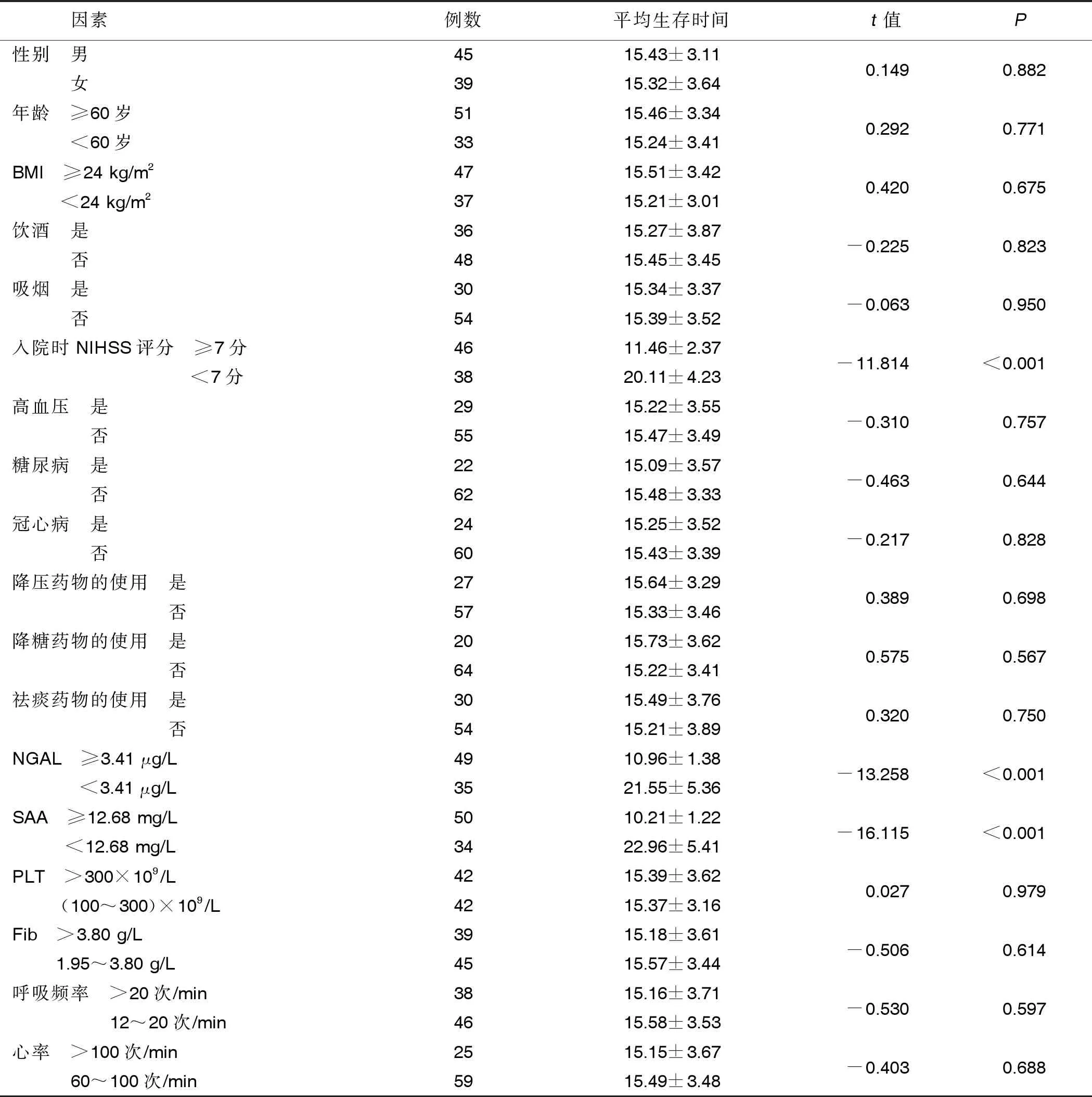
表2 影响COPD合并ACI病人预后生存情况的单因素分析 单位:d
2.5 不同血清NGAL、SAA水平病人生存曲线分析 高NGAL组与低NGAL组病人生存曲线比较,差异有统计学意义(χ2=10.367,P<0.05);高SAA组与低SAA组生存曲线比较,差异有统计学意义(χ2=13.251,P<0.05)。详见图2。
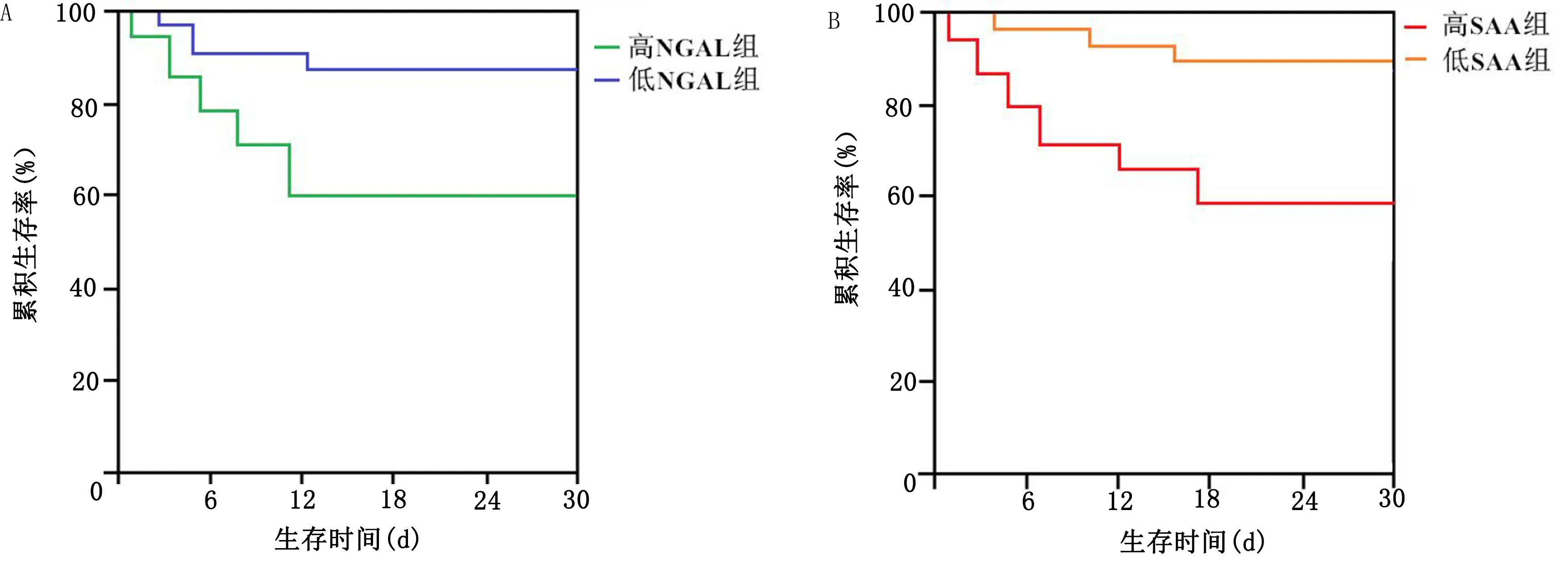
图2 不同血清NGAL、SAA水平病人生存曲线
2.6 影响COPD合并ACI病人生存情况的COX多因素分析 对入院时NIHSS评分、血清NGAL、SAA水平以前进法(Forward:LR)进行COX回归多因素模型分析,结果显示,入院时NIHSS评分、血清NGAL、SAA水平是影响COPD合并ACI病人预后生存情况的独立危险因素(P<0.05)。详见表3。

表3 影响COPD合并ACI病人生存情况的COX多因素分析
3 讨 论
ACI为临床常见病、多发病,致残率、病死率均较高,已经成为威胁我国居民身体健康的社会公共卫生问题[10]。COPD是呼吸内科常见病,以咳痰、气短、慢性咳嗽、呼吸困难等为主要临床表现,具有较高的致残率和病死率,其可加重脑梗死的病情进展[11]。目前关于COPD影响脑梗死的病理机制尚不明确,认为主要涉及以下方面[12-13]:①COPD病人长期处于慢性低氧状态或二氧化碳潴留状态,长期缺氧刺激病人体内儿茶酚胺水平急剧升高,诱导血压升高,加重心脏负担,最终导致病人血流动力学改变。此外,长时间缺氧亦可导致红细胞代偿异常,增加血液黏度,从而升高血栓发生的风险。②COPD是一种炎性疾病,其发生后,病人体内的系统性炎性因子水平明显升高,而炎症反应可诱导脑梗死的发生,并能加速病人病情进展,甚至是恶化。因此,COPD合并ACI会加重脑梗死的病情,加大治疗难度,加重病人神经功能损伤,且病死率及致残率会更高。故研究COPD合并ACI病人的预后具有十分重要的临床意义,可为最大限度保护病人的神经功能,降低不良预后提供临床参考。
血清NGAL是一种新型载脂蛋白,可参与机体内的炎症反应、免疫应答、细胞凋亡、组织重构等,其主要通过诱导白细胞内颗粒如白细胞介素、趋化因子等的分泌参与机体内的炎症反应[14]。Bchir等[15]研究表明,COPD发生时机体内NGAL水平会急剧升高,影响病人病情进展。Hutanu等[16]研究表明,ACI病人体内的血清NGAL水平高于健康对照组,即提示血清NGAL水平参与脑梗死的发生发展。血清SAA是一种急性时相反应蛋白,其可通过刺激单核细胞、内皮细胞以及肝细胞等分泌多种炎性因子,从而引起炎症细胞对血管内膜的浸润作用,导致动脉粥样硬化的发生[17]。另外,SAA能增加脂质在动脉粥样硬化部位的沉积,加速动脉粥样硬化的过程[18]。Lin等[19]研究表明,血清SAA在COPD发生后呈现高表达。Liang等[20]研究表明,血清SAA在ACI病人中具有较高的表达。本研究结果显示,与COPD组相比,合并组与ACI组血清NGAL、SAA水平更高;与ACI组相比,合并组血清NGAL、SAA水平更高;Pearson相关性分析显示,血清NGAL、SAA水平均与病人梗死面积呈正相关,提示血清NGAL、SAA水平参与COPD合并ACI的发生与发展,并能加速病情进展。
此外,单因素分析显示,性别、年龄、BMI、饮酒、吸烟、高血压、糖尿病、冠心病、降压药物、降糖药物、祛痰药物的使用、PLT、Fib、呼吸频率、心率与COPD合并ACI病人预后生存时间无关;而入院时NIHSS评分、血清NGAL、SAA水平是影响COPD合并ACI病人预后生存时间的因素,提示血清NGAL、SAA水平与COPD合并ACI病人预后生存时间相关,同时病人入院时NIHSS评分与COPD合并ACI病人预后生存时间也存在相关性。Kaplan-Meier生存曲线显示,高NGAL组与低NGAL组病人生存曲线比较,差异有统计学意义。高SAA组与低SAA组病人生存曲线比较,差异有统计学意义。再次证明血清NGAL、SAA水平与COPD合并ACI病人预后生存情况相关,故在临床治疗中应密切关注血清NGAL、SAA水平较高的病人,并根据病人病情采取积极治疗措施,降低不良预后的发生。另外,COX回归多因素模型分析结果显示,入院时NIHSS评分、血清NGAL、SAA水平是COPD合并ACI病人预后生存情况的影响因素。再次提示了血清NGAL、SAA水平与COPD合并ACI病人预后生存情况关系密切,提示在病人入院后应注意监测血清NGAL、SAA水平,延缓病人病情进展,以期达到提高生存率的目的。
综上所述,血清NGAL、SAA水平与COPD合并ACI病人脑梗死面积具有相关性,是COPD合并ACI病人预后生存情况的影响因素,可作为预测COPD合并ACI病人预后的指标。
