真空预冷中雾化微酸性电解水处理对鸡毛菜低温流通及其货架期品质的影响
2023-03-09赵安琪安容慧王馨渝李鹏霞李国锋胡花丽
赵安琪,安容慧,王馨渝,韩 颖,谢 宏,李鹏霞,李国锋,胡花丽,,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江苏省农业科学院农业设施与装备研究所,江苏 南京 210014;3.农业农村部农产品冷链物流技术重点实验室,江苏 南京 210014)
鸡毛菜是十字花科芸苔属植物小白菜(BrassicarapaL.chinensis)幼苗的俗称,是江苏地区常见的蔬菜品种之一。鸡毛菜含有丰富的维生素和矿物质,且质地柔嫩,味道清香,深受消费者喜爱。但由于鸡毛菜常于嫩苗时期通过切割采收,因此采后极易发生失水萎蔫、黄化衰老及腐烂症状。如果不采取保鲜措施,一般鸡毛菜采收后仅1~2 d就会发生上述品质劣变问题,致使鸡毛菜失去商品价值[1]。如何保持鸡毛菜的品质、延长其货架期是目前鸡毛菜采后生产中需解决的问题。
真空预冷是叶类蔬菜产地商品化处理中常用的物理保鲜技术之一,它可快速去除叶类蔬菜的呼吸热,抑制蔬菜呼吸作用从而延缓组织衰老[2]。通常真空预冷温度每下降10 ℃,产品的水分会损失1.7%左右,严重影响其新鲜度[3]。研究人员主要通过真空预冷前的补水处理控制失水。解新方等[4]的研究发现,在真空预冷前用喷壶在菠菜表面均匀喷洒水,可以减少叶片组织水分的流失。同样,在甘蓝和生菜[5]进行真空预冷之前,直接喷淋补水可明显降低水分损失。但这种处理方式不仅费时费力,而且在预冷后仍有水分残留,可能加重采后叶菜的腐烂。
微酸性电解水是将稀盐(NaCl)溶液或稀盐酸溶液在无隔膜电解装置中进行电解,得到pH 5.0~6.5、含有高质量浓度有效氯(available chlorine concentration,ACC)的电解水[6]。因其广谱高效、绿色安全、无残留等优势,被广泛应用于食品的杀菌消毒等方面[7]。近年来,有研究表明微酸性电解水不仅在肉类[8]和水产品[9]杀菌保鲜中有所应用,在绿叶蔬菜、水蜜桃等果蔬的保鲜方面同样也具有显著效果[10]。目前的研究中,关于微酸性电解水的作用效果主要是通过浸泡和清洗的方式来实现,增加了处理环节与繁琐程度。最重要的是,当微酸性电解水长时间暴露在空气和光照下会使其灭活微生物和保鲜果蔬的能力减弱甚至丧失,这又进一步给其实际应用带来困难,这些问题现已成为制约该项绿色、高效非热杀菌技术实现工业化发展的障碍。将真空预冷与微酸性电解水处理技术结合,不仅可以控制真空预冷后叶菜的失水,而且微酸性电解水的杀菌作用还能在一定程度维持叶菜的品质。然而目前关于真空预冷结合微酸性电解水处理是否能延缓采后鸡毛菜品质变化的研究鲜有报道。因此,本研究以鸡毛菜为试材,分析真空预冷过程中通过微酸性电解水处理对鸡毛菜在低温流通及货架期间感官品质、营养成分及抗氧化能力的影响,以期为采后鸡毛菜的复合保鲜技术及流通和货架期品质控制提供理论与技术支持。
1 材料与方法
1.1 材料与试剂
鸡毛菜购买于南京众彩物流批发市场,采购后1 h内运至江苏省农业科学院农产品设施与装备研究所农产品贮藏保鲜研究室,挑选大小一致、色泽鲜艳、无黄叶和病害的鸡毛菜作为实验材料。
酚酞、蒽酮、抗坏血酸、盐酸萘乙二胺、乙醇、甲醇 国药集团化学试剂有限公司;乙酸锌、草酸、磷酸二氢钾、氢氧化钾、对氨基苯磺酸、考马斯亮蓝G-250上海麦克林生化科技有限公司;无水葡萄糖、亚硝酸钠、亚铁氰化钾 西陇科学股份有限公司;浓硫酸(质量分数98%) 南京化学试剂股份有限公司;福林-酚试剂、邻二氮菲、三氯乙酸 上海源叶生物技术有限公司;三甲醇氨基甲烷 北京索莱宝科技有限公司。
1.2 仪器与设备
CR-400型色差仪 日本柯尼卡美能达公司;HD-240L型“水神”微酸性次氯酸水生成机 上海旺旺集团;Seven-Multi型pH/电导率/离子综合测试仪、PL202-L型分析天平 梅特勒-托利多仪器(上海)有限公司;A11 Basic液氮研磨器 广州艾卡仪器设备有限公司;3K15高速冷冻离心机 美国Sigma-Aldrich公司;UV-1102紫外-可见分光光度计 上海天美科学仪器有限公司;喷雾加湿型真空预冷机 东莞科美斯科技实业有限公司。
1.3 方法
1.3.1 鸡毛菜的处理方法及微酸性电解水的制备
将鸡毛菜(每组处理约4 kg)整齐摆放于塑料筐(47 cm×31 cm×26 cm)中,置于真空预冷室的中部,将温度传感器插入鸡毛菜菜心中心,开始预冷。所有鸡毛菜分为4 组:真空预冷组:初温25 ℃、终温4 ℃、终压0.8 kPa、不补水,降温速率约为1.2 ℃/min;真空预冷补自来水(记为真空预冷+自来水)组:初温25 ℃、终温4 ℃、终压0.8 kPa,降温速率约为1.41 ℃/min,当真空压力降为15 kPa时按照50 mL/s喷雾补水50 s(基于预实验结果设置),总共补水250 mL;真空预冷+微酸性电解水组:初温25 ℃、终温4 ℃、终压0.8 kPa,降温速率约为1.42 ℃/min,当真空压力降为15 kPa时按照50 mL/s喷雾补充ACC为50 mg/L(基于预实验优选的结果)的微酸性电解水50 s,总共补充250 mL;对照组(CK):不进行真空预冷及补水处理,在真空预冷期间将相同质量的鸡毛菜置于室温(25 ℃左右)。每个处理重复3 次。预冷结束后将上述处理好的鸡毛菜装入厚30 μm的聚乙烯袋(袋子正反面各有2 个直径约1 mm的孔)中,每袋装10 棵,每组处理设15 袋,然后模拟低温((4±1)℃)流通1 d,随后在(20±1)℃模拟常温货架贮藏4 d,流通及货架贮藏期间每天测定色泽并取样。所取外部叶片(避开主叶脉)迅速用液氮冷冻,置于-80 ℃冰箱保存,用于相关指标的测定。
微酸性电解水的制备参考赵德锟等[11]的方法,在自来水中添加质量分数9%稀盐酸,用微酸性次氯酸水生成机制备ACC为85 mg/L的微酸性电解水。电解约30 min,待电流稳定后取微酸性电解水进行实验。用蒸馏水稀释以得到ACC为50 mg/L的微酸性电解水,采用pH/电导率/离子综合测试仪测定微酸性电解水的pH值和氧化还原电位,采用碘量法[12]测定ACC。
1.3.2 色泽测定
参照卢瑞雪等[13]的方法,每个处理取15 棵鸡毛菜,每棵鸡毛菜取2 片叶子,避开主叶脉在叶片中上部对称取2 个点,利用色差仪测定鸡毛菜叶片亮度(L*值)、红绿度(a*值)、黄蓝度(b*值)。
1.3.3 叶绿素含量的测定
参照李合生[14]、韦友欢[15]等的方法,略有改动。称取0.2 g经液氮研磨器研磨后的鸡毛菜粉末,加入10 mL体积分数80%丙酮溶液,避光常温浸提6 h,过滤后取上清液,以80%丙酮溶液为空白校零,测定上清液在642、665 nm波长处吸光度A642nm、A665nm,重复测定3 次,分别按式(1)~(3)计算叶绿素a、叶绿素b、总叶绿素含量。
式中:V为提取液总体积/mL;m为样品质量/g。
1.3.4 可滴定酸质量分数的测定
参考Marsh等[16]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加8 mL水于75~80 ℃水浴加热30 min并不断摇晃,冷却至室温后离心(10 000 r/min、4 ℃)15 min。加入0.2 g 活性炭脱色后离心(10 000×g、15 min,4 ℃),吸取滤液3 mL至锥形瓶,加入酚酞指示剂,用0.001 mol/L NaOH溶液滴定至混合溶液呈淡红色,30 s内不褪色。重复滴定3 次,结果取平均值。
1.3.5 可溶性蛋白含量的测定
参考Bradford等[17]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加入5 mL 0.1 mol/L磷酸缓冲液(pH 7.2)匀浆,10 000×g、4 ℃离心15 min,取0.1 mL上清液,加入0.9 mL蒸馏水和5 mL 0.1 g/L考马斯亮蓝G-250,混匀测定595 nm波长处吸光度。以0.5 mg/mL牛血清白蛋白制作标准曲线,根据标准曲线方程计算可溶性蛋白含量,单位为mg/g。
1.3.6 可溶性糖含量的测定
采用张志良[18]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加5 mL体积分数80%乙醇溶液,研磨匀浆,80 ℃水浴中浸提10 min,冷却,10 000×g、4 ℃离心15 min,取0.1 mL上清液,沿管璧缓缓加入5 mL蔥酮,待全部加完后,充分混匀放入沸水浴中反应10 min,取出后自然冷却至室温,测定620 nm波长处吸光度,以葡萄糖为标准品绘制标准曲线,根据标准曲线方程计算可溶性糖含量,单位为mg/g。
1.3.7 亚硝酸盐含量的测定
参照GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[19]中的盐酸萘乙二胺法测定亚硝酸盐含量。
1.3.8 抗氧化物质含量的测定
抗坏血酸含量的测定参考张佳楠等[20]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加5 mL草酸-乙二胺四乙酸溶液,10 000×g、4 ℃离心15 min,取1 mL上清液依次加入4 mL草酸-乙二胺四乙酸溶液(含6.3 g/L草酸和0.075 g/L乙二胺四乙酸)、0.5 mL质量分数3%的偏磷酸-乙酸溶液、1 mL质量分数5%硫酸溶液和2 mL质量分数为5%钼酸铵溶液,摇匀后于30 ℃水浴15 min,测定760 nm波长处吸光度。以抗坏血酸为标准品绘制标准曲线,根据标准曲线方程计算抗坏血酸含量。
叶酸含量的测定参考姚瑛等[21]的方法,略有改动。称取1 g经液氮研磨器研磨后的鸡毛菜粉末,加入2.5 mL质量分数0.5%氨水,振摇30 min后离心10 000×g、4 ℃离心20 min,取上清液经0.22 μm微孔滤膜过滤后采用高效液相色谱测定叶酸质量浓度,然后按式(4)计算叶酸含量。
式中:ρ0为叶酸质量浓度/(µg/mL);V为上清液总体积/mL;m为样品质量/g。
高效液相色谱条件:色谱柱:C18柱(250 mm×4.6 mm,5 μm);流动相:6.8 g磷酸二氢钾溶于70 mL 0.1 mol/L 氢氧化钾溶液,用水稀释至850 mL,调节pH 6.3,加甲醇80 mL,用水稀释至1 000 mL;流速:0.8 mL/min;检测波长:254 nm;柱温:30 ℃;进样体积:10 μL。
类胡萝卜素含量的测定参照李合生[14]的方法并稍作修改。按照1.3.3节方法处理并计算叶绿素a、叶绿素b含量(分别记为w1、w2,单位为mg/g),测定上清液在474 nm波长处的吸光度A474nm,按式(5)计算类胡萝卜素含量。
式中:V为提取液总体积/mL;m为样品质量/g。
总酚含量的测定参考Ghasemnezhad等[22]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加2.5 mL体积分数80%乙醇充分匀浆,10 000×g、4 ℃离心15 min,取0.5 mL上清液,加3.5 mL蒸馏水、0.4 mL福林-酚试剂,25 ℃反应3 min,再加入1 mL饱和Na2CO3溶液,25 ℃反应1 h,测定760 nm波长处吸光度,以没食子酸作为标准物质做标准曲线,计算样品中的总酚含量,单位为mg/g。
1.3.9 自由基清除率的测定
称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加入5 mL体积分数95%乙醇充分研磨,浸提5 h,离心,收集上清液。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的测定:参考张映曈等[23]的方法,略有改动。取上清液0.5 mL,加入3 mL DPPH-乙醇溶液,反应30 min,测定517 nm波长处吸光度,并计算DPPH自由基清除率[23]。
羟自由基清除率的测定:参考Dong Tiantian等[24]的方法,略有改动。取2 mL 0.1 mol/L磷酸缓冲液(pH 7.4),加入0.3 mL 2.5 mmol/L邻二氮菲溶液、0.2 mL 5 mmol/L FeSO4溶液、0.1 mL上清液、1 mL 0.1%的H2O2,每次加入溶液后均充分混匀。37 ℃条件下保温1 h,测定510 nm波长处吸光度,并计算羟自由基清除率[24]。
超氧阴离子自由基清除率的测定:参考Alothman等[25]的方法,略有改动。取2.5 mL 0.05 mol/L Tris-HCl缓冲溶液(pH 8.2),25 ℃水浴20 min,加入0.5 mL上清液和0.25 mL 25 mmol/L的邻苯三酚溶液,充分混匀,记录3 min内混合溶液于425 nm波长处吸光度的变化。以蒸馏水代替上清液为对照组,计算超氧阴离子自由基清除率[25]。
1.3.10 丙二醛含量的测定
参考Du Qi等[26]的方法,略有改动。称取0.5 g经液氮研磨器研磨后的鸡毛菜粉末,加入5 mL 100 g/L三氯乙酸溶液,充分混匀,10 000×g、4 ℃离心15 min,取2 mL上清液加入2 mL质量分数0.67%硫代巴比妥酸溶液中,混合充分,沸水浴中反应20 min,取出冷却至室温,10 000×g、4 ℃离心15 min,取上清液分别测定450、532、600 nm波长处的吸光度,计算丙二醛(malondialdehyde,MDA)含量,单位为µmol/g。
1.4 数据处理与分析
所有数据均平行测定3 次,结果以平均值±标准差表示,使用SPSS 24软件进行t检验及单因素方差分析,采用Duncan检验进行显著性分析,P<0.05为差异显著,采用Origin 21.0软件作图。
2 结果与分析
2.1 鸡毛菜外观品质变化
由图1可知,对照组在货架第1天时开始出现黄化的迹象,在货架贮藏第3天时黄化严重,失去商品价值,因此未分析其货架贮藏第4天时的品质变化;经单独真空预冷处理的鸡毛菜在货架贮藏第2天出现轻微黄化现象,但在货架贮藏3 d时叶片组织出现失水萎蔫症状,因此未分析其货架贮藏第4天鸡毛菜的品质变化;与对照组和单独真空预冷组相比,真空预冷+自来水处理延缓了叶片的黄化,在货架贮藏第3天表现出轻微黄化,货架贮藏第4天黄化开始加重;相比之下,真空预冷+微酸性电解水处理明显延缓了鸡毛菜采后的黄化进程,在货架贮藏前3 d时仍维持着叶片的浓绿,货架贮藏第4天时仅出现轻微的黄化。可见,真空预冷结合微酸性电解水可有效延缓鸡毛菜外观品质的劣变,延长其货架期。

图1 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜外观品质的影响Fig.1 Effect of atomized SAEW treatment during vacuum precooling on the appearance quality of postharvest Chinese little greens
2.2 鸡毛菜色泽变化
由图2A可知,在流通和货架期间各处理组鸡毛菜L*值总体呈上升的趋势,在低温流通及货架贮藏1 d时无明显差异。在货架贮藏2~3 d,对照组鸡毛菜的亮度维持在较高水平,显著高于其他组(P<0.05)。在货架贮藏3 d时,单独真空预冷组和对照组鸡毛菜L*值显著高于真空预冷+微酸性电解水处理组(P<0.05);在货架贮藏4 d时,真空预冷+微酸性电解水处理组的L*值最低。
随着鸡毛菜货架时间的延长,b*值逐渐增加(图2B)。在货架贮藏期间,对照组鸡毛菜的b*值与单独真空预冷组无显著性差异(P>0.05)。此外,与单独的对照组和真空预冷组相比,复合处理组尤其是真空预冷+微酸性电解水处理组明显延缓了b*值的升高。例如,在货架贮藏第3天和第4天时真空预冷+微酸性电解水处理组的b*值分别比真空预冷+自来水处理组低6%和7%。
与L*、b*值的变化不同,鸡毛菜a*值在低温流通及货架期间呈现增加的趋势(图2C)。在货架1~3 d时,对照组鸡毛菜a*值高于其他3 组处理,且在货架贮藏第2天显著高于其他组(P<0.05)。真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的a*值在货架贮藏3 d时分别比单独真空预冷处理组低11%和15%。在货架贮藏4 d时,真空预冷结合微酸性电解水处理的鸡毛菜a*值是真空预冷+自来水处理组的1.13 倍。可见,真空预冷结合微酸性电解水可以维持鸡毛菜较好的色泽,延缓黄化进程。
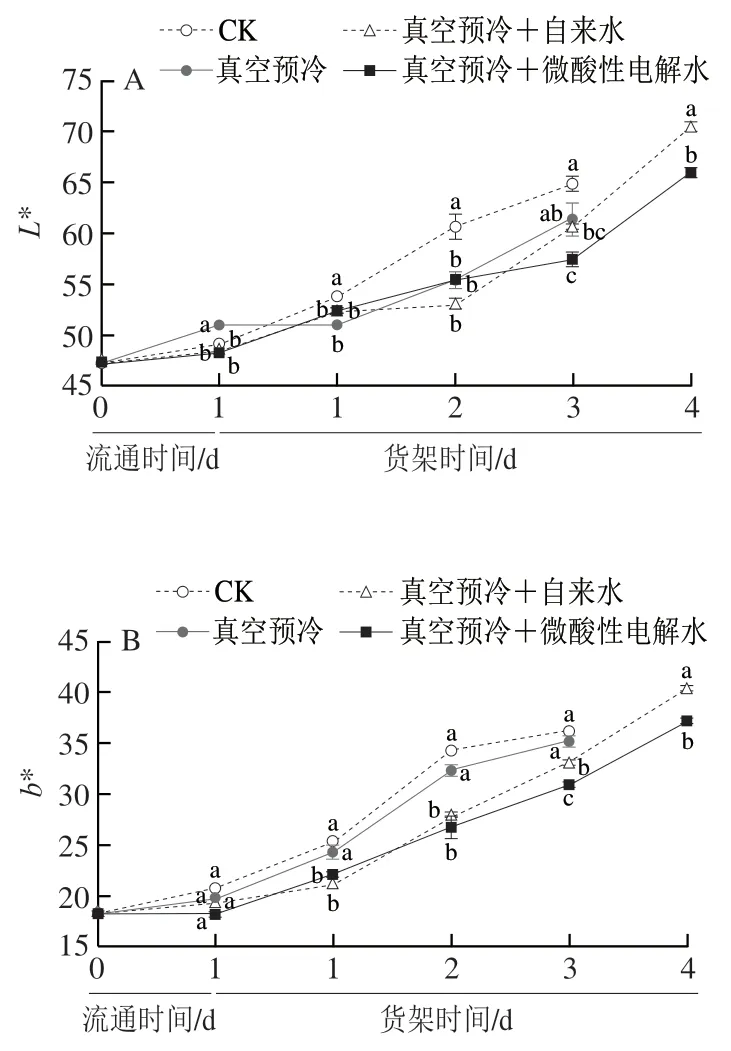
图2 真空预冷过程中的雾化微酸性电解水处理对鸡毛菜叶片L*值(A)、b*值(B)和a*值(C)的影响Fig.2 Effects of atomized SAEW treatment during vacuum precooling on the L* value (A),b* value (B) and a* value (C) of postharvest Chinese little greens
2.3 鸡毛菜叶绿素含量变化
如图3所示,随着货架时间的延长,各组的叶绿素a、叶绿素b和总叶绿素含量均呈下降的趋势。货架贮藏第3天时对照组的总叶绿素含量相比于0 d时下降了67.2%,而单独真空预冷组、真空预冷+自来水以及真空预冷+微酸性电解水处理组的叶绿素含量分别较0 d时下降了56.8%、51.9%和40.4%。此外,在货架贮藏3~4 d期间,真空预冷与微酸性电解水结合处理组的叶绿素损失显著低于同期真空预冷+自来水组(P<0.05)。这与鸡毛菜的外观品质的变化相互印证,黄化程度越高,叶绿素含量越低。以上结果表明,微酸性电解水与真空预冷结合处理可以延缓鸡毛菜叶绿素含量的损失。
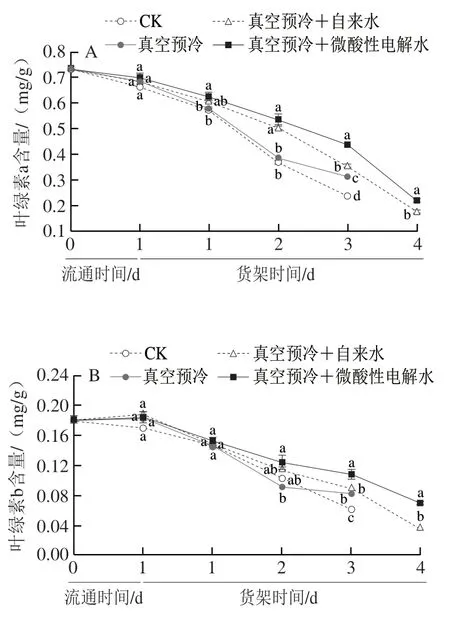
图3 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜叶绿素a(A)、叶绿素b(B)、总叶绿素(C)含量的影响Fig.3 Effect of atomized SAEW treatment during vacuum precooling on the contents of chlorophyll a (A),chlorophyll b (B) and total chlorophylls (C) in postharvest Chinese little greens
2.4 鸡毛菜可滴定酸质量分数变化
如图4所示,随着低温流通和货架贮藏时间的延长,除真空预冷组外,其余各组鸡毛菜组织中的可滴定酸质量分数总体呈现先升高后下降的趋势。鸡毛菜的可滴定酸质量分数在流通和货架贮藏1 d期间呈上升趋势,在货架贮藏1~2 d期间,除了真空预冷+微酸性电解水处理组的可滴定酸质量分数呈升高趋势外,其他处理组均呈下降趋势;货架贮藏2 d后,对照组的可滴定酸质量分数始终呈下降趋势而其他组出现上升趋势。货架贮藏3 d开始,经过单独真空预冷处理的鸡毛菜,其可滴定酸质量分数均显著高于对照组(P<0.05),货架贮藏第3天,单独真空预冷处理组、真空预冷+自来水处理处理组和真空预冷+微酸性电解水处理组的可滴定酸质量分数相比于对照组分别升高了39.3%、56.7%和75.2%,说明与对照组相比真空预冷处理可以保持较高的可滴定酸质量分数。在货架贮藏第4天时,真空预冷+微酸性电解水处理组和真空预冷+自来水处理组的可滴定酸质量分数相较于0 d时的分别降低了9.8%和28.1%,这表明真空预冷与微酸性电解水结合处理能有效维持鸡毛菜在低温流通和货架期间的可滴定酸质量分数。
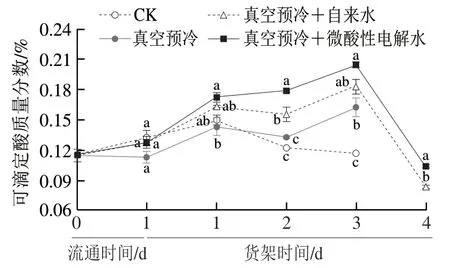
图4 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜可滴定酸质量分数的影响Fig.4 Effect of atomized SAEW treatment during vacuum precooling on the content of titratable acid in postharvest Chinese little greens
2.5 鸡毛菜可溶性蛋白和可溶性糖含量变化
由图5A可知,除对照组、单独真空预冷处理组外,其他组鸡毛菜的可溶性蛋白含量随时间延长呈现先上升后下降的趋势。在低温流通和货架期间,真空预冷+微酸性电解水处理组和真空预冷+自来水处理组的可溶性蛋白含量始终显著高于对照组(P<0.05);在货架第3天时,真空预冷+自来水处理组可溶性蛋白含量是对照组的1.19 倍,而单独真空预冷处理组与对照组无显著差异(P>0.05);与0 d时相比,货架贮藏4 d时真空预冷+自来水处理组与真空预冷+微酸性电解水处理组的可溶性蛋白含量损失率分别为46.6%和36.1%。可知,相较于在真空预冷过程中喷淋自来水,微酸性电解水能更好地延缓鸡毛菜可溶性蛋白含量的下降。
由图5B可知,随时间延长,真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的可溶性糖含量呈现先升高后下降的趋势;而对照组和单独真空预冷处理组呈现先下降后上升再下降的趋势,对照组在低温流通期间的下降趋势最为明显。在货架贮藏1~3 d,单独真空预冷处理组的可溶性糖含量显著低于真空预冷+自来水处理组与真空预冷+微酸性电解水处理组(P<0.05);而在货架第4天时,真空预冷+自来水处理组与真空预冷+微酸性电解水处理组的可溶性糖含量相较于0 d时的分别减少了37.69%和21.79%。这表明真空预冷与微酸性电解水结合处理能有效延缓鸡毛菜中可溶性糖含量的下降。

图5 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜可溶性蛋白(A)和可溶性糖(B)含量的影响Fig.5 Effect of atomized SAEW treatment during vacuum precooling on the contents of soluble protein (A) and soluble sugar (B) in postharvest Chinese little greens
2.6 鸡毛菜亚硝酸盐含量变化
由图6可知,随着货架时间的延长,所有鸡毛菜中的亚硝酸盐含量整体呈上升趋势。在低温流通期间,单独真空预冷处理组、真空预冷+自来水处理组与真空预冷+微酸性电解水处理组的亚硝酸盐含量均显著低于对照组(P<0.05)。这表明真空预冷可延缓鸡毛菜中亚硝酸盐含量的上升幅度。货架贮藏第1天时,各处理组的亚硝酸盐含量再次出现明显增长,其中在货架贮藏第3天时,真空预冷+自来水处理组和真空预冷+微酸性电解水处理组与0 d时的亚硝酸盐含量相比分别增加了57.82%和46.17%,而对照组增加了88.35%。与对照组相比,真空预冷过程中可以通过补自来水或微酸性电解水来延缓亚硝酸盐含量的增加,在货架贮藏第4天时真空预冷+自来水处理组的亚硝酸盐含量是真空预冷+微酸性电解水处理组的1.16 倍。可见,真空预冷与微酸性电解水结合处理能有效的抑制组织中亚硝酸盐含量的积累。
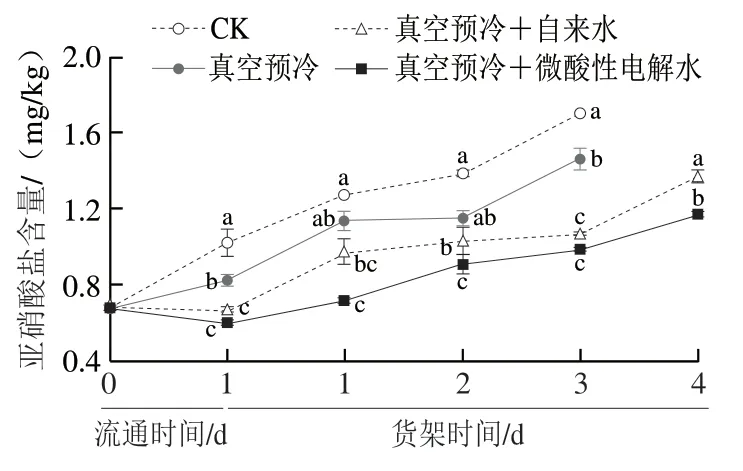
图6 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜亚硝酸盐含量的影响Fig.6 Effect of atomized SAEW treatment during vacuum precooling on the content of nitrite in postharvest Chinese little greens
2.7 鸡毛菜抗氧化物质含量变化
如图7A所示,在流通及货架期间,鸡毛菜中的抗坏血酸含量均呈现逐渐下降趋势,其中对照组的下降趋势尤为明显。真空预冷结合微酸性电解水处理明显延缓了鸡毛菜抗坏血酸含量的下降。与0 d相比,货架贮藏第3天时,单独真空预冷处理组抗坏血酸含量的损失率为21%,而真空预冷+自来水处理组和真空预冷结合微酸性电解水处理组的抗坏血酸含量的损失率分别为17.62%和11.84%。在货架贮藏第4天时,真空预冷+微酸性电解水处理组的抗坏血酸含量显著高于同期真空预冷+自来水处理组(P<0.05),并且与货架贮藏第3天时真空预冷+自来水处理组的抗坏血酸含量相当。可见,真空预冷结合微酸性电解水处理能够有效地维持鸡毛菜贮藏期间较高的抗坏血酸含量。
如图7B所示,在低温流通和货架期间,各组鸡毛菜的叶酸含量均明显降低。与0 d相比,在低温流通1 d后,经过真空预冷和微酸性电解水结合处理鸡毛菜中的叶酸保留率约80%,而其他处理组叶酸的保留率约70%。在货架贮藏3 d时,单独真空预冷处理组、真空预冷+自来水处理组以及真空预冷+微酸性电解水处理组的叶酸含量均显著高于对照组(P<0.05)。在货架贮藏第4天时,经过真空预冷+微酸性电解水处理的鸡毛菜其叶酸含量显著高于真空预冷+自来水处理组(P<0.05)。这表明真空预冷与微酸性电解水结合处理能有效减少鸡毛菜中叶酸的损失。
如图7C所示,随着低温流通及货架时间的延长,鸡毛菜中的类胡萝卜素含量呈下降的趋势。在货架第2天时,真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的类胡萝卜素含量分别是对照组的1.21 倍和1.40 倍,均显著高于对照组(P<0.05)。货架贮藏3 d时,单独真空预冷处理组、真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的类胡萝卜素含量同时期显著高于对照组(P<0.05)。相较于0 d,货架贮藏第4天时真空预冷+自来水处理组中类胡萝卜素含量的损失率为54.7%,而真空预冷+微酸性电解水处理组中类胡萝卜素含量的损失率为43.49%,这表明微酸性电解水与真空预冷结合处理可以延缓类胡萝卜素含量的减少。
由图7D可知,在低温流通和货架期间,所有鸡毛菜中的总酚含量随时间的延长均有所下降,真空预冷+微酸性电解水处理延缓了鸡毛菜中总酚含量的下降。流通期间,真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的总酚含量显著高于对照组和单独真空预冷处理组(P<0.05)。在整个货架期,真空预冷+微酸性电解水处理组的总酚含量均显著高于对照组(P<0.05)。在货架贮藏第4天时,真空预冷+微酸性电解水处理中的总酚含量(2.23 mg/g)是真空预冷+自来水处理组的1.06 倍。由此可知,真空预冷结合微酸性电解水处理可有效延缓鸡毛菜总酚含量的下降。
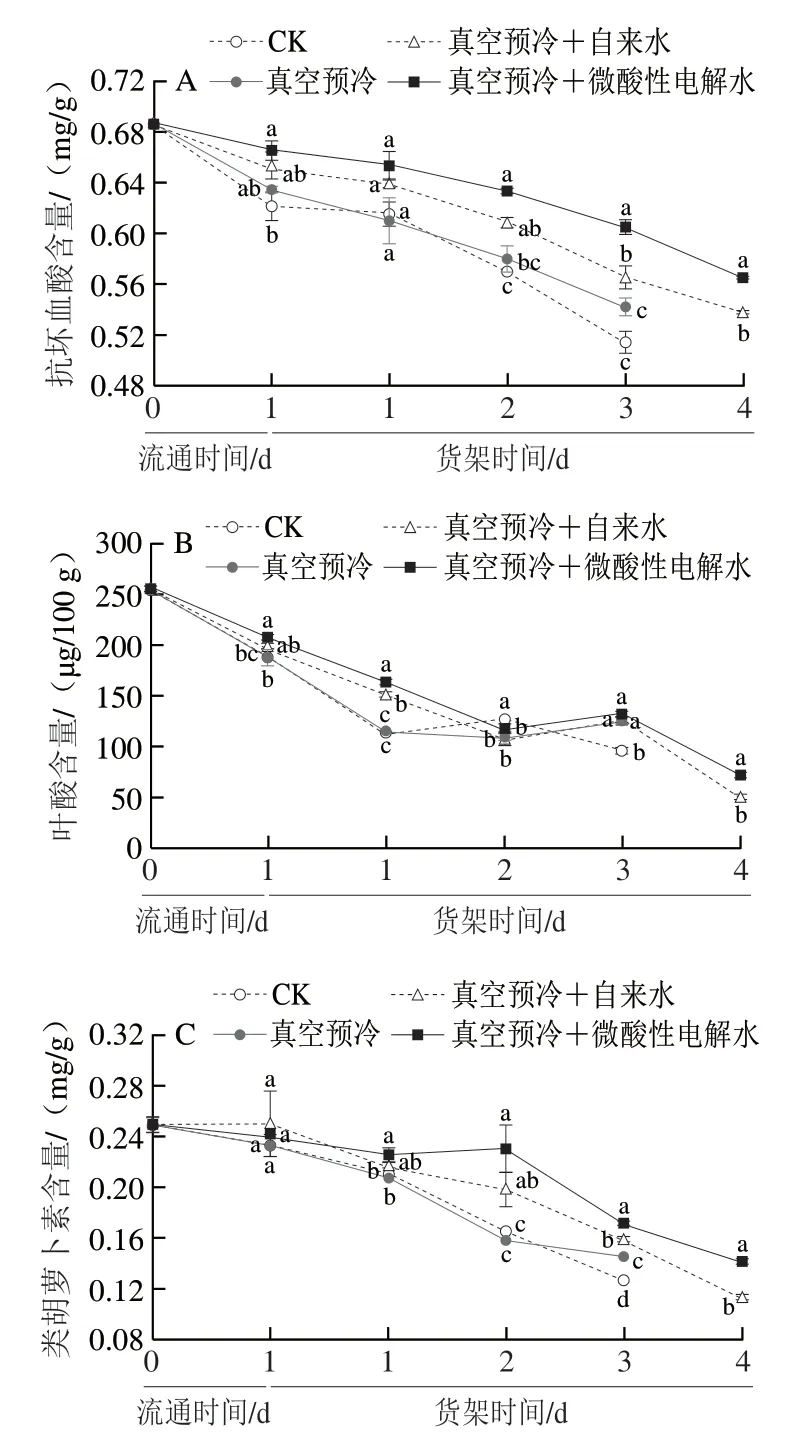
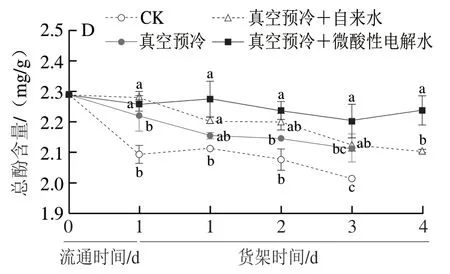
图7 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜抗坏血酸(A)、叶酸(B)、类胡萝卜素(C)、总酚(D)含量的影响Fig.7 Effect of atomized SAEW treatment during vacuum precooling on the contents of ascorbic acid (A),folic acid (B),carotenoid (C) and total phenols (D) in postharvest Chinese little greens
2.8 鸡毛菜对自由基清除率的变化
由图8A可知,DPPH自由基清除率整体呈先升高后下降的趋势,真空预冷+微酸性电解水处理组相较于其他组始终维持较高的DPPH自由基清除率。在低温流通和货架期的第1天期间,真空预冷+微酸性电解水处理组的DPPH自由基清除率显著高于其他组(P<0.05)。货架贮藏第2天时,真空预冷+微酸性电解水处理组显著高于对照组(P<0.05),但同期单独真空预冷处理组和真空预冷+自来水处理组与对照组无显著性差异(P>0.05)。在货架贮藏第3天时,单独真空预冷处理组、真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的DPPH自由基清除率分别为88%、89.7%和90.1%。货架贮藏第4天时,真空预冷+微酸性电解水处理组的DPPH自由基清除仍显著高于真空预冷+自来水处理组(P<0.05)。
如图8B所示,在低温流通期间,对照组和其他处理组的羟自由基清除率迅速上升,而货架期间均呈下降趋势。羟自由基清除率在货架贮藏第1天出现大幅度下降,之后降幅有所减小。在低温流通期间对照组的羟自由基清除率明显低于其他组,在货架贮藏第1天时,真空预冷+自来水处理组和真空预冷+微酸性电解水处理组的羟自由基清除率显著高于对照组(P<0.05),但单独真空预冷处理组与对照组无显著差异(P>0.05)。货架贮藏第3天时,真空预冷+微酸性电解水处理组的羟自由基清除率明显高于其他组,其他3 组的羟自由基清除率无显著差异(P>0.05)。货架贮藏第4天时,真空预冷+微酸性电解水处理组的羟自由基清除率显著高于真空预冷+自来水处理组(P<0.05)。
如图8C所示,采后鸡毛菜中超氧阴离子自由基清除率的变化具有波动下降的特点,而真空预冷+微酸性电解水处理组的超氧阴离子自由基清除率在整个过程中维持较高水平。在货架贮藏第3天时,真空预冷+微酸性电解水处理组的超氧阴离子自由基清除率为27.9%,是对照组的1.7 倍,但单独真空预冷、真空预冷+自来水处理组与对照组无显著差异(P>0.05)。在货架贮藏第4天时,真空预冷+微酸性电解水处理组的超氧阴离子自由基清除率是真空预冷+自来水处理组的1.3 倍。这表明真空预冷结合微酸性电解水处理可维持采后鸡毛菜中较高的超氧阴离子自由基清除能力。
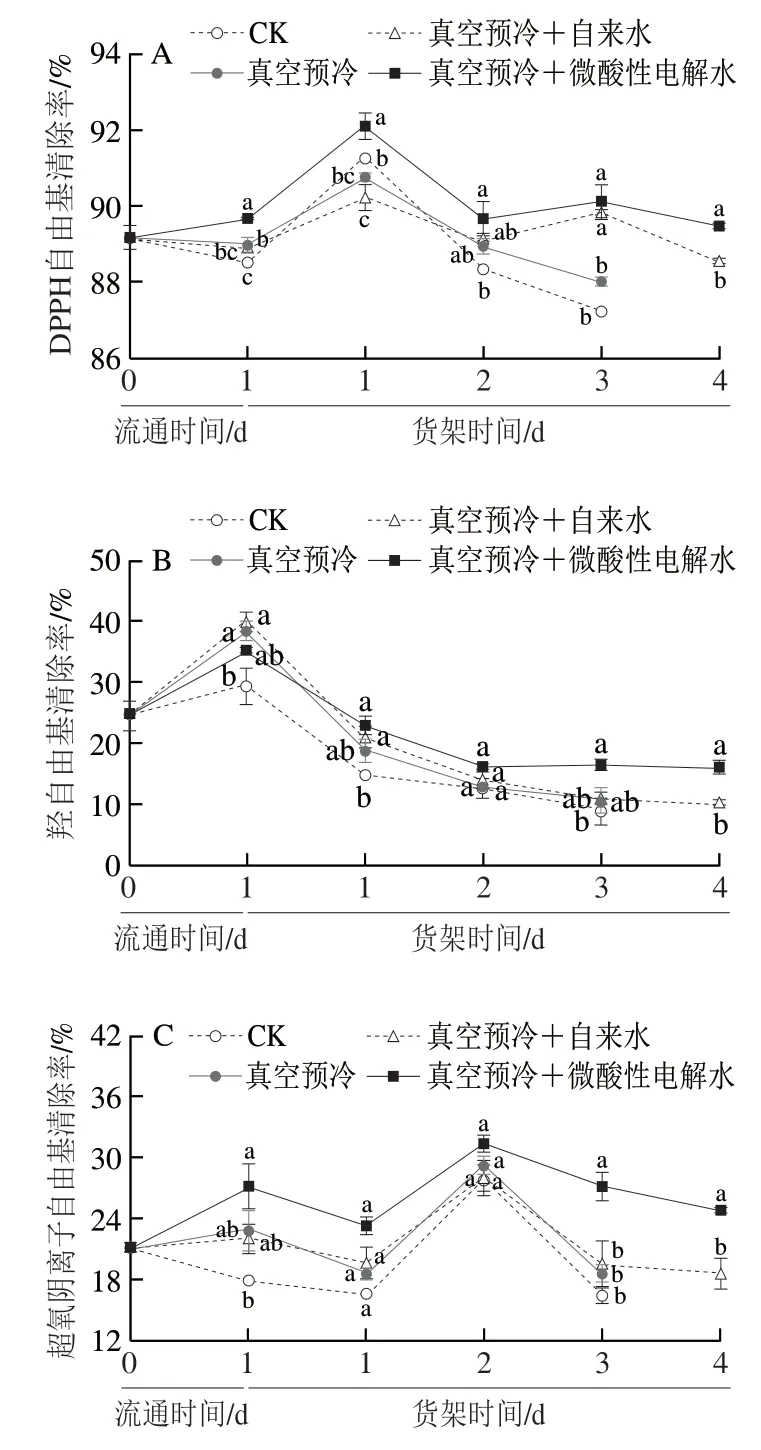
图8 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜DPPH自由基清除率(A)、羟自由基清除率(B)和超氧阴离子自由基清除率(C)的影响Fig.8 Effect of atomized SAEW treatment during vacuum precooling on DPPH (A),hydroxyl (B) and superoxide anion radical scavenging capacity (C) of postharvest Chinese little greens
2.9 鸡毛菜MDA含量变化
如图9所示,随着低温流通和货架时间的延长,所有样品中的MDA含量均呈上升趋势。货架贮藏3 d后,对照组的MDA含量相比0 d时增加了82.9%,同期单独真空预冷和真空预冷+自来水处理组的MDA含量较0 d时分别增加了65.4%和61.8%,然而真空预冷+微酸性电解水处理组的MDA含量仅比0 d时增加了36.8%。货架贮藏第4天时,真空预冷+自来水处理的MDA含量显著高于真空预冷+微酸性电解水处理组(P<0.05),表明真空预冷结合微酸性电解水能够很好地抑制采后鸡毛菜中MDA的积累。

图9 真空预冷过程中的雾化微酸性电解水处理对采后鸡毛菜MDA含量的影响Fig.9 Effect of atomized SAEW treatment during vacuum precooling on the content of malondialdehyde in postharvest Chinese little greens
3 讨论
外观品质是衡量果蔬货架期的重要指标。与其他叶菜相比,鸡毛菜具有质地柔嫩、味道清香的特性,因而深受广大消费者喜爱,但这些脆嫩的特性致使其更容易黄化衰老。黄化后的鸡毛菜色泽和营养品质均大幅度下降。叶菜组织的黄化与叶绿素分解有直接联系。叶绿素含量会随着低温流通和货架期的延长而降低。本研究发现无论是单独真空预冷处理,还是真空预冷+自来水处理以及真空预冷+微酸性电解水处理均能延缓叶绿素a、叶绿素b、总叶绿素含量的下降,这与Ding Tian等[27]研究发现真空预冷结合补水处理可以有效延缓西兰花叶绿素含量下降的结论相似。其中真空预冷+微酸性电解水处理能更好地维持鸡毛菜中叶绿素的含量,说明微酸性电解水处理也在一定程度上抑制了组织中叶绿素的降解,保持了鸡毛菜的品质。采后叶菜品质的劣变与其所携带致病菌的数量密切相关,而微酸性电解水能延缓黄化的主要原因是其杀菌成分HClO,通过高氧化还原电位渗入到细菌及其他致病菌细胞内,破坏微生物细胞内的氨基酸及酶系统[28],使致病菌失活从而延缓叶菜的衰老进而延缓叶绿素的减少。这与林永艳等[29]通过电解水对鸡毛菜进行清洗,延缓组织叶绿素含量下降的结论一致。
鸡毛菜中含有可滴定酸、可溶性蛋白、可溶性糖等重要的营养物质,这些营养物质含量同时也是表征果蔬生命活力的重要指标。本研究结果显示,随着低温流通及货架时间的延长,可滴定酸、可溶性蛋白和可溶性糖水平均呈先升高再下降的趋势。总体来看,采后鸡毛菜经单独真空预冷处理或真空预冷+自来水处理,均可抑制鸡毛菜营养成分的损失。这与安容慧等[30]研究发现真空预冷结合补水可以延缓上海青的可滴定酸、可溶性蛋白、可溶性糖含量下降的结果相似。此外,经过真空预冷+微酸性电解水处理能进一步降低组织中营养成分的损失,这可能是由于微酸性电解水处理抑制了致病微生物的生长,进而延缓了采后鸡毛菜中营养成分损耗。赵德锟等[11]同样发现用微酸性电解水处理云南红梨可以延缓其总糖含量的降低。这些结果表明,真空预冷与微酸性电解水联合可以维持采后鸡毛菜中较高的营养成分。
本研究表明,随着采后时间的延长,鸡毛菜中的亚硝酸盐含量整体呈上升趋势,这与慕钰文等[31]研究发现新鲜蔬菜在贮藏过程中硝酸盐和亚硝酸盐含量也呈现积累的结论一致,对照组相较于其他处理组的亚硝酸盐含量始终是最高的。其中,与对照和其他真空预冷处理相比,真空预冷结合微酸性电解水可有效延缓鸡毛菜组织中亚硝酸盐含量增长,这可能是真空预冷过程中微酸性电解水使硝酸盐还原酶直接失活,进而抑制硝酸盐向亚硝酸盐的转变[32],使其始终低于国家安全食用标准(4 mg/kg)[33]。
自由基是植物正常代谢的产物,若果蔬清除自由基的能力下降或产生的自由基过多,会对果蔬组织和细胞膜产生伤害,加速果蔬的衰老。因此,果蔬的抗氧化能力直接影响果蔬的采后品质。植物体内含有的活性物质主要有抗坏血素、叶酸、总酚、类胡萝卜素等。Kongwong等[34]研究发现真空预冷可有效延缓小莴苣的抗坏血酸、总酚的损失,并且抗氧化活性也得到了较好的保留。本研究的结果也表明,抗坏血酸、叶酸、类胡萝卜素和总酚含量均呈下降趋势,真空预冷处理可延缓这些抗氧化物质含量的下降。其中真空预冷与微酸性电解水结合处理延缓这些活性物质含量减少的效果更好。另外在研究中发现总酚含量在货架后期有所上升,这可能是因为微酸性电解水中以HClO分子为主要存在形式的有效氯刺激植物体发生机体氧化应激,产生了更多的酚类物质以抵御环境中活性氧对机体的损伤所致[35]。进一步的研究发现,相较于其他处理组,真空预冷结合微酸性电解水处理可有效延缓鸡毛菜中DPPH自由基、羟自由基以及超氧阴离子自由基清除能力的下降,这可能与微酸性电解水处理提高组织中活性氧清除酶的活性有关[36]。这些结果进一步说明,真空预冷结合微酸性电解水处理可维持组织对自由基较高的清除能力,从而减少自由基对鸡毛菜组织造成伤害,膜脂过氧化产物变化的结果也证实了这一推测。采后鸡毛菜在流通和货架贮藏期间,随着时间的延长,组织中的MDA含量近乎呈直线增加。其中单独真空预冷处理可延缓鸡毛菜组织中MDA含量的积累,这与张晓娟等[37]研究发现的真空预冷可抑制毛豆MDA含量增加的结论类似。另外,与单独真空预冷、真空预冷+自来水处理相比,真空预冷+微酸性电解水处理可最大程度延缓鸡毛菜中MDA含量的积累。这说明除了真空预冷对MDA积累的抑制作用外,协同处理过程中的微酸性电解水也延缓了组织中MDA含量的积累。且已有类似的研究证实微酸性电解水处理“尖脆”枣可有效地抑制其果实MDA的积累[38]。
4 结论
在(4±1)℃冷链流通1 d、(20±1)℃常温货架贮藏4 d期间,真空预冷结合微酸性电解水处理可显著抑制鸡毛菜的叶绿素降解,维持其较高的可滴定酸、可溶性蛋白、可溶性糖水平。此外,该联合处理方法还可有效控制采后鸡毛菜中亚硝酸盐的积累;显著延缓组织中类胡萝卜素、抗坏血酸、叶酸、总酚等活性物质含量的下降和自由基清除能力的下降,维持较高的抗氧化能力,从而减轻采后鸡毛菜组织的膜脂氧化程度,延长鸡毛菜的货架期。
