三明治型魔芋葡聚糖/海藻酸钠/魔芋葡聚糖复合保鲜涂膜对三文鱼鱼片蛋白氧化的影响
2023-03-09王雅妮杨峻乙李秋莹李颖畅励建荣
宋 颖,王雅妮,2,杨峻乙,乔 羽,李秋莹,李颖畅,杨 旭,励建荣,孙 彤,*
(1.渤海大学食品科学与工程学院,海洋食品精深加工关键技术省部共建协同创新中心,辽宁 锦州 121013;2.辽宁安井食品有限公司,辽宁 鞍山 361003;3.民泽龙羊峡生态水殖有限公司,青海 海南藏族自治州 811800)
水产品指鱼、虾、蟹、贝类、藻类等鲜活产品以及经冷冻、熟制、腌制和综合利用的加工制品[1],水产品富含蛋白质、氨基酸、维生素、无机盐等多种营养物质。但其水分含量高,组织柔软,易滋生微生物,内源性蛋白酶活跃。同时,水产品中不饱和脂肪酸极易被氧化,生成醛、酮、羧酸等物质,产生不良气味,并出现黏度增加、口感下降的现象,最终导致水产品腐败变质,营养价值和商品价值降低[2]。水产品保鲜技术针对引起水产品腐败变质的因素采取一系列干预,达到延长货架期、增加食用价值、减少经济损失的目的。
常用的水产品保鲜技术包括物理保鲜、化学保鲜及生物保鲜等[3]。而将多种保鲜技术复合使用,可使其优势互补,协同增效,是水产品保鲜技术的主要发展方向。其中,蔡路昀等[4]研究发现超高压结合姜酚处理后的海鲈鱼鱼肉的品质优于单一处理组和未处理组,表明复合处理具有一定协同保鲜效应,使保鲜效果更优;谢晶等[5]采用复合生物保鲜剂涂膜结合气调包装贮藏带鱼,研究结果表明,复合生物保鲜剂对带鱼有良好的抗菌保鲜作用,与气调包装结合使用后,其保鲜效果更优。涂膜保鲜通过喷涂、铺展和浸渍等方法将保鲜剂涂覆于食品或包装材料表面,可抑制食品氧化,同时提高食品的耐菌、耐机械损伤能力,最大限度地保持食品品质,延长货架期[6]。有研究表明,单一成膜基质涂膜的机械阻隔性能及抗菌、抗氧化性能较差,对食品的保鲜性能有限,应用和推广受到了限制[7]。因此,保鲜涂膜的改性研究具有十分重要的意义。目前,利用生物保鲜技术改善涂膜的机械性能及抗菌、抗氧化性能已成为国内外的研究热点[8]。
魔芋葡聚糖(konjac glucan,KGM)和海藻酸钠(sodium alginate,SA)都是安全无毒、成本较低的天然高分子成膜材料,可作为食品保鲜涂膜的主体材料[9]。百里香酚(thymol,Thy)又称麝香草酚,是一种天然的抑菌剂,可导致病原菌细胞膜损伤,从而达到抗菌和延长食品货架期的目的[10-11]。ε-聚赖氨酸盐酸盐(ε-poly-Llysine hydrochloride,ε-PL)是GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中允许使用的食品添加剂,具有抗菌性,在食品保鲜领域应用广泛[12-13]。基于此,本实验以KGM和SA为成膜基质,以Thy和ε-PL为保鲜剂,制备三明治型复合保鲜涂膜,并研究涂膜对三文鱼鱼片蛋白氧化的影响,为可食性涂膜在三文鱼鱼片贮藏保鲜中的应用提供参考。
1 材料与方法
1.1 材料与试剂
三文鱼((5.00±0.50)kg/条)购于辽宁省锦州市某海水养殖场。
KGM(食品级) 昭通市三艾有机魔芋发展有限公司;SA(分析纯) 深圳市益百顺科技有限公司;Thy(生物技术级别) 上海麦克林生化科技有限公司;ε-PL(食品级) 浙江新银象生物工程有限公司;超微量Ca2+-ATPase测定试剂盒 南京建成生物工程研究所;Bradford法蛋白浓度测定试剂盒 上海吉至生化科技有限公司;蛋白质羰基试剂盒 北京盒子生工科技有限公司;其他试剂均为分析纯;去离子水(电导率<15 μS/cm)为实验室自制。
1.2 仪器与设备
MS-105DU电子分析天平 瑞士梅特勒托利多仪器有限公司;DF-II型集热式磁力加热搅拌器 江苏省金坛市荣华仪器制造有限公司;MLS-3030CH立式高压灭菌锅 三洋电机(广州)有限公司;FE20 pH计梅特勒-托利多仪器(上海)有限公司;FSH-2A高速均质机 常州越新仪器制造有限公司;UV-2250紫外-可见光光度计 尤尼柯仪器有限公司;HHS21-4数显双列四孔水浴锅 上海博讯实业有限公司医疗设备厂;Legend Micro21R台式微量离心机 赛默飞世尔科技(中国)有限公司;970 CRT荧光分光光度计 上海精密科学仪器有限公司;Scimitar 2000傅里叶变换红外光谱仪 美国安捷伦公司。
1.3 方法
1.3.1 涂膜液的制备
分别取一定量的KGM和SA溶于去离子水中,并加入终体积分数0.3%的丙三醇,在45 ℃条件下磁力搅拌1 h,制备0.5 g/100 mL的KGM和1.0 g/100 mL的SA涂膜液。在SA涂膜液中分别按照0.09、0.18 g/100 mL加入ε-PL,制备SA+ε-PL涂膜液;在KGM涂膜液中按照2 g/100 mL加入Thy,制备KGM+Thy涂膜液;在SA涂膜液中按照4 g/100 mL加入Thy,制备SA+Thy涂膜液。
1.3.2 三文鱼鱼片涂膜处理
将三文鱼置于消毒后的实验台上用冰猝死,去头、皮及内脏后取鱼体两侧背脊鱼肉,每片(250±5)g。将鱼片置于无菌操作台中,用无菌水清洗后无菌吸水纸擦干其表面水分进行涂膜处理。将鱼片在KGM涂膜液中浸渍1 min,覆盖第1层涂膜液;然后于SA涂膜液中浸渍1 min,覆盖第2层涂膜液;最后将鱼片完全浸渍于KGM涂膜液中后立即取出,即为三明治型KGM/SA/KGM涂膜处理的样品。将上述第2层涂膜液分别换成SA+ε-PL(0.18 g/100 mLε-PL)、SA+Thy涂膜液,即为三明治型KGM/SA+ε-PL/KGM和KGM/SA+Thy/KGM涂膜液处理的样品;将上述第2层涂膜液换成SA+ε-PL(0.09 g/100 mLε-PL)涂膜液,第3层涂膜液换成KGM+Thy涂膜液,即为三明治型KGM/SA+ε-PL/KGM+Thy涂膜处理的样品。用无菌水替代涂膜液处理的鱼片为空白组样品。将各组鱼片表面的膜液自然风干,装入灭菌后的蒸煮袋中,密封后放入4 ℃冰箱中贮藏。课题组前期研究表明贮藏第12天时三文鱼已腐败[14],故在贮藏第0、3、6、9、12天测定相关蛋白氧化指标。
1.3.3 三文鱼鱼片肌原纤维蛋白的提取与测定
1.3.3.1 肌原纤维蛋白的提取
参照ZhaoXue等[15]的方法稍作修改。取一定量的鱼肉,绞碎后称取5.00 g于离心管中,按料液比1∶4(m/V)加入Tris-HCl溶液(20 mmol/L、pH 7.2),匀浆后于4 ℃、5 000 r/min离心20 min,取沉淀按上述步骤重复提取2 次。将最终所得沉淀按料液比1∶3(m/V)加入至含0.6 mol/L NaCl的Tris-HCl溶液(20 mmol/L、pH 7.2),混合均匀后,置于4 ℃下充分提取1 h,然后4 ℃、5 000 r/min离心20 min,取上清液即为肌原纤维蛋白溶液,采用双缩脲法[16]测定肌原纤维蛋白质量浓度,然后用含0.6 mol/L NaCl的Tris-HCl溶液(20 mmol/L、pH 7.2)将肌原纤维蛋白质量浓度调至5 mg/mL备用。
1.3.3.2 总巯基和活性巯基含量的测定
参照Xu Yanshun等[17]的方法稍作修改。采用5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)测定肌原纤维蛋白总巯基和活性巯基的含量。取1.00 mL 5 mg/mL肌原纤维蛋白溶液和9.00 mL 50 mmol/L、pH 7.0磷酸盐缓冲液(含0.6 mol/L KCl、10 mmol/L 乙二胺四乙酸、8 mol/L尿素)充分混匀。取5 mL上述混合溶液加入0.50 mL DTNB,于25 ℃反应25 min,测定412 nm波长处吸光度,代入标准曲线方程计算总巯基含量,结果以蛋白质量计,单位为nmol/mg。类似地,上述操作中磷酸盐缓冲液不加尿素,将混合液于4 ℃反应60 min,测定412 nm波长处吸光度,按上述方法计算活性巯基的含量,结果以蛋白质量计,单位为nmol/mg。
1.3.3.3 表面疏水性的测定
参照Chelh等[18]的方法稍作修改。取1.00 mL 5 mg/mL肌原纤维蛋白溶液于90 ℃水浴30 min,然后室温冷却10 min。然后加入200 μL 1 mg/mL溴酚蓝溶液,混匀后室温反应10 min,于4 ℃、5 000 r/min离心10 min,取上清液,测定595 nm波长处的吸光度A,以不含肌原纤维蛋白的磷酸缓冲溶液作为对照,并按相同方法测定其595 nm波长处的吸光度A0。表面疏水性以溴酚蓝结合量(下式)表示。
1.3.3.4 溶解度的测定
参照Riebroy等[19]的方法稍作修改。取1.00 g鱼肉,加入19.0 mL 20 mmol/L、pH 7.2 Tris-HCl缓冲溶液(含0.6 mol/L NaCl)均质匀浆,于4 ℃、6 000 r/min离心15 min,采用双缩脲法[16]测定上清液蛋白质含量,单位为mg/g。
1.3.3.5 羰基含量的测定
取5 mg/mL肌原纤维蛋白溶液,采用蛋白质羰基试剂盒测定羰基含量,结果以蛋白质量计,单位为nmol/mg。
1.3.3.6 Ca2+-ATPase活力的测定
取5 mg/mL 肌原纤维蛋白溶液,参照超微量Ca2+-ATPase测定试剂盒说明书进行测定。以1 h内1 mg组织蛋白催化ATP分解产生1 μmol无机磷为1 个酶活力单位,单位为U/mg。
1.3.3.7 傅里叶变换红外光谱分析
取适量贮藏第0、6、12天的肌原纤维蛋白样品,冷冻干燥后与溴化钾混合,研磨后进行压片,用傅里叶变换红外光谱仪测定其透光率曲线,采用Omnic软件和PeakFit 4软件处理数据,分析肌原纤维二级结构相对含量变化。
1.3.3.8 荧光光谱分析
取贮藏第0、12天的5 mg/mL肌原纤维蛋白溶液,参照Moradi等[20]的方法,采用荧光分光光度计测定肌原纤维蛋白内源荧光、同步荧光、三维荧光光谱,分析蛋白质三级结构变化。
1.4 数据处理与分析
上述实验均进行3 次平行测定,结果以平均值±标准差表示。采用SPSS 20.0软件进行单因素方差分析,采用Duncan检验进行显著性分析,P<0.05表示差异显著。采用Origin 9.1软件作图。
2 结果与分析
2.1 复合涂膜对三文鱼肌原纤维蛋白总巯基和活性巯基含量的影响
巯基对维持肌原纤维蛋白空间结构稳定性具有重要意义。蛋白质中巯基由活性巯基和蛋白质内部隐藏巯基两部分组成[21]。如图1所示,随着贮藏时间的延长,各组鱼片的总巯基和活性巯基含量均明显下降,其中空白组下降幅度最大,经复合涂膜处理鱼片的总巯基和活性巯基含量下降较缓慢,说明复合涂膜处理有助于延缓蛋白质的氧化。经KGM/SA+ε-PL/KGM涂膜处理后,鱼片的总巯基和活性巯基含量略高于空白组,这可能是由于ε-PL具有抗菌性[22],抑制了三文鱼贮藏过程中微生物的生长,进而减缓了蛋白氧化,使鱼片的总巯基和活性巯基含量下降减缓。经KGM/SA+Thy/KGM和KGM/SA+ε-PL/KGM+Thy复合涂膜处理后,鱼片的总巯基和活性巯基含量下降明显减缓,且在贮藏后期,KGM/SA+ε-PL/KGM+Thy复合涂膜处理的效果更优。这可能是由于Thy可以吸附在巯基上,与巯基竞争捕获自由基,进而抑制巯基被氧化[23],且ε-PL具有抗菌性[12-13],ε-PL和Thy产生了协同增效作用,抑制了巯基氧化,延缓总巯基和活性巯基含量的下降,从而较好地维持三文鱼鱼片的品质。
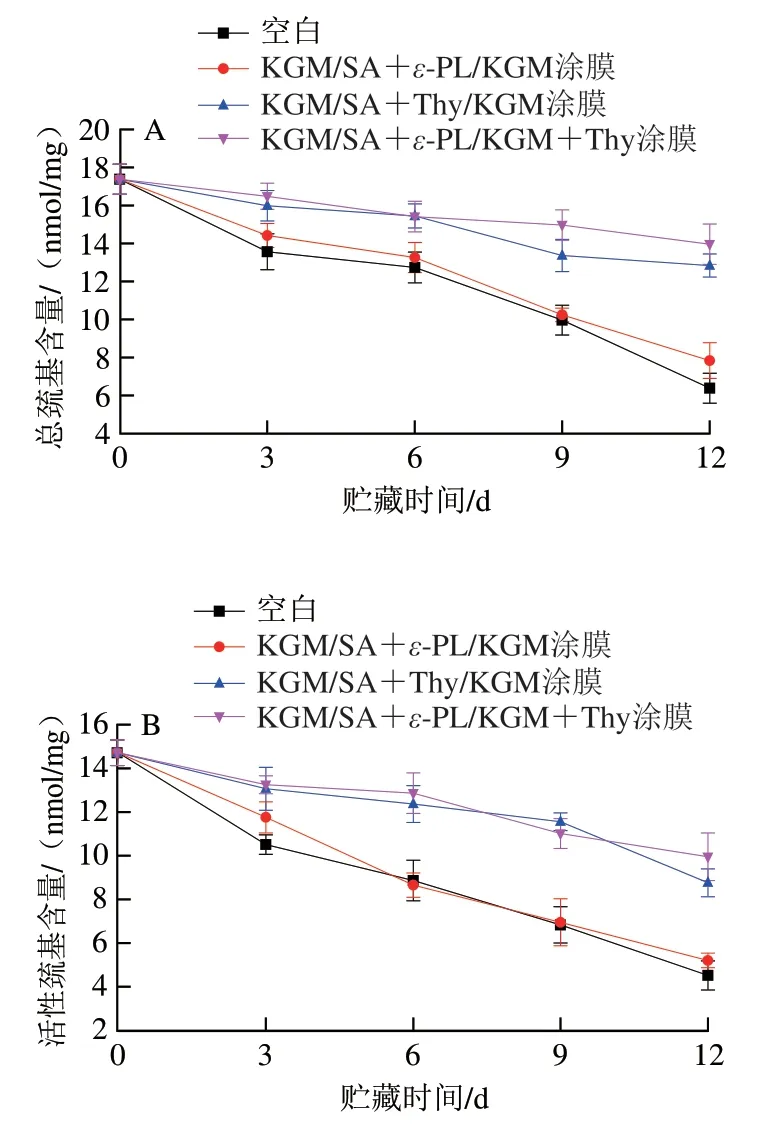
图1 鱼片贮藏过程中肌原纤维蛋白总巯基(A)和活性巯基(B)含量的变化Fig.1 Changes in total sulfhydryl (A) and active sulfhydryl (B) of MP contents in fillets during storage
2.2 复合涂膜对三文鱼鱼片肌原纤维蛋白表面疏水性、溶解度、羰基含量和Ca2+-ATPase活力的影响
蛋白质表面疏水性在一定程度上反映了蛋白质的变性程度,可根据溴酚蓝结合量表征蛋白表面疏水性[24],进而衡量蛋白质的变性程度。如图2A所示,随着贮藏时间的延长,各组鱼片的蛋白表面疏水性均明显上升,其中空白组上升幅度最大,且与KGM/SA+ε-PL/KGM复合涂膜处理组的表面疏水性变化无明显差异,经KGM/SA+Thy/KGM和KGM/SA+ε-PL/KGM+Thy复合涂膜处理鱼片的表面疏水性增长缓慢,说明ε-PL作为抗菌剂虽然延缓了鱼片肌原纤维蛋白的氧化,但对蛋白质表面疏水性几乎没有影响[25],添加Thy的复合涂膜使鱼片蛋白表面疏水性的增长速度减缓,说明Thy和ε-PL复合后,涂膜的抗菌、抗氧化性能增强,延缓了蛋白质内部疏水基团的暴露和蛋白氧化。
蛋白质溶解度的降低缘于蛋白质氧化变性、交联和聚集。因此,蛋白质溶解度越低,其蛋白氧化程度越高[26-28]。如图2B所示,随着贮藏时间的延长,各组鱼片的蛋白质溶解度均明显下降,其中空白组下降幅度最大,经复合涂膜处理鱼片的蛋白质溶解度下降缓慢,说明ε-PL和Thy可以有效地抑制微生物的生长繁殖和内源酶活性,充分发挥其抗菌、抗氧化活性[25,29],从而延缓了三文鱼鱼片肌原纤维蛋白的变性。KGM/SA+ε-PL/KGM涂膜处理组在贮藏前期略高于空白组,在后期与空白组无明显差异。KGM/SA+Thy/KGM和KGM/SA+ε-PL/KGM+Thy处理组的蛋白质溶解度在前期无明显差异,说明添加2 g/100 mL和4 g/100 mL Thy对蛋白质溶解度无明显影响。在贮藏后期,KGM/SA+ε-PL/KGM+Thy处理组的蛋白质溶解度略高于KGM/SA+Thy/KGM处理组,这可能是由于ε-PL具有抗菌性[14],使KGM/SA+ε-PL/KGM+Thy处理三文鱼鱼片菌落总数低于KGM/SA+Thy/KGM处理组,所以蛋白质溶解度下降缓慢。
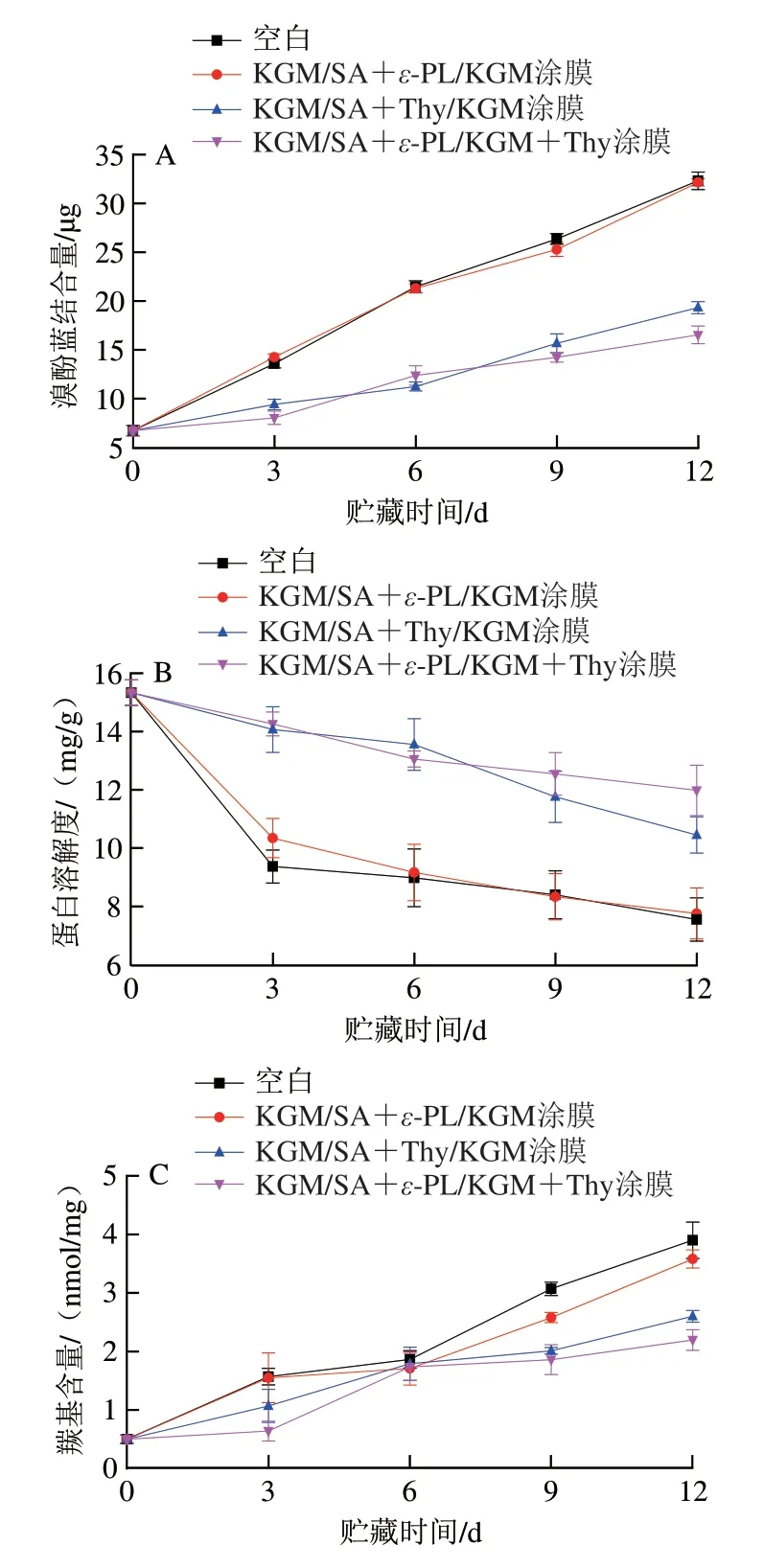
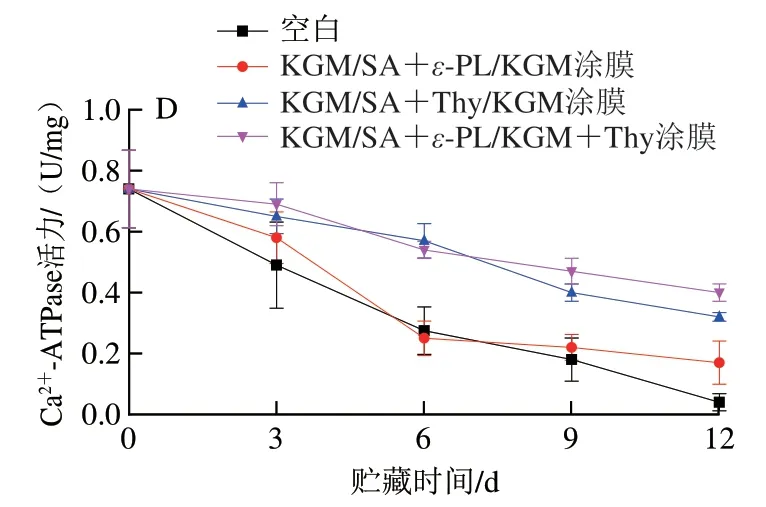
图2 贮藏过程中鱼片肌原纤维蛋白表面疏水性(A)、蛋白溶解度(B)、羰基含量(C)和Ca2+-ATPase活力(D)的变化Fig.2 Changes in surface hydrophobicity (A),protein solubility (B),carbonyl content (C) and Ca2+-ATPase activity (D) of MP in flilets during storage
氨基酸侧链被活性氧氧化后生成羰基衍生物,因此羰基含量被认为是蛋白质氧化的重要指标之一[30]。如图2C所示,随着贮藏时间的延长,各组鱼片的蛋白质羰基含量均明显上升,其中空白组上升幅度最大,其他处理组上升较为缓慢,这可能是由于涂膜在一定程度上阻隔了氧气的进入,延缓了三文鱼肌原纤维蛋白的氧化。KGM/SA+ε-PL/KGM涂膜处理组在前期与空白组无明显差异,在后期明显高于空白组,与KGM/SA+Thy/KGM复合涂膜处理组相比,KGM/SA+ε-PL/KGM+Thy复合涂膜处理的效果更优。这是由于Thy有较强的自由基清除活性[31],与ε-PL发挥协同增效作用,延缓了蛋白质的氧化,减缓了羰基含量的上升。
Ca2+-ATPase活力取决于肌球蛋白的变性程度,可用来反映肌球蛋白的变性程度,可作为判断蛋白氧化的重要指标[32]。如图2D所示,随着贮藏时间的延长,各组鱼片的蛋白质Ca2+-ATPase活力均逐渐下降,其中空白组下降幅度最大,经复合涂膜处理鱼片的蛋白质羰基含量上升较为缓慢。经KGM/SA+ε-PL/KGM涂膜处理后,鱼片的Ca2+-ATPase活力与空白组差异不大。当加入Thy后,KGM/SA+Thy/KGM和KGM/SA+ε-PL/KGM+Thy复合涂膜处理组的蛋白质Ca2+-ATPase活力下降速率明显降低,且KGM/SA+ε-PL/KGM+Thy复合涂膜处理组略高于KGM/SA+Thy/KGM复合涂膜处理组,这是由于涂膜可以隔绝外界氧气,且ε-PL与Thy产生了协同增效作用。Ca2+-ATPase活力的变化与巯基含量的变化一致。
2.3 三文鱼鱼片肌原纤维蛋白傅里叶变换红外光谱分析结果
蛋白质中酰胺I带在1 700~1 600 cm-1处有特征吸收[33],可通过傅里叶变换红外光谱分析三文鱼鱼片肌原纤维蛋白二级结构的变化情况,如图3所示,新鲜鱼片的肌原纤维蛋白二级结构以β-折叠为主(相对含量55.68%),α-螺旋、β-转角和无规卷曲的相对含量分别为14.99%、15.46%、13.62%,说明此时蛋白质的二级结构较稳定。随着贮藏时间的延长,各处理组鱼片蛋白质β-折叠相对含量均呈下降趋势,无规卷曲、β-转角相对含量呈上升趋势,α-螺旋相对含量在14.99%~16.06%,这可能是蛋白质在氧化分解过程中,由于非共价键的相互作用,造成部分β-折叠向β-转角和无规卷曲转变[34]。空白组样品的β-折叠相对含量在第12天降至44.01%,而β-转角、无规卷曲相对含量分别上升至2 5.99%和15.34%,说明空白组鱼片稳定的蛋白质二级结构遭到破坏,蛋白质发生了变性。在第12天,KGM/SA+ε-PL/KGM+Thy涂膜处理三文鱼鱼片具有更高的规则二级结构比例,其α-螺旋与β-折叠相对含量之和明显高于空白组和其他涂膜组样品,说明ε-PL和Thy复合处理可有效地延缓蛋白质的氧化变性,对蛋白质的二级结构具有一定的保护作用[35]。
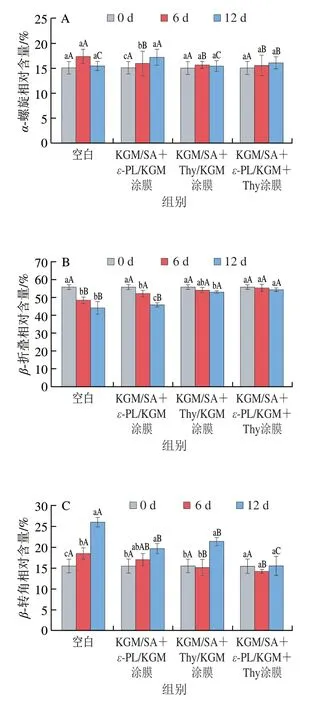
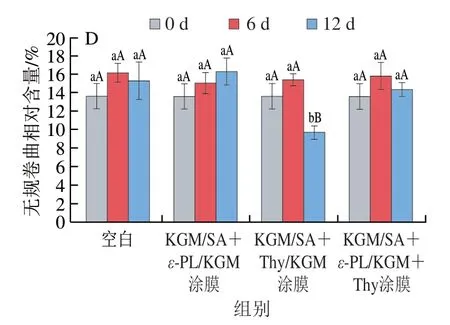
图3 贮藏过程中鱼片肌原纤维蛋白的α-螺旋(A)、β-折叠(B)、β-转角(C)和无规卷曲(D)相对含量的变化Fig.3 Changes in percentages of α-helix (A),β-sheet (B),β-turn (C)and random coil (D) in MP from fish fillets during storage
2.4 贮藏过程中三文鱼鱼片肌原纤维蛋白荧光强度的变化
2.4.1 内源荧光、同步荧光光谱分析结果
色氨酸具有强荧光性和高敏感性等特点,因此,蛋白质内源荧光强度可以反映蛋白质三级结构的变化[36]。如图4A所示,在贮藏12 d后,各组三文鱼鱼片肌原纤维蛋白荧光强度均明显下降,这是由于贮藏过程中在微生物和内源酶的作用下,蛋白质氧化变性,空间结构发生变化,色氨酸暴露,蛋白质分子聚集,最终导致内源荧光强度下降[19]。其中空白组内源荧光强度下降幅度最大,复合涂膜组下降较为缓慢,KGM/SA+ε-PL/KGM和KGM/SA+Thy/KGM复合涂膜处理组无明显性差异,KGM/SA+ε-PL/KGM+Thy涂膜组的内源荧光强度明显高于同期其他处理组,表明ε-PL和Thy的协同作用可以有效降低蛋白质中色氨酸的暴露,延缓蛋白质内源荧光强度下降,保护蛋白质的结构。
同步荧光光谱分析可表征蛋白质分子中荧光官能团以及附近微环境的变化,当固定激发波长和发射波长的间隔Δλ为15 nm时,同步荧光光谱可表征酪氨酸残基的光谱特征[37]。如图4B所示,三文鱼鱼片肌原纤维蛋白中酪氨酸残基的特征荧光光谱峰位置发生了不同程度的蓝移,说明酪氨酸残基所在的微环境发生了改变,疏水性增强[38]。这可能是由于蛋白质氧化变性引起的空间结构改变。其中KGM/SA+ε-PL/KGM+Thy涂膜组的同步荧光强度明显高于其他处理组,说明ε-PL和Thy复配有助于延缓酪氨酸残基所在微环境的变化,进而延缓了蛋白质的氧化变性。
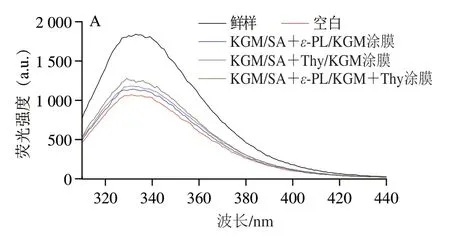
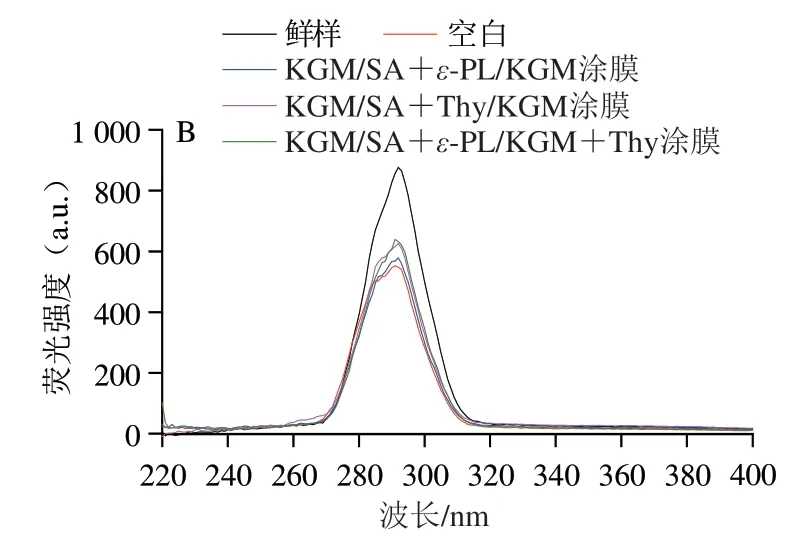
图4 鲜样和贮藏12 d后鱼片肌原纤维蛋白的内源荧光光谱(A)和同步荧光光谱(B)Fig.4 Fluorescence spectra (A) and synchronous fluorescence spectra (B)of MP from fish fillets fresh and stored for 12 days
2.4.2 三维荧光光谱分析结果
三维荧光光谱能同步记录荧光强度随激发波长和发射波长变化的荧光信息[39]。峰A荧光强度表示蛋白质肽链结构的致密性,峰B荧光强度表示酪氨酸和色氨酸残基的水平[40-41]。如图5所示,与鲜样相比,在贮藏12 d后,各组样品的峰A和峰B的荧光强度均明显下降,说明在贮藏过程中,在微生物和内源酶的作用下,蛋白质发生了降解,荧光强度降低[42]。其中空白组荧光强度下降幅度最大,KGM/SA+ε-PL/KGM+Thy涂膜组样品峰A和峰B的荧光强度明显高于贮藏12 d的其他样品,说明ε-PL和Thy复配能更有效地保护蛋白质的结构,延缓蛋白质氧化变性,这与内源荧光和同步荧光光谱分析结果一致。
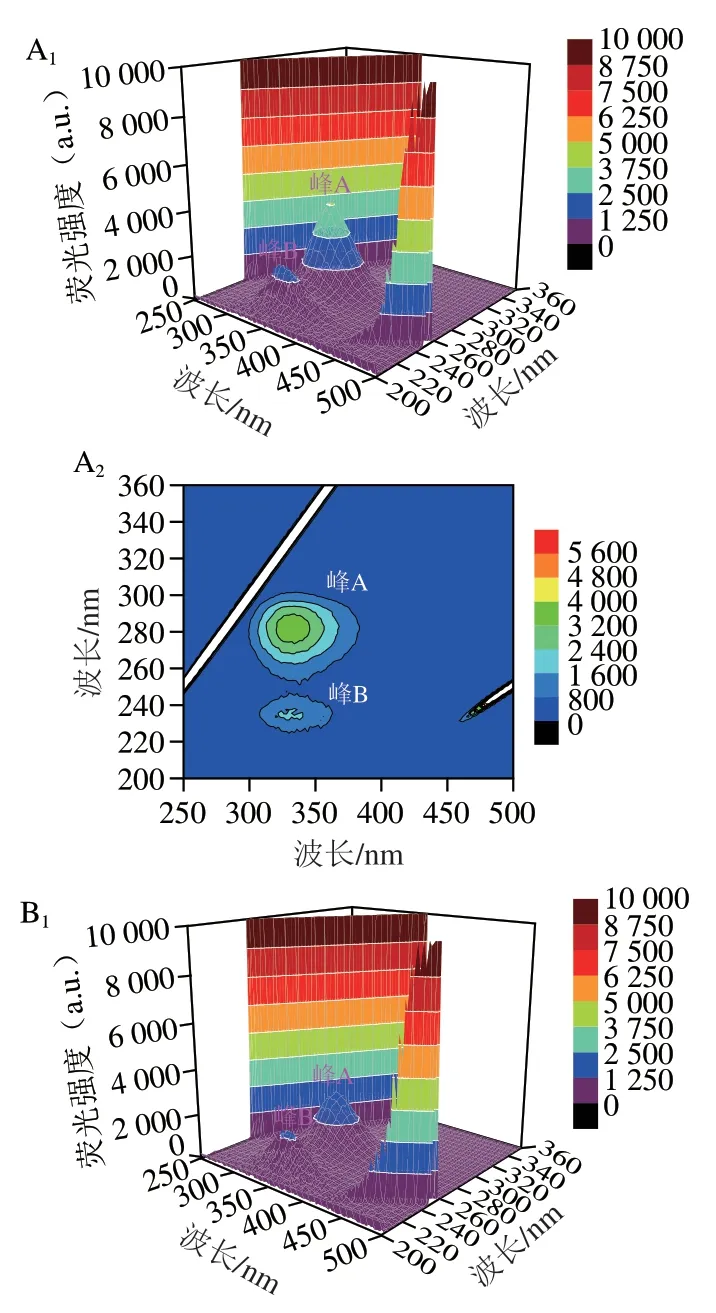
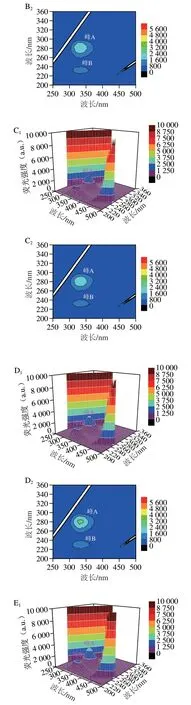
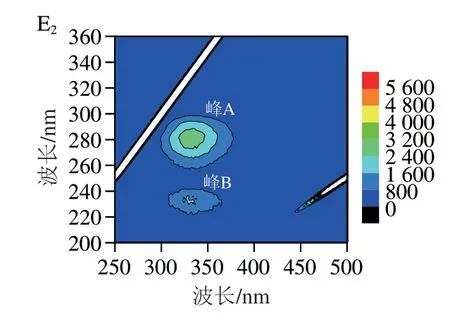
图5 鲜样和贮藏12 d后鱼片肌原纤维蛋白的三维荧光光谱和等高线图Fig.5 3D fluorescence spectra and contour plots of MP from fresh and fish fillets stored for 12 days
3 结论
本实验以KGM和SA为成膜基质,以Thy和ε-PL为保鲜剂,制备了三明治型复合保鲜涂膜,研究了复合涂膜对三文鱼鱼片蛋白氧化程度的影响。与空白组相比,复合涂膜处理后的三文鱼鱼片肌原纤维蛋白的活性巯基含量、蛋白质溶解度、Ca2+-ATPase活力下降减缓;表面疏水性和羰基含量较低;荧光光谱和傅里叶变换红外光谱结果表明,蛋白质的三级结构和二级结构较完整。研究表明,涂膜处理有效延缓了蛋白质氧化变性,其中,KGM/SA+Thy/KGM复合涂膜的抗蛋白质氧化性能优于KGM/SA+ε-PL/KGM复合涂膜。经KGM/SA+ε-PL/KGM+Thy复合保鲜剂涂膜处理后,鱼片贮藏后期的各项蛋白氧化指标均优于同期单一保鲜剂复合涂膜处理样品,说明ε-PL和Thy有协同增效作用,有效地缓解了贮藏过程中蛋白质氧化变性,提高了三文鱼鱼片的贮藏品质。
