高盐刺激嗜碱性粒细胞产生促炎因子及其分子机制
2023-03-09钟菁华王中亮高金燕陈红兵
钟菁华,王中亮,武 涌,高金燕,陈红兵,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.江西省食物过敏重点实验室,江西 南昌 330047;4.南昌大学中德联合研究院,江西 南昌 330047)
食物过敏是影响人体健康的特异性免疫性疾病之一,表现为机体在摄入某些食物蛋白后会产生一系列不良反应。临床症状主要有呕吐、腹泻、便血、湿疹等,严重时可导致休克和死亡[1]。大量的研究表明,在过去20~30 年中,食物过敏的发病率逐渐上升,且呈现出每10 年增加1.2 个百分点的趋势[2-3]。环境因素似乎是导致最近食物过敏患病率增加的主要因素,而环境因素中饮食习惯的改变被认为是这种流行趋势的潜在驱动因素[4]。西方饮食成分以高脂、高糖、高盐、深加工以及低纤维为特点,高脂和低纤维饮食已被明确证实可以影响食物过敏的发病进程[5-7]。而高盐饮食对食物过敏的影响尚不清楚。根据相关文献报道,成年人每天对于食盐的生理需求量仅为4 g,世界卫生组织建议成年人每天摄盐量不应超过5 g[8]。但调査发现,部分国家人均每日摄盐量超过了10 g。中国是传统的高盐饮食国家,中国北方仍然是世界上盐摄入量最高的地区之一(每天11.2 g),甚至以清淡饮食著称的南方,其居民日均食盐摄入量已从1980年代的8.8 g,大幅增加到2010年代的10.2 g[9]。高盐是否是诱发食物过敏患病率上升的原因有待研究。
食物过敏主要是由辅助性Th2细胞驱动的,具体而言,Th2细胞产生的白细胞介素(interleukin,IL)-4促使B细胞发生类别转换,进而分泌大量的抗原特异性免疫球蛋白(immunoglobulin,Ig)E,最终介导肥大细胞和嗜碱性粒细胞的效应反应[10-11]。在早期的研究中,嗜碱性粒细胞是晚期的效应细胞,当致敏机体再次摄入过敏原后,抗原会迅速与致敏的嗜碱性粒细胞表面的特异性IgE结合,使嗜碱性粒细胞脱颗粒[12];最近的研究表明嗜碱性粒细胞是产生IL-4的主要来源之一,在诱导Th2细胞介导的免疫和炎症反应中起着关键作用[13-14]。此外,嗜碱性粒细胞在外周血中循环并迁移到炎症部位,可以通过调节其他免疫细胞(包括T细胞、B细胞或肥大细胞)来促进食物过敏的发生[15-16]。因此,嗜碱性粒细胞产生的IL-4可能是前期初始T细胞活化进而向Th2方向分化的重要因素,然而嗜碱性粒细胞产生IL-4的条件及免疫机制尚不清楚。
近年来,越来越多的研究表明,过量摄入食盐可以显著影响机体的免疫系统[17-19]。例如,Wu Chuan等[19]发现高盐饮食可以调节T细胞反应,特别是可以激活血清和糖皮质激素调节蛋白激酶1(serum and glucocorticoidregulated kinase 1,SGK1)通路来诱导致病性Th17细胞的产生,进而加重自身免疫性疾病。另一项独立研究也表明,高盐诱导致病性Th17细胞的产生依赖于P38及其下游靶点SGK1的激活[20]。进一步的研究也证实高盐会促进促炎性Th细胞的产生,其机制可能是通过抑制调节性T(regulatory T,Treg)细胞的免疫抑制功能从而发挥作用[21]。针对过敏性疾病,Matthias等[22]发现NaCl可以在体外诱导Th2细胞极化(显著增加Th2细胞因子IL-4和IL-13的产生和转录因子GATA3的表达),进而调节过敏性皮炎微环境,而这也与SGK1信号通路有关。本研究聚焦食物过敏的重要效应细胞——嗜碱性粒细胞,探究高盐条件下KU812细胞脱颗粒及相关细胞因子的产生情况,随后,重点探究高盐条件下是否会促进嗜碱性粒细胞产生IL-4,及其产生IL-4细胞因子的分子机制。
1 材料与方法
1.1 材料与试剂
人外周血嗜碱性白细胞株(KU812) 中国科学院上海生化与细胞研究所;鸡蛋过敏患者血清 江西省儿童医院;1640培养基、胎牛血清 北京CellMax公司;CCK-8试剂盒 上海碧云天生物技术有限公司;IL-6试剂盒、肿瘤坏死因子(tumor necrosis factor,TNF)-α试剂盒、TRIzol 美国Thermo Fisher公司;组胺试剂盒、β-氨基己糖苷酶(β-hexaminosidase,β-HEX)试剂盒上海抚生实业有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)、TB Green Premix ExTaqII(Tli RNaseH Plus) 日本TaKaRa公司;P38抑制剂SB202190、SGK1抑制剂GSK650394 美国MCE公司;无酶无菌水、青链霉素混合液(100×) 北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CO2细胞培养箱、全波长多功能酶标仪、超低温冰箱、高速冷冻离心机、Applied Biosystems QuantStudioTM3、超微量核酸蛋白测定仪 美国Thermo Fisher公司;聚合酶链式反应(polymerase chain reaction,PCR)仪日本Biometra 公司;CKX41 倒置荧光显微镜美国Olympus公司。
1.3 方法
1.3.1 细胞培养
KU812细胞用含10%胎牛血清、1%青链霉素混合液(100×)的1640培养基,于37 ℃、5% CO2的培养箱中进行培养。
1.3.2 不同浓度NaCl干预后KU812细胞存活率的测定
取对数期的KU812细胞以每孔100 μL加入96 孔板中,保证每孔细胞数2×105个/mL,空白组加入等量培养基,96 孔板外圈加入一圈磷酸盐缓冲液,次日每孔分别加入10 μL不同浓度的NaCl,使其终浓度分别为10、20、30、40、50、60 mmol/L,对照组和空白组加入等量磷酸盐缓冲液,24 h后,每孔加入10 μL的CCK-8试剂,2 h后于450 nm波长处测定吸光度。根据下式计算不同浓度NaCl干预后KU812细胞的存活率。
1.3.3 高盐条件下卵白蛋白诱导的KU812细胞脱颗粒模型的构建
1.3.3.1 鸡蛋过敏血清池的构建
鸡蛋过敏患者血清池是由鸡蛋过敏患者的血清等体积混合制备而成(n=10),患者的血清信息如表1所示。

表1 鸡蛋过敏患者信息Table 1 Information of egg allergic patients
1.3.3.2 IgE介导的KU812细胞体外活化实验
取对数期的KU812细胞以每孔300 μL加入48 孔板中,保证每孔细胞数2×106个/mL;次日,每孔加入30 μL鸡蛋过敏血清池与细胞共孵育24 h;24 h后,阳性组加入终质量浓度为100 μg/mL的卵白蛋白(ovalbumin,OVA),实验组加入终浓度为40 mmol/L的NaCl和终质量浓度为100 μg/mL的OVA,对照组加入等量磷酸盐缓冲液,继续培养4 h。反应结束后,常温下1 000 r/min离心10 min,收集上清液并分装(用来测定组胺、β-HEX、IL-6、TNF-α水平),置于-20 ℃冻存备用;收集的细胞立即加入TRIzol,吹打均匀后置于-80 ℃冻存以备后续提取RNA。
1.3.3.3 组胺、β-HEX质量浓度的测定
按相应试剂盒的说明书测定组胺、β-HEX质量浓度。
1.3.3.4 IL-6、TNF-α质量浓度的测定
按相应试剂盒的说明书测定IL-6、TNF-α质量浓度。
1.3.4 NaCl刺激KU812细胞实验
取对数期的KU812细胞以每孔1 mL加入2 孔板中,保证每孔细胞数106个/mL;次日,实验组每孔加入终浓度为40 mmol/L的NaCl,对照组加入等量的无菌水。培养24 h后收集细胞,提取RNA。
取对数期的KU812细胞以每孔1 mL加入12 孔板中,保证每孔细胞数106个/mL;次日,实验组每孔加入终浓度为5 μmol/L的SGK1抑制剂或终浓度为10 μmol/L的P38抑制剂刺激0.5 h,对照组加入等量的二甲基亚砜刺激,0.5 h后两组再加入终浓度为40 mmol/L的NaCl刺激。培养24 h后收集细胞,提取RNA。
1.3.5 KU812细胞RNA的提取
根据TRIzol试剂说明书进行操作,步骤如下:在加入1 mL TRIzol的KU812细胞中加入200 μL的氯仿,混匀,剧烈涡旋15 s,冰上静置3 min;4 ℃、12 000 r/min离心15 min,取上层液体400 μL后加入等量异丙醇,轻轻混匀,冰上静置10 min;4 ℃、12 000 r/min离心10 min;去上清液,加入500 μL的体积分数75%乙醇溶液,混匀使沉淀悬浮,4 ℃、7 500 r/min离心10 min,重复此步骤一次;去上清液,倒扣离心管3 min左右来简单干燥RNA,吸取适量的无酶水溶解RNA,电泳检测提取RNA的质量并测定样品的OD260nm/280nm比值和RNA浓度,样品于-80 ℃保存。
1.3.6 KU812细胞RNA的反转录及荧光定量PCR
将RNA反转录成DNA:1)在0.2 mL无酶管中加入2 μL的5×gDNA Eraser Buffer和1 μL的gDNA Eraser,再加入RNA,最后加无酶水至总体系为10 μL,置于42 ℃反应2 min。2)再配制10 μL的Master Mix(1 μL Prim eScript RT Enzyme Mix I、1 μL RT Primer Mix 4、4 μL 5×PrimeScript Buffer 2(for Real Time)、4 μL RNase Free dH2O),再分别加入至步骤1中的反应液中,放入PCR仪中进行反转录,反应条件为:37 ℃ 15 min;85 ℃ 5 s;最后结束温度设为4 ℃。反应结束后样品置于-20 ℃保存。
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)网站查找相应的引物序列,进行筛选后由上海生工公司进行合成,引物信息如表2所示。

表2 qPCR相关引物信息Table 2 Primer sequences used for qPCR
PCR条件:采用20 μL的体系,在八连管中分别加入10 μL TB Green Premix ExTaqII(Tli RNaseH Plus)(2×)、0.8 μL PCR正向引物(10 μmol/L)、0.8 μL PCR反向引物(10 μmol/L)、0.4 μL ROX Reference Dye II(50×)、2 μL的cDNA溶液和6 μL灭菌水,扩增程序为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃34 s,40 个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.4 数据处理与分析
数据分析及图表绘制均采用GraphPad Prism 8.3.0软件进行,数据表示为平均值±标准差。
2 结果与分析
2.1 不同浓度NaCl对KU812细胞增殖的影响
使用细胞存活率这一指标来表征KU812细胞受NaCl浓度影响下的增殖能力变化,一般认为,样品对细胞无毒性时细胞存活率不低于95%。通过CCK-8实验发现,随着NaCl浓度的升高,细胞存活率下降(图1)。在设置的6 个NaCl浓度中,10~40 mmol/L NaCl浓度下细胞存活率能保持在95%以上,说明此浓度范围对细胞无毒性;而50 mmol/L和60 mmol/L的NaCl使细胞的存活率低于95%,说明该浓度NaCl对细胞有毒性。因此,在后续的实验中,选取40 mmol/L作为NaCl作用细胞的最大无毒终浓度,这也与之前Kleinewietfeld[20]和Hernandez[21]等探究T细胞分化时所选取的NaCl浓度一致。

图1 不同浓度NaCl对KU812细胞增殖的影响Fig.1 Effects of different concentrations of NaCl on KU812 cell proliferation
2.2 NaCl对KU812细胞脱颗粒释放生物活性介质组胺和β-HEX的影响
鸡蛋过敏患者血清池与KU812细胞共孵育时,血清中的抗原特异性IgE会与嗜碱性粒细胞表面高亲和力的FcεRI受体结合,使细胞处于致敏状态,再加入OVA(在有无高盐条件下)激发后,OVA与IgE特异性结合,引起FcεRI交联并触发致敏的KU812细胞脱颗粒。KU812细胞在脱颗粒时会释放预合成的生物活性介质(组胺和β-HEX),两者是嗜碱性粒细胞脱颗粒的标志性检测物,其释放水平的高低直接影响过敏症状的严重程度[23]。本实验通过ELISA检测KU812细胞脱颗粒产生的生物活性介质,如图2所示,对照组、OVA组和OVA+NaCl组释放的组胺质量浓度分别为45.98、47.69、46.91 ng/mL;释放的β-HEX质量浓度分别为69.68、70.52、71.01 ng/mL。最终结果表明OVA组和OVA+NaCl组释放的组胺和β-HEX质量浓度并没有显著性差异(P>0.05),说明NaCl并不能促进KU812细胞脱颗粒产生生物活性介质。

图2 NaCl对KU812细胞脱颗粒释放生物活性介质的影响Fig.2 Effect of NaCl on the release of bioactive mediators by KU812 cells after degranulation
2.3 NaCl对KU812细胞产生细胞因子IL-6和TNF-α的影响
IL-6和TNF-α是常见的促炎细胞因子,有研究表明在食物过敏患者的血清中IL-6和TNF-α水平显著上升,它们能作为食物过敏患者后期随访的标志性检测物[24]。本实验通过ELISA检测KU812细胞脱颗粒产生的炎症因子,如图3所示,对照组、OVA组和OVA+NaCl组释放的IL-6质量浓度分别931.58、1 015.91、1 255.69 pg/mL;释放的TNF-α质量浓度分别为3.46、5.71、7.51 pg/mL。结果表明OVA+NaCl组比OVA组更能促进KU812细胞产生IL-6和TNF-α(P<0.05)。进一步通过qPCR进行验证,同样也发现OVA+NaCl组中KU812细胞的IL-6和TNF-α基因相对表达量显著升高(P<0.05)。这些结果揭示NaCl虽然不能调节KU812细胞产生生物活性介质,但是可以促进KU812产生相关的促炎细胞因子。现有文献报道,NaCl是Th2细胞的离子检查点,能够促进T细胞向Th2细胞分化并产生相应的细胞因子[22]。因此推测,NaCl可能也是促进KU812细胞产生细胞因子的离子检查点。

图3 ELISA和qPCR检测40 mmol/L NaCl对KU812细胞脱颗粒相关细胞因子分泌的影响Fig.3 Effect of 40 mmol/L NaCl on the secretion of degranulationrelated cytokines by KU812 cells detected by ELISA and qPCR
2.4 NaCl对KU812细胞产生细胞因子IL-4的影响
IL-4是由过敏反应中Th2细胞、嗜碱性粒细胞和肥大细胞产生的促炎因子和多效性细胞因子在初始T细胞分化成Th2细胞和过敏反应的发生中发挥着至关重要的作用。嗜碱性粒细胞能分泌大量的IL-4,通过嗜碱性粒细胞-IL-4-肥大细胞轴来促进食物过敏的产生[14]。Matthias等[22]在过敏性皮炎患者的皮肤活检标本中发现嗜碱性粒细胞,且过敏性皮炎患者受损皮肤钠浓度是未受损皮肤和健康对照组皮肤的30 倍,表明皮肤中的钠积累与这种Th2介导的疾病有关。本研究发现NaCl可以高度显著促进嗜碱性粒细胞KU812细胞释放IL-4(P<0.001)(图4A)。而IL-4是促进和维持Th2型细胞免疫的关键细胞因子,NaCl很可能促进食物过敏的产生。
研究表明NaCl浓度的增加伴随着高渗透性的增加,可以诱导免疫系统的激活[25]。且在其他细胞中SGK1基因可以调节Na+运输和盐稳态[26]。SGK1在NaCl转运的背景下被广泛研究,NaCl浓度的适度升高可以诱导T细胞中SGK1的表达,从而促进致病性Th17细胞的产生[20]。同样地,本研究也发现高盐条件下会高度显著促进KU812细胞SGK1基因的表达(P<0.001)(图4B)。综上,是否是由于SGK1的高表达从而导致高盐条件下KU812细胞产生IL-4,仍需后续继续研究。

图4 NaCl对KU812细胞IL-4和SGK1基因表达的影响Fig.4 Effect of NaCl on IL-4 and SGK1 gene expression in KU812 cells detected by qPCR
2.5 NaCl促进KU812产生IL-4的分子机制
为了进一步探究在嗜碱性粒细胞KU812细胞中SGK1和IL-4表达间的靶向关系,本研究在40 mmol/L的NaCl条件下,利用SGK1的特异性抑制剂GSK650394处理KU812细胞,结果发现SGK1抑制剂可以极显著降低KU812细胞中SGK1的表达(P<0.01)(图5A),并可以显著降低IL-4基因的表达(P<0.05)(图5B)。这一结果揭示NaCl调节KU812细胞产生IL-4是由渗透敏感转录因子SGK1所介导的。
此外,哺乳动物的高渗应激是通过P38感知的,其下游靶标是渗透敏感转录因子SGK1[27]。P38信号可以调节SGK1激活,高浓度的NaCl可以促进P38磷酸化,从而激活SGK1[20]。在T细胞活化的相关研究中,NaCl通过P38-SGK1信号通路来促进Th17和Th2细胞的产生[22,28]。Guo Hongxia等[29]也发现,高浓度NaCl加重结肠炎的机制依赖于P38和SGK1的上调。本实验进一步探究NaCl调节KU812细胞产生IL-4是否受到P38-SGK1通路的调控。为了证实SGK1受P38信号的调控,本实验在有无P38抑制剂(SB202190)的情况下,测定了NaCl刺激下KU812细胞中SGK1的表达情况。结果显示,P38抑制剂可以高度显著抑制SGK1的表达(P<0.001)(图5C),这与许多文献中的结果[20,30]一致。此外,P38抑制剂可以高度显著降低NaCl刺激下KU812细胞产生的IL-4含量(P<0.001)(图5D)。Kleinewietfeld等[20]研究NaCl调节初始T细胞分化时发现,葡萄糖酸钠与NaCl效果一样,可以促进致病性Th17细胞的产生,而甘露醇和氯化镁却不能,这揭示了NaCl起作用的因素是钠离子。在本实验的细胞培养体系中,具体是Na+还是Cl-产生作用并不能够确定,仍需要进一步研究。综合以上结果,本研究初步揭示NaCl可以通过P38-SGK1信号通路来调节KU812细胞产生IL-4,具体的机制示意图如图6所示。
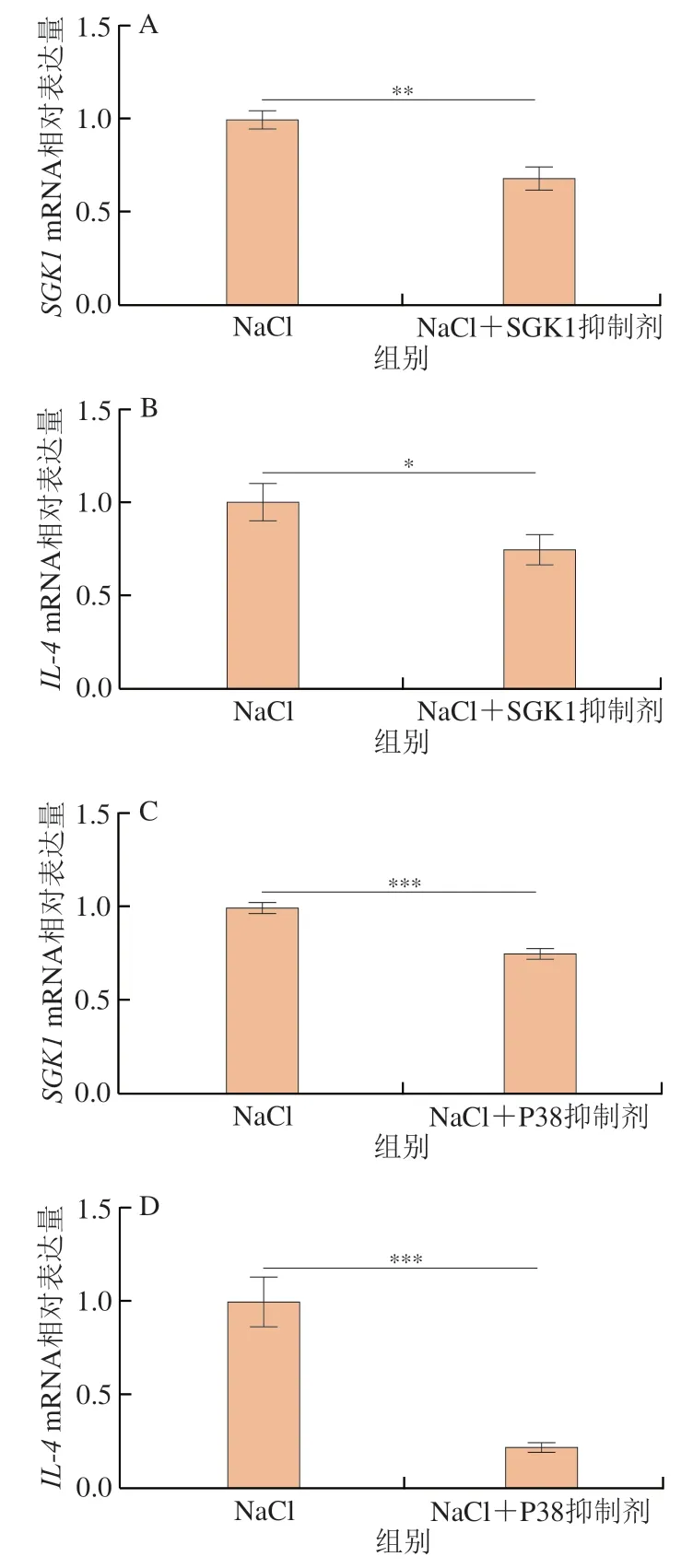
图5 qPCR检测SGK1抑制剂和P38抑制剂对NaCl刺激KU812相关基因SGK1和IL-4表达的影响Fig.5 Effect of SGK1 inhibitor and p38 inhibitor on the expression of SGK1 and IL-4 in KU812 stimulated by NaCl detected by qPCR

图6 NaCl对KU812细胞产生IL-4的影响机制示意图Fig.6 Schematic diagram of the mechanism of the effect of sodium chloride on IL-4 production by KU812 cells
3 结论
本研究发现高浓度的NaCl并不能促进嗜碱性粒细胞(KU812)脱颗粒产生生物活性介质组胺和β-HEX,但可以调节KU812细胞的炎症因子反应。值得注意的是,NaCl可以促进KU812细胞产生食物过敏重要调控因子IL-4,其产生机制依赖于P38-SGK1信号通路。因此,本研究结果提示NaCl可能是嗜碱性粒细胞炎症因子反应的离子检查点,然而高盐饮食是否增加食物过敏的风险,仍需要进一步研究。
