MBF2转录调控小菜蛾谷胱甘肽 S-转移酶代谢氯虫苯甲酰胺的功能
2023-03-09葛天成尹飞胡琼波彭争科李振宇
葛天成,尹飞,胡琼波,彭争科,李振宇
1广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室,广州 510640;2华南农业大学植物保护学院,广州 510642
0 引言
【研究意义】小菜蛾(Plutella xylostella)属鳞翅目(Lepidoptera)菜蛾科(Plutellidae),主要危害十字花科蔬菜,每年造成的经济损失达7.7亿美元,是抗药性最强的世界性害虫之一[1]。氯虫苯甲酰胺(chlorantraniliprole)自 2008年[2]上市以来一直是防治小菜蛾的主要双酰胺类药剂[3],每年全球销售额超1.4亿美元[4]。但该药剂的连续使用使小菜蛾对其已产生严重抗性[5],广东地区抗性最高可达1 749.96倍[6]。抗药性机理的阐明是抗性治理的基础,针对小菜蛾抗药性机理的研究主要集中在靶标抗性和代谢抗性两方面,其中代谢抗性在抗药性产生的初期起主要作用,课题组前期研究表明谷胱甘肽 S-转移酶(glutathione S-transferase,GST)在小菜蛾对氯虫苯甲酰胺抗性中起主要作用[7],明确其转录调控机制,将有助于小菜蛾的抗药性治理及新药剂的研发。【前人研究进展】靶标抗性与解毒酶活性的增加是小菜蛾抗性升高的主要原因[8]。氯虫苯甲酰胺作用于小菜蛾鱼尼丁受体,破坏细胞内钙离子释放通道,G4946E为主要突变位点[9]。解毒酶活性升高是另一个主要原因,多种解毒酶参与到抗性升高过程中[10-11]。GST作为昆虫体内重要的解毒酶之一,已被证实参与到小菜蛾抗性发展的过程中[12],在对氯虫苯甲酰胺的抗性发展过程中更是起主要作用[13-14]。外源化合物可以诱导昆虫解毒酶基因的表达水平升高,反式作用因子在其中起着非常重要的作用。ZHU等[15]研究证实GSTU1参与小菜蛾解毒过程,其反义转录本能从转录水平阻止GSTU1降解,增强小菜蛾抗性;王茹梦[16]研究发现PxCRBL2参与小菜蛾GST代谢茚虫威的过程。目前,氯虫苯甲酰胺诱导小菜蛾 GST共表达的转录调控机制尚不明确,从转录水平系统研究GST在抗性中的作用,有助于找到调控多个GST基因的途径,从而为抗药性研究提供新的靶标基因。转录调控因子MBF2(multiprotein bridging factor 2)是一个22 kD的糖蛋白转录激活因子,可以在转录过程中与转录起始因子TFIIA结合[17],作为转录辅助因子来调控下游基因的表达[18]。少量研究表明其或其同源基因在昆虫病毒免疫及抗逆性反应中起作用[19-20]。研究较多的同源MBF1在植物抗热胁迫等应激反应中起重要作用[21];在哺乳动物中有调节类固醇激素的生成[22]、调节脂类代谢平衡的功能[23];参与马铃薯青枯病抗性升高过程,在响应 ABA信号通路中发挥重要作用[24]。【本研究切入点】目前未见MBF家族基因参与昆虫抗药性发生的报道。前期在抗性/敏感小菜蛾转录组数据中筛选到差异表达的转录调控基因MBF2,该基因对GST的调控作用及其在小菜蛾抗氯虫苯甲酰胺中的功能有待于进一步明确。【拟解决的关键问题】测定不同抗性小菜蛾种群GST活性,研究MBF2表达量与抗性水平的关系、氯虫苯甲酰胺处理对MBF2表达量的影响以及MBF2对GST基因的调控作用,为解毒酶基因在转录水平上的研究提供新思路。
1 材料与方法
试验于2021年3月至2022年6月在广东省农业科学院植物保护研究所完成。
1.1 材料
1.1.1 供试虫源 选定不同种植模式下的广东连州(LZ)、云南通海(TH)及室内敏感(SS)小菜蛾种群作为实验种群。LZ种群于2021年11月3日采自广东省连州市龙坪监测点;TH种群于 2019年2月26日采自云南省通海市监测点饲养至今,隔代用LC25处理以保持小菜蛾的抗药性水平。SS种群由中国农业科学院蔬菜花卉研究所提供,该种群为2014年采集于深圳市田间的幼虫和蛹,之后用菜心苗(Brassica campestris)在室内未接触任何杀虫剂条件下饲养至今。
1.1.2 药剂及试剂 98.6%氯虫苯甲酰胺原药购自广州进展生物科技有限公司,使用二甲基亚砜DMSO和乳化剂配置成5%乳油。
细胞组织RNA快速提取试剂盒Easyspin RNA kit(Aidlab艾德莱生物);反转录试剂盒 TransScript One-Step gDNA Removal and cDNA STHthesis SupperMix(Transgen全式金生物);荧光定量预混试剂 2×RealStar Green Fast Mixture(Genstar康润生物);dsRNA合成试剂盒T7 RNAi Transcription Kit-BOX1(Vazyme诺唯赞生物)。
1.2 方法
1.2.1 不同小菜蛾种群对氯虫苯甲酰胺的抗性及GST活性测定 采用浸叶法进行不同小菜蛾种群抗性测定,测定方法、结果调查等均参照中华人民共和国农业行业标准“十字花科小菜蛾抗药性监测技术规程”(NY/T 2360—2013)进行。抗性倍数(RR)=田间种群的LC50/敏感品系的LC50。其中,RR≤10为低水平抗性;10<RR<100为中等水平抗性;RR≥100为高水平抗性。GST活性测定参照梁沛等[25]的方法。
1.2.2 不同小菜蛾种群MBF2表达量测定 各种群总RNA提取按试剂盒说明书进行,根据反转录试剂盒说明书进行cDNA的合成,用1%的琼脂糖凝胶电泳进行RNA质量检测,Nanodrop2000微量紫外分光光度计测定浓度。
引物由北京擎科生物科技有限公司合成,以核糖体蛋白基因RPL32为内参基因。采用CFX96实时荧光定量PCR仪系统(美国Bio-Rad公司),以SYBR Green I为染料,测定MBF2的相对表达量。反应体系:2×RealStar Fast SYBR qPCR Mix 10 µL,cDNA 模板1 μg,上、下引物各0.5 µL,用 ddH2O补足至20 µL。RT-qPCR程序采用两步法:95℃ 2 min;95℃ 15 s,60℃ 30 s,72℃ 30 s,40个循环。每组3个生物学重复,统计分析时将敏感种群的表达量作为对照,设置为1。
1.2.3 氯虫苯甲酰胺短时诱导小菜蛾后MBF2表达量变化 采用浸叶法,选用致死中浓度(LC50)氯虫苯甲酰胺对LZ、TH和SS种群3龄幼虫进行诱导,诱导后每2 h取15头3龄早期小菜蛾幼虫,取满12 h,放入-80℃冰箱中。每5头作为一个生物学重复,每组3个生物学重复。MBF2的相对表达量测定方法同1.2.2。统计分析时以同等浓度DMSO处理种群的表达量作为对照,计算时表达量设置为1。
1.2.4 基于RNAi的MBF2功能验证 根据MBF2序列信息,设计特异性上游引物(5′-TCTACACGAACCC TGGGAAC-3′),下游引物(5′-ACACCTGCACCTGGT ATGTG-3′),dsRNA合成引物在5′端加上T7启动子 TAATACGACTCACTATAGGG,合成方法参照Vazyme T7 RNAi Transcription Kit-BOX1说明书。用1%琼脂糖凝胶电泳检测dsRNA完整性。选取LZ 3龄早期小菜蛾幼虫,使用Nanoliter 2010微量注射泵,在小菜蛾第3腹足处注射,每头注射300 ng dsRNA。以ddH2O、dsGFP(绿色荧光蛋白 green fluorescent protein)为对照,重复3次,干扰24 h后,使用RT-qPCR方法进行相关表达量测定。参考YOU等[26]的小菜蛾基因组及课题组转录组测序结果,筛选22个GST基因,设计检测引物,验证引物扩增效率介于 90%—110%。
1.3 数据统计与分析
数据分析使用 IBM SPSS Statistics 23软件ordinary one-way ANOVA检验,荧光定量数据使用Bio-Rad CFX Manager计算相对表达量,GraphPad Prism 8.3作图。
2 结果
2.1 不同小菜蛾种群对氯虫苯甲酰胺的抗性水平
生物活性测定结果表明,通海(TH)小菜蛾种群对氯虫苯甲酰胺抗性水平为中等抗性,其抗性倍数为54.27;连州(LZ)小菜蛾种群达到高抗性水平,其抗性倍数为289.58(表1)。

表1 氯虫苯甲酰胺对3个小菜蛾种群的毒力Table 1 Toxicity of chlorantraniliprole on three P.xylostella populations
2.2 不同小菜蛾种群GST活性
3个小菜蛾种群GST活性存在显著差异,GST活性随着种群抗性倍数的增加而增加,LZ小菜蛾种群GST活性是SS种群的2.19倍,TH小菜蛾种群GST活性是SS种群的1.62倍(表2)。
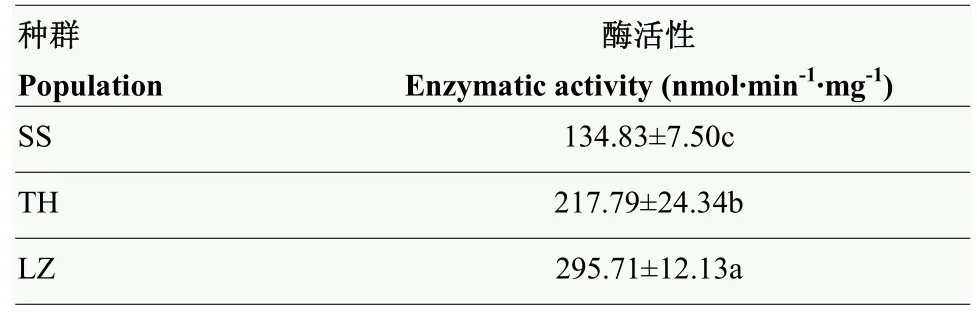
表2 不同小菜蛾种群GST活性Table 2 GST activity of different P.xylostella populations
2.3 抗性与敏感小菜蛾种群中MBF2的表达量
MBF2在SS、TH和LZ 3个小菜蛾种群中的表达量呈梯度变化,TH和LZ小菜蛾种群表达量显著高于SS种群,MBF2在TH种群小菜蛾体内的表达量为SS种群的4.6倍,在LZ种群小菜蛾体内的表达量为SS种群的9.4倍(图1)。

图1 MBF2在不同小菜蛾种群中的相对表达量Fig.1 Relative expression of MBF2 in different P.xylostella populations
2.4 氯虫苯甲酰胺短时诱导后小菜蛾MBF2表达量变化
用LC50的氯虫苯甲酰胺处理SS、LZ和TH 3个小菜蛾种群3龄幼虫后,以相同浓度DMSO处理的3龄小菜蛾为对照,SS与TH种群处理6 h时,MBF2表达量达到最高,SS种群表达量达到4.94倍,TH种群达到7.02倍;LZ种群在8 h时表达量最高,为对照组的10.27倍;SS种群在12 h时与对照组无显著差异,而另外两个种群在12 h时仍显示出一定的上调,且差异显著(图2)。

图2 氯虫苯甲酰胺诱导后不同小菜蛾种群MBF2表达变化Fig.2 Relative expression changes of MBF2 in different P.xylostella populations after chlorantraniliprole induction
2.5 MBF2与GST的关系
LZ种群注射dsMBF224 h后,与对照dsGFP组和注射 ddH2O处理组相比,沉默效率达到 70%(图3-A)。检测22个GST基因的表达量,发现与对照组相比,dsMBF2组小菜蛾体内多个GST基因表达出现显著下调,GSTD2、GSTD5、GSTE1、GSTE5、GSTO1、GSTO5、GSTT1、GSTU1及GSTZ1下调量均超过50%,GSTU1和GSTZ1效果最为显著,下调量90%以上(图3-B)。

图3 MBF2沉默效率(A)及沉默后GST基因表达量(B)Fig.3 MBF2 knocking down efficiency (A) and GST genes expression level after knocking down (B)
LZ小菜蛾种群沉默MBF2后,GST活性检测发现,dsGFP组、注射ddH2O及dsMBF2组酶活性分别为 42.21、32.65 和 17.83 nmol·min-1·mg-1,dsMBF2处理组GST活性显著低于对照组,与dsGFP对照组相比活性降低57.76%(图4)。

图4 RNAi后小菜蛾3龄幼虫GST活性Fig.4 GST activity of the 3rd instar larvae of P.xylostella after RNAi
dsMBF2处理小菜蛾3龄幼虫24 h,使用75 mg·L-1氯虫苯甲酰胺对MBF2沉默后的小菜蛾进行毒力测定,结果如图5所示,dsMBF2处理组小菜蛾死亡率显著高于对照组,处理组小菜蛾死亡率为56.67%,比对照组死亡率高23.34%。

图5 RNAi后小菜蛾对氯虫苯甲酰胺胁迫的敏感性Fig.5 Sensitivity of P.xylostella after RNAi to chlorantraniliprole stress
3 讨论
3.1 GST在小菜蛾对氯虫苯甲酰胺的抗药性中起重要作用
害虫抗性升高主要是由于解毒酶活性升高、靶标位点敏感性降低以及表皮穿透性降低导致[27]。在解毒酶领域研究较多的主要有细胞色素酶(P450)、羧酸酯酶(CarE)及谷胱甘肽S-转移酶(GST),三者被认为与抗药性有密不可分的关系。GST在昆虫第二阶段解毒过程中起到了关键作用[28-29],LIU等[30]利用氯虫苯甲酰胺诱导菜粉蝶(Pieris rapae)后,9个GST基因上调,推测其参与了菜粉蝶抗氯虫苯甲酰胺的过程;飞蝗(Locusta migratoria)抗氯虫苯甲酰胺过程中GST活性显著提升[31];课题组前期利用RNAi技术证实了PxGST2L在小菜蛾抗氯虫苯甲酰胺过程中起重要作用[7]。本研究结果亦表明GST在小菜蛾抗药性中起重要作用,对选取的3个小菜蛾种群进行GST活性测定,发现随着抗性的升高,GST活性不断升高,而GSTD2、GSTD5、GSTE1等多个基因下调表达,致使 GST活性降低,小菜蛾对氯虫苯甲酰胺的敏感性上升,表明GST与小菜蛾对氯虫苯甲酰胺抗性有密不可分的关系且多个 GST基因共表达调控,结果与HU等[32]研究结果相一致。
3.2 MBF2通过调控GST的表达参与抗性发展
外源化合物可以诱导昆虫解毒酶基因的表达水平升高,反式作用因子在其中起着非常重要的作用。在转录过程中,反式调控因子和顺式作用元件的变化均会导致下游转录产物的表达量改变。在反式调控因子即转录因子的研究中,Nrf2(nuclear factor erythroid-derived 2-related factor 2)被多次证实参与解毒酶基因上调的过程。MISRA等使用苯巴比妥刺激果蝇(Drosophila melanogaster),发现GST解毒酶基因通过Nrf2/Keap1转录途径显著上调[33]。CHEN在2018年证明活性氧(ROS)可通过诱导转录因子Nrf2与启动子结合的方式使GSTE1过量表达[34]。在昆虫体内,Nrf2 的直系同源物 CncC(cap “n” collar isoform C)是GST、P450等解毒酶的关键转录因子[35-37]。以往研究已明确,在家蚕(Bombyx mori)、甜菜夜蛾(Spodoptera exigua)及斜纹夜蛾(S.litura)中,CncC对于GSTE3、GSTD1、GSTT1、GSTE6有调控作用[38-41]。转录激活因子MBF家族基因在昆虫免疫和抗逆性中起重要作用,在果蝇中可调节与代谢相关的基因来参与冷胁迫,周春燕使用黑胸败血芽孢杆菌(Bacillus bombyseptieus)处理家蚕后,MBF2被诱导上调,说明MBF2参与到家蚕的免疫过程中[42]。在植物中,MBF家族基因可作为正向调节子协同有关信号分子和抗性标志基因参与马铃薯青枯病抗性[24]。本研究结果表明,MBF2参与小菜蛾对氯虫苯甲酰胺的抗性。致死中浓度(LC50)氯虫苯甲酰胺诱导小菜蛾,在 1—8 h内MBF2表达量显著提高。同时,沉默MBF2后多个GST表达量显著下调,GST活性也下降,而在沉默MBF2后,抗性种群对于氯虫苯甲酰胺的敏感性升高,同等浓度下较对照组死亡率显著上升23.34%。研究结果说明MBF2直接或间接参与了小菜蛾GST抗氯虫苯甲酰胺的解毒过程,但是其调控通路需进一步明确。
3.3 MBF2调控通路预测
过往研究中,MBF2与转录起始因子TFIIA结合,形成转录起始复合体的一部分[43],经由转录因子再去调控下游基因的表达。笔者在MBF2上游200 bp的转录启动子区域预测到了与CncC结合的位点信息。推测该转录调控完整通路是MBF2结合 CncC/Maf-s的转录起始复合体TFIIA,激活CncC/Maf-s转录因子的调控或上调转录因子的表达水平,由CncC/Maf-s来调控GST的转录表达,从而三者形成一个抗性响应过程。
4 结论
小菜蛾在受到氯虫苯甲酰胺的毒性胁迫时,可能通过过表达转录激活因子MBF2,从转录水平直接或间接地调控GST基因大量表达,从而提高小菜蛾对氯虫苯甲酰胺的代谢能力,进而提高小菜蛾对氯虫苯甲酰的抗性。
