粗盐提纯实验的问题探讨
2023-03-08刘文皓,黄燕宁,李丽萍
刘文皓,黄燕宁,李丽萍


摘要: 粗盐提纯实验中存在关于除杂试劑选择、沉淀成分、实验室与工业生产差异等多方面的疑问,如Ba(OH)2溶液是否可以代替BaCl2溶液、NaOH溶液进行除杂;为什么不选用碳酸钠溶液同时除去粗盐中的Mg2+、 Ca2+及引入的过量Ba2+;碳酸钠溶液的加入会不会导致氢氧化镁沉淀转化为碱式碳酸镁沉淀;用NaOH溶液除去粗盐中的Mg2+会不会生成Mg(OH)2胶体。对这些常见问题进行了探讨,以期为化学教学提供一些有益的参考。
关键词: 粗盐提纯; 分离除杂; 问题探讨
文章编号: 1005-6629(2023)02-0094-03 中图分类号: G633.8 文献标识码: B
粗盐提纯是中学阶段经典的学生必做实验之一,承载着物质分离的重要思路与方法。初中阶段关注粗盐中难溶性杂质的去除[1],而高中阶段则侧重于用化学沉淀法除去粗盐中Ca2+、 Mg2+、 SO2-4三种可溶性杂质离子[2]。依据人教版[3]、鲁科版[4]、苏教版[5]高中化学教材,该实验原理为用BaCl2溶液除去SO2-4,用NaOH溶液除去Mg2+,用Na2CO3溶液除去Ca2+与过量的Ba2+,将沉淀过滤后用盐酸调节滤液pH至中性或微酸性。然而在实际教学过程中,教师和学生对该实验仍存在一些疑问,值得进一步探究与思考。
1 Ba(OH)2溶液是否可以代替BaCl2溶液、NaOH溶液进行除杂
教师在粗盐提纯实验教学中为了发展学生的实验探究能力,强化学生对分离除杂思路方法的认识,往往会要求学生自主思考如何选择该实验的除杂试剂。然而,在很多学生眼中,Ba(OH)2溶液是更为便捷的除杂试剂,因为它可以同时除去粗盐水中的SO2-4、 Mg2+。那么教师面对学生的这一想法该作何解释呢?不选择Ba(OH)2溶液做除杂试剂的原因是什么呢?
从理论上分析,Ba(OH)2溶液确实可以同时沉淀溶液中的SO2-4与Mg2+,但在实际应用中Ba(OH)2溶液并不可以代替BaCl2溶液、NaOH溶液进行除杂,原因主要包括以下三点:
(1) 粗盐中各杂质的具体含量是未知的,在进行除杂操作前无法判断SO2-4和Mg2+的物质的量之比。若直接加入Ba(OH)2溶液必然会引入过量的Ba2+或OH-,在后续操作中将加入更多的碳酸钠溶液或盐酸,造成试剂的浪费。
(2) Ba(OH)2溶解度很低,20℃时氢氧化钡的溶解度为3.89g,不易制得浓度较高的Ba(OH)2溶液。实验中所用Ba(OH)2溶液中的氢氧根离子浓度远小于氢氧化钠溶液,使得加入溶液体系的除杂试剂量进一步增加。
(3) Ba(OH)2的成本比BaCl2和NaOH更高。
2 为什么不用碳酸钠溶液同时除去粗盐中的Mg2+、 Ca2+及引入的过量Ba2+
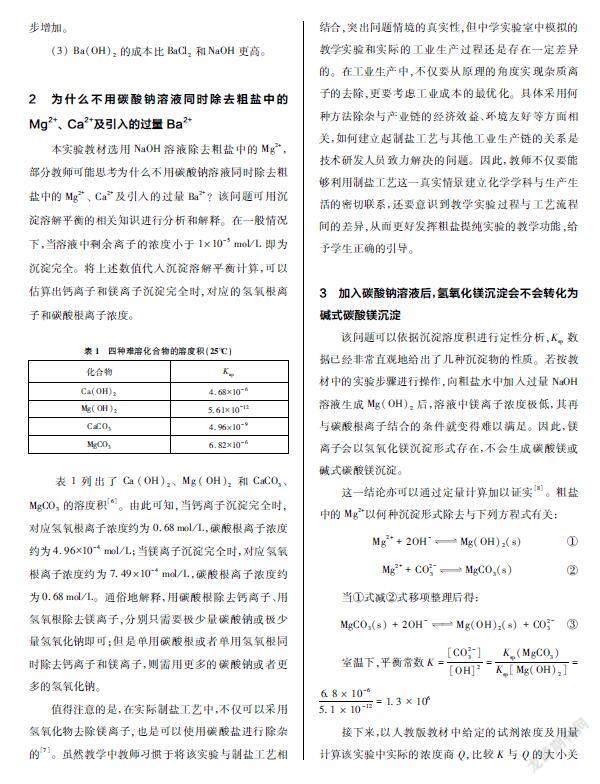
本实验教材选用NaOH溶液除去粗盐中的Mg2+,部分教师可能思考为什么不用碳酸钠溶液同时除去粗盐中的Mg2+、 Ca2+及引入的过量Ba2+?该问题可用沉淀溶解平衡的相关知识进行分析和解释。在一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L即为沉淀完全。将上述数值代入沉淀溶解平衡计算,可以估算出钙离子和镁离子沉淀完全时,对应的氢氧根离子和碳酸根离子浓度。
表1列出了Ca(OH)2、 Mg(OH)2和CaCO3、 MgCO3的溶度积[6]。由此可知,当钙离子沉淀完全时,对应氢氧根离子浓度约为0.68mol/L,碳酸根离子浓度约为4.96×10-4mol/L;当镁离子沉淀完全时,对应氢氧根离子浓度约为7.49×10-4mol/L,碳酸根离子浓度约为0.68mol/L。通俗地解释,用碳酸根除去钙离子、用氢氧根除去镁离子,分别只需要极少量碳酸钠或极少量氢氧化钠即可;但是单用碳酸根或者单用氢氧根同时除去钙离子和镁离子,则需用更多的碳酸钠或者更多的氢氧化钠。
值得注意的是,在实际制盐工艺中,不仅可以采用氢氧化物去除镁离子,也是可以使用碳酸盐进行除杂的[7]。虽然教学中教师习惯于将该实验与制盐工艺相结合,突出问题情境的真实性,但中学实验室中模拟的教学实验和实际的工业生产过程还是存在一定差异的。在工业生产中,不仅要从原理的角度实现杂质离子的去除,更要考虑工业成本的最优化。具体采用何种方法除杂与产业链的经济效益、环境友好等方面相关,如何建立起制盐工艺与其他工业生产链的关系是技术研发人员致力解决的问题。因此,教师不仅要能够利用制盐工艺这一真实情景建立化学学科与生产生活的密切联系,还要意识到教学实验过程与工艺流程间的差异,从而更好发挥粗盐提纯实验的教学功能,给予学生正确的引导。
3 加入碳酸钠溶液后,氢氧化镁沉淀会不会转化为碱式碳酸镁沉淀
该问题可以依据沉淀溶度积进行定性分析,Ksp数据已经非常直观地给出了几种沉淀物的性质。若按教材中的实验步骤进行操作,向粗盐水中加入过量NaOH溶液生成Mg(OH)2后,溶液中镁离子浓度极低,其再与碳酸根离子结合的条件就变得难以满足。因此,镁离子会以氢氧化镁沉淀形式存在,不会生成碳酸镁或碱式碳酸镁沉淀。
这一结论亦可以通过定量计算加以证实[8]。粗盐中的Mg2+以何种沉淀形式除去与下列方程式有关:
Mg2++2OH-Mg(OH)2(s)①
Mg2++CO2-3MgCO3(s)②
当①式减②式移项整理后得:
MgCO3(s)+2OH-Mg(OH)2(s)+CO2-3③
室温下,平衡常数K=[CO2-3][OH]2=Ksp(MgCO3)Ksp[Mg(OH)2]=6.8×10-65.1×10-12=1.3×106
接下来,以人教版教材中给定的试剂浓度及用量计算该实验中实际的浓度商Q,比较K与Q的大小关系,即可得知Mg2+以何种形式沉淀。
加完三种除杂试剂后粗盐溶液总体积V:
V=V水+VBaCl2+VNaOH+VNa2CO3
=20+3+0.25+3=26.25mL
假设体系中无过量的Ba2+与CO2-3反应,假设实验在室温下进行。
在20℃时,碳酸钠在水中的溶解度为21.5g[9], c饱和Na2CO3=1.67mol/L
ρ20%NaOH=1.22g/mL
则[CO2-3]max=c饱和Na2CO3·VNa2CO3V=1.67×326.25
=0.19mol/L
[OH-]=ρ20%NaOH·VNaOH·20%V·MNaOH=1.22×0.25×20%26.25×40
=5.8×10-2mol/L
Q=[CO2-3]max[OH-]2=0.19(5.8×10-2)2=56
Q< 因此,若按教材中的实验步骤操作,粗盐中的Mg2+以Mg(OH)2沉淀形式除去。换言之,若要制备碱式碳酸镁,需要控制氢氧根、碳酸根、镁离子的浓度在合适比例下,实际操作中经常还要考虑温度等条件的控制。 4 用NaOH溶液除去粗盐中的Mg2+会不会生成Mg(OH)2胶体 胶体的形成条件较为严苛,只有当分散相粒子的大小落在胶体分散系统的范围之内,同时保证足够的稳定性才可以形成胶体。制备胶体的方法主要分为分散法和凝聚法,前者是使固体的粒子变小,后者是使分子或离子聚结成胶粒。通常金属氢氧化物的胶体制备采用化学凝聚法,即通过化学反应使生成物呈过饱和状态,然后粒子再结合成胶粒[10]。例如,向沸腾的蒸馏水中滴加几滴FeCl3溶液,趁热用渗析法除去HCl,就可以得到稳定的Fe(OH)3胶体。 在本实验中,溶液体系显然不满足胶体形成的条件。向粗盐水中加入过量的NaOH溶液会使体系中存在大量OH-,而离子浓度对胶体的稳定性有着直接影响,OH-浓度太大会引起胶粒聚沉,直接生成Mg(OH)2沉淀。因此,该实验用NaOH溶液除去粗盐中的Mg2+不会生成Mg(OH)2胶体。 参考文献: [1]中华人民共和国教育部制定. 义务教育化学课程标准(2022年版)[S]. 北京: 北京师范大学出版社, 2022: 14~15. [2]中华人民共和国教育部制定. 普通高中化學课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 14~15. [3]王晶, 郑长龙主编. 普通高中教科书·化学必修第二册[M]. 北京: 人民教育出版社, 2019: 29. [4]王磊, 陈光巨主编. 普通高中教科书·化学必修第一册[M]. 济南: 山东科学技术出版社, 2019: 58~60. [5]王祖浩主编. 普通高中教科书·化学必修第一册[M]. 南京: 江苏凤凰教育出版社, 2020: 78~79. [6]北京师范大学无机化学教研室等编. 无机化学(上册)(第4版)[M]. 北京: 高等教育出版社, 2002: 419~420. [7]周仲怀, 徐丽君, 于银亭等. 我国海水制盐工艺改革的设计研究[J]. 海洋科学, 1997, (6): 43~46. [8]张福林, 戴仲善. 粗食盐精制过程中镁盐沉淀形式的研究[J]. 天津纺织工学院学报, 1995, (4): 61~64. [9]郑平. 碳酸钠的溶解度[J]. 纯碱工业, 1984, (2): 53~55. [10]傅献彩, 沈文霞, 姚天扬等. 物理化学(第五版)(下册)[M]. 北京: 高等教育出版社, 2006: 408~411.
