巴豆酰化修饰在恶性肿瘤中的研究进展
2023-03-08刘芳远苏丽娅
刘芳远,苏丽娅
0 引言
作为调控表观遗传机制的重要成员之一,翻译后修饰(protein translational modification,PTM)在多种生物学过程中都发挥了重要的作用,包括DNA复制[1]、细胞分化[2]、胚胎发育[3]和疾病发生[4-5]等。随着质谱检测技术的升级和发展,越来越多的PTM得以鉴定,其中包括了一系列的短链赖氨酸酰化修饰,如丁酰化修饰[6]、丙酰化修饰[6]、琥珀酰化修饰[7]、丙二酰化修饰[7]、巴豆酰化修饰[8]和苯甲酰化修饰[9]等。这些PTM能够通过影响蛋白质的结构调节蛋白质的稳定性和生物活性。
2011年Tan等通过一种基于质谱技术的蛋白质组学技术,在组蛋白中的赖氨酸残基中首次发现并鉴定了巴豆酰化修饰,同时证实了巴豆酰化修饰能够通过调控染色体活性影响精子的发生过程[8]。在接下来的研究中,研究人员在一些非组蛋白上也发现了大量巴豆酰化修饰位点,这些发生修饰的非组蛋白参与了多种生物学过程的调控[10]。随着研究的不断深入,巴豆酰化修饰已被证实在人类疾病中发挥了重要的作用,比如急性肾损伤[11]、抑郁症[12]、HIV感染[13]和恶性肿瘤[14]等。本文将对巴豆酰化修饰在恶性肿瘤领域的研究进展进行综述,并讨论巴豆酰化修饰在恶性肿瘤中的研究前景。
1 巴豆酰化修饰的发现与功能
随着人们对甲基化、磷酸化、糖基化、乙酰化等研究的不断深入,通过高精度的检测技术鉴定出了越来越多的新型翻译后修饰。2011年,Tan等通过高分辨率质谱技术在组蛋白的28个赖氨酸残基中,首次证明了巴豆酰化修饰的存在。与乙酰化修饰不同,巴豆酰基包含了一个独特的、四碳长度的π-键,从而产生了独特的刚性平面构象,导致了其在蛋白活性调控方面具有与乙酰化修饰不同的功能特征[8],见图1A~B。此外,在人类HeLa细胞、小鼠、酵母菌、果蝇和线虫等不同类型的真核生物细胞中,通过使用巴豆酰化修饰泛抗体进行检测后,均可以在组蛋白上鉴定到发生修饰的位点。除了组蛋白,在许多非组蛋白上同样存在大量的巴豆酰化修饰,Xu等在1 024个非组蛋白上鉴定了2 696个赖氨酸巴豆酰化修饰位点[10],Yu等则使用SILAC标记定量蛋白质检测技术在3 734个蛋白上鉴定到了14 311个巴豆酰化修饰位点[15]。这些非组蛋白中修饰位点的发现,证实了巴豆酰化修饰能够通过不同途径在生物体内参与调控,表明其在生物学过程调控方面存在潜在的研究价值。
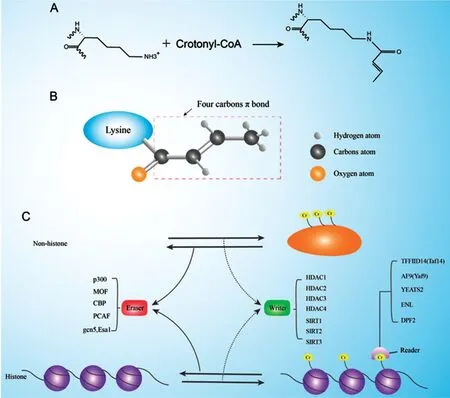
图1 巴豆酰化修饰的化学分子式(A)、构象(B)和调节因子(C)Figure 1 Chemical formula(A),conformation(B),and regulatory factor of crotonylation(C)
由于修饰位点上的差异,巴豆酰化修饰主要以组蛋白巴豆酰化修饰和非组蛋白巴豆酰化修饰两种形式发挥作用。在组蛋白中,巴豆酰化修饰被证实与基因转录调控、精子活性、干细胞分化、DNA损伤修复和细胞周期等生物学过程密切相关。在Tan等的报道中,组蛋白巴豆酰化修饰高度分布于小鼠精子细胞中性染色体上活性基因的启动子区域和增强子区域,提示巴豆酰化修饰可能密切参与了雄性生殖细胞中基因转录活性以及性染色体活性的调控[8]。Fang等[16]研究发现,在小鼠胚胎干细胞(mouse embryonic stem cell,mESC)中,由组蛋白脱乙酰酶1(histone deacetylase 1,Hdac1)介导的组蛋白巴豆酰化修饰可以影响核心多能性调控因子基因Sox2、Oct4和Nanog的表达,并调控胚层谱系基因的表达,促进mESC分化。进一步研究还发现,在组蛋白H4K77和H4K91上的巴豆酰化修饰与人胚胎干细胞(human embryonic stem cell,hESC)向内胚层方向分化密切相关,使用巴豆酸盐对hESC进行诱导处理后,多能性基因Oct4和Sox2的表达明显受到抑制,内胚层标记基因Cxcr4、Sox17和Gata6的表达显著上调[16]。DNA损伤和修复是近年来研究人员关注的热点领域之一。已有的研究结果表明,巴豆酰化修饰与DNA损伤机制存在密切的联系。Abu-Zhayia等经过研究发现,通过电离辐射、紫外辐射或使用依托泊苷对人骨肉瘤细胞进行处理后,组蛋白H3K9上的巴豆酰化修饰水平出现短暂下降,进一步使用HDAC抑制剂曲古抑素A(trichostatin A,TSA)对细胞进行诱导后,H3K9上的巴豆酰化修饰水平会迅速回升[17]。在最近的一项研究中,Abu-Zhayia等又发现DNA双链断裂位点附近的组蛋白赖氨酸巴豆酰化修饰水平显著降低,通过染色质免疫共沉淀实验和目的基因敲除进行鉴定,染色质域Y蛋白1(chromodomain Y-like,CDYL1)在DNA双链断裂过程中,会募集到断裂位点并促进转录沉默,同时发挥巴豆酰辅酶A水合酶活性,抑制H3K9的巴豆酰化修饰水平,但是CDYL1在断裂后同源重组修复中却是非必需的[18]。
在非组蛋白中,巴豆酰化修饰同样可以影响蛋白质的活性和定位,引起生物学功能发生变化。Liao等通过研究证明巴豆酸能够使p53蛋白中的丝氨酸46发生修饰,在不影响mRNA水平的条件下,抑制p53蛋白的活性,进而增强了细胞中p53依赖性的糖酵解,提高了肿瘤细胞在DNA损伤或代谢环境下的抵抗能力[19]。Wei等研究证实,使用巴豆酸盐或TSA处理细胞后,原本位于异染色质的HP1α蛋白出现在了核质上,蛋白质互作实验结果表明发生巴豆酰化修饰的HP1α蛋白与H3K9me3残基的结合效率显著下降,这可能是引起HP1α蛋白定位发生变化的原因之一[20]。此外,Xu等大规模的巴豆酰化修饰组学分析结果表明,发生修饰的非组蛋白广泛参与了RNA剪接、蛋白质合成、DNA损伤和修复、细胞内吞以及细胞间连接等多种生物学过程[10]。
2 真核生物体内巴豆酰化修饰的调控
与乙酰化、琥珀酰化、丙二酰化等蛋白质赖氨酸酰化修饰类似,真核生物体内的巴豆酰化修饰也可以通过酶促反应或非酶促反应机制进行调节。巴豆酰辅酶A被认为是发生巴豆酰化修饰的供体,其短链脂肪酸合成来源于巴豆酸盐。改变细胞内巴豆酸盐的浓度,或者调节巴豆酰辅酶A的酶都会影响巴豆酰辅酶A的浓度,从而影响巴豆酰化修饰水平。Sabari等发现加入外源性巴豆酸盐后,会引起细胞内巴豆酰辅酶A的丰度显著上升,同时组蛋白和非组蛋白上的巴豆酰化修饰水平也显著上调,证实了细胞内巴豆酰化修饰水平与巴豆酰辅酶A的密切联系[21]。酰基辅酶A合成酶短链家族成员2(acyl-CoA synthetase short-chain family member 2,ACSS2)能够将细胞代谢活动产生的巴豆酸转化为巴豆酰辅酶A,当ACSS2被敲除后,会导致细胞内巴豆酰辅酶A丰度和组蛋白巴豆酰化修饰水平降低,表明细胞内产生的巴豆酸是巴豆酰辅酶A合成的内源性来源[13,21]。Fang等研究结果表明,酰基辅酶 A 脱氢酶短链(acyl Coenzyme A dehydrogenase short-chain,ACADS)和酰基辅酶A氧化酶(acyl Coenzyme A Oxidase,ACOX3)在mESC分化过程中也会影响巴豆酰辅酶A的产生[16]。作为一种巴豆酰辅酶A水合酶,CDYL1能够将巴豆酰辅酶A转化为β-羟基丁酰辅酶A,从而完成对H3K9巴豆酰化修饰的抑制作用[22]。这一发现证明巴豆酰辅酶A在生物体内具有促进和调节巴豆酰化修饰的作用,但是针对巴豆酰辅酶A的具体调控机制,仍需进一步的研究。
除了巴豆酰辅酶A外,最近研究发现在细胞内巴豆酰化修饰调控过程中,存在功能不同的调节蛋白使修饰过程处于一种动态的平衡,其中包括能够将巴豆酰基团添加到底物蛋白上的巴豆酰转移酶(也称阅读器,writer),能去除蛋白上巴豆酰基团的去巴豆酰化酶(也称擦除器,eraser),以及能够识别蛋白上发生巴豆酰化修饰位点的巴豆酰化识别蛋白(也称识别器,Cr reader),见图1C。Writer能够催化巴豆酰化修饰的发生,Sabari等首先报道了组蛋白乙酰转移酶p300同时具有催化组蛋白巴豆酰化修饰的作用[21];另一种组蛋白乙酰转移酶 KAT8(MOF)也被证明具有writer的活性,能够催化组蛋白 H3K4、H3K9、H3K18、H3K23、H4K8和H4K12 上的巴豆酰化修饰[23];此外,Kollenstart等发现Gcn5和Esa1在出芽酵母中能形成Gcn5-Ada2-Ada3(ADA)和Esa1-Yng2-Epl1(Piccolo NuA4)两种复合体,分别催化组蛋白H3和H5的N末端的巴豆酰化修饰[24]。Eraser能够去除巴豆酰化的共价修饰,与writer共同调控巴豆酰化修饰的动态平衡,目前已经被报道的eraser包括HDAC家族蛋白(HDAC1、HDAC2、HDAC3)[25]、Sirtuins家族蛋白(SIRT1、SIRT2和SIRT3)[26],在mESC中,Fang等敲减HDAC1和HDAC2后细胞内整体组蛋白巴豆酰化水平提高,去巴豆酰化酶活性大大降低,提示HDAC1和HDAC2可能发挥了eraser的功能[16]。Reader具有一些特定结构域,能够识别巴豆酰化的修饰位点,参与转录调控过程。YEATS、Bromodomain和double-PHD(DPF)是识别酰化修饰的三类经典结构域,在此基础上,Andrews首先确认了含有YEATS结构域的转录起始因子TFIID14(Taf14)是巴豆酰化修饰的reader之一[27]。其他几种含有YEATS 结构域的蛋白质,包括AF-9同源物(Yaf9)、ENL、AF-9,以及含有DPF结构域的 DPF2也被证实能够识别巴豆酰化修饰[28-29]。
3 巴豆酰化与恶性肿瘤
作为一种新发现的翻译后修饰,巴豆酰化已经被证实与多种人类疾病有关。在恶性肿瘤中,研究人员发现参与调控巴豆酰化修饰的基因在多种恶性肿瘤组织中均有显著性的表达差异,见图2,这表明巴豆酰化修饰在恶性肿瘤中具有潜在的影响。
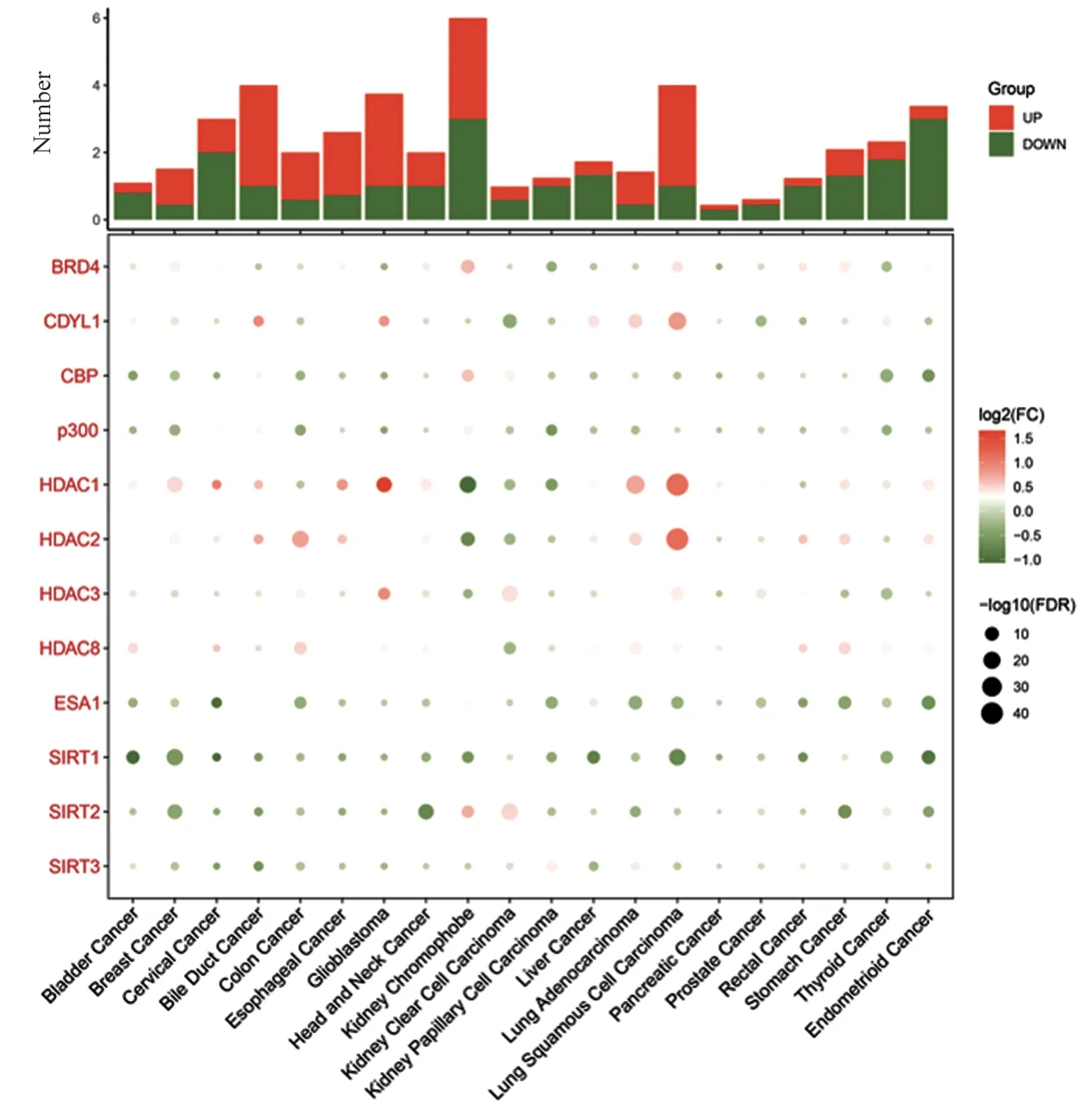
图2 泛癌中巴豆酰化修饰调控因子的mRNA表达情况Figure 2 mRNA expression of regulatory factors of crotonylation in pan-cancer
3.1 肝细胞肝癌
作为全球死亡率第三的癌症类型,肝细胞肝癌(hepatocellular carcinoma,HCC)的恶化与DNA甲基化和翻译后修饰等表观遗传调控机制密切相关。为了探讨巴豆酰化修饰在HCC中的作用机制,Wan等通过敲除HDAC1和HDAC3,并使用TSA对Huh-7肝癌细胞系进行处理,提高细胞中整体巴豆酰化修饰水平,证实提高修饰水平可以抑制HCC细胞的增殖和侵袭能力,表明巴豆酰化能够作为抑制因素抑制HCC的进展[14]。Zhang等研究发现,小鼠体内酰基辅酶A氧化酶 2(Acox2)的缺失可以通过下调几种代谢酶和过氧化物酶的巴豆酰化修饰水平,从而破坏代谢稳态,最终诱发小鼠肝癌的发生[30]。尽管还没有其他研究可以进一步证明巴豆酰化能够直接影响肝细胞癌,但是一些参与修饰调控的关键蛋白被证实在HCC的发生和发展中发挥了重要作用。Cai等的研究中,p300被证实能够通过促进乙酰化修饰,进而调节糖酵解来影响HCC的进展[31]。作为eraser之一的SIRT3,也被证实能够降低HCC的抗药性,从而提高索拉非尼的治疗效果[32]。考虑到p300等参与调控修饰的蛋白同时对乙酰化修饰具有调控作用,所以这些蛋白在HCC中的功能还需要进一步研究来验证。
3.2 结直肠癌
巴豆酰化修饰在人体内小肠上皮组织中异常丰富,尤其在小肠和结肠的隐窝部分,这可能是由于人体肠道中的微生物群落对食物发酵降解后产生巴豆酸导致。在使用抗生素消耗小鼠肠道中的细菌群落后,肠腔内和血清内的巴豆酸会出现显著性的下降,并导致结肠中HDAC2表达上调及组蛋白巴豆酰化水平的降低。进一步研究发现,发生在组蛋白H3K18的巴豆酰化修饰是肠道中最丰富的巴豆酰化修饰类型,发生修饰的位点大多富集于癌症相关的信号通路,提示巴豆酰化修饰的异常水平可能与结直肠癌有关[33]。在体外细胞实验中,Liao等使用巴豆酸对结直肠癌细胞系进行处理后,证实了巴豆酸能够抑制p53活性,促进结直肠癌细胞的增殖[19]。Hou等的研究结果表明,在结直肠癌组织中ENO1的K420Q位点会发生高频率的巴豆酰化修饰,进一步的研究表明ENO1的K420Q修饰与结直肠癌的增殖、侵袭和转移有关[34]。Huang等通过对p300敲除的结直肠癌HCT116细胞系进行全局定量分析后,发现32个发生巴豆酰化修饰的蛋白与癌基因相关,其中6种p300靶向修饰的蛋白均为癌基因编码蛋白,这些发现证明p300及其调控的巴豆酰化修饰在结直肠癌中具有潜在的研究意义[35]。这些研究成果证明巴豆酰化修饰对结直肠癌的发生和进展具有重要的调控意义,为研究人员进一步开发靶向巴豆酰化修饰的治疗药物提供了基础。
3.3 宫颈癌
巴豆酰化对宫颈癌的调控作用在最近的研究中也得到了的证实。在干扰p300的表达后,Han等通过研究发现,HNRNPA1蛋白的巴豆酰化修饰和表达水平均出现显著下降,加入巴豆酸盐后能够恢复修饰水平并促进HNRNPA1蛋白的表达,增强了Hela细胞的增殖、侵袭和迁移能力[36]。其他巴豆酰化调控蛋白,SIRT1[37]、SIRT2[38]和SIRT3[39]均被证实在宫颈癌中具有调控作用,但尚未证实巴豆酰化修饰在这些蛋白调控过程中的具体作用机制,因此需要更多的实验验证巴豆酰化修饰在宫颈癌中的调控机制。
3.4 前列腺癌
在前列腺癌中,Xu等的研究发现癌组织中的巴豆酰化水平要高于癌旁组织,并且与前列腺癌的临床分期相关。研究人员使用BRD4抑制剂I-BET762对肿瘤细胞系处理后,I-BET762能够明显抑制前列腺癌细胞系的增殖和迁移。当加入巴豆酸盐后,I-BET762对肿瘤细胞的抑制作用明显减弱。通过进一步的研究发现,BRD4被抑制后,细胞内p300的表达水平以及整体巴豆酰化水平均下降,表明BRD4可能通过p300影响细胞内的巴豆酰化修饰水平,调控前列腺癌细胞的增殖和迁移能力,这一研究成果提示了巴豆酰化能够作为前列腺癌的潜在治疗靶点[40]。研究人员使用I-BET762对细胞进行处理时,HDAC家族的蛋白表达水平并未出现明显的变化,表明在前列腺癌中巴豆酰化并非是通过HDAC影响修饰调控。
3.5 其他类型癌症
巴豆酰化修饰在其他恶性肿瘤中的作用还需要更广泛、更深入的研究来探索。Gao等的研究结果表明,在急性淋巴细胞白血病细胞模型中,能够检测到组蛋白H4K5和H4K8上的巴豆酰化修饰水平发生了显著变化,并且这一变化受脂肪酸合成和β-氧化作用的调节[41]。作为识别巴豆酰化修饰的重要结构域之一,YEATS结构域与多种恶性肿瘤的进展有关[42-43],目前已有多种靶向结合YEATS结构域的抑制剂应用在恶性肿瘤治疗领域[44-45],这为进一步开发巴豆酰化修饰相关的肿瘤治疗药物提供了可能。
4 讨论和展望
自2011年赵英明教授的团队首次证实巴豆酰化修饰存在以来[8],越来越多的研究表明无论在发育生物学还是基础医学研究领域,巴豆酰化修饰都发挥了重要的作用,参与调节了从基因表达到端粒功能维持的多种生物学功能。然而由于参与巴豆酰化修饰的修饰转移酶、去修饰酶和修饰识别蛋白尚未完全明确,巴豆酰化修饰在生物体内调节生理功能的具体机制仍不清楚。此外,修饰位点的多样性使巴豆酰化不仅能够发生在组蛋白上,在其他非组蛋白的赖氨酸残基中也可以检测到巴豆酰化修饰的信号,修饰位点的随机性和多样性增加了研究人员理解巴豆酰化修饰作用机制的难度。令人振奋的是,随着深度学习技术在蛋白质修饰组学研究领域的应用和发展,不断有新的预测工具被开发出来,能够帮助寻找巴豆酰化修饰位点[46-47]。
由于肠道菌群产生的巴豆酸在人体消化系统中广泛存在,巴豆酰化修饰在消化道肿瘤微环境和肿瘤细胞中的影响受到越来越多的关注[33]。消化道内高浓度的巴豆酸可以通过巴豆酰化修饰调控转录水平和蛋白活性,从而影响恶性肿瘤的进展已经得到证实,这表明针对巴豆酸和巴豆酰化修饰开发肿瘤治疗药物也成为了一种可能。不仅如此,随着高通量检测技术的发展,相信越来越多的巴豆酰化修饰调节酶会被鉴定出来,巴豆酰化修饰在非消化道肿瘤中的作用机制也将被揭示。因此,接下来的研究应当更加集中地探索巴豆酰化修饰的调节因子,帮助我们全面系统地认识巴豆酰化在恶性肿瘤以及其他疾病中的发生和作用机制,为开发新的肿瘤靶向治疗药物提供理论基础。
