18F⁃FDG PET/CT 影像组学预测晚期非小细胞肺癌化疗预后的价值
2023-03-07李雪艳王大维于丽娟
李雪艳,王大维 ,于丽娟,陈 璐,潘 登
(海南省肿瘤医院医学影像部,海南 海口 570311)
肺癌是当前全球最重要的公共卫生问题之一,是发病和死亡风险最大的恶性肿瘤[1]。非小细胞肺癌(non‑small cell lung cancer, NSCLC)约占肺癌总量的80%[2],其细胞增殖速度通常较迟缓,且病情发展不明显,在发病后往往容易错失根治性治疗的优良时机。统计表明,大约75%的NSCLC 病人就诊时已处于中晚期,5 年生存率极差[3]。尽管肺癌治疗方法不断多样化,传统细胞毒性化疗仍然是NSCLC 患者全程管理特别是辅助治疗中的主要手段,因此,寻找能够预测化疗疗效的分子标志物,建立有效的预后模型来无创地评估NSCLC 患者的生存,筛选可能从化疗中受益的靶向人群等都是亟待解决的问题。
PET 代谢影像组学不仅融合了传统医学影像、基因组学及临床各类大数据,同时把影像组学的基本概念和临床诊断方法进行融合。其更具优势之处在于通过计算机得到了高维信息,使PET 图像内的微观信息在宏观影像上的数据化成为可能。本研究通过计算机技术深度挖掘多模态18F‑脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT 数据,预测晚期NSCLC 化疗敏感性,建立并筛选优势预后模型。
1 材料与方法
1.1 一般资料
选取本院2017 年9 月~2021 年4 月期间行18F‑FDG PET/CT 检查的146 例晚期NSCLC 患者作为研究对象。入组要求为:(1)初次诊断,支气管镜咬检或细针穿刺病理确诊为NSCLC;(2)临床分期为Ⅲ、Ⅳ期;(3)接受PET/CT 检查,并在之后进行了至少两周期的化学药物治疗;(4)PET/CT 影像清晰,且不伴有可能影响图像分析的其他肺部疾病;(5)既往或目前无其他恶性肿瘤;(6)病例资料完整可追踪。查阅入组病例的临床数据,包括年龄、性别、吸烟状况、病理类型、血清肿瘤标志物、化疗方案及周期数以及是否接受过放疗等。
随访患者的无进展生存期(Progression‑free survival, PFS)。PFS 定义为患者初始治疗开始到检查发现任何原因的进展、复发或死亡之间的时间。通过我院云平台病案系统或电话随访,所有病例自初始治疗之日开始随访,均随访至死亡或截止日期(2022 年4 月20 日),中位随访时间为8.6(范围:2.8~57.6)个月。
1.2 PET/CT 显像及影像参数收集
所有受检者检查前禁食4~6 h,并检查外周血血糖(<150 md/dL 为正常)。使用GE Discovery 710 PET/CT 仪,显像剂18F‑FDG 由GE Qilin 回旋加速器设备和化学合成系统制备,放化纯度超过95%。显像剂静脉注射量为5.5~7.4 MBq/kg, 注射后嘱受检者休息1 h 后行全身扫描、图像重建、衰减校正、图像融合。使用PET VCAR 软件收集肺癌形态学参数及代谢参数。形态学参数主要包括:肿块大小、部位、密度、邻近支气管情况、内部及边缘情况等;代谢参数如下:原发灶最大标准化摄取值(maximum standardized uptake value, SUVmax)、原发灶和全身肿瘤代谢体积(metabolic tumor vol‑ume, MTV)及病灶糖酵解总量[total lesion glycoly‑sis, TLG;TLG= 平 均SUV(mean SUV, SU‑Vmean)×MTV]。在测定或计算原发灶MTV 和TLG 时我们同时使用30% SUVmax、40% SUV‑max、50% SUVmax 为阈值得出多组数据,而全身MTV(MTVwb)和全身TLG(TLGwb)使用原发灶40% SUVmax 为阈值。
1.3 VOI 勾画及PET/CT 组学特征提取
将全部病例PET/CT 图像输出至Lifex 软件(版本6.20),并由两名经验丰富的核医学医生进行阅片及分析。在PET 图像中逐层描绘病变的感兴趣区(Region of interest,ROI),直至ROI 涵盖全部肿瘤部位;以42% SUVmax 为优化阈值,半自动获得三维感兴趣体积(Volume of interest,VOI),并提取原发灶PET 影像组学特征。应用ITK‑SNAP 3.8应用软件勾画并提取CT 组学特征。在勾画ROI时,应在尽量避开周围血管和内部坏死区基础上,完整包含整个病灶。在上述VOI 内提取形态、灰度统计、纹理和小波特征。
1.4 组学特征筛选及预后模型构建
为了避免组学模型过度拟合,在创建模型前对组学特征做降维处理。通过最小绝对收缩和选择算子(Least absolute shrinkage and selection opera‑tor,LASSO)方法在训练组中筛选优势特征用于创建组学模型。将上述特征通过相应的系数加权,再利用公式得到每个病例的放射组学评分(Rad‑score,RS)。为了模拟常规的临床决策过程,将组学特征和多因素Cox 回归后有预测价值的临床参数进行综合,形成复合预测模型。并通过受试者工作特征 曲 线(Receiver operating characteristic curve,ROC)来评估模型效能。
1.5 统计学处理
根据PFS 中位数将全部病例分为高风险组和低风险组,训练组中,应用秩和检验初步分析两组间存在明显差异的影像组学特征。应用支持向量机(support vector machine,SVM)的机器学习技术对LASSO 算法筛选出的最佳特征进行分类,随机抽取 80%的数据建立模型,其余20%作为测试集。临床预后模型通过单因素和多因素Cox 风险比例回归模型加以分析。利用ROC 曲线计算模型的AUC、敏感性和特异性。所有检验结果均为双侧检验,P<0.05 为差异具有统计学意义。以上数据使用python 软件及SPSS26.0 软件进行分析。
2 结果
2.1 入组患者的一般资料
本研究入组病例中位PFS 是7.1(范围:0.8~55.6)个月,以7.1 为界将全组病例分为两组,PFS≥7.1 个月者划为低风险组,PFS<7.1 个月者划为高风险组。将最终纳入研究的146 例NSCLC 患者按照8:2 的比率随机分为训练组(n=116 例)和测试组(n=30 例)。训练组116 例病例年龄范围31~79岁,平均年龄(58.6±9.7)岁。测试组30 例病例年龄范围42~80 岁,平均年龄(58.2±10.7)岁。采用卡方检验验证训练组和测试组中基线特征分布基本均衡(χ2=0.019~2.429,P=0.144~1.000),所有患者一般资料详见表1。

表1 146 例晚期NSCLC 患者临床病理参数表Tab1 Clinicopathological parameters of 146 patients with advanced NSCLC
2.2 影像组学特征的筛选与预后模型创建
使用LIFEx 6.20 和ITK‑SNAP 3.8 勾画肿瘤VOI,然后使用python 从每个原发灶中提取了1017个影像组学特征参数,并通过Wilcoxon 秩和检验在训练组中选择出具有显著差异的特征,共得到47 个特征,包括6 个PET 特征及41 个CT 特征。为了防止组学模型过度拟合,使用LASSO 算法行进一步行特征降维过滤,并通过十倍交叉检验选取最佳预测参数。最终共筛选出4 个组学特征(2 个PET 特征和2 个CT 特征),分别是original_firstorder_90Percentile(OF90P)、 wavelet ‑ LHH_firstorder_90Percentile(WLF90P)、wavelet‑HHL_firstorder_10Percentile (WHF10P)和NGLDM_Coarseness,特征的系数分别是−0.056,0.048,−0.004,−0.074。LASSO 特征筛选过程如图1 所示。通过下列公式计 算 每 个 病 人 的RS:RS= −0.056×OF90P+0.048×WLF90P − 0.004×WHF10P − 0.074×NGLDM_Coarseness。ROC结果显示:影像组学模型在训练组中预测NSCLC PFS 的AUC 为0.746,测试组为 0.622(图2)。

图1 LASSO 特征筛选 (1A、1B 代表影像组学特征筛选过程,1C 代表LASSO 后系数权重)Fig1 Feature selection using the LASSO method

图2 影像组学特征预测NSCLC 患者PFS 的ROC 曲线Fig2 ROC curves of radiomics features to predict PFS of NSCLC patients
2.3 临床预后模型及复合预后模型的构建
本研究通过COX 多因素分析共纳入了3 种与NSCLC 患者PFS 相关的临床影像特征,分别是病理 类 型[Hazard Ratio:0.596(95%CI:0.364~0.913),P=0.019])、临床分期[Hazard Ratio:0.626(95%CI:0.429~0.912),P=0.015]及 MTV30[Hazard Ratio:0.158(95%CI: 0.044~0.573),P=0.005]。将RS 与临床模型结合,得到预测PFS 的复合预测模型。通过ROC 曲线比较临床模型、影像组学模型及复合模型3 者对NSCLC 患者PFS 的预测能力,其各自的ROC 曲线下面积为0.746、0.753、0.716(图3),以影像组学的模型诊断效能最高,其灵敏度及特异度分别为0.663 及0.833(表2)。Delong检验验证影像组学模型与复合模型(Z=1.777,P=0.076)及临床模型(Z=0.323,P=0.747)间的预测效能无统计学差异。
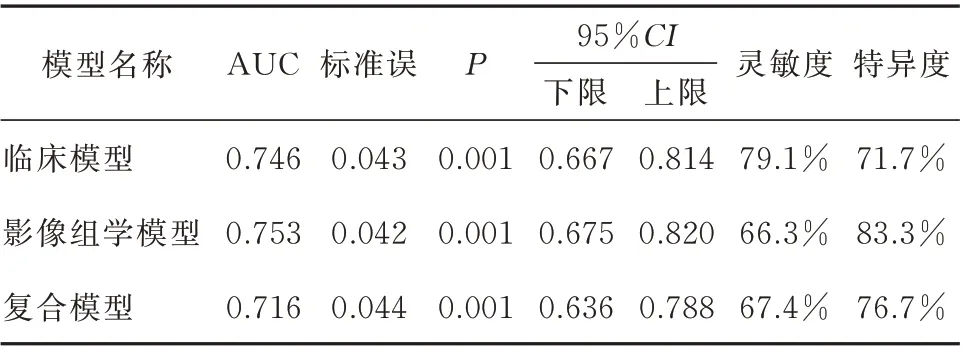
表2 临床模型、影像组学模型及复合模型的预后效能Tab2 Prognostic efficacy of imaging model, Radiomics model and composite model
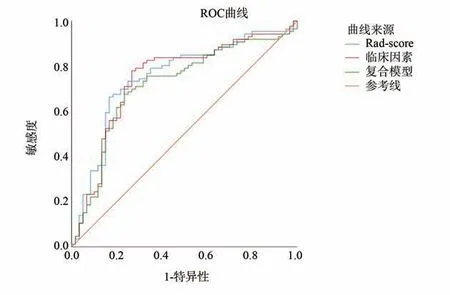
图3 临床模型、影像组学模型及复合模型的ROC 曲线Fig3 ROC curves of clinical imaging model, Radiomics model and composite model
3 讨论
肺癌是严重危害人类生命健康的恶性肿瘤,预后影响因素众多,构建有效的预后模型来评估肺癌患者的生存,无创地为肺癌精准治疗提供客观依据,具有重要临床意义。然而,目前在大量相关生物标志物的研究中,仅有少数标志物表现临床应用潜能[4]。影像组学基于计算机技术图像特征分析,是新兴的、飞速发展的研究方法,并于本世纪初开始逐渐运用于核医学领域,主要对PET 图像中肿瘤内部异质性进行研究。大量研究表明PET/CT 影像组学在鉴别肺结节良恶性、肺癌病理分型、基因突变及分子表型等方面超越传统CT、PET/CT 图像的视觉评估,表现出更精准的诊断效能[5‑8]。
PET/CT 影像组学技术在肺癌预后方面的相关研究证实CT 和PET 两种成像模式均可得到肿瘤预后相关组学特征参数,并对肺癌预后评估有一定 预 测 价 值[9‑13]。Oikonomou 等[11]发 现 仅 用SUV‑max 不能有效预测放疗后肺癌患者的总生存期,而结合影像组学特征后预测价值大大提高。国内赵新明主任团队通过对300 例NSCLC 患者进行影像组学分析,分别构建影像组学模型、临床预测模型及二者相结合的复合模型,结果显示组学模型的RS和复合模型得分均是预测NSCLC 患者总生存期的独立预后因子[14]。本研究通过ROC 曲线评价三种预后模型的效能,结果显示影像组学模型的AUC最大(0.753),诊断效能最高。将该模型在验证中进行验证,结果曲线下面积为0.622,效果仍较为理想。在传统临床参数的COX 多因素分析中,仅病理类型、临床分期及MTV30 是预测NSCLC 患者PFS的独立预后因子,而SUVmax 及其他阈值相应的MTV 和TLG 均与预后无明确相关,以上结果与多数研究结果相似,也进一步说明影像组学特征较传统影像参数在预测NSCLC 预后方面效能更佳。
然而,目前关于PET/CT 影像组学预测NSCLC 疗效及预后的研究仍相对较少。影像组学研究要求相对较大的样本量,而大部分单中心研究往往难以满足组学分析对样本量的要求,故大部分研究在设计纳入标准时往往比较宽泛,并未对入组患者进行科学的分组分层。众所周知,肿瘤的分期和治疗手段对患者的预后影响巨大,如将不同分期和接受不同治疗方式的患者进行同层分析,结果难免会产生偏倚。故本研究设置了相对严格的入组标准:所有患者均为不可手术的晚期NSCLC,且治疗手段均以化疗为主,同时,综合考虑了临床病理因素的干扰,在此基础上进行生存分析,以获取预测晚期NSCLC 化疗预后的独立预测因子并建立预后模型。
放射组学特征提取是放射组学研究中的一个关键环节。理论上,对整个肿瘤的立体分析要比最大横截面分析更能体现肿瘤的异质性。因此,本研究在三维VOI 中进行组学特征提取,并以42%SU‑Vmax 为优化阈值,以尽可能避免SUVmax 固有噪声、变异性、背景摄取及部分容积效应等的干扰[15]。PET/CT 图像特征和RS 都来自原始图像,但它们代表了两种不同的图像分析方法。传统的影像判读是对影像特征的宏观观察,具有主观性,易受到医师经验的影响。放射组学技术能够以无创的方式来揭示与肿瘤异质性相关的微观特征,并对其进行量化,但亦受其计算的复杂性和缺乏标准化的限制。因此,将两种影像学分析方法以及临床因素整合到一个复合模型中,可能为NSCLC 患者做出更好的决策。然而,本研究发现虽然组学模型的预测效能优于其他两种模型,但3 种模型的Delong 检验结果并无统计学差异。分析出现该结果的原因,可能有以下两个方面:(1)回顾性小样本研究,数据存在一定程度偏移;(2)SUV 优化阈值的选取对ROI形状和大小影响巨大,进而干扰组学特征提取[15‑17]。以上两方面也是本研究的局限性所在。因此,我们的目标是在前瞻性多中心临床试验中对模型进行验证,以提高数据的稳定性和可重复性。
近年来NSCLC 的靶向治疗和免疫治疗发展迅猛,大 大 提 高 了 特 定 人 群 的 生 存 预 后[18‑20]。针 对EGFR、ROS1 融合基因、MET 基因扩增、BRAF 突变基因靶点的靶向治疗药物正在精准地为NSCLC病人提供更多的生存获益。与此同时,免疫治疗也在不断变革着晚期NSCLC 的诊疗模式,尤其针对传统化疗和靶向治疗出现耐药的病例。基于此,本研究下一步将针对不同基因组和免疫表达组间影像组学预后效能进行深度研究和剖析,以期为更加精准的个性化治疗提供依据。
综上所述,PET/CT 影像组学模型对晚期NSCLC 的化疗预后具有较好的预测价值。作为一种非侵入性和定量的方法,放射组学特征可能成为一种潜在的生物标志物,为NSCLC 患者的个性化治疗提供一种传统临床和影像学预测模式的补充,但在临床实践中广泛应用之前,尚需要进一步的验证。
作者贡献度说明:
李雪艳:试验方案设计、论文撰写与修改;王大维:负责论文审阅及图片处理;于丽娟负责写作指导;潘登:负责入组患者临床数据收集;陈璐:负责图像分析及影像组学分析。
所有作者声明不存在利益冲突关系。
