miR-767-5p通过调控TBL1XR1蛋白表达抑制人卵巢癌细胞系侵袭
2023-03-04冷海娜王晓栋张学友李洪利
冷海娜,张 艳,王晓栋,张学友,李洪利
1.潍坊市妇幼保健院 妇科,山东 潍坊 261000;潍坊医学院 2.生命科学与技术学院; 3.基础医学院,山东 潍坊 261000
卵巢癌(ovarian cancer)是发生于卵巢或输卵管的上皮细胞癌,是女性第七大常见癌和第八大常见癌死亡原因,5年生存率低于45%[1]。每年卵巢癌确诊的病例数量仍不断增加,因此探索卵巢癌发生发展的过程,寻找相关的分子靶标尤为重要。
微小RNA(microRNA,miRNA)是一类长度约为20个核苷酸的小分子RNA,已有报道证实miRNA可通过调节靶基因或者受其他非编码RNA调控发挥作用[2]。本研究选择的miR-767-5p已被证能影响胶质瘤、肝癌和胃癌等肿瘤进展[3],但在卵巢癌中的研究尚未见报道。
转导素β1X连锁受体蛋白1(transducin beta-like 1 X-linked receptor,TBL1XR1)与转导素β1(TBL1)家族蛋白具有高度同源性[4]。TBL1XR1在细胞增殖、凋亡、炎性反应和转录激活中发挥重要作用,目前相关的研究主要集中在TBL1XR1在癌进展中的作用及机制[5]。例如TBL1XR1可通过PI3K/AKT途径诱导胰腺导管腺癌细胞增殖并抑制细胞凋亡[6];TBL1XR1经miR-186-5p负调控从而促进骨肉瘤细胞的迁移和侵袭[7]。
综上所述,miR-767-5p与TBL1XR1在卵巢癌进展中可能发挥重要功能,但其作用机制尚不明确,亟待进一步探究和阐明。
1 材料与方法
1.1 材料
1.1.1 细胞:人卵巢癌细胞系OC3、SKOV-3、HO-8910、人正常卵巢上皮细胞系IOSE80,实验所用细胞购自ATCC(American type culture collection),细胞均已通过细胞检测。
1.1.2 试剂:β-actin、TBL1XR1抗体(Abcam公司);反转录试剂盒及SYBR Green real-time PCR Master Mix(杭州博日科技股份有限公司);实验所用质粒(上海吉凯基因医学科技股份有限公司)。
1.2 方法
1.2.1 收集数据库中miR-767-5p及TBL1XR1相关数据进行分组处理及进一步分析:GEO(http://www.ncbi.nlm.nih.gov/geo/); miRPATH(http://snf-515788.vm.okeanos.grnet.gr/);miRDB(http://www.mirdb.org/);TargetScan(http://www.targetscan. org/);miRTarBase(http://mirtarbase.mbc.nctu. edu.tw/);miRWalk(http://mirwalk.umm.uni-heidelberg.de/);Open Target Platform(https://www.targe-tvalidation.org/);THPA(https://www. proteinatlas. org/);GEPIA(http://gepia.cancer-pku. cn/);microT-CD(http://diana.imis.athena-innovation.gr/DianaTools/index.php?r=microT_CDS/index)。
1.2.2 细胞的培养及转染:将OC3、SKOV-3、HO-8910细胞、IOSE80细胞,置于5% CO2、37 ℃培养箱培养。瞬时转染实验依照Lipofectamine 2000说明书操作。转染细胞分组如下: 1)SKOV-3(未处理);2)SKOV-3/Ctrl(转入miR-767-5p过表达对照质粒);3)SKOV-3/miR-767(转入miR-767-5p过表达质粒);4)SKOV-3/TBL1XR1(转入TBL1XR1过表达质粒);5)SKOV-3/miR-767+TBL1XR1(转入miR-767-5p过表达和TBL1XR1过表达质粒)。
1.2.3 RT-qPCR检测质粒转染是否成功:Trizol法提取各组细胞总RNA,以2 μg RNA为模板进行反转录。反转录获得cDNA后,采用荧光定量PCR试剂盒(SYBR Green I染料,U6为内参)进行RT-qPCR,结果分析采用2-△△Ct。miR-767-5p上游引物:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAG TTGAGCATGCTCAG-3′,下游引物:5′-ACACTCCAG CTGGGTGCACCATGGTTGTCTGAG-3′;U6上游引物5′-TCCGATCGTGAAGCGTTC-3′,下游引物5′-GTGC AGGGTCCGAGGT-3′。
1.2.4 双荧光素酶报告基因实验验证靶向关系:将TBL1XR1的 PCR产物克隆到pGL3载体中,构建pGL3-TBL1XR1-3-UTR-MUT和pGL3-TBL1XR1-3-UTR-WT质粒,将SKOV-3细胞培养于24孔板中。100 ng的pGL3-TBL1XR1-3-UTR-MUT 和 pGL3-TBL1XR1-3-UTR-WT用Lipofectamine 2000将miRNA对照及过表达载体分别共转染SKOV-3细胞。48 h后获得细胞,双荧光素酶检测系统测定荧光素酶活性。
1.2.5 Western blot检测相关蛋白质的表达:将各组细胞提取总蛋白质,电泳、转膜、封闭、一抗孵育、4 ℃过夜、次日二抗孵育、X胶片曝光,最后使用Image J软件进行灰度值分析。抗体浓度:β-actin(1∶1 000);TBL1XR1(1∶1 000)。每组实验均重复3次。
1.2.6 Transwell 小室法检测细胞侵袭能力:实验方法见参考文献[8],实验完成后将小室置高倍镜(400×)下观察,随机选取5个高倍镜视野,分别计数穿过基质胶的细胞数,实验重复3次,取均数作为实验结果。
1.3 统计学分析
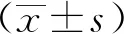
2 结果
2.1 卵巢癌相关数据集的筛选及分析
GSE65819中microRNA(normal vs primary tumor)的总体表达情况和良好的区分度(图1A);选择低表达的miR-767-5p作为研究对象(图1B)发现miR-767-5p可靶向调节的基因在多种基因表达调节和癌相关通路中发挥作用(图1C);相较于正常卵巢上皮细胞系(IOSE80),miR-767-5p在卵巢癌细胞系(OC3、SKOV-3、HO-8910)中表达显著降低(图1D,E)。
A,B.microRNA in GSE65819 was analyzed and miR-767-5p was selected;C.miR-767-5p targeted regulation of genes was associated with the development of a variety of cancers;D.miR-767-5p expression was significantly decreased in ovarian cancer cell lines (OC3, SKOV-3, HO-8910); *P<0.05 compared with IOSE80
2.2 靶蛋白的预测、筛选以及表达情况
预测miR-767-5p可结合的靶基因,并取交集,最后得到14个靶基因(图2A);TBL1XR1与多种女性疾病有密切联系,尤其是乳腺癌和卵巢癌(图2B);除此之外,TBL1XR1在卵巢癌中呈现明显的高表达(图2C)。

A.target genes that could bind to miR-767-5p were predicted;B.TBL1XR1 was strongly linked to breast and ovarian cancer;C.TBL1XR1 was highly expressed in ovarian cancer
2.3 TBL1XR1在卵巢癌中高表达
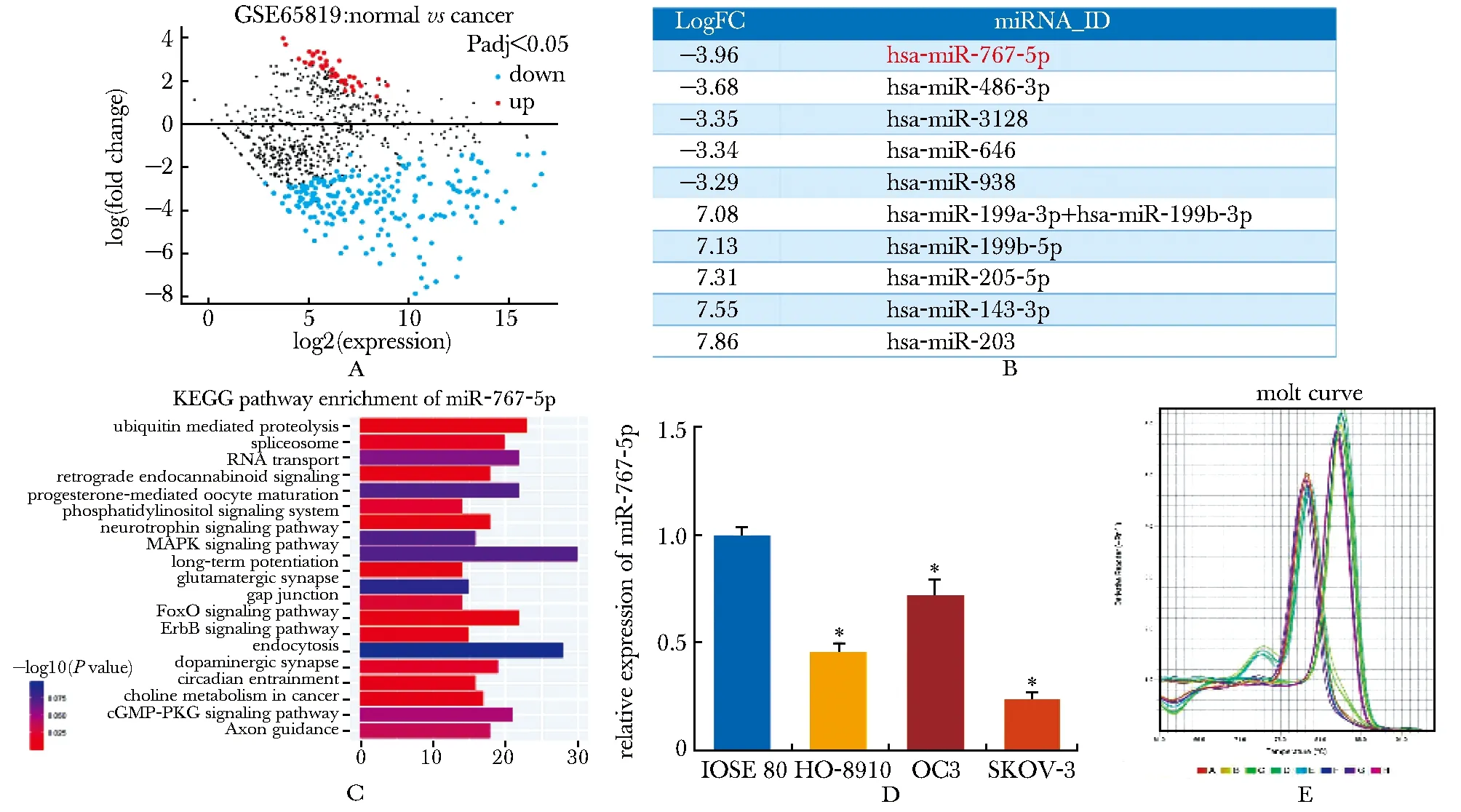
TBL1XR1高表达与预后不良有关(P<0.05)(图3A);同时,TBL1XR1在卵巢癌组织中呈现高表达(图3B);相较于正常卵巢上皮细胞,TBL1XR1在卵巢癌细胞系中高表达(图3C,D)。
A.high expression of TBL1XR1 was associated with poor prognosis;B.TBL1XR1 was highly expressed in ovarian cancer tissues;C,D.Western blot showed that TBL1XR1 was highly expressed in ovarian cancer cell lines; *P<0.05 compared with IOSE80
2.4 miR-767-5p与TBL1XR1靶向结合
双荧光素酶实验结果表明,TBL1XR1 mRNA 的 3′-UTR 是 miR-767-5p 的直接结合位点(P<0.05)(图4)。

*P<0.05 compared with TBL1XR1-WT
2.5 miR-767-5p通过调节TBL1XR1抑制卵巢癌细胞侵袭
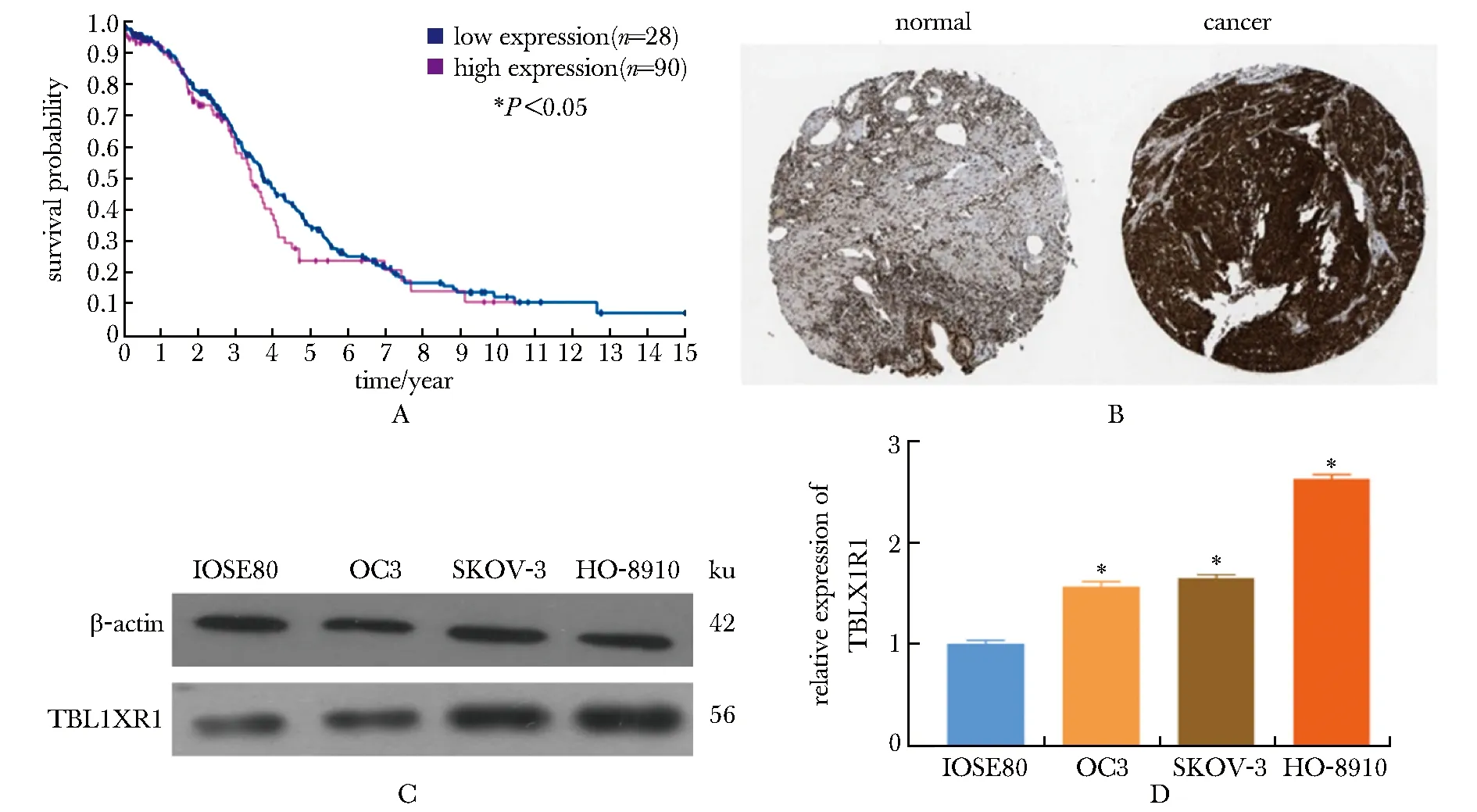
过表达TBL1XR1后,TBL1XR1表达量显著提高;而同时过表达miR-767-5p后可在一定程度上减弱这种促表达作用(图5A,B)。相较于对照组,过表达miR-767-5p后细胞侵袭能力明显降低,而共转染miR-767-5p和TBL1XR1过表达质粒后,可在一定程度上减弱过表达miR-767-5p后对卵巢癌细胞侵袭能力的抑制(P<0.05)(图5C,D)。
A,B.Western blot was used to detect TBL1XR1 expression after over-expression of miR-767-5p; *P<0.05 compared with Ctrl.C,D.invasiveness of miR-767-5p and TBL1XR1 cells after over-expression was detected by Transwell cell assay; *P<0.05 compared with SKOV-3/Ctrl
3 讨论
卵巢癌是女性生殖系统常见的恶性肿瘤。卵巢癌的临床治疗方法主要包括手术和化疗,但化疗后常出现耐药现象,限制了临床治疗效果,且复发率较高。因此,研究卵巢癌侵袭转移的分子机制,寻找卵巢癌相关的分子标志物,对于卵巢癌的诊断和治疗具有重要意义。
有研究证明miRNA能够抑制或促进卵巢癌进展,例如miR-636[9]和miR-141[10]等。现已有研究指出,miR-767-5p可经lncRNA、circRNA靶向调节从而影响下游靶基因的表达,以此发挥功能。例如miR-767-5p可通过SOCS2/JAK/STAT信号通路促进乳腺癌进展[11];miR-767-5p具有抑制胃癌进展的作用,且受多种circRNA的调控[12]。此外,miR-767-5p也可通过调节下游靶基因的形式来影响肿瘤进展[13]。以上报道充分说明miR-767-5p较为广泛地参与了多种类型肿瘤的进展,并且发挥功能的途径具有多样性。
综合前言部分有关TBL1XR1的介绍,在筛选差异表达microRNA以及后期靶基因预测时,选择研究miR-767-5p/TBL1XR1调节轴在卵巢癌中的作用。本研究首先对GEO数据集进行筛选,选择GSE65819数据集对卵巢癌中的差异表达microRNA进行分析,最终选择差异表达倍数较高且在卵巢癌中低表达的miR-767-5p,RT-qPCR实验验证了miR-767-5p在卵巢癌细胞中呈现低表达。miR-767-5p进行KEGG分析显示miR-767-5p的靶基因参与了多种肿瘤相关的信号通路。miRDB、GEPIA数据库分析选择与多项女性生殖系统疾病相关且在卵巢癌中高表达的TBL1XR1进行后续研究。多种数据库都说明TBL1XR1在卵巢癌中很可能扮演着癌基因的角色。
但miR-767-5p和TBL1XR1在卵巢癌中具体作用机制仍不明确。双荧光素酶报告基因实验证实miR-767-5p和TBL1XR1的靶向结合。过表达miR-767-5p后可在一定程度上减弱过表达TBL1XR1的促进作用;Transwell小室法结果同样印证了这一点,相较于对照组,过表达miR-767-5p后细胞侵袭能力明显降低,而共转染miR-767-5p和TBL1XR1过表达质粒后,可在一定程度上逆转过表达miR-767-5p造成的影响。
综上,miR-767-5p能靶向调节TBL1XR1的表达抑制卵巢癌的进展。本研究结果可为卵巢癌的早期诊断以及临床治疗提供理论依据,TBL1XR1作为一种卵巢癌进展的标志物和靶向治疗位点。
