miR-425-5p靶向TGF-β1/Smad2信号通路减少小鼠增生性瘢痕组织胶原纤维沉积
2023-03-04王丽娟吴惠林
梁 艳,王丽娟,吴惠林
1.西安交通大学第一附属医院 皮肤性病科,陕西 西安 710061; 2.西安医学院第二附属医院 皮肤科,陕西 西安 710038
增生性瘢痕(hypertrophic scar,HS)是皮肤创面异常修复的结果,主要临床表现为红肿、增厚、硬化、瘙痒。增生性瘢痕的发病机制复杂,涉及多种基因的异常表达,并且一直是创伤修复和美容外科领域研究的热点和难点。MicroRNA(miRNA)是高度保守的非编码单链RNA,通过与靶基因mRNA的3′UTR区域特异性结合,从而加速mRNA降解或抑制翻译[1]。miRNA的紊乱会导致细胞周期和细胞外基质分泌异常,这与器官纤维化的发生和发展密切相关[2-3]。目前,miRNA对增生性瘢痕的调控作用受到了学者的关注[4-5]。先前已经报道过miR-425通过靶向转化生长因子-β1(transforming growth factor-β,TGF-β1)/Smad信号通路在急性呼吸窘迫综合征中抑制胶原合成及纤维化[6]。还有研究表明,表皮干细胞来源的外泌体中由于富含miR-425-5p在抑制肌成纤维细胞分化中发挥重要作用,可促进创面愈合,减少瘢痕形成[7]。然而,目前尚无文献报道miR-425-5p在增生性瘢痕形成中的确切作用。TGF-β1/Smad信号通路是影响增生性瘢痕形成的重要途径,可促进其形成,并且已经成为临床治疗的靶标[8-9]。本研究通过生物信息学软件预测TGF-β1和Smad2均是miR-425-5p的靶标。基于上述背景,本研究旨在考察miR-425-5p是否通过抑制TGF-β1/Smad2信号通路来减少增生性瘢痕形成。
1 材料与方法
1.1 材料
1.1.1 试剂:Ⅰ型胶原酶(Sigma-Aldrich 公司)。胎牛血清、DMEM(Gibco公司)。Lipofectamine 2000转染试剂、博来霉素(bleomycin,BLM)(Invitgen公司)。Masson三色染色试剂盒(北京索莱宝科技有限公司)。RNAiso Plus、PrimeScriptTMRT Master Mix、Mir-XTMmiRNA First-Strand Synthesis Kit和SYBR Premix EX Taq(TaKaRa公司)。PVDF膜(Millipore公司)。所有一抗及相应二抗(Abcam公司)。BCA蛋白质检测试剂盒、RIPA缓冲液、超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司)。miR-425-5p-mimic及阴性对照(NC-mimic)、miR-425-5p-inhibitor及阴性对照(NC-inhibitor)、过表达TGF-β1的pcDNA3.1质粒(TGF-β1-pcDNA3.1)、阴性对照(NC-pcDNA3.1)、NC-agomir和miR-425-5p-agomir(上海吉玛制药技术有限公司)。
1.1.2动物:SPF级6周龄雄性BALB/c小鼠(25~35)g(西安交通大学实验动物中心),使用许可证号:SYXK(陕)2020-005。实验小鼠均饲养于12 h光/暗循环的标准饲养室内,给予标准小鼠饲料和自来水喂养。
1.1.3 组织标本:16对增生性瘢痕组织(HS组)和正常皮肤组织(normal组)均为西安交通大学第一附属医院皮肤性病科手术标本,患者包括女性10例,男性6例,年龄为18~46岁。采集的组织样本分为三部分处理:第一部分用于总RNA的提取,第二部分用于总蛋白质的提取,第三部分用于成纤维细胞的分离。本研究内容获得西安交通大学第一附属医院伦理委员会批准(XJTU1AF2021LSK-340),所有受试患者均签署知情同意书。
1.2 方法
1.2.1 原代成纤维细胞获取:取1.1.3部分正常皮肤组织标本用0.25%的Dispaase Ⅱ消化6~8 h,分离表皮和真皮。真皮部分用含100 U/mL青霉素和100 U/mL链霉素的PBS反复洗涤,剪碎后转移到含有0.1%的Ⅰ型胶原酶(0.1 mg/mL)的溶液中,37 ℃消化处理3 h,然后沉淀成纤维细胞,并在含有10%胎牛血清、100 U/mL青霉素和100 U/mL链霉菌的DMEM中培养。收集第3~5代细胞进行实验。
1.2.2 细胞的分组和转染:根据转染类型将细胞分为以下9组:对照组(control组)、miR-425-5p-mimic组、NC-mimic组、miR-425-5p-inhibitor组、NC-inhibitor组、TGF-β1-pcDNA3.1组、NC-pcDNA3.1组、miR-425-5p-mimic+NC-pcDNA3.1组和miR-425-5p-mimic+TGF-β1-pcDNA3.1组,并按照说明采用Lipofectamine 2000转染试剂将miR-425-5p-mimic、NC-mimic、miR-425-5p-inhibitor、NC-inhibitor、TGF-β1- pcDNA3.1、NC-pcDNA3.1分别转染入成纤维细胞,control组细胞不进行转染。转染24 h后,PBS洗涤细胞,加入新鲜的完整培养基,在37 ℃、5% CO2的潮湿环境中继续培养。通过RT-qPCR和Western blot验证目的基因在基因水平和蛋白水平的表达情况。
1.2.3 双荧光素酶报告基因实验验证miR-425-5p和TGF-β1的靶向关系:由上海吉玛制药技术有限公司将TGF-β1的野生型或突变型3′-UTRs克隆到pmirGLO双荧光素酶载体中构建TGF-β1-3′-UTR-WT和TGF-β1-3′-UTR-MUT载体。将成纤维细胞与miR-425-5p-mimic或NC-mimic以及TGF-β1-3′-UTR-WT或TGF-β1-3′-UTR-MUT共转染。转染48 h后,使用双萤光素酶报告基因分析系统分析。
1.2.4 小鼠的分组及处理:通过博来霉素(bleomycin,BLM)诱导小鼠增生性瘢痕。将实验小鼠随机分为3组:对照组(NC-agomir组)、模型组(NC-agomir+BLM组)和转染miR-425-5p干预模型组(miR-425-5p-agomir+BLM组),每组6只。首先,NC-mimic+BLM组和miR-425-5p-agomir+BLM组小鼠每日背侧皮下注射100 μL BLM(1.0 mg/mL,溶于PBS),NC-agomir组小鼠注射等体积的PBS。共注射21 d。在此基础上,NC-agomir组和NC-agomir+BLM组小鼠另行皮下注射100 μL NC-agomir(1.0 nmol/μL),miR-425-5p-agomir+BLM组皮下注射100 μL miR-425-5p-agomir(1.0 nmol/μL),每7 d注射1次,共注射21 d。21 d后采用断头法处理小鼠,然后分离皮肤组织,常规制作石蜡切片。
1.2.5 Masson三色染色检测胶原沉积:使用Masson三色染色试剂盒检测组织切片中胶原纤维的表达。通过Image Pro Plus软件对胶原纤维沉积进行半定量分析。
1.2.6 Western blot分析蛋白质表达水平:组织或成纤维细胞用RIPA缓冲液冰冻裂解。按照BCA蛋白质检测试剂盒的说明测定蛋白浓度。将50 μg总蛋白质在10%的SDS-PAGE上电泳分离,然后转移到PVDF膜上。用5%脱脂牛奶在室温下封闭膜2 h,并与Col-Ⅰ(1∶3 000稀释)、Col-Ⅲ(1∶3 000稀释)、α-SMA(1∶3 000稀释)、TGF-β1(1∶3 000稀释)、Smad2(1∶3 000稀释)、β-actin(1∶3 000稀释)在4 ℃下孵育过夜。第2天,将膜与辣根过氧化物酶标记的二抗(1∶3 000稀释)室温孵育1 h。应用超敏ECL化学发光试剂盒显影,用Image J软件对条带进行定量。β-actin作为内参。
1.2.7 RT-qPCR检测基因表达水平:用RNAiso Plus试剂盒裂解组织或成纤维细胞。用PrimeScriptTMRT Master Mix或Mir-XTMmiRNA First-Strand Synthesis Kit将500 ng的总RNA反转录成cDNA。用SYBR Premix EX Taq和美国Bio-Rad iQ5实时荧光定量PCR仪进行扩增。以GAPDH和U6作为mRNA和miRNA的内部对照。PCR扩增条件分为4个阶段:1)初始变性,95 ℃ 30 s;2)变性,95 ℃ 30 s;3)退火,58 ℃或60 ℃ 10 s;4)延伸,72 ℃ 15 s,共40个循环。按2-△△Ct法计算相对表达量。引物序列如下:miR-425-5p,上游引物5′-TGCGGAATGACAC GATCACTCCCG-3′和下游引物5′-CCAGTGCAGGG TCCGAGGT-3′。U6,上游引物5′-ATTGGAACGATA CAGAGAAGATT-3′和下游引物5′-GGAACGCTTC ACGAATTTG-3′。Col-Ⅰ,上游引物5′-GAGGCAACA GCAGGTTCACTTA-3′和下游引物5′-TCAGCACCAC CGATGTCCA-3′。Col-Ⅲ,上游引物5′-CCACGGA AACACTGGTGGAC-3′和下游引物5′-GCCAGCTGC ATCAAGGAC-3′。α-SMA,上游引物5′-GACAATGG CTCTGGGCTCTGTAA-3′和下游引物5′-TGTGCTT CGTCACCCACGTA-3′。TGF-β1,上游引物5′-CGCA TCCTAGACCCTTTCTCCTC-3′和下游引物5′-GGTG TCTCAGTATCCCACGGAAAT-3′。Smad2,上游引物5′-TGGCTGGCACCCTGCAACAG-3′和下游引物5′-TGCCTTCGGTATTCTGCTCCCCA-3′。GAPDH,上游引物5′-CGCTTCGGCAGCACATATAC-3′和下游引物5′-CAGGGGCCATGCTAATCTT-3′。
1.3 统计学分析
2 结果
2.1 增生性瘢痕组织和正常皮肤组织中miR-425-5p和TGF-β1的表达
与正常组相比,HS组的miR-425-5p表达水平降低(P<0.001),TGF-β1的mRNA和蛋白表达水平均升高(P<0.001)(图1)。
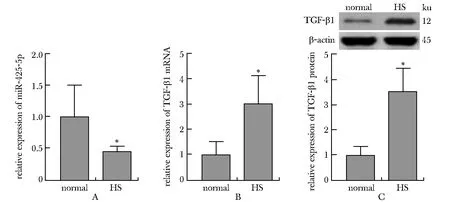
A.relative expression of miR-425-5p; B and C.relative expression of TGF-β1 mRNA and protein; *P<0.05 compared with normal group
2.2 成纤维细胞的转染效率
与对照组相比,miR-425-5p-mimic组的miR-425-5p表达水平升高(P<0.05),miR-425-5p-inhibitor组的miR-425-5p表达水平降低(P<0.05),TGF-β1-pcDNA3.1组的TGF-β1的mRNA和蛋白表达水平均升高(P<0.05)(图2)。

A.relative expression of miR-425-5p in cells transfected with miR-425-5p-mimic or NC-mimic; B.relative expression of miR-425-5p in cells transfected with miR-425-5p-inhibitor or NC-inhibitor; C,D.relative expression of mRNA and protein of TGF-β1 in cells transfected with TGF-β1-pcDNA3.1 or NC-pcDNA3.1; *P<0.05 compared with control group
2.3 miR-425-5p对成纤维细胞中Col-Ⅰ、Col-Ⅲ、α-SMA、TGF-β1和Smad2表达的影响
与对照组相比,miR-425-5p-mimic组细胞的Col-Ⅰ、Col-Ⅲ、α-SMA、TGF-β1和Smad2的mRNA和蛋白表达水平均降低(P<0.05),miR-425-5p-inhibitor组细胞的Col-Ⅰ、Col-Ⅲ、α-SMA、TGF-β1和Smad2的mRNA和蛋白表达水平均升高(P<0.05)(图3)。
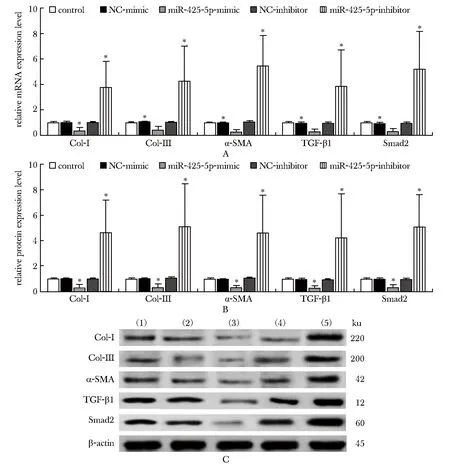
A:mRNA relative expression of Col-Ⅰ, Col-Ⅲ, α-SMA, TGF-β1 and Smad2; B,C:relative protein expression of Col-Ⅰ, Col-Ⅲ, α-SMA, TGF-β1 and Smad2,(1)control, (2)NC-mimic, (3)miR-425-5p-mimic, (4)NC-inhibitor, (5)miR-425-5p-inhibitor; *P<0.05 compared with control group
2.4 miR-425-5p靶向调节成纤维细胞中TGF-β1及其下游分子的表达
生物信息学工具(TargetScan)预测TGF-β1和Smad2均是miR-425-5p的潜在靶标(图4A)。双荧光素酶报告基因实验结果显示(图4B),与miR-425-5p-mimic共转染后,TGF-β1-3′-UTR-WT组的相对荧光素酶活性比TGF-β1-3′-UTR-MUT组降低(P<0.05)。与miR-425-5p-mimic+NC-pcDNA3.1组相比,miR-425-5p-mimic+TGF-β1-pcDNA3.1组的Col-Ⅰ、Col-Ⅲ、α-SMA、TGF-β1和Smad2的mRNA和蛋白表达水平均升高(P<0.05)(图5)。

A.binding site of miR-216a-5p to TGF-β1 and Smad2 3′UTR region; B.dual luciferase reporter gene assay; *P<0.05 compared with TGF-β1-3′-UTR-MUT group
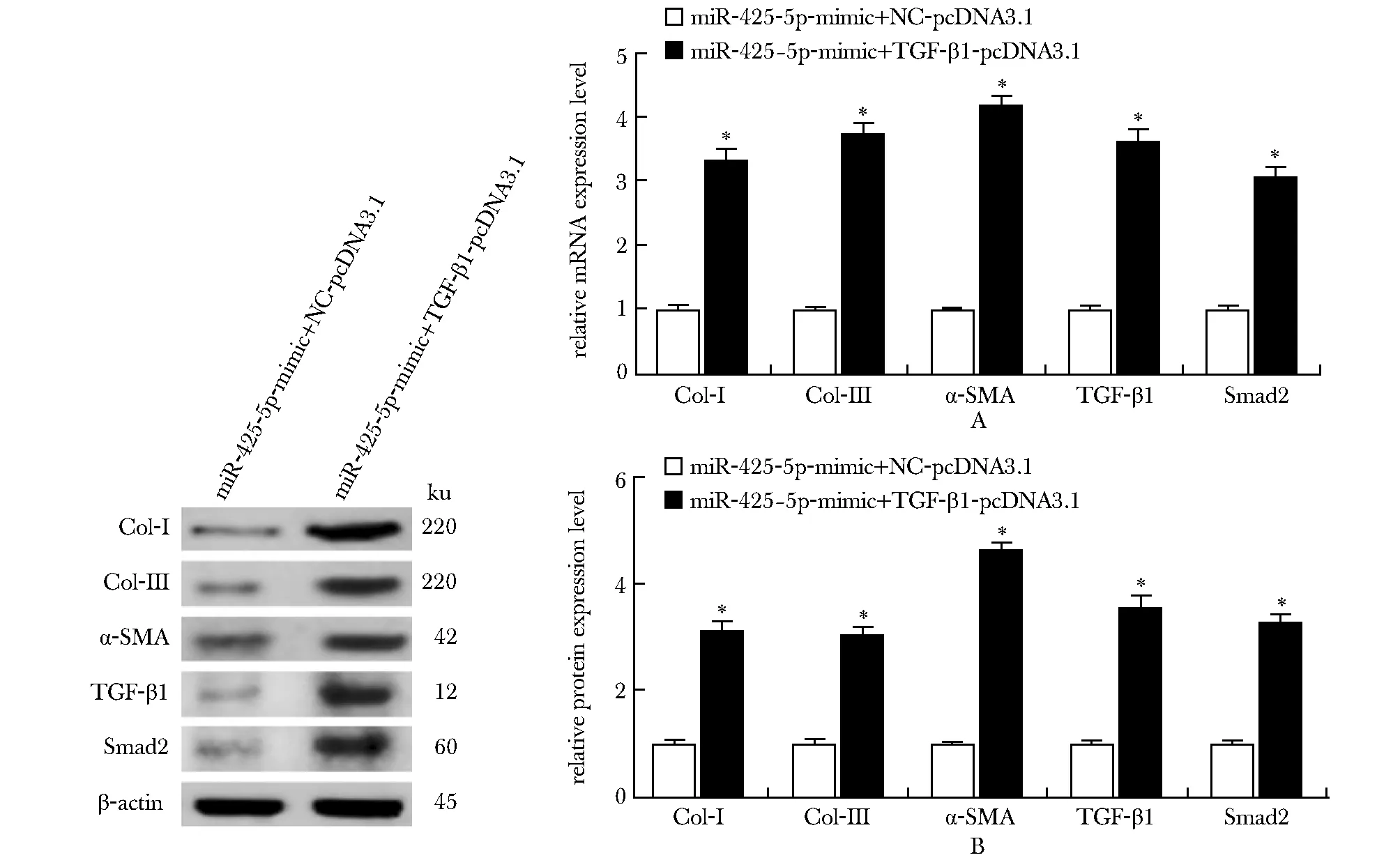
A.mRNA relative expression of Col-Ⅰ, Col-Ⅲ, α-SMA, TGF-β1 and Smad2; B.relative protein expression of Col-Ⅰ, Col-Ⅲ, α-SMA, TGF-β1 and Smad2; *P<0.05 compared with miR-425-5p-mimic+NC-pcDNA3.1 group
2.5 上调miR-425-5p对博来霉素(BLM)诱导的小鼠增生性瘢痕组织胶原纤维沉积的影响
与NC-agomir组(正常皮肤)相比,NC-agomir+BLM组小鼠皮肤组织中相对胶原蛋白含量升高(P<0.05)。与NC-agomir+BLM组相比,miR-425-5p-agomir+BLM组小鼠皮肤组织中相对胶原蛋白含量降低(P<0.05)(图6A)。与NC-agomir组相比,NC-agomir+BLM组的miR-425-5p表达水平降低,TGF-β1的mRNA和蛋白水平均升高(P<0.05)。与NC-agomir+BLM组相比,miR-425-5p-agomir+BLM组小鼠皮肤组织中miR-425-5p表达水平升高,TGF-β1的mRNA和蛋白水平均降低(P<0.05)(图6B~D)。
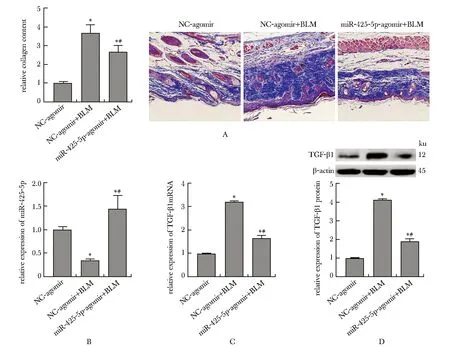
A.relative collagen content of mouse hypertrophic scar tissue detected by Masson’s trichrome staining (×200); B.relative expression of miR-425-5p in mouse hypertrophic scar tissue; C, D.mRNA and protein relative expression of TGF-β1 in mouse hypertrophic scar tissue; *P<0.05 compared with NC-agomir group; #P<0.05 compared with NC-agomir+BLM group
3 讨论
增生性瘢痕主要由成纤维细胞增殖紊乱引起,其特征是细胞外基质如胶原过度沉积[10-11]。miR-425是最近发现的与胶原沉积和纤维化有关的miRNA,具有抑制肌成纤维细胞分化、减少瘢痕形成的作用[7]。有研究显示[12],在血管紧张素Ⅱ处理的心脏成纤维细胞中,miR-425的表达减少与Col-Ⅰ和α-SMA的过度表达有关,过表达miR-425可显著抑制胶原形成和纤维化形成。本课题组推测miR-425可能参与增生性瘢痕的发生发展,因此开展了本研究。本研究表明增生性瘢痕组织中miR-425-5p的表达水平较正常皮肤组织明显降低,并且上调miR-425-5p可抑制Col-Ⅰ、 Col-Ⅲ和α-SMA的表达,而下调miR-425-5p则可促进Col-Ⅰ、Col-Ⅲ和α-SMA的表达。这些结果提示增生性瘢痕中miR-425-5p的异常表达参与了疾病的进展。
过度的瘢痕形成和纤维化与创伤愈合过程中TGF-β1的高表达密切相关[13]。TGF-β1通过Smad蛋白家族的磷酸化和激活下游相关基因如α-SMA和Col-Ⅰ来诱导肌成纤维细胞分化[14-15]。因此,抑制TGF-β1及其下游基因的活性可能会减少肌成纤维细胞的形成和过度聚集,从而减少瘢痕形成。本研究通过双荧光素酶报告基因实验证实miR-425-5p靶向抑制TGF-β1。该结果与前人一致[12]。此外,miR-425-5p之间调控TGF-β1/Smad2信号通路的活化,过表达TGF-β1逆转了上调miR-425-5p对胶原蛋白形成的抑制作用。这些结果充分说明miR-425-5p通过TGF-β1/ Smad2信号通路调节增生性瘢痕形成。另外,有研究表明[6],抑制miR-425通过增加A549和HFL-1细胞中KDM6A的水平诱导Smad2过表达,并使Smad2启动子区域的H3K27me3去甲基化,抑制miR-425可减少TGF-β1诱导的胶原蛋白表达,并促进成纤维细胞增殖。这些研究结果提示miR-425可能在多种纤维化相关疾病中调控TGF-β1/ Smad2信号通路。
为了验证miR-425-5p是否可作为增生性瘢痕的治疗靶点,本研究构建了博来霉素诱导的小鼠增生性瘢痕模型,应用稳定高表达miR-425-5p的miR-425-5p-agomir治疗小鼠21 d,研究表明miR-425-5p-agomir明显抑制了增生性瘢痕组织胶原纤维沉积及TGF-β1/Smad2信号通路,这一结果证实上调miR-425-5p是治疗增生性瘢痕的一种有效策略。
综上所述,本研究表明miR-425-5p在增生性瘢痕组织中表达下调。上调miR-425-5p通过抑制TGF-β1/Smad2信号通路抑制胶原纤维沉积和增生性瘢痕形成。miR-425-5p有望成为治疗增生性瘢痕的一个高潜力分子靶标。
