贝伐珠单抗通过调控PI3K/AKT信号通路下调肺腺癌H1299细胞PD-L1表达①
2023-03-04张亚玲邓述恺西南医科大学附属医院呼吸内科泸州646000
张亚玲 刘 单 邓述恺 (西南医科大学附属医院呼吸内科,泸州 646000)
肺癌是全球范围内与癌症相关的主要死亡原因,非小细胞肺癌(non-small cell lung carcinoma,NSCLC)约占所有肺癌的85%。程序性细胞死亡受体1(programmed cell death protein 1,PD-1)/程序性细胞死亡配体1(programmed death ligand 1,PD-L1)抑制剂通过阻断抑制性受体与T细胞相互作用,恢复T细胞功能,增强机体免疫应答,在晚期NSCLC的治疗中占据重要地位[1-2]。然而大多数患者对PD-1/PD-L1抑制剂的有效应答率低,迫切需要探寻包括联合治疗在内的更佳治疗策略以提高疗效。贝伐珠单抗(Bevacizumab,Beva)是一种人源化IgG1单克隆抗体,可特异性阻断血管内皮生长因子(vascular endothelial growth factor, VEGF)与其受体(VEGFR)的结合,从而减少肿瘤新生血管形成[3]。近年来研究发现,抗VEGF治疗可显著降低肿瘤细胞PD-1、PD-L1及其他免疫检查点阻断分子的表达[4-5]。磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路在NSCLC中过表达,与细胞增殖、血管生成及免疫调节等过程密切相关[6]。人肺腺癌H1299细胞株对VEGF有较强表达,而在产生VEGF的肿瘤中,抗VEGF治疗与PD-1/PD-L1抑制剂具有协同作用[7]。为进一步探讨抗血管生成药物对免疫微环境的影响及其机制,本文通过设计实验探讨Beva对H1299细胞PD-L1、p-PI3K、p-AKT表达的影响,为临床上肺癌的联合治疗提供有效方案及理论依据。
1 材料与方法
1.1 材料 H1299细胞株(西南医科大学中心实验室);贝伐珠单抗(Roche Pharma Ltd公司);740-YP、LY294002(MCE公司);CCK-8检测试剂盒(碧云天研究所);1640培养基(HyClone公司);CD274 Monoclonal Antibody、PE(eBioscience公司);SDS-PAGE凝胶制备试剂盒、山羊抗兔二抗(南非Aspen公司);兔抗人p-PI3K一抗、p-AKT一抗(美国CST公司);内参GAPDH抗体(英国Abcam公司);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 细胞的培养及传代 采用含10%胎牛血清的1640培养基培养肺腺癌H1299细胞,置于37℃、5%CO2培养箱中,贴壁生长至85%时用0.25%胰酶传代。
1.2.2 CCK-8法检测Beva对H1299细胞增殖抑制作用 向处于对数生长期的H1299细胞中分别加入5、10、20、40、80 μg/ml Beva,对照组加入等量培养液,设置5个复孔。分别培养36 h、48 h、72 h后,向每孔中加入10 μl CCK-8溶液孵育4 h,酶标仪测定450 nm吸光度值(OD值),计算不同时间Beva半数抑制浓度(IC50)及细胞增殖抑制率。选择细胞增殖抑制作用最为明显的72 h为后续实验的干预时间,其对应的IC50为56.312 μg/ml,作为后续实验的干预浓度。
1.2.3 流式细胞仪检测Beva对H1299细胞PD-L1表达的影响 取对数生长期H1299细胞制备细胞悬液,接种于6孔板,加入1 ml 0.25%胰酶消化细胞,300 g离心5 min,弃上清,重悬,向H1299细胞中分别加入5、10、20、40、80 μg/ml Beva,对照组加入等量培养液,分别培养36 h、48 h、72 h,按照试剂盒说明步骤进行操作。实验独立重复3次。
1.2.4 流式细胞仪检测各组细胞PD-L1表达 将对数生长期H1299细胞制成细胞悬液接种于6孔板,操作步骤同1.2.3。分为5组:①对照组:不加药物处理;②Beva组:加入56.312 μg/ml Beva;③740-YP组:加入25 nmol/L 740-YP;④LY294002组:加入20 μmol/L LY294002;⑤Beva+740-YP组:加 入56.312 μg/ml Beva和25 nmol/L 740-YP;培养72 h,按照试剂盒说明步骤进行操作,使用流式细胞仪检测各组细胞PD-L1表达情况,实验独立重复3次。
1.2.5 Western blot检测各组细胞p-PI3K、p-AKT蛋白水平 将H1299细胞接种于6孔培养板,分为4组:①对照组:不加药物处理;②Beva组:加入56.312 μg/ml Beva;③740-YP组:加入25 nmol/L 740-YP;④Beva+740-YP组:加入56.312 μg/ml Beva和25 nmol/L 740-YP;室温孵育72 h后提取总蛋白。BCA法检测蛋白浓度,制胶、上样、电泳、转膜,5%脱脂奶粉溶液封闭1 h,加入p-PI3K及p-AKT一抗4 ℃过夜,TBST漂洗,加二抗后再次漂洗,ELC发光剂显影,定影,拍照,实验独立重复3次。
1.3 统计学方法 数据分析采用SPSS19.0统计软件。计量资料以±s表示,各组之间数据采用单因素方差分析进行对比,组内比较用LSD-t检验,方差齐性检测采用Levene法,检验水准α取0.05,P<0.05为差异有统计学意义。
2 结果
2.1 Beva对H1299细胞增殖活性的影响 CCK-8法检测结果显示,在同一时间下,不同浓度Beva对H1299细胞增殖均有抑制作用,且抑制作用随药物浓度的增加逐渐增强(P<0.05)。在36 h、48 h、72 h时,Beva的IC50分别为:87.435 μg/ml、69.049 μg/ml、56.312 μg/ml。见图1、表1。
表1 各组H1299细胞增殖抑制率之间的比较(±s,n=5)Tab.1 Comparison of inhibition rate of H1299 cell proliferation in each group (±s,n=5)

表1 各组H1299细胞增殖抑制率之间的比较(±s,n=5)Tab.1 Comparison of inhibition rate of H1299 cell proliferation in each group (±s,n=5)
Note:Compared with 0 μg/ml Beva group, 1)P<0.05, 2)P<0.01.

图1 CCK-8检测贝伐珠单抗对H1299细胞增殖的影响Fig.1 Effect of Beva on proliferation of human lung denocarcinoma H1299 cells detected by CCK-8
2.2 Beva对H1299细胞PD-L1表达的影响 流式细胞术检测结果显示,在同一浓度不同时间点,Beva浓度≥20 μg/ml时,H1299细胞表面PD-L1表达量均能显著降低(P<0.05),且随着时间延长,PD-L1表达量越低(P<0.05);在相同时间不同浓度下,H1299细胞表面PD-L1表达量随Beva药物浓度升高而下降(P<0.05),但在36 h时,5 μg/ml Beva组分别与0 μg/ml Beva组、10 μg/ml Beva组相比,细胞PD-L1表达差异无统计学意义(P>0.05),10 μg/ml Beva组与20 μg/ml Beva组相比,细胞PD-L1表达差异无统计学意义(P>0.05)。见表2、图2。

图2 不同浓度贝伐珠单抗作用H1299细胞不同时间对PDL1表达的影响Fig.2 Effect of different concentrations of Beva on H1299 cells and different time on PD-L1 expression
表2 不同浓度贝伐珠单抗作用H1299细胞不同时间对PD-L1表达的影响(±s,%)Tab.2 Effect of different concentrations of Beva on H1299 cells and different time on PD-L1 expression (±s,%)

表2 不同浓度贝伐珠单抗作用H1299细胞不同时间对PD-L1表达的影响(±s,%)Tab.2 Effect of different concentrations of Beva on H1299 cells and different time on PD-L1 expression (±s,%)
Note:Compared with 0 μg/ml Beva group, 1)P<0.05, 2)P<0.01.
2.3 Beva、740-YP、LY294002单药使用和Beva联合740-YP使用对H1299细胞PD-L1的影响 分别使用Beva、740-YP、LY294002单药处理细胞和Beva联合740-YP使用处理H1299细胞干预72 h,PD-L1表达量分别为:对照组(60.300±3.132)%、Beva组(20.633±4.130)%、740-YP组(81.000±3.120)%、LY294002组(19.167±2.483)%、Beva+740-YP组(72.600±2.862)%。与对照组相比,Beva组PD-L1表达量明显降低,740-YP组PD-L1表达量明显升高,LY294002组PD-L1表达量明显降低(P<0.01);Beva+740-YP组PD-L1表达量较Beva组高、较740-YP组低(P<0.05)。见图3。

图3 各组H1299细胞PD-L1表达的情况Fig.3 PD-L1 expression of H1299 cells in each group
2.4 Western blot法检测H1299细胞p-PI3K、p-AKT蛋白的表达 Beva/740-YP单药处理或联合处理H1299细胞干预72 h,p-PI3K、p-AKT蛋白表达水平分别为:对照组(p-PI3K蛋白表达量0.313±0.031,p-AKT蛋白表达量0.122±0.028)、Beva组(p-PI3K蛋白表达量0.102±0.023,p-AKT蛋白表达量0.044±0.024)、740-YP组(p-PI3K蛋 白 表 达 量0.867±0.045,p-AKT蛋白表达量0.555±0.044)、Beva+740-YP组(p-PI3K蛋白表达量0.611±0.031,p-AKT蛋白表达量0.310±0.038)。与对照组相比,Beva组p-PI3K、p-AKT蛋白表达均较低(P<0.05),而740-YP组p-PI3K、p-AKT蛋白表达水平均较高(P<0.05);Beva+740-YP组p-PI3K、p-AKT蛋白表达水平较Beva组高,较740-YP组低(P<0.01,图4)。
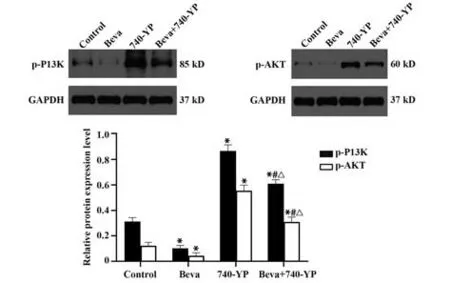
图4 Western blot法检测p-PI3K、p-AKT蛋白表达水平Fig.4 Protein expression level of p-PI3K and p-AKT detected by Western blot
3 讨论
PD-1/PD-L1抑制剂通过特异性阻断CD8+T细胞的PD-1和肿瘤细胞表达的PD-L1的结合,重新激活T细胞进而有效杀伤肿瘤细胞[2]。Beva是新一代血管靶向抗肿瘤药,通过抑制VEGF相关通路减少血管形成,抑制肿瘤的生长和转移[3]。但单用PD-1/PD-L1抑制剂或单用抗血管生成药物都不可避免地存在原发性或继发性耐药问题。文献报道,Beva联合PD-1/PD-L1抑制剂治疗肺癌可协同抑制肿瘤生长[8]。然而,高剂量和/或长时间的抗血管生成药物可能导致过度的“血管修剪”,反而加剧肿瘤组织缺氧,增强抑制性免疫微环境[9]。如何在联合治疗中优化抗血管生成治疗方案以及抗血管生成药物对免疫微环境的作用机制均值得进一步探讨。
Beva对多种VEGF高表达的恶性肿瘤均具有明显的抗癌活性[10]。HUANG等[9]研究表明,低剂量的抗血管生成剂优于较高剂量治疗,可能是高剂量的抗血管生成药物使肿瘤灌注迅速减少,周细胞覆盖率降低,加剧肿瘤组织缺氧情况所致。WANG等的体外实验表明,不同浓度Beva(0、1、5、25 μmol/L)处理A549细胞12 h、24 h、48 h、72 h,24 h后Beva以剂量依赖方式抑制癌细胞增殖[11]。本研究结果显示,当不同浓度Beva处理H1299细胞36 h时,5 μg/ml、10 μg/ml Beva对细胞增殖抑制作用不明显,48 h后以剂量依赖方式抑制H1299细胞增殖,与上述研究结果一致。
相关研究表明,VEGF-VEGFR信号参与肿瘤血管异常分化的同时也通过多种机制促进免疫抑制,主要包括诱导具有免疫抑制特性细胞(例如调节性T细胞、髓源性抑制细胞)的分化、阻碍树突状细胞成熟、上调免疫检查点的表达来促进T细胞衰竭[4,12-13]。2015年,THIBAULT等[4]在大肠癌(CT26)小鼠模型中观察到,靶向阻断VEGF-VEGFR途径能显著降低肿瘤浸润性CD8+T细胞上PD-1等抑制性免疫检查点分子的表达。同样,DENG等[5]也发现,抗VEGF类药物能抑制人脐静脉内皮细胞PD-L1的表达。抗VEGF治疗能将肿瘤免疫环境从免疫抑制状态转变为免疫支持状态,解除T细胞免疫抑制,其与抗PD-1/PD-L1疗法具有协同作用,均可以有效阻断PD-1/PD-L1轴。IMpower150试验表明,与接受贝伐珠单抗+紫杉醇+卡铂治疗的患者相比,接受阿特珠单抗+贝伐珠单抗+紫杉醇+卡铂治疗的晚期非鳞NSCLC患者的生存率显著提高[14]。此外,JVDF试验和RIZVI等[15-16]进行的肺癌临床试验也表明两药联合治疗的疗效明显优于单一疗法。为研究不同浓度Beva对肺癌免疫微环境的影响,本实验选取5、10、20、40、80 μg/ml Beva作用于H1299细胞36 h、48 h、72 h,结果表明,在此范围内,Beva以时间-剂量依赖方式下调肺癌细胞PD-L1的表达,并且在72 h,80 μg/ml Beva作用时下调作用最为显著。
PI3K/AKT通路是细胞内具有酶活性的信号传导途径,通过磷酸化或去磷酸化下游效应分子改变通路活化状态[17]。NSCLC中的多种因素可激活PI3K/AKT信号通路,例如上游EGFR、VEGFR及PI3K/AKT中的基因突变或扩增[18]。肺腺癌内皮细胞在VEGFR的刺激下,PI3K磷酸化产生第二信使三羧酸肌醇,促使下游效应子AKT磷酸化。PI3K通路被激活后,一方面促进了NSCLC细胞生长、增殖和新血管形成,另一方面诱导了PD-L1的表达从而介导肿瘤细胞免疫逃逸[17,19-20]。本实验分别使用PI3K通路激活剂740-YP和PI3K抑制剂LY294002作用于H1299细胞时,发现PI3K通路激活后可显著上调PD-L1的表达,而抑制PI3K通路表达可显著下调PD-L1的表达,提示H1299细胞中PD-L1的表达受到PI3K/AKT通路的调控。此外,在单独使用Beva干预H1299细胞时,Beva可显著下调细胞表面PD-L1、p-PI3K、p-AKT蛋白表达,而加入740-YP后,Beva对PD-L1、p-PI3K、p-AKT蛋白抑制作用被解除,从而使上述蛋白表达增加。因此抗VEGF治疗可能是在磷酸化水平上抑制H1299细胞PI3K/AKT通路的激活来下调肿瘤细胞PD-L1的表达,使得PD-1与PD-L1结合受阻,从而与PD-1/PD-L1抑制剂起到协同增效作用。
综上所述,Beva在一定范围内可以有效抑制人肺腺癌H1299细胞增殖,并通过抑制PI3K/AKT相关信号转导下调人肺腺癌H1299细胞PD-L1的表达来改善免疫微环境,从而与PD-1/PD-L1抑制剂起到联合抗肿瘤作用。
