MBD2对Th2/Th17细胞平衡的调控及其在哮喘中的作用研究①
2023-03-04马乙云郑亚妹许玉妮海南省人民医院海南医学院附属海南医院检验科海口570311
马乙云 郑亚妹 许玉妮 (海南省人民医院, 海南医学院附属海南医院检验科,海口570311)
支气管哮喘(简称哮喘)是常见的一种呼吸系统慢性疾病,其特征是气道反应性增高,临床表现主要为反复发作的喘息、气促、胸闷和(或)咳嗽等症状,严重者可危及生命[1]。流行病学数据显示,我国约有超3 000万哮喘患者,病死率高达49.2/10万,居世界第一,给社会及家庭造成严重经济负担[2]。众所周知,Th细胞比例失衡在哮喘的发病机制中占重要地位[3]。大量数据分析发现嗜酸性粒细胞炎症类型是临床上最常见的哮喘类型,其次是以嗜酸性粒细胞和中性粒细胞混合浸润的气道炎症类型(又被称为以中性粒细胞主导的哮喘),而后者对经典的糖皮质激素吸入性治疗方法并不敏感[3-4]。而中性粒细胞介导的哮喘并不依赖经典的Th2细胞途径,研究表明其主要以Th17及其相关细胞因子为主[3,5]。
甲基CpG结合区域蛋白2(methyl-CpG binding domain protein 2,MBD2)能够特异性结合靶基因的启动子区域,并通过招募其他分子改变组蛋白的转录后修饰,改变染色质结构,从而调控靶基因的表达[6]。本课题组既往研究发现MBD2能够调控多种基因的表达,如细胞因子传导抑制蛋白3(SOCS3),干扰素调节因子4(IRF4)、缺氧诱导因子1(HIF-α)的表达而参与Th17细胞的分化[7-9]。然而,均未在体内实验进行系统地探究MBD2对哮喘发病及Th2与Th17细胞分化的影响。鉴于此,本实验通过屋尘螨联合卵清蛋白与脂多糖(lipopolysaccharide,LPS)对条件基因敲除小鼠进行诱导重症哮喘模型,观察MBD2在其发病过程中的作用及其相关机制。
1 材料与方法
1.1 材料 由南方模式动物研究中心应用Cre-flox体系与Crisper-cas9 方法构建C57BL/6小鼠的CD4CreMBD2fl/fl及MBD2fl/fl对照品系(WT);屋尘螨(house dust mite,HDM)(美国Greer公司);LPS、氢氧化铝凝胶、卵清蛋白(ovalbumin,OVA)、乙酰胆碱(methacholine,Mch)(美国Sigma公司);TRIzol试剂(美国Invitrogen公司);4%甲醛、戊巴比妥钠(武汉博士德生物公司);FITC、APC、PE标记的大鼠抗小鼠CD4(FITC-CD4)、IL-17(APC-IL-17)及IL-4(PEIL-4)(美国Biolegend公司);CD4+T细胞磁珠分选试剂盒(德国Miltenyi生物公司);携带靶向沉默MBD2基因的siRNA(si-MBD2)与阴性对照序列si-NC的慢病毒载体(广州锐博生物科技有限公司);SYBR Green Real-time PCR (上海索莱宝生物公司);IL-4、IL-17 ELISA试剂盒(美国R&D公司);大鼠抗Gr1、Ecp、GAPDH单克隆抗体(美国Abcam公司);大鼠抗MBD2单克隆抗体(美国Santa Cruz公司);辣根过氧化酶(HRP)标记的山羊抗大鼠IgG(广州晶彩生物公司);HE染色试剂盒(江苏碧云天生物公司);RT-PCR引物由上海生工合成;其余均为国产分析纯。
1.2 方法
1.2.1 小鼠哮喘模型的制备及分组 根据随机数字表法将雌性WT小鼠与CD4CreMBD2fl/fl随机分为 4组,分别记为WT生理盐水组,WT哮喘组,CD4CreMBD2fl/fl生理盐水组,CD4CreMBD2fl/fl哮喘组,每组10只。参考既往文献[9]方法,使用如下方法构建哮喘小鼠模型:将含有100 μg HDM、100 μg OVA、15 μg LPS、2 mg氢氧化铝的200 μl生理盐水于第0、1、2天经腹腔注射至WT哮喘组和CD4CreMBD2fl/fl哮喘组小鼠体内进行致敏,并于第14、15、18和19天时,使用6%OVA液雾化上述小鼠30 min后在鼻内注射10 μg/μl的HDM进行激发。WT生理盐水组和CD4CreMBD2fl/fl生理盐水组小鼠仅使用生理盐水进行致敏及刺激,处理方法及时间与哮喘组一致。认真观察并记录所有小鼠在实验期间的行为改变,如呼吸节奏的改变、打喷嚏的频率,情绪是否易怒、躁动等,大小便有无失禁,是否出现易疲倦、嗜睡等哮喘相关症状样改变。所有实验小鼠均于第21天时处死。
1.2.2 气道高发反应(airway hyperreactivity,AHR)检测 参考文献[9]方法在第21天时(即最后一次激发的24 h)通过Buxco肺功能直接容积描记仪检测Mch诱导下的气道阻力变化,步骤如下:应用10%的水合氯醛麻醉小鼠,切开气管进行插管,首先测定肺阻力基线值1 min,然后予以10 μl生理盐水及浓度呈递增趋势(0.39、0.78、1.56、3.12 mg/ml) 10 μl Mch进行刺激气道,再次记录肺阻力值。取各组小鼠各个刺激物质及浓度的平均值进行分析计算并绘制小鼠气道反应曲线,以表示AHR的高低。
1.2.3 肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的收集 根据文献[10]方法收集BALF,处死小鼠后,切开小鼠气管并插入气管导管,暴露肺脏,摘取小鼠左肺并用丝线结扎断端后,向导管内注入0.5 ml无菌生理盐水灌洗右肺并回收BALF,重复 3次。将收集的BALF于4 ℃、3 000 r/min 离心15 min,收集上清液,-20 ℃保存备用。取离心后的底层沉淀,经红细胞裂解,并按上述方法进行离心2次后,使用血细胞仪测定BALF中的细胞总数。使用 Biping沉降系统制作细胞切片,HE染色后对200个BALF细胞进行中性粒细胞(neutrophile,NEU)和嗜酸性细胞(eosinophils,EOS)计数。
1.2.4 肺组织病理学观察 将1.2.3摘取的左肺组织固定于10%甲醇溶液中,梯度乙醇脱水,石蜡包埋,切片至5 μm后固定,苏木素-伊红(HE)染色后,光镜下观察肺组织病理学改变。
1.2.5 脾脏T细胞的分离、活化及流式分析 小鼠处死后,于无菌条件下取脾脏,PBS充分冲洗后,采用70 μm孔的尼龙网将其切碎,200目不锈钢滤网过滤后,收集细胞悬液,300 g离心10 min,取上清液进行细胞因子检测,PBS重悬底层细胞沉淀,利用Ficoll密度梯度离心法分离小鼠脾脏中的单个核细胞。参考CD4+T细胞磁珠分选试剂盒说明方法利用阳选法分选各组小鼠脾脏单个核细胞中的CD4+T细胞,计数后,接种至12孔板中,并应用含50 ng/ml PMA、1 μg/ml 离子霉素和3 μg/ml 莫能菌素,1% 青链霉素,10%FBS的RPMI1640于37 ℃、5%CO2细胞培养箱中刺激、活化细胞5 h。PBS洗涤细胞后,再调整细胞密度至1×105个/ml加入流式管,加入FITC-CD4于4 ℃避光孵育30 min后,再加入100 μl细胞固定/破膜液,于室温下避光孵育30 min,300 g离心10 min后分别加入PE-IL-4与APC-IL-17试剂,并于4 ℃避光孵育30 min。对照管分别加入各色的同型对照抗体。每管加入适量PBS,再次离心后,加入0.5 ml多聚甲醛重悬细胞,300目滤膜过滤细胞团块后,流式细胞仪检测。实验单独重复3次。
1.2.6 ELISA实验 按照ELISA试剂盒说明方法检测小鼠BALF中IL-4与IL-17表达水平;将各组小鼠脾脏分离的CD+T细胞,联合使用160 ng/ml PMA、4 μg/ml的离子霉素刺激6 h后,使用ELISA检测 IL-4与IL-17的表达。
1.2.7 siRNA慢病毒载体的体外感染 参考文献[9]方法,使用免疫磁珠分选小鼠脾脏naïve CD4+T细胞,按1×105个/孔密度接种至包被CD3/CD28抗体的12孔板,使用含10 U/ml IL-2的RPMI1640刺激48 h后,去除培养基,使用含10%FBS的RPMI1640培养基重悬细胞,并将其分为3组,si-NC组,si-MBD2组和Control组。其中si-NC组与si-MBD2组的慢病毒感染操作如下:取约2×106个细胞悬液置于流式管中,加入6 μg/ml polybrene,使用si-MBD2和阴性对照慢病毒载体si-NC以感染复数MOI=20进行感染CD4+T细胞,并在室温下800 r/min离心4 h以提高干扰效率。
1.2.8 Th2与Th17细胞的分化和流式分析 取1.2.7中3组约1×106个CD4+T细胞,接种至包被CD3/CD28抗体的培养皿,加入含10 ng/ml IL-4、30 U/ml IL-2、2 000 ng/ml 可溶性CD28、5 000 ng/ml IFN-γ抗体、10%FBS和1%青链霉素RPMI1640进行Th2的定向诱导分化6 d,隔日更换培养液,随后按上述条件进行破膜,加入PE-IL-4,PBS洗涤细胞2次后,加入0.5 ml多聚甲醛重悬细胞,按1.2.5方法处理细胞后上机检测。Th17细胞定向诱导分化步骤如下:按上述方法进行接种已包被CD3/CD28抗体后,加入含5 ng/ml TGF-β、 20 ng/ml IL-1β、20 ng/ml IL-6、10 ng/ml IL-21和10 μg/ml IL-4与IFN-γ抗体、10%FBS和1%青链霉素的RPMI1640进行Th17定向诱导分化6 d,进行换液、破膜,最后加入APC-IL-17上机检测。实验单独重复3次。
1.2.9 RT-PCR实验 按照TRIzol法提取各组小鼠脾脏中分离的CD4+T细胞中的总RNA,分光光度计检测RNA纯度与浓度。利用逆转录试剂盒将RNA逆转录为cDNA,根据SYBR Green Real-time PCR试剂说明书及预实验确定的反应时间与温度进行实时定量PCR。RT-PCR引物序列为:MBD2正向引物5'-CCCAGCGGATGAATGAACAAC-3',反 向 引 物 5'-CTGGACCGACTCCTTGAAGACC-3';RORγt正向引物5'-AGTGTAATGTGGCCTACTCCTGAPDH-3',反向引物5'-GCTCCTGTTGCAGTTGTTTCT-3';GATA3正向引物5'-ACACTCTGGAGGAGGAATGCCAAT-3',反向引物5'-TTCGGTTTCTGGTCTGGATGCCTT-3';GAPDH正 向 引 物5'-AGAAGGCTGGGGCTCATTTG-3',反向引物5'-AGGGGCCATCCACAGTCTTC-3'。以GAPDH为待测miRNA或mRNA的内参,采用2-ΔΔCt方法分析。上述实验单独重复3次。
1.2.10 Western blot实验 取各组小鼠待测组织,加入RIPA细胞裂解液及蛋白酶抑制剂提取组织中总蛋白。BCA法进行蛋白定量,按照1∶4向上清液中加入5×上样缓冲液,并于沸水中加热变性10 min。取30 μg蛋白进行SDS-PAGE分离蛋白,采用湿转法将分离蛋白转至PVDF膜上,5%脱脂牛奶于室温下封闭2 h后,分别加入MBD2(1∶300)、Gr1(1∶300)、ECP(1∶300),β-actin (1∶1 000)一抗,4 ℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗(1∶5 000)室温孵育1 h,TBST溶液清洗3次。均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参β-actin的比值作为其相对含量。以上实验单独重复3次。
1.3 统计学分析 采用统计学软件SPSS19.0和 GraphPad Prism 5.0进行统计分析,符合正态分布的计量资料数据用±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA)的Dunnett's或Bonferroni's多重比较进行分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 MBD2在各组小鼠中的表达 RT-PCR与Western blot实验结果显示,与WT生理盐水组小鼠相比,CD4CreMBD2fl/fl小鼠脾脏CD4+T细胞中MBD2 mRNA及蛋白表达均显著降低(P<0.01),而WT哮喘组小鼠脾脏CD4细胞中MBD2 mRNA及蛋白表达均明显增加(P<0.05,图1)。

图1 MBD2在各组小鼠中的表达Fig.1 Expression level of MBD2 of mice in each group
2.2 MBD2缺陷改善小鼠哮喘症状 小鼠的一般情况观察显示,WT哮喘组在刺激后的第4天开始出现精神萎靡、嗜睡等症状,而CD4CreMBD2fl/fl哮喘组在刺激后的第5天开始出现躁动、呼吸加快与易疲倦等现象,WT生理盐水组与CD4CreMBD2fl/fl生理盐水组小鼠精神状态正常,无上述相关症状。肺功能检测结果显示,与WT生理盐水组或CD4CreMBD2fl/fl生理盐水组相比,WT哮喘组与CD4CreMBD2fl/fl哮喘组的气道反应性明显增加(P<0.05),但WT哮喘组具有较高的基线值,其在低剂量Mch刺激下即气道阻力明显增加,且随着Mch浓度的增加,气道反应性升高趋势较CD4CreMBD2fl/fl哮喘组更为显著(P<0.05),WT生理盐水组与CD4CreMBD2fl/fl生理盐水组差异无统计学意义(P>0.05,图2)。

图2 各组小鼠气道阻力变化Fig.2 Changes of airway resistance of mice in each group
BALF细胞分类计数结果显示,与WT生理盐水组或CD4CreMBD2fl/fl生理盐水组小鼠相比,WT哮喘组与CD4CreMBD2fl/fl哮喘组BALF中的细胞总数、中性粒细胞和嗜酸性细胞均显著增加(P<0.05),前两组无明显差异(P>0.05);而与WT哮喘组相比,CD4CreMBD2fl/fl哮喘组BALF中的细胞总量、中性粒细胞均明显降低(P<0.05),嗜酸性细胞明显增加(P<0.05,图3)。
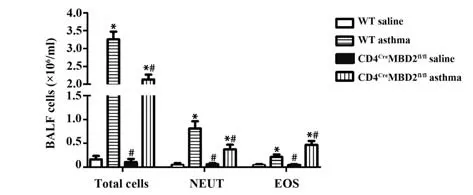
图3 各组小鼠BALF中细胞总数与成分Fig.3 Total number of cells and components in BALF of each group of mice
肺组织病理学染色结果显示,WT哮喘组小鼠肺组织的支气管黏膜充血水肿,管腔狭窄,其内可见黏液栓形成,黏膜上皮细胞出现大量坏死脱落,气道、肺间质和血管周围浸润大量炎症细胞;而CD4CreMBD2fl/fl哮喘组肺组织损伤明显减轻,浸润的炎症细胞显著减少;WT生理盐水组与CD4CreMBD2fl/fl生理盐水组小鼠肺组织结构正常,管腔通畅,气道黏膜上皮细胞完整,肺间质无明显炎症细胞浸润。ELISA检测BALF中细胞因子结果显示,与WT生理盐水组小鼠相比,WT哮喘组与CD4CreMBD2fl/fl哮喘组小鼠脾脏中IL-17、IL-4均显著增加(P<0.01),CD4CreMBD2fl/fl生理盐水组IL-4明显增加(P<0.05);而与WT哮喘组相比,CD4CreMBD2fl/fl生理盐水组上述细胞因子均显著降低(P<0.01),而CD4CreMBD2fl/fl哮喘组小鼠IL-17明显减少(P<0.05),但IL-4显著增加(P<0.05);Western blot实验结果显示,与WT生理盐水组或CD4CreMBD2fl/fl生理盐水组相比,WT哮喘组和CD4CreMBD2fl/fl哮喘组小鼠肺组织内中性粒细胞显著增加(P<0.05),且与WT哮喘组相比,CD4CreMBD2fl/fl生理盐水组和CD4CreMBD2fl/fl哮喘组的中性粒细胞升高趋势明显降低(P<0.05);与WT生理盐水组相比,WT哮喘组,CD4CreMBD2fl/fl生理盐水组及CD4CreMBD2fl/fl哮喘组小鼠肺组织内的嗜酸性细胞显著增加(P<0.05),而与WT哮喘组相比,CD4CreMBD2fl/fl生理盐水组小鼠肺组织内的嗜酸性细胞明显降低(P<0.05),CD4CreMBD2fl/fl哮喘组差异无统计学意义(P>0.05,图4A,B)。

图4 各组小鼠肺组织病理学改变和肺组织中浸润的炎症因子与细胞检测Fig.4 Pathological changes of lung tissue and inflammatory factors and cells in lung tissue of mice in each group
2.3 MBD2缺陷对哮喘小鼠体内Th2与Th17表达的影响 流式细胞术、RT-PCR和ELISA结果显示,与WT生理盐水组小鼠相比,WT哮喘组与CD4CreMBD2fl/fl哮喘组小鼠脾脏中Th17、Th2细胞比例,RORγt与GATA3 mRNA,IL-17和IL-4细胞因子均显著增加(P<0.05),CD4CreMBD2fl/fl生理盐水组Th2细胞比例、GATA3 mRNA和IL-4细胞因子均明显增加(P<0.05);而与WT哮喘组相比,CD4CreMBD2fl/fl生理盐水组及哮喘组小鼠以Th2细胞及相关细胞因子占主要优势,即Th2细胞比例、GATA3 mRNA和IL-4细胞因子均明显增加(P<0.05,图5)。
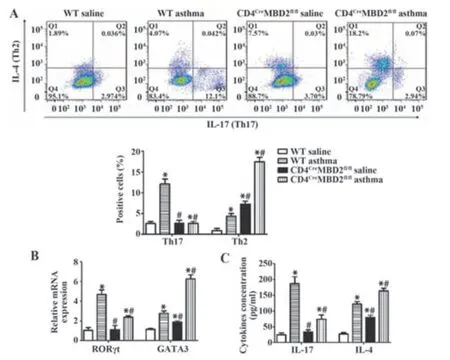
图5 MBD2缺陷促进哮喘小鼠体内Th2细胞表达Fig.5 MBD2 deficiency promotes Th2 expression in asthmatic mice
2.4 沉默MBD2对小鼠naïve CD4+T细胞Th2与Th17分化的影响 RT-PCR检测慢病毒载体感染后小鼠naïve CD4+T细胞中MBD2 mRNA的表达水平,结果显示,与Control组相比,si-MBD2组中MBD2mRNA的表达水平明显降低(P<0.05),si-NC组差异无统计学意义(P>0.05)。流式细胞术检测Th2与Th17的分化结果显示,与Control组相比,si-MBD2组中Th2细胞比例显著增加(P<0.05),而Th17细胞比例明显降低(P<0.05),si-NC组差异无统计学意义(P>0.05,图6)。
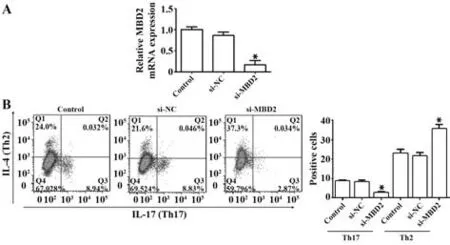
图6 沉默MBD2在体外调控Th2与Th17细胞的分化Fig.6 Silencing MBD2 regulates differentiation of Th2 and Th17 cells in vitro
3 讨论
本课题组前期工作发现小鼠脾脏CD4+T细胞在经刺激分化后,细胞中MBD2的表达水平显著升高。同时,通过对比哮喘患者与健康人群外周血的研究证实,CD4+T细胞中MBD2在哮喘患者体内同样存在高表达现象,这提示MBD2可能与哮喘的免疫发病机制及CD4+T的分化密切相关[7]。而MBD2作为表观遗传调控元件,既往研究表明其能够通过甲基化Tbet/HIx诱导T细胞向Th17细胞分化,从而参与哮喘,尤其是重型哮喘的发病过程[11]。Th17细胞是CD4+T细胞的重要组成部分,维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt,RORγt)是Th17细胞分化的关键转录调控因子[12]。与Th2细胞产生以IL-4为主的细胞因子相比,Th17细胞主要通过产生IL-17招募中性粒细胞浸润至气道,且其诱发的哮喘类型不易受到糖皮质激素的抑制[13]。这也进一步证实临床上对激素治疗产生抵抗的哮喘类型多以Th17介导中性粒细胞炎症为主[14]。
本研究通过HDM联合OVA与LPS在特异性敲除CD4+T细胞中MBD2基因表达的小鼠体内构建哮喘模型,与既往文献证实的结果一致,即该条件诱导的哮喘模型主要以中性粒细胞浸润为主[15]。在验证MBD2在各组小鼠中的mRNA与蛋白表达后,小鼠行为学改变、Mch激发的气道高反应试验和肺组织病理学染色均证实哮喘小鼠模型的成功建立。BALF细胞类型分析及细胞因子检测的结果表明,在野生型小鼠哮喘中以中性粒细胞及IL-17炎症因子占主导地位,这与NEWCOMB等[16]学者研究发现IL-17表达增加与中性粒细胞浸润为主的哮喘具有相关性的结果一致。而在MBD2基因缺陷的小鼠哮喘模型中,肺组织损伤明显减轻,且以嗜酸性粒细胞与IL-4相关的炎症反应占主要地位。COOK等[17]学者在研究树突状细胞活化机制中发现MBD2的缺失可导致CD4+T细胞向Th2细胞分化,而抑制其向Th17细胞分化,进一步的研究表明MBD2可调控Th2细胞及相关细胞因子的表达,从而下调初始CD4+T细胞向该方向的分化水平。这说明MBD2可能是调控Th2与Th17的关键环节。本研究为进一步明确MBD2在哮喘疾病过程中是否同样发挥上述作用,再次通过流式细胞术、RT-PCR及ELISA实验检测各组小鼠脾脏中Th2与Th17及相关细胞因子的表达,结果表明在MBD2基因缺陷的哮喘小鼠中,Th17细胞的表达、分化及相关细胞因子的分泌均较野生型哮喘小鼠显著降低,而Th2细胞及其相关细胞因子的表达均显著增加,且对体外分离的naïve CD4+T细胞进行靶向沉默MBD2基因表达进一步证实了MBD2基因能够通过调控Th2与Th17细胞的分化,在哮喘发生的免疫机制中发挥重要作用。
综上,本研究表明可通过促进Th2细胞及IL-4细胞因子表达敲除CD4+T细胞中MBD2基因表达,抑制Th17细胞及IL-17的表达从而改善以中性粒细胞浸润为主的重症哮喘。然而,MBD2作为重要的甲基化调节蛋白,其在免疫细胞中广泛表达,前期虽研究证实MBD2能够通过调控相关基因影响Th2/Th17细胞的分化,但Th细胞的发育、分化等生物学过程涉及众多分子与蛋白,MBD2能否通过调节其他基因表达而参与哮喘的发生发展尚不得而知,后续将进一步通过基因芯片等技术对比分析CD4+T细胞中MBD2基因缺陷的哮喘小鼠中差异表达的基因验证其在哮喘发病过程中的作用,以期进一步阐明哮喘发生的免疫学机制,并且MBD2有望成为哮喘的新型临床标志物和治疗靶点。
