附子多糖对深低温冻存血管保存效果的影响研究
2023-03-04钟郁佳史业弘王成
钟郁佳 史业弘 王成
近年来,随着血管移植技术和低温医学的不断发展,经深低温冻存的血管组织在临床得以应用[1]。目前,临床上常以渗透性冷冻保护剂二甲基亚砜(dimethyl sulfoxide,DMSO)保存血管组织。渗透性冷冻保护剂可以进入细胞有效地减轻冻存损伤,但DMSO自身具有一定的细胞毒性,随着其浓度不断增加,它对组织及细胞产生的损伤也逐渐加重[2]。因此,最适冷冻保护剂的选择需要考虑到保护剂的特性和浓度,以此来达到更好的保存效果。目前,冷冻保护剂的发展趋势是找寻安全无毒的冷冻保护成分代替DMSO等渗透性保护剂。糖类作为非渗透性冷冻保护剂的一种,因其无毒性且具有多种生物特性在深低温冻存中的作用已被大量研究证实[3-5]。程晨晨等[6]通过观察不同冷冻保护剂对液氮深低温冻存同种带瓣大动脉的研究结果显示,海藻糖对深低温保存同种带瓣大动脉活性的效果优于使用DMSO,可有效抑制组织细胞凋亡发挥对血管的保护作用。目前,将中药多糖,如红景天多糖、枸杞多糖等作为冷冻保护剂应用于深低温保存的相关研究也逐渐开展[7-8]。
附子多糖(fuzi-polysaccharides,FPS)是从中药附子中提取的葡聚糖,无明显毒性,且具有抗氧化应激、清除自由基,保护血管平滑肌细胞等作用[9]。但附子多糖能否作为冷冻保护剂发挥对深低温冻存血管的保护作用目前尚未见相关报道。本研究将FPS应用于经深低温冻存的SD大鼠腹主动脉,探讨其能否在深低温环境中通过抑制线粒体凋亡通路发挥对血管的保护作用,并探寻FPS的最适浓度。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠36只,8周龄,体质量为(200±20)g,购于长沙市天勤生物技术有限公司(实验动物生产许可证号:SCXK(湘)2019-0014)。所有大鼠适应性喂养1周,保持12小时的光/暗周期,自由活动进食和饮水。本实验经遵义医科大学实验动物伦理委员会批准,编号:伦审(2021)2021ZH0091。
1.2 实验试剂与仪器
附子多糖(批号:U-F-FZTQW20200825),购自陕西昂盛生物医药科技有限公司。精准称量附子多糖粉剂1 mg、10 mg、100 mg、200 mg,各自溶于10 mL灭菌注射用水中,充分搅拌使其溶解,用滤膜过滤至10 mL离心管中,配制成浓度0.1 mg/mL、1 mg/mL、10 mg/mL、20 mg/mL的附子多糖冷冻保护剂,4℃冰箱冷藏保存。
4%多聚甲醛固定液(批号:E672002-0500)、苏木素伊红染色试剂盒(批号:E607318),购自上海生工生物技术公司;RIPA裂解液(批号:P0013E)、组织线粒体分离试剂盒(批号:C3606)、BCA蛋白浓度测定试剂盒(批号:P0012)、SDS-PAGE凝胶配置试剂盒(批号:P0012A)均购自中国碧云天生物科技公司;兔抗Bcl-2(批号:ab182858)、Bax(批号:ab32503)、Cyt-c(批号:ab133504)、Caspase-9(批号:ab32539),购自Abcam公司;兔抗GAPDH(批号:KGAA002)、山羊抗兔二抗(批号:KGAA35)购自江苏凯基生物技术股份有限公司;Bcl-2、Bax、GAPDH引物由上海生工合成;RNA提取试剂盒(批号:9767)、反转录试剂盒(批号:RR047A)、SYBR Premix Ex TaqⅡ(批号:RR820A)均购自日本Takara公司。
全自动组织切片机(德国莱卡公司,型号:RM2235);光学显微镜(日本Olympus公司,型号:BX43);超微量分光光度计(美国Thermo公司,型号:NanoDrop2000);荧光定量PCR仪(美国安捷伦科技公司,型号:Mx3000P);转印电泳仪(北京六一生物科技有限公司,型号:DYCZ-40K);台式高速冷冻离心机(美国sigma公司,型号:3K15)。
1.3 动物分组与处理
将36只大鼠随机分为对照组(未做任何处理)、冻存模型组(灭菌注射用水)、FPS 0.1 mg/mL组、FPS 1 mg/mL组、FPS 10 mg/mL组和FPS 20 mg/mL组。空气栓塞法处死大鼠后,无菌环境下游离腹主动脉,生理盐水洗去残血,修剪周围多余脂肪、结缔组织。将冻存模型组和FPS浓度组分别置于对应溶液的冻存管中,经4℃平衡20分钟后放入程序降温盒梯度降温至-80℃过夜,次日放入液氮中保存,1周后取出冻存管于37℃水浴中快速复温进行指标检测。对照组取材后直接进行检测。
1.4 指标检测
1.4.1 苏木精—伊红(hematoxylin-eosin,HE)染色 4%多聚甲醛固定24小时后脱水、包埋、切片(0.3 μm)。60℃烤片1小时,二甲苯及梯度酒精脱蜡,苏木素染色,盐酸酒精分化,伊红染色,逆梯度酒精及二甲苯脱水,树脂封片。光学显微镜下400倍观察腹主动脉各层结构完整性。
1.4.2 蛋白免疫印迹法(western blot,WB)检测 B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、细胞色素c(cytochrome c,Cyt-c)、半胱氨酸天冬氨酸蛋白酶-9(cysteinE-dependent aspartatE-specifc proteases-9,Caspase-9)蛋白表达腹主动脉剪切成细小的碎片放入1.5 mL灭菌干燥EP管中,一次性研磨棒充分研磨,其间不断加入液氮,直至研磨成粉末状。加入裂解液提取总蛋白和胞浆蛋白,胞浆蛋白提取时需加入组织线粒体分离试剂,Cyt-c使用胞浆蛋白,Bcl-2、Bax、Caspase-9使用总蛋白。用BCA蛋白定量试剂盒测定蛋白浓度;配制SDS-PAGE分离胶和浓缩胶,放入电泳槽内;取适量蛋白质样品与5×上样缓冲液4∶1混匀,于沸水中处理使蛋白变性;上样,电泳;将目的蛋白转至PVDF膜上,5%脱脂牛奶摇床封闭2小时,TBST溶液洗膜3次,每次5分钟,分别加入稀释的Bcl-2、Bax、Cyt-c、Caspase-9、GAPDH一抗中,4℃孵育过夜。次日室温孵育复温,TBST溶液洗膜3次,每次10分钟;加入羊抗兔二抗工作液(1∶1500稀释)内,室温孵育1小时,TBST溶液洗膜洗膜3次,每次10分钟;最后采用ECL发光试剂盒显影。Image J分析条带的吸光度值,计算蛋白相对内参GAPDH的表达量。
1.4.3 实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)腹主动脉中Bcl-2、Bax mRNA表达 取大鼠腹主动脉50 mg,按动物组织总RNA提取试剂盒说明书方法进行总RNA提取。采用紫外—可见分光光度计测定RNA的浓度和纯度,取光密度比值OD260/OD280值最好在1.9~2.0之间的样品,根据试剂盒说明书进行操作,在基因扩增仪中(37℃孵育15分钟;85℃孵育5秒)逆转录得到cDNA。以cDNA为模板采用两步法进行PCR扩增。反应体系(共20 μL)包括2× TB Green Premix Ex Taq II 10 μL,cDNA模板2 μL,上、下游引物各0.8 μL,RNasE-free ddHO 6.4 μL。反应条件为95℃预变性30秒;95℃退火5秒,60℃延伸30秒,共40个循环。GAPDH为内参,采用2-ΔΔCt法计算各组大鼠腹主动脉中Bcl-2、Bax mRNA表达水平。引物由生工生物工程股份有限公司合成,引物序列见表1。
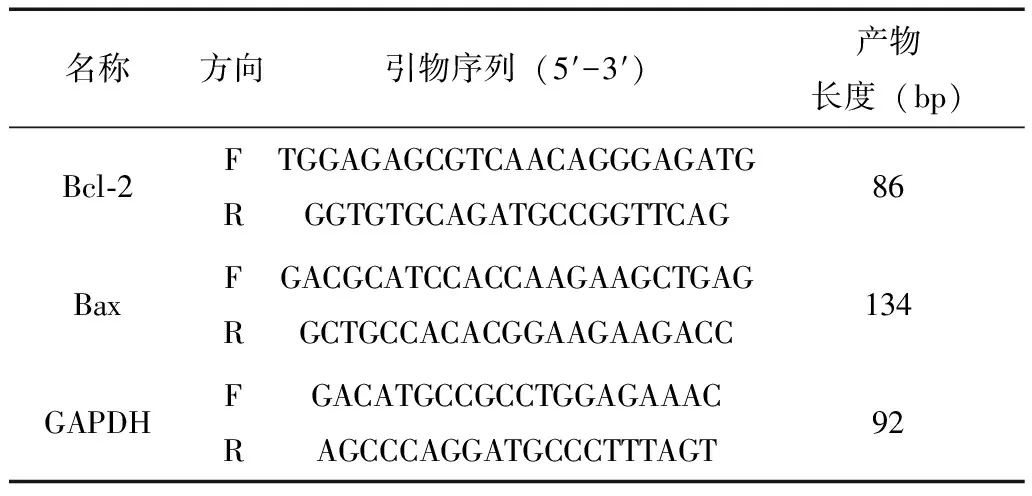
表1 引物序列
1.5 统计学分析

2 结果
2.1 附子多糖对深低温冻存大鼠血管组织病理形态的影响
光镜下,与对照组相比,冻存模型组内膜断裂,中膜结构层次紊乱,平滑肌细胞排列疏松,空泡样改变严重,细胞核数目明显减少,胞质染色浅,外膜结构消失。说明深低温冻存过程破坏了血管组织结构的完整性;与冻存模型组相比,FPS 0.1 mg/mL组表现类似,可见内皮细胞大面积脱失,内弹力膜断裂不连续,平滑肌细胞排列疏松,空泡样改变严重,细胞核数目明显减少,胞质染色浅;从FPS浓度1 mg/mL起,血管组织内膜连续性开始增强,中膜层纤维组织排列相对紧密,外膜可见;FPS 10 mg/mL组、FPS 20 mg/mL组膜结构保存与对照组相似,内皮细胞连续排列,内弹性膜完整,平滑肌细胞紧密排列,细胞核呈杆状,胞质粉红色,组织结构保存相对完整。见表2、图1。

注:A为对照组;B为冻存模型组;C为FPS 0.1 mg/mL组;D为FPS 1 mg/mL组;E为FPS 10 mg/mL组;F为FPS 20 mg/mL组。

表2 各组深低温冻存大鼠血管组织病理形态学比较鼠只=6)
2.2 附子多糖对深低温冻存大鼠血管组织Bcl-2、Bax、Cyt-c、Caspase-9蛋白表达的影响
与对照组比较,冻存模型组Bcl-2蛋白表达水平显著降低(P<0.05),Bax、Cyt-c、Caspase-9蛋白表达水平均显著增加(P<0.05)。与冻存模型组比较,不同浓度FPS组Bcl-2蛋白表达均明显增加(P<0.05);FPS 0.1 mg/mL组Bax、Cyt-c、Caspase-9蛋白表达无显著差异(P>0.05),其余各浓度组Bax、Cyt-c、Caspase-9蛋白表达明显降低(P<0.05);与FPS 0.1 mg/mL、FPS 1 mg/mL组相比较,高剂量组(FPS 10 mg/mL、FPS 20 mg/mL)可以显著上调Bcl-2蛋白表达水平(P<0.05),下调Bax、Cyt-c、Caspase-9蛋白表达水平(P<0.05),且FPS 10 mg/mL时,对促凋亡因子蛋白表达的抑制和抗凋亡因子蛋白表达的促进基本达到饱和。见图2、表3。

表3 各组大鼠血管组织Bcl-2、Bax、Cyt-c、Caspase-9蛋白表达水平比较鼠只=6)

注:A为对照组;B为冻存模型组;C为FPS 0.1 mg/mL组;D为FPS 1 mg/mL组;E为FPS 10 mg/mL组;F为FPS 20 mg/mL组
2.3 附子多糖对深低温冻存大鼠血管组织Bcl-2、Bax mRNA表达的影响
与对照组比较,冻存模型组Bcl-2 mRNA表达水平明显降低(P<0.05),Bax mRNA表达水平均显明增加(P<0.05)。与冻存模型组比较,不同浓度FPS组Bax mRNA表达均明显降低(P<0.05);除FPS 0.1 mg/mL组外,其余FPS浓度组Bcl-2 mRNA表达均增加(P<0.05);各浓度FPS组相比,FPS 10 mg/mL组可以显著上调Bcl-2 mRNA表达水平,下调Bax mRNA表达水平。见表4。

表4 各组大鼠血管组织Bcl-2、Bax mRNA表达水平比较鼠只=6)
3 讨论
学术界普遍认同深低温冻存技术可以长期保存生物器官组织活性[10]。低温生物学研究证实,细胞的活跃程度在低温的周围环境中逐渐下降,各种酶活性也会相应下降。在深低温环境(-196℃液氮)中,理论上所有生物活动都会停止。此时,细胞既不会凋亡,也不会坏死,故组织细胞的生命活性得以保存[11]。待需要使用时,给予一定条件复温后组织细胞可以恢复其活性,发挥功能。然而,冷冻和解冻过程都会对细胞、组织造成一定损伤[12]。在冷冻过程中,由于各种外界刺激的影响可促使细胞内发生一系列的级联反应,从而发生凋亡[13]。研究发现,低温损伤导致的凋亡更多是通过线粒体介导的[14]。线粒体对低温很敏感,强烈的低温刺激造成线粒体功能障碍,从而导致自噬、凋亡、坏死等下游事件的发生。Bcl-2家族是线粒体凋亡途径的主要调节因子,其中以Bcl-2为代表的抗凋亡蛋白和Bax为代表的促凋亡蛋白间的相互抗衡和相互作用决定着细胞的生存或死亡[15]。两者通过稳定细胞膜完整性和抑制线粒体通透性转换孔(mitochondrial permeablity transition pore,MPTP)的开放来阻止Cyt-c从线粒体释放。而Cyt-c可以通过结合凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1)和Caspase-9前体形成凋亡小体,从而激活凋亡执行者半胱氨酸天冬氨酸蛋白酶-3(cysteinE-dependent aspartatE-specifc proteases-3,CaspasE-3)诱导细胞凋亡[16]。
中医学认为中药附子有回阳救逆、补火助阳、温阳散寒止痛的功效[17]。深低温保存具有阴寒之环境,根据中医“阴阳”辨证关系,性大热的附子有可能对抗深低温之寒冷。本研究发现,冻存模型组大鼠腹主动脉损伤高于对照组,说明低温环境可以导致血管组织细胞损伤。而FPS作为冷冻保护剂时有较好的保护效果,结果显示,添加一定浓度的FPS有利于保存血管结构的完整性,其中较高浓度的FPS(FPS 10 mg/mL组、FPS 20 mg/mg组)内皮细胞、内弹力膜及平滑肌细胞结构保存明显优于其余各组,能较好的保持大鼠腹主动脉正常结构。
为进一步探讨FPS抑制低温损害导致凋亡的可能机制,本研究对Bcl-2/Bax-Cyt-c-Caspase-9信号途径进行了检测。结果表明,当血管组织经深低温冻存后,Bcl-2和Bax比例平衡被打破,导致线粒体通透性增加,Cyt-c从线粒体内膜释放,进一步激活Caspase-9,诱发凋亡。本研究结果中,蛋白表达与mRNA表达结果不一致。一方面,可能因为低温对RNA和蛋白等生物大分子具有不同程度的影响[18];另一方面,基因经转录、翻译成蛋白质后,还需进行磷酸化、糖基化等修饰,因而会存在蛋白质与基因表达并不完全一致[19-20]。而蛋白质作为生理功能的执行者,更能够直观反映出基因的表达水平。研究发现,只有达到一定浓度的FPS才能起到抑制冻存所致血管组织细胞凋亡的作用,不同浓度的FPS对凋亡的影响并不一致。根据实验结果,我们得出浓度为1 mg/mL的FPS是对深低温冻存血管组织产生保护作用的起始浓度;FPS浓度为10 mg/mL时对促凋亡因子的抑制和抗凋亡因子的促进基本达到饱和,FPS浓度为10 mg/mL和20 mg/mL时能最大限度地抑制线粒体凋亡通路中相关基因的表达,两者效果相近,但FPS 10 mg/mL组即在药物用量相对较少的情况下就能产生对深低温冻存血管的保护作用,故浓度为10 mg/mL时可能是FPS作为冷冻保护剂的最适浓度。
综上所述,本研究通过光镜、WB和qRT-PCR证实FPS可以减轻深低温冻存血管组织的冻存损伤,其作用机制可能与其通过对线粒体凋亡通路相关基因的调控,抑制细胞凋亡,从而起到对血管组织的保护作用有关。然而鉴于细胞凋亡途径的多样性以及是否还涉及其他相关基因,后续的研究还需在此方面做出进一步探索。
